有益菌根真菌及其互作对带叶兜兰试管苗生理生长的影响
2022-04-11陈宝玲杨开太龚建英李秋荔汪小玉苏莉花
陈宝玲 杨开太 黄 森 龚建英 李秋荔 汪小玉 苏莉花
(1. 广西壮族自治区林业科学研究院,广西 南宁 530002;2. 广西国有钦廉林场,广西 钦州 535099)
兜兰属(Paphiopedilum)是兰科(Orchidaceae)名贵花卉,全世界约有80~85种,中国多达27种,是世界上兜兰种类最为丰富的国家之一,主要分布在广西、贵州和云南等地[1-4]。兜兰属于兰科植物中濒危程度最高的类群,不仅自然分布区域狭窄,而且大多数种类自然居群小,个体分布不集中。近年来,由于人类活动的干扰及野生生境的破坏,野生兜兰居群数量急剧减少,因此,兜兰属的所有种均被纳入野生动植物濒危物种国际贸易公约(CITES)附录I的保护范围[1,5]。由于兜兰自然繁殖力低,人工繁殖效率不高,生长周期长,兜兰产业发展进程缓慢。兜兰属是兰科中的地生或半附生植物[1],在自然生长中整个生活史都与菌根真菌有着密不可分的关系,二者之间独特的生态功能构成了偏好与兰科植物一方的复杂的共生关系,菌根真菌能促进兰花种子萌发和幼苗形态发生,有助于兰花的生态入侵,影响生物群落的组成,有利于生态系统的保护、恢复或重建等方面[6]。此外,兜兰植物根际具有复杂的微生态系统,除了病原菌、益生菌和宿主植物三者在相互作用中形成稳固的微生态平衡外,不同微生物在物理结构、活性成分代谢、功能发挥等方面也密切相关,彼此间相互影响,相互作用[7]。目前,微生物相互作用已成为菌根研究中最活跃和最具应用前景的领域之一[8]。近年来,国内学者在部分松属(Pinus)、杨属(Populus)及降香黄檀(Dalbergia odorifera)等种类上对微生物互作机理进行了研究[9-12]。兰花菌根的研究已经覆盖了包括兰属(Cymbidium)、五唇兰属(Doriti)、兜兰属及杓兰属(Cypripedium)等多数珍稀濒危种类[13-23],然而,关于多种多样的菌根真菌在兰科植物生长中的相互作用,尤其是菌根真菌混合接种对兜兰生长及生理效应的系统研究报道较少。本研究以前期研究中从野生兜兰分离筛选出3个有益菌根菌种为研究材料,采用7种不同的接种方式回接到带叶兜兰组培苗上,在实验室环境下揭示了菌根真菌对兜兰生长和生理的影响,从而提高菌根的生长与合成效率,最大限度地发挥菌根真菌对宿主植物的有益效果。研究结果不仅具有重要的生态价值,促进濒危兜兰植物的科学保护和合理开发,而且具有重要的经济价值,有助于建立兜兰高效栽培技术体系,缩短栽培周期,节约成本,促进兜兰产业向生态环保产业的方向高效、快速发展。
1 材料与方法
1.1 试验材料
1.1.1供试植株
选取继代3次以上,根系2~3条,叶片3~4片,长势一致、植株健壮且无变异的带叶兜兰无菌组培苗为供试植株。
1.1.2供试菌种
供试菌种为广西野生兜兰营养根中分离、筛选出的3种有益菌根真菌,编号分别为PF02、PF06、PF07,经筛选均为带叶兜兰幼苗的不致病菌株。经16S rDNA序列测定与分析,PF02为Kirschsteiniothelia tectonae、PF06为瓶霉Phialophorasp.、PF07为杯梗孢Cyphellophorasp.,3种真菌均在中国微生物菌种保藏管理委员会普通微生物中心(CGMCC NO. 21 051、21 052、21 053)进行超低温冻结保存。
1.2 试验方法
1.2.1菌株活化
将供试菌株接种于PDA培养基上,人工气候箱25 ℃培养7~10 d,作为备用菌株。
1.2.2组培苗菌根化
1) 共生培养基。试验中共生培养基采用DE培养基[16]。
2)共生培养方法。在超净工作台上,用无菌水冲洗无菌组培苗根部残留的培养基,无菌滤纸吸干水分,称量组培苗的鲜质量,叶片数和根数,然后移入DE培养基中,每瓶接种6株组培苗,然后用打孔器(孔直径为0.5 cm)从已活化菌种的PDA平板菌落边缘打孔单个菌块,再用接种针挑取该菌块接入相应的位置(方法见表1),接菌量为每个菌种1个菌块。单菌接种设3个处理,重复3次,每瓶6株苗;混合接种试验采用双菌混合接种和三菌混合接种方式,共设4个处理,重复3次,每瓶6株苗。对照组不接种真菌。接种后瓶口用保鲜膜密封,移入25 ℃培养室中培养,光照时长12 h/d、光照强度25 μmol/(m2·s),在共生培养45 d内每隔3 d观察1次。

表 1 实验处理Table 1 Experimental treatments
1.2.3测定方法
1)生长指标测定。共生培养120 d后将收获的菌根苗除去培养基,测定苗的鲜质量、干质量、叶片数、根数及根系长度等生长指标,在80 ℃恒温烘干箱中干燥至恒质量,测定干质量。计算鲜质量增长率及与对照鲜质量增长率[16]。
2)生理指标测定。共生培养120 d后,采集菌根苗新鲜叶片测定POD、CAT、SOD等叶片保护酶活性和叶绿素含量等生理指标,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性以及叶绿素含量的测定采用李合生[24]的方法,每个处理各项指标重复3次测定。
1.2.4兰科菌根真菌的重分离
取带叶兜兰单菌接种菌株的植株和不接种的对照植株若干,挑选新生根系。经0.1%的HgCl2溶液表面消毒1 min后,用无菌水清洗4次;然后采用组织块分离法进行菌根真菌的重分离。置于含1 μL/mL庆大霉素的PDA培养基上,28 ℃恒温暗培养7~10 d,观察各处理根段长菌的情况。
1.2.5数据处理
采用DPS 7.05分析各处理组所增加的组培物生长指标及生理指标,并分别进行单因素方差分析,用Duncan新极复差法进行多重比较,筛选最佳菌根真菌及其互作方式。
2 结果与分析
2.1 共生关系的建立
培养120 d后,在接种菌株对应的植株根部进行真菌重分离(表2),研究结果发现接种处理均能分离得到对应的3个原接种菌株,而无菌苗对照则未分离到任何菌株。说明原接种菌株均与带叶兜兰幼苗形成了共生关系,确定为带叶兜兰的兰科菌根真菌。
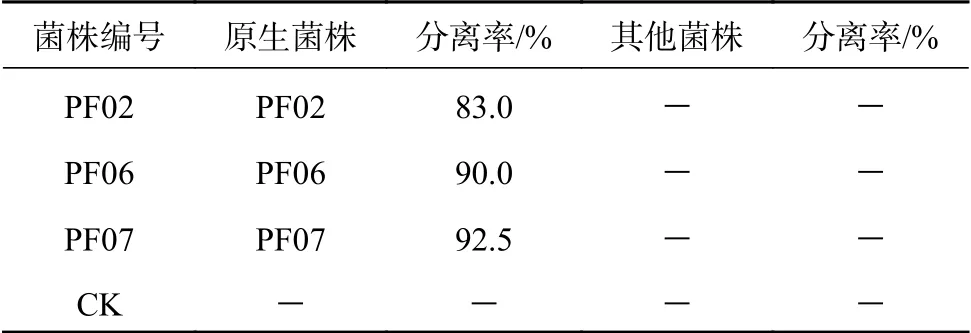
表 2 菌根真菌重分离情况Table 2 Re-isolation of mycrrhizal fungi of P. hirsutissimum seedling
2.2 3种菌根真菌对带叶兜兰组培苗生长的影响
采用单菌根接种法研究了3种兰花菌根真菌对兜兰生长的影响(图1)。经过120 d的培养,数据和分析结果表明,3种菌根真菌均能不同程度地提高兜兰组培苗的生物量,促进植株干物质积累和生长发育(表3)。其中PF02和PF07两个菌株对组培苗植株鲜质量增长率具有显著(P<0.05)作用,较对照分别增长了90.0%、105.2%,较PF06分别增长了37.2%、48.2%。同时PF02和PF07两个菌株对组培苗的干物质积累提高显著,干质量比对照增加40.0%、60.0%,差异极显著(P<0.01),较PF06分别增长了16.7%、33.3%,差异显著。3种真菌均能较好的侵染和定殖组培苗的根系,发挥了兰科菌根的功效,促进根系萌发和伸长生长。值得一提的是PF07菌株,它体现了较好的促生功能,不仅有利于促进植株干物质的积累,而且加快了植株新叶的生长和新根的发育,平均新增叶片数2.69片,与对照相比差异显著,平均新根萌发数量多达2.72条,但与对照差异不显著。

表 3 3种菌根真菌对带叶兜兰植株生长的影响Table 3 Effects of 3 beneficial symbiotic fungi on growth of P. hirsutissimum

图 1 带叶兜兰单菌接种育苗Fig. 1 P. hirsutissimum seedling in vitro with mycrrhizal fungi single inoculation and CK
2.3 菌根真菌混合接种对带叶兜兰组培苗生长的影响
将3个菌株分别通过双菌混合接种及三菌混合接种方式接种带叶兜兰组培苗(图2),结果表明,3种菌根真菌的不同混合接种方式对植株生长产生了不同程度的促进作用,与CK相比具有显著或极显著的正向互作效应,但双菌混合接种比单菌接种及三菌混合接种方式对植株的生长更有效。由表4可知,4种混合接种方式对组培苗各项生长指标的影响程度不同,特别是PF02×PF06双菌组合。菌株PF06单菌接种的植株总体促生效果处于中等水平,但混合接种了菌株PF02后,双菌组合的总体促生效果明显提高,鲜质量增长率、新叶数和新根数增长极显著。接种PF02×PF06双菌组合的组培苗鲜质量增长率为220.78%,干质量为0.09g,新叶数为3.2片,新根数为4.4条,其中,鲜质量增长率较PF02×PF07、PF02×PF06×PF07及CK差异极显著,分别提高了51.4%、74.7%、258.6%,新叶数较CK差异极显著,增加了42.7%,新根数较PF06×PF07、PF02×PF06×PF07及CK差异极显著,分别提高了50.5%、41.3%、
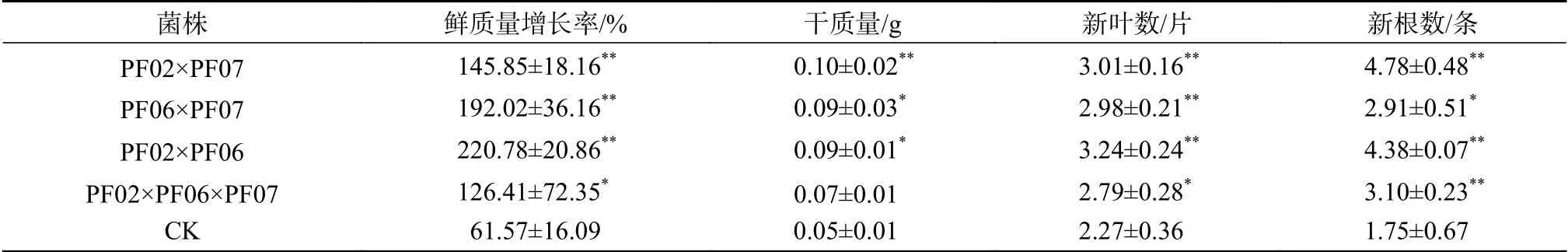
表 4 菌根真菌及其互作对带叶兜兰植株生物量增长的影响Table 4 Effects of mycorrhizal fungi interaction on biomass growth of P. hirsutissimum

图 2 带叶兜兰混合接种育苗Fig. 2 P. hirsutissimum seedling in vitro with mycorrhizal fungi mixed inoculation and CK
150.3%。
其次是PF02×PF07,鲜质量增长率为145.9%,干质量为0.10 g,新根数为4.8条,新叶数为3.0片,各生长指标较CK差异极显著,特别是可较好的促进干质量和新根数的增加。PF02×PF07干质量较PF02×PF06×PF07及CK差异极显著,分别高出42.9%与100%,新根数较PF06×PF07、PF02×PF06×PF07及CK差异极显著,分别提高了54.2%、64.3%、173.1%。
PF06×PF07各生长指标较CK差异显著或极显著,鲜质量增长率较PF02×PF06×PF07差异极显著,提高了51.9%。
由此可见,不同功效的菌株相互组合后产生了不同程度上的菌根真菌互作效应,在3组双菌接种方式中,PF02×PF06及PF06×PF07通过强-弱菌株组合相互作用,相互促进,体现了互作协同效应;PF02×PF07通过强-强菌株组合相互制约,在接种势、生长空间及养分等方面产生竞争,互作效应减弱,促进植株生长缓慢,体现了菌根真菌互作弱协同效应。同理,三菌混合接种的组培苗各项生长指标增加效果也不及双菌混合接种方式,说明菌株的种类、数量和接种量在一定程度上削弱了互作效应。在生产中,应重点寻找微生物相互作用增强的协同效应。
2.4 菌根真菌混合接种对带叶兜兰组培苗生理的影响
将3个菌株双菌混合接种及3菌混合接种并共生培养120 d后,比较各处理叶片的保护性酶活性及叶绿素含量等生理指标差异,结果表明,经菌株处理的植株,尤其是部分混合接种的植株,其生理指标与CK相比均有不同程度上的提高(表5),效果比较突出的是PF02×PF06处理。其中,PF02×PF06的SOD与POD酶活性最高,分别为2472.8、129.4 U/g,与其他处理相比差异显著或极显著;PF02×PF06×PF07的CAT酶活性与叶绿素总量最大,分别为108.2、0.8 mg/g,与其他处理相比差异显著或极显著。PF02×PF07的SOD酶活性最高,为136.8 U/g,与其他处理相比差异显著或极显著。因此,微生物互作对植株生理指标有较好的促进作用,但不同的微生物互作组合产生了不同程度的生理效应,PF02×PF06是较好的互作组合,该处理能较好的提高植株保护性酶和叶绿素总量,同时又对植株生长指标具有极强的促进作用。本研究结果进一步表明,筛选出最优的菌根真菌及最佳的微生物互作组合,将快速提高植株的生长速度和生理响应,有效地发挥菌根真菌之间的协同作用。
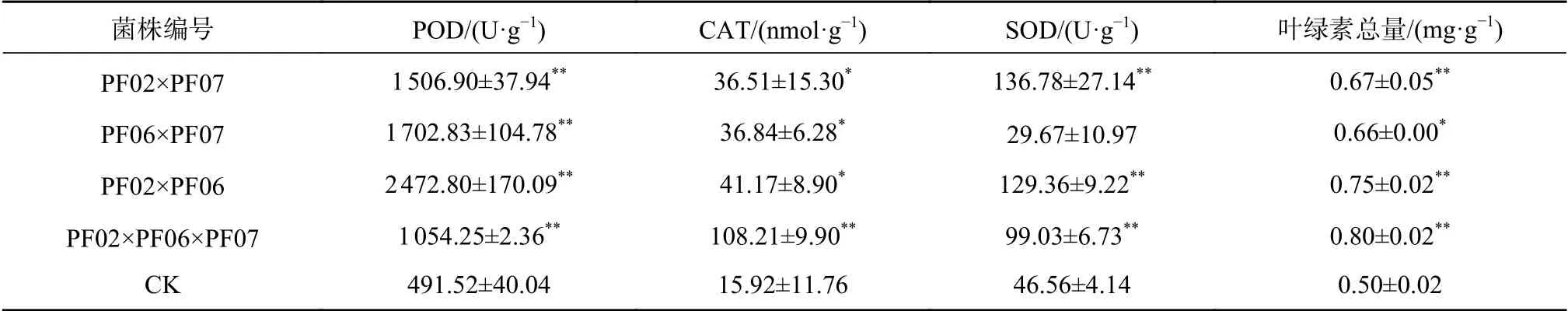
表 5 菌根真菌及其互作对带叶兜兰植株生理指标的影响Table 5 Effects of mycorrhizal fungi interaction on physiological indexes of P. hirsutissimum
综上所述,PF02×PF06、PF02×PF07、PF06×PF07等是较适合带叶兜兰组培苗生长的菌根真菌互作组合。
3 结论与讨论
菌根-植物共生体与根际微生物之间存在着密切的相互作用模式[7],同时,根际微生物在菌根定殖过程中起着积极地调控作用,促进菌根合成和植物生长。目前微生物互作在一些木本植物在研究较深入。多种外生菌根混合接种能显著促进尾叶桉(Eucalyptus urophylla)、马尾松(P. mas-soniana)幼苗生长[25-27];双接种幼套球囊霉(Glomus etunicatum)与慢生根瘤菌(Bradyrhzobium japonicum)有利于降香黄檀植株生长和必需养分的吸收及AMF侵染率提高[28]。樟子松(Pinus sylvestrisvar.mongolica)复合接种研究发现当根际微生物数量增加,抗氧化酶活性显著提高[29]。黄秋良等采用芳樟(Cinnamomum camphora)苗高、地径建立回归方程,以针对性的微生物菌剂方案促进苗木不同生长指标达到最大值[30]。
应用微生物互作开展菌根化育苗技术繁育种苗,是解决兜兰产业瓶颈的关键。近年来,兰科植物有关微生物互作方面的研究鲜少报道,特别兜兰的相关研究尚未发现。已有的研究证实,菌根真菌双菌及三菌混合接种促进美花石斛(D.loddigesii)生物量高效积累[31]。丝核菌属(Rhizoctonia)和角菌根菌属(Ceratorhiza)混合接种促进美花兰(Cymbidium insigne)组培苗的鲜质量及叶绿素净a、b含量增加[32]。菌根真菌和内生细菌混合接种促进五唇兰(Doritis pulcherrima)鲜质量和干质量提高[33]。王晓鸣研究发现“真菌与细菌”互作组合促进华石斛(D. sinense)矿质元素的吸收,光合性能及抗旱性,调节内源激素[34]。植物乳杆菌(Lactobacillus plantarum)和枯草芽孢杆菌ZJU(Bacillus Subtilis)混合接种显著抑制兰花茎腐病[35]。因此,微生物相互对兰花生产具有较广泛的适用性和应用前景。
在本研究中原接种菌株均与带叶兜兰幼苗形成了共生关系,确定为带叶兜兰的兰科菌根真菌。PF07是单菌接种促生功能显著的菌株,可与兜兰形成有效的菌根以延伸水分吸收范围,提供必需的养分,促进植株鲜质量增长率的提高与干物质的积累,加快了植株新叶的生长,促进植株的生长发育并参与植物生理代谢。不同功效的菌株相互组合后产生了不同程度的互作效应,但双菌混合接种比单菌接种及三菌混合接种方式对植株的生长更有效。其中,PF02×PF06双菌组合的总体促生效果最好,有利于植株鲜质量、新叶和新根的增长,PF02×PF07次之,促进干质量增加和新根的生长发育。PF02×PF06及PF06×PF07通过强-弱菌株组合出现了强协同互作效应,PF02×PF07的强-强菌株组合受接种势、生长空间及养分竞争等影响,共生效应弱化,缓慢促进植株生长,呈现弱协同互作效应。受菌株的种类、数量和接种量影响,三菌混合接种效果不及双菌混合接种方式互作效应减弱。PF02×PF06是较好的互作组合,对植株生长指标具有极强的促进作用,同时能较好的提高植株保护性酶和叶绿素总量。生产中应重点筛选促使微生物相互作用增强的协同效应,快速提高植株的生长速度和生理响应。
本研究结果与前人结论一致,双菌混合接种明显优于单菌或三菌混合接种,仲凯研究发现长速快的真菌优先入侵根部并形成侵染通道,利于生长慢的真菌快速获得侵染方位,同时,生长慢的真菌的入侵改善了根部微生态环境,促进相互侵染和植物协同生长[32]。虽然PF06单菌接种缓慢促进植株鲜质量增长,但是联合PF02共同侵染后则显著提高植株生物量,但三菌同时侵染根部后,产生一定程度的抑制作用,说明共生平衡与协同效应是有条件的,随着菌根真菌种类和数量的增加,不同真菌种类在侵染潜力、菌丝发育、菌根分泌物、根系生理变化、营养元素及空间竞争等方面产生影响[26],证明并非所有的混合接种效果都较单菌接种具有积极作用[27]。筛选优势微生物种类、数量及相互作用方式,可最大程度上发挥拮抗性和兼容性的统一[36-39],最大限度发挥菌根对宿主植物的有益作用,这将是一个提高提高兰花栽培效率、节约成本、提高产量、改善花卉品质的有效途径。此外,植株的生理指标尤其是保护酶活性与根系中菌根侵染的不同时期有关,呈动态变化,因此,今后的研究将侧重于菌根苗生理指标的动态监测与互作机理深入分析方面。
