天然杀线虫先导化合物Waltherione A 类似物的合成及杀线虫活性
2022-04-09谢世爽张北京刘启凤丁晓帆孙然锋
张 羲, 谢世爽, 胡 展, 张北京, 刘启凤,丁晓帆, 谢 佳, 邵 雨, 孙然锋*,
(1. 热带农林生物灾害绿色防控教育部重点实验室,海南大学,海口 570228;2. 海南大学 植物保护学院,海口 570228;3. 海南省烟草公司儋州公司,海南 儋州 571700)
根结线虫 (Meloidogynespp.) 是一类严重危害农作物的专性植物寄生线虫, 种类较多,分布在世界各地,可攻击3 000 多种作物,每年给世界作物造成1 000 多亿美元的损失,对农业可持续发展构成巨大威胁[1]。目前,化学药剂防治仍是最有效的防治手段,但全球用于线虫防治的药剂种类有限,且大多是由杀虫剂、杀菌剂发展而来,作用方式单一、抗药性严重。更重要的是,随着食品安全和环境保护要求的提高,灭线磷、噻唑磷等毒性较大的杀线虫剂已逐渐不符合现代绿色农业的发展需求,因此,亟待研发新型、高效、低毒、环境友好的杀线虫剂。植物源农药是当前农药学领域具有广阔前景的研究方向之一。从植物中筛选出具有农用活性和化学结构新颖的先导化合物,再通过对先导化合物进行衍生化设计,最终可合成出对环境友好的新型绿色农药。
生物碱Waltherione A (图式1) 是目前已知的对南方根结线虫具有较好杀虫活性的天然产物。其最早由Hoelzel 等[2]从梧桐科植物Waltheria douradinha的根部分离得到,其后从其他植物中也分离得到了该物质[3-5]。Rahim 等[6]从锦葵科植物Melochia umbellatavar.deglabrata的叶中分离得到了Waltherione A,并发现其对A547 和MCF-7 细胞株有抗增殖和抗HIV 活性 (IC50值为5.9~8.4 μmol/L) 。Jang 等[7]从蛇婆子Waltheria indicaL.根中分离的Waltherione A 对花生根结线虫Meloidogyne arenaria、北方根结线虫Meloidogyne hapla、南方根结线虫Meloidogyne incognita及松材线虫Bursaphelenchus xylophilus均有较高的致死率 (LC50值0.09~3.54 μg/mL) 。Kim 等[8]从粗齿刺蒴麻中也分离得到Waltherione A,其对南方根结线虫2 龄幼虫表现出很高的致死活性 (LC50值0.27 μg/mL) 。
虽然Waltherione A 的杀线虫活性很好,但其结构复杂 (包含3 个部分:X―喹诺酮,Y―七元桥环,Z―与桥环相连的取代基,图式1),全合成难度大。为了简化Waltherione A 的化学结构,本研究设计合成了一系列类Waltherione A 的苯并七元氧桥环衍生物 (合成路线见图式2,部分化合物取代基结构见表1),并初步测定了其杀线虫活性,旨在探索出Z 部分取代基与杀线虫活性之间的关系,找出Waltherione A 杀线虫活性的关键药效团。
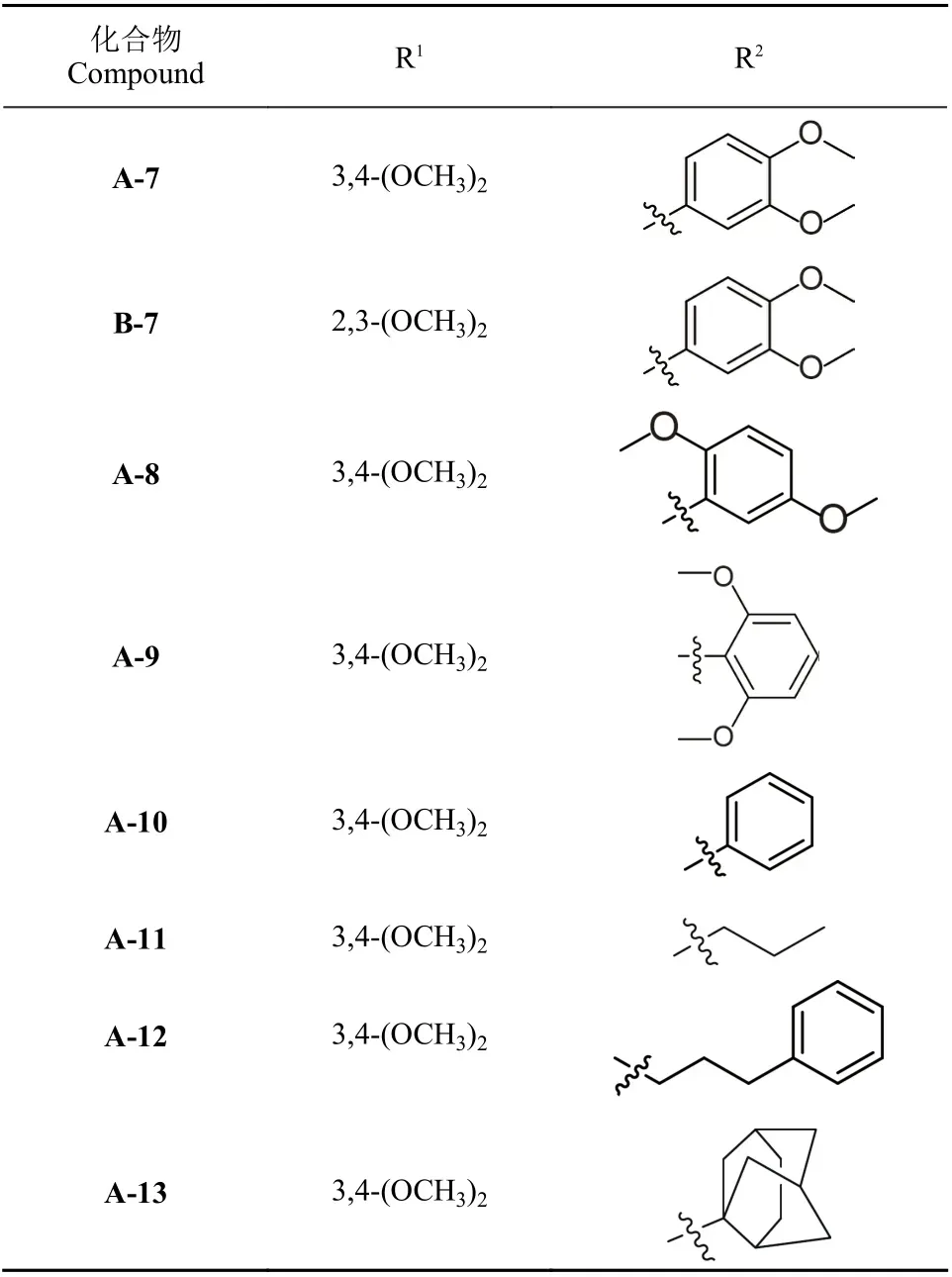
表1 化合物A-7~A-13 和B-7 中R1、R2 的结构Table 1 The structures of R1 and R2 in compounds A-7-A-13 and B-7

图式1 Waltherione A 的结构和设计思路Scheme 1 Structure of Waltherione A and the design strategy

图式2 目标化合物的合成路线Scheme 2 Synthetic routes of target compounds
1 材料与方法
1.1 供试线虫
南方根结线虫Meloidogyne incongnita2 龄幼虫,由海南大学植物保护学院孙然锋课题组提供。
1.2 试剂与仪器
GF 254 硅胶板和柱层析硅胶粉 (300~400 目,筛孔径38~48 μm) 购于青岛海洋化工有限公司;溶剂均为分析纯,购于广东西陇科技股份有限公司;反应原料均为分析纯,购于北京伊诺凯科技有限公司或上海毕得医药科技有限公司;阿维菌素原药 (纯度大于98%)购于上海毕得医药科技有限公司;Waltherione A 由海南大学植物保护学院孙然锋课题组分离鉴定。
Bruker Avance 400 型核磁共振分析仪 (TMS为内标) ;质谱分析仪(Agilent 6210 ESI/TOF MS);X-4 型数字显示显微熔点仪(北京泰克仪器有限公司)。
1.3 化合物的合成
1.3.1 中间体的合成
1.3.1.1 化合物A-1、B-1 的合成 参考文献方法[9]并加以改进。称取 (3-羧丙基) 三苯基溴化膦(28.4 g,66 mmol) 加入500 mL 三颈瓶中,氮气氛围下加入无水四氢呋喃300 mL,将反应液温度降至0 ℃后加入双 (三甲基硅烷基) 氨基钠 (NaHMDS,2 mol/L) 的四氢呋喃溶液 (66 mL,132 mmol),反应1 h 后降温至 -78 ℃。称取3,4-二甲氧基苯甲醛(10 g,60 mmol) 溶于适量无水四氢呋喃,用注射器于氮气氛围下缓慢滴加于反应体系中,30 min后置于室温继续反应,薄层层析(TLC)监测 (V(石油醚) :V(乙酸乙酯)= 5 : 1) 反应进程,约16 h 反应结束时加入饱和氯化铵溶液淬灭反应,减压蒸出溶剂,用乙醚 (20 mL × 3) 萃取。保留水相,加入4 mol/L 的稀盐酸,析出固体,再用乙酸乙酯(40 mL × 3) 萃取。合并有机相,经饱和氯化钠水溶液洗涤后,有机相加入无水硫酸镁干燥,过滤除去固体,滤液减压除去溶剂,经硅胶柱层析(V(石油醚) :V(乙酸乙酯)= 4 : 1) 分离纯化。得到(E)-5-(3,4-二甲氧基苯基)戊-4-烯酸(A-1),黄色固体,5.97 g,产率60% (文献值[9]41%),m.p.70~72 ℃。制得(E)-5-(2,3-二甲氧基苯基)戊-4-烯酸(B-1),黄色油状物,6.61 g,产率66% (文献值[9]41%) 。
1.3.1.2 化合物A-2、B-2 的合成 参考文献方法[10]制备。
(S)-5-((R)-(3,4-二甲氧基苯基)(羟基)甲基)二氢呋喃-2(3H)-酮(A-2):黄色油状物,1.79 g,产率59% (文献值[10]76%).1H NMR (400 MHz, CDCl3),δ:6.90 (d,J= 1.9 Hz,1H), 6.87~6.77 (m, 2H), 4.98 (d,J= 3.1 Hz, 1H), Hz, 1H),4.69~4.60 (m, 1H), 3.83 (d,J= 5.4 Hz, 6H), 3.07 (s, 2H),2.53~2.30 (m, 2H), 2.26~2.15 (m, 1H), 1.99~1.85 (m, 1H);13C NMR (100 MHz, CDCl3),δ:178.3, 149.0, 148.6, 131.2,118.4, 111.1, 109.3, 83.7, 73.1, 55.9, 55.9, 28.6, 20.8.
(S)-5-((R)-(2,3-二甲氧基苯基)(羟基)甲基)二氢呋喃-2(3H)-酮(B-2):黄色或红棕色油状物,1.68 g,产率56%.1H NMR (400 MHz, CDCl3),δ:7.14~7.02 (m, 2H), 6.86 (dd,J= 7.6, 2.1 Hz, 1H), 5.34 (d,J=3.1 Hz, 1H), 4.84~4.75 (m,1H), 3.85 (s, 6H), 3.40 (s, 1H), 2.63~2.49 (m, 1H), 2.44~2.32(m, 1H), 2.28~2.18 (m, 1H), 1.90~1.78 (m, 1H);13C NMR(100 MHz, CDCl3),δ:178.4, 152.2, 145.5, 132.2, 124.3,118.9, 112.0, 82.3, 69.0, 60.7, 55.7, 28.8, 20.8. ESI-HRMS:m/z[M+Na]+C13H16O5Na 计算值:275.089 5,测量值:275.089 3.
1.3.1.3 化合物A-3、B-3 的合成 参考文献方法[11]制备。
(S)-5-((R)-(叔丁基二苯基硅氧基)(3,4-二甲氧基苯基)甲基)二氢呋喃-2(3H)-酮(A-3):无色透明油状物,4.20 g,产率86% (文献值[11]84%).1H NMR (400 MHz, CDCl3),δ:7.65~7.59 (m, 2H), 7.50~7.45 (m, 2H), 7.45~7.37 (m, 1H), 7.36~7.29 (m, 3H), 7.26~7.19 (m, 2H), 6.76~6.60 (m, 3H), 4.88 (d,J=3.2 Hz, 1H), 4.59~4.52 (m, 1H), 3.83 (s, 3H), 3.72 (s, 3H),2.42~2.22 (m, 3H), 2.09~1.93 (m, 1H), 1.08 (s, 9H);13C NMR (100 MHz, CDCl3),δ:177.3, 148.6, 148.5, 136.1,135.9, 133.2, 132.9, 131.4, 129.9, 129.7, 127.6, 127.4, 119.3,110.7, 110.1, 83.8, 76.0, 55.9, 55.8, 28.4, 27.0, 21.6, 19.4. ESIHRMS:m/z[M+Na]+C29H34O5SiNa 计算值:513.207 3,测量值:513.207 0.
(S)-5-((R)-((叔丁基二苯基硅)氧基)(2,3-二甲氧基苯基)甲基)二氢呋喃-2(3H)-酮(B-3):白色固体,4.38 g,产率89%,m.p. 115~116 ℃.1H NMR (400 MHz, CDCl3),δ:7.66~7.60 (m, 2H), 7.54~7.48 (m, 2H), 7.42~7.30 (m, 4H),7.24 (dd,J= 8.0, 6.8 Hz, 2H), 7.16 (dd,J= 7.9, 1.4 Hz, 1H),6.96 (t,J= 8.0 Hz, 1H), 6.77 (dd,J= 8.1, 1.5 Hz, 1H), 5.40 (d,J= 2.7 Hz, 1H), 4.64~4.57 (m, 1H), 3.80 (s, 3H), 3.39 (s, 3H),2.47~2.30 (m, 3H), 1.93~1.82 (m, 1H), 1.10 (s, 9H);13C NMR(100 MHz, CDCl3),δ: 177.5, 152.1, 145.3, 136.3, 136.1, 133.5,132.9, 132.7, 129.9, 129.7, 127.6, 127.5, 123.9, 120.1, 111.8,82.7, 70.3, 60.1, 55.8, 28.7, 27.1, 20.9, 19.6. ESI-HRMS,m/z:[M+Na]+C29H34O5SiNa 计算值:513.207 3,测量值:513.207 2.
1.3.1.4 化合物A-4、B-4 的合成 参考文献方法[12]制得(5S)-5-((R)-(叔丁基二苯基硅氧基)(3,4-二甲氧基苯基)甲基)四氢呋喃-2-醇 (A-4 ),透明油状物,4.21 g,产率86% (文献值[12]87%)。ESI-HRMS:m/z[M+Na]+C29H36O5SiNa 计算值:515.223 0,测量值:515.223 2。制得(5S)-5-((R)-(叔丁基二苯基硅氧基)(2,3-二甲氧基苯基)甲基)四氢呋喃-2-醇(B-4),透明油状物,4.30 g,产率87%。ESI-HRMS,m/z:[M+Na]+C29H36O5SiNa 计算值:515.223 0,测量值:515.222 8.
1.3.2 目标化合物的合成
1.3.2.1 化合物A-5、B-5 的合成 参考文献方法[12]制备。
(5R,8R,9R)-3,4-二甲氧基-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(A-5):黄色固体,110 mg,产率53% (文献值[12]71%),m.p. 141~142 ℃.1H NMR (400 MHz, CDCl3),δ:6.89 (s, 1H), 6.49 (s, 1H), 4.94 (d,J= 5.8 Hz, 1H), 4.64 (d,J= 8.0 Hz, 1H), 4.03 (s, 1H), 3.87 (d,J= 2.6 Hz, 6H),2.20~2.00 (m, 2H), 1.79~1.68 (m, 1H), 1.53~1.41 (m, 1H);13C NMR (100 MHz, CDCl3),δ:148.9, 148.52, 132.6, 125.2,113.0, 106.6, 79.7, 76.2, 70.8, 56.0, 33.0, 24.1. ESI-HRMS:m/z[M+Na]+C13H16O4Na 计算值:259.094 6,测量值:259.094 8.
(5R,8R,9R) -2,3-二甲氧基-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(B-5):黄色油状物,97 mg,产率48%.1H NMR (400 MHz, CDCl3),δ:6.82 (d,J= 8.3 Hz, 1H), 6.73(d,J= 8.3 Hz, 1H), 5.01 (d,J= 5.8 Hz, 1H), 4.69~4.63 (m, 1H),4.40 (s, 1H), 3.93 (s, 3H), 3.84 (s, 3H), 2.16~2.01 (m, 2H),1.72~1.64 (m, 1H), 1.50~1.39 (m, 1H);13C NMR (100 MHz,CDCl3),δ:151.8, 148.6, 133.1, 127.4, 119.3, 112.6, 79.0,76.0, 67.2, 61.3, 56.0, 33.2, 24.0. ESI-HRMS:m/z[M+H]+C13H17O4计算值:237.112 7,测量值:237.113 0.
1.3.2.2 化合物A-6、B-6 的合成 参考文献方法[12]制备。
(5R,8R)-3,4-二甲氧基-5,6,7,8-四氢-9H-5,8-环氧苯并[7]环烯-9-酮(A-6):黄色固体,223 mg,产率95% (文献值[12]51%,m.p. 133~134℃.1H NMR (400 MHz, CDCl3),δ:7.41(s, 1H), 6.67 (s, 1H), 5.20 (d,J= 6.4 Hz, 1H), 4.73~4.64 (m,1H), 3.92 (s, 3H), 3.87 (s, 3H), 2.43~2.23 (m, 2H), 1.83~1.70(m, 2H);13C NMR (100 MHz, CDCl3),δ:195.2, 154.0, 148.7,142.3, 121.3, 108.3, 105.9, 81.1, 76.8, 56.3, 56.2, 30.6, 25.1。ESI-HRMS:m/z[M+H]+C13H15O4计算值:235.097 0,测量值:235.096 6.
(5R,8R)-2,3-二甲氧基-5,6,7,8-四氢-9H-5,8-环氧苯并[7]环烯-9-酮(B-6):红棕色固体,219 mg,产率93%,m.p. 133~135℃.1H NMR (400 MHz, CDCl3),δ:7.39 (s,1H), 6.65 (s, 1H), 5.18 (d,J= 6.3 Hz, 1H), 4.67 (d,J= 7.8 Hz,1H), 3.90 (s, 3H), 3.85 (s, 3H), 2.43~2.17 (m, 2H), 1.85~1.62(m, 2H);13C NMR (100 MHz, CDCl3),δ:195.2, 154.0, 148.6,142.3, 121.2, 108.2, 105.8, 81.0, 77.2, 56.2, 56.1, 30.5, 25.0.ESI-HRMS:m/z[M+H]+C13H15O4计算值:235.097 0,测量值:235.097 2.
1.3.2.3 目标化合物 A-7~A-13 和 B-7 的合成 参考文献方法[12],在氮气氛围下,用注射器吸取3,4-二甲氧基溴苯 (185 mg,0.85 mmol) 加入无水四氢呋喃 (2 mL) 中,降温至 -78 ℃,用注射器缓慢加入1.6 mol/L 的正丁基锂 (n-BuLi) 的己烷溶液(0.54 mL,0.86 mmol) 于反应体系中。反应2 h后,称取化合物A-6 (100 mg,0.43 mmol) 溶于无水四氢呋喃中,在 -78 ℃下用注射器缓慢滴加该溶液于反应体系中,搅拌反应1 h 后缓慢升至室温,继续反应过夜。反应结束后,于氮气氛围下缓慢滴加饱和氯化铵溶液淬灭,并用乙酸乙酯萃取 (15 mL × 3),合并有机相,饱和氯化钠水溶液洗涤后,加入无水硫酸镁干燥,过滤除去固体,滤液减压除去溶剂,经硅胶柱层析 (V(二氯甲烷) :V(乙酸乙酯) = 40 : 1) 分离纯化制得A-7~A-13和B-7。
(5R,8R,9S)-9-(3,4-二甲氧基苯基)-3,4-二甲氧基-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(A-7):黄色油状物67 mg,产率42%.1H NMR (400 MHz, CDCl3),δ:6.93 (s,1H), 6.88 (d,J= 8.9 Hz, 1H), 6.73 (dd,J= 8.9, 3.1 Hz, 1H),6.52 (s, 1H), 5.99 (d,J= 3.1 Hz, 1H), 5.05 (s, 1H), 4.96 (d,J=5.7 Hz, 1H), 4.67 (dd,J= 7.7, 2.0 Hz, 1H), 3.96 (s, 3H), 3.90(s, 3H), 3.80 (s, 3H), 3.59 (s, 3H), 2.50~2.37 (m, 1H),2.14~1.95 (m, 2H), 1.89~1.79 (m, 1H);13C NMR (100 MHz,CDCl3),δ:158.0, 147.8, 147.1, 131.3, 131.1, 128.4, 123. 9,110.0, 105.5, 81.9, 75.5, 56.3, 55.8, 55.6, 34.6, 22.5. ESIHRMS:m/z[M+H]+C21H25O6计算值:373.165 1,测量值:373.165 4.
(5R,8R,9S)-9-(3,4-二甲氧基苯基)-2,3-二甲氧基-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(B-7):红棕色固体93 mg,产率58%,m.p. 118~119℃.1H NMR (400 MHz,CDCl3),δ:7.14 (d,J= 2.1 Hz, 1H), 6.86~6.77 (m, 2H), 6.74(d,J= 8.4 Hz, 1H), 6.67 (dd,J= 8.4, 2.1 Hz, 1H), 5.09 (d,J=5.9 Hz, 1H), 4.60 (s, 1H), 4.26 (dd,J= 7.6, 1.9 Hz, 1H), 3.86(s, 3H), 3.83 (s, 3H), 3.82 (s, 3H), 3.19 (s, 3H), 2.56~2.44 (m,1H), 2.17~1.96 (m, 2H), 1.80 (m, 1H);13C NMR (100 MHz,CDCl3),δ:151.8, 148.5, 147.9, 147.4, 142.1, 133.6, 132.2,119.6, 118.9, 112.0, 110.2, 109.3, 82.6, 77.0, 76.4, 60.0, 56.0,55.9, 55.9, 34.4, 29.8, 23.2. ESI-HRMS:m/z[M+H]+C21H25O6计算值:373.165 1,测量值:373.165 3.
(5R,8R,9R)-9-(2,5-二甲氧基苯基)-3,4-二甲氧基-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(A-8):黄色固体112 mg,产率70%,m.p. 152~154℃.1H NMR (400 MHz,CDCl3),δ:6.93 (s, 1H), 6.87 (d,J= 8.9 Hz, 1H), 6.72 (dd,J=8.9, 3.1 Hz, 1H), 6.52 (s, 1H), 5.99 (d,J= 3.1 Hz, 1H), 5.06 (s,1H), 4.96 (d,J= 5.7 Hz, 1H), 4.67 (dd,J= 7.7, 2.0 Hz, 1H),3.95 (s, 3H), 3.89 (s, 3H), 3.80 (s, 3H), 3.58 (s, 3H), 2.50~2.36(m, 1H), 2.14~1.94 (m, 2H), 1.88~1.78 (m, 1H);13C NMR(100 MHz, CDCl3),δ:153.4, 150.4, 148.6, 148.5, 136.1,133.3, 127.9, 119.1, 111.8, 111.4, 111.3, 105.7, 80.9, 77.9,77.1, 56.1, 56.0, 55.9, 55.5, 34.7, 22.8. ESI-HRMS:m/z[M+H]+C21H25O6计算值:373.165 1,测量值:373.164 9.
(5R,8R,9R)-9-(2,6-二甲氧基苯基)-3,4-二甲氧基-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(A-9):黄色固体82 mg,产率52%,m.p. 174~175℃.1H NMR (400 MHz,CDCl3),δ:7.18 (t,J= 8.3 Hz, 1H), 7.00 (s, 1H), 6.59 (d,J=8.4 Hz, 2H), 6.50 (s, 1H), 5.54 (s, 1H), 5.00 (d,J= 5.7 Hz,1H), 4.70 (dd,J= 7.9, 2.1 Hz, 1H), 3.88 (s, 3H), 3.80 (s, 3H),3.54 (s, 6H), 2.49~2.36 (m, 1H), 2.15~2.03 (m, 1H), 2.02~1.82(m, 2H);13C NMR (100 MHz, CDCl3),δ:158.3, 148.1, 147.4,131.6, 131.4, 128.7, 124.2, 110.3, 105.8, 82.2, 75.8, 56.7, 56.1,56.0, 34.9, 22.8.ESI-HRMS:m/z[M+H]+C21H25O6计算值:373.165 1,测量值:373.165 4.
(5R,8R,9S)-3,4-二甲氧基-9-苯基-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(A-10):淡黄色固体102 mg,产率68%,m.p. 85~87℃.1H NMR (400 MHz, CDCl3),δ:7.32~7.20 (m, 5H), 6.71 (s, 1H), 6.56 (s, 1H), 5.04 (d,J= 5.6 Hz, 1H), 4.44~4.38 (m, 1H), 3.89 (s, 3H), 3.73 (s, 3H),2.33~2.24 (m, 1H), 2.19~2.05 (m, 2H), 1.90~1.73 (m, 1H);13C NMR (100 MHz, CDCl3),δ:148.8, 148.6, 147.8, 133.2,129.8, 128.0, 127.2, 127.0, 110.3, 106.0, 83.2, 76.6, 56.1, 34.2,23.4. ESI-HRMS:m/z[M+H]+C19H21O4计算值:313.144 0,测量值:313.144 3.
(5R,8R,9S)-3,4-二甲氧基-9-丙基-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(A-11):白色固体91 mg,产率76%,m.p. 122~123℃.1H NMR (400 MHz,CDCl3),δ:6.95 (s, 1H),6.44 (s, 1H), 4.92 (d,J= 5.2 Hz, 1H), 4.45~4.37 (m, 1H), 3.85(s, 3H), 3.83 (s, 3H), 2.08~1.91 (m, 3H), 1.89~1.71 (m, 3H),1.35~1.26 (m, 2H), 0.89 (t,J= 7.3 Hz, 3H);13C NMR (100 MHz, CDCl3),δ:148.4, 148.1, 132.0, 131.4, 109.4, 106.3,79.4, 74.7, 56.1, 56.0, 42.7, 34.4, 26.0, 23.3, 22.8, 14.2. ESIHRMS:m/z[M+H]+C16H23O4计算值:279.159 6, 计算值:279.159 6,测量值:279.159 9.
(5R,8R,9S)-3,4-二甲氧基-9- (3-苯基丙基) -6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(A-12):白色固体89 mg,产率59%,m.p. 121~123℃.1H NMR (400 MHz, CDCl3),δ:7.31~7.25 (m, 2H), 7.21~7.15 (m, 3H), 6.94 (s, 1H), 6.47 (s,1H), 4.96 (d,J= 5.4 Hz, 1H), 4.47~4.39 (m, 1H), 3.87 (s, 3H),3.86 (s, 3H), 2.70~2.54 (m, 2H), 2.16~1.98 (m, 4H), 1.97~1.84(m, 2H), 1.77~1.68 (m, 2H);13C NMR (100 MHz, CDCl3),δ:148.5, 148.2, 142.5, 132.1, 131.0, 128.5, 128.4, 125.8,109.3, 106.3, 79.6, 74.7, 56.1, 56.1, 42.7, 36.4, 34.3, 25.9,22.9. ESI-HRMS:m/z[M+H]+C22H27O4计算值:355.190 9,测量值:355.191 2.
(5R,8R,9S)-3,4-二甲氧基-9-(八氢-3aH-2,5-甲氧基-3a-基)-6,7,8,9-四氢-5H-5,8-环氧苯并[7]环烯-9-醇(A-13):白色固体103 mg,产率65%,m.p. 115~117℃.1H NMR (400 MHz, DMSO-d6),δ:8.78 (s, 1H), 6.57 (s, 1H), 5.07 (d,J=5.5 Hz, 1H), 4.24~4.13 (m, 1H), 3.73 (s, 3H), 3.63 (s, 3H),2.18~2.02 (m, 1H), 1.97~1.37 (m, 9H), 1.36~1.16 (m, 5H),0.90~0.79 (m, 4H);13C NMR (100 MHz, DMSO-d6),δ:151.4, 147.6, 147.3, 143.8, 136.4, 134.3, 119.9, 110.3, 106.7,101.3, 78.4, 73.0, 71.8, 60.2, 55.5, 42.5, 33.2, 25.5, 22.9, 22.3,14.2. ESI-HRMS:m/z[M + H]+C23H31O4计算值:371.222 2,测量值:371.222 5。
1.3.3 目标化合物对南方根结线虫的致死活性测试 采用浸虫法测定[13]。用无菌水将供试线虫配制成80~100 条/mL 的线虫水溶液,备用。用移液枪各吸取1 mL 线虫水溶液加入12 孔板中,同时吸取配制好的各浓度目标化合物水溶液 (用适量DMF 溶解化合物,加入少量吐温-80 后,用无菌水稀释至所需浓度) 1 mL 加入样品孔,轻微振荡使药液混合均匀,于28 ℃光照培养箱中培养。以加等量DMF 和吐温-80 的无菌水为空白对照,以Waltherione A 和阿维菌素为阳性对照,每个浓度设3 次平行,3 次重复试验,观察记录24、48、72 h 后线虫的死亡情况,按 (1) 式计算线虫的校正死亡率。
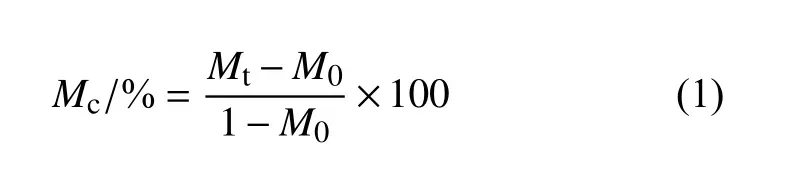
其中:Mc为校正死亡率,Mt为处理组死亡率,M0为对照组死亡率。
2 结果与分析
2.1 Waltherione A 类似物的合成
本研究顺利完成了12 个苯并七元氧桥环Waltherione A 类似物的合成,其中A-7~A-13 和B-7 8 个化合物未见文献报道,所有目标化合物的结构均经1H NMR、13C NMR 和高分辨质谱确证。
文献中以3,4-二甲氧基苯甲醛为原料,利用烯烃复分解反应来获得中间体A-1,该反应中需要使用Grubbs 催化剂,价格较贵且收率不高(41%)[9];而本研究利用试剂相对廉价的Wittig 反应代替烯烃复分解反应,产率同时也提高到60%以上。
反应的第5 步通过分子内傅-克烷基化反 应形成苯并七元氧桥环是本次合成中最为关键的部分,所用到的SnCl4为路易斯酸,具有吸电子效应,导致氧碳鎓阳离子的形成。该反应具有很强的区域选择性,虽然芳环上有C2、C6 两个反应位点,但是C2 的空间位阻较大,不利于反应进行,故反应高度区域选择性在C6 位发生 (反应机理见图式3)[12]。
关于目标化合物的非对映选择性,当A-4 用SnCl4处理时,可形成氧羰基阳离子,存在两种反应性构象 (图式3 中Ⅰ和Ⅱ),但由于几何约束,能量更低的中间体Ⅰ不利于通过分子内酰化反应而发生环化,而中间体Ⅱ是化合物Ⅰ环翻转后的产物,其取代苄基位于直立键位置,更容易发生Marson 环化反应[12]。
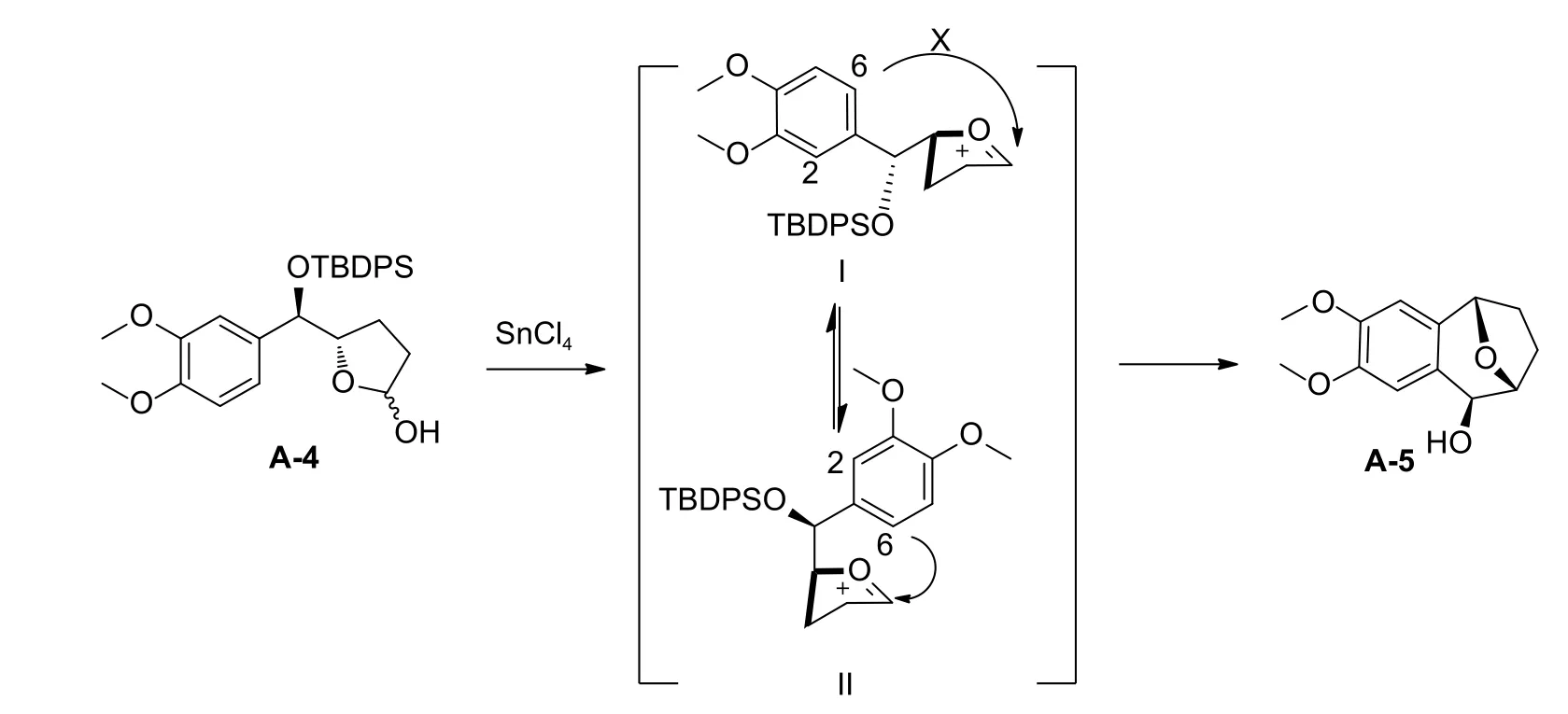
图式3 合成目标化合物A-5 的反应机理Scheme 3 Reaction mechanism of synthesis of target compound A-5
2.2 Waltherione A 类似物的杀线虫活性
如表2 所示,虽然目标化合物对南方根结线虫有一定杀虫活性,但均较差,只有A-12 在200 μg/mL 下对南方根结线虫2 龄幼虫 72 h 的致死率达到了69.7%。化合物A-5 与B-5、A-6 与B-6、A-7 与B-7 对线虫的致死率相差不大,说明在该结构中,X 部分苯环上甲氧基的连接位点的变化对化合物杀线虫活性的影响不大;而通过在七元桥环外连接取代基的方式得到的化合物A-7~A-13 和B-7 的活性略有提高,表明Z 部分取代基对提高该类结构杀线虫活性有一定积极作用。相较于脂肪烃取代基,七元桥环外连芳香烃取代基更有利于化合物杀线虫活性的提升,且苯环上取代基的有无和连接位点的差异并不会引起活性发生较大的变化。同时,引入大空间位阻取代基,与引入其他小空间位阻取代基对于杀线虫活性没有明显差异,说明活性提升更重要的还是取代基是否具有芳香环结构。

表2 目标化合物对南方根结线虫的致死活性 (校正死亡率/%)Table 2 Nematicidal activity of the target compounds against Meloidogyne incongnita (Adjusted mortality/%)
3 结论
本研究设计合成了一系列Waltherione A 的结构简化类似物,探索出Waltherione A 结构中与苯并七元氧桥环相连的取代基与杀线虫活性之间的构效关系,为进一步优化先导结构而发现活性更高的绿色杀线虫剂提供了研究思路。在化合物合成方法方面,对文献方法[9]加以改进,用Wittig反应代替烯烃复分解反应,在降低成本的同时提高了20%的产率。从杀线虫活性结果来看,尚未得到一个与Waltherione A 杀线虫活性相媲美的化合物,推测Waltherione A 结构中七元氧桥环部分(Y 部分) 和与桥环相连的取代基部分 (Z 部分) 同时存在对杀线虫活性的必要性,为下一步开展Waltherione A 结构优化以发现活性更优的杀线虫化合物奠定了基础和指明了方向。
