茶树转录因子CsbHLH137基因鉴定及光合特性与生物钟响应分析
2022-04-06刘春方刘文艳滕瑞敏刘洁霞
刘春方,刘文艳,滕瑞敏,杨 妮,刘洁霞,庄 静*
(1 南京农业大学 园艺学院,茶叶科学研究所,农业农村部华东地区园艺作物生物学与种质创制重点实验室,南京 210095;2 南京农业大学,作物遗传与种质创新国家重点实验室,南京 210095)
茶树[Camelliasinensis(L.) O. Kuntze]作为一种重要的叶用经济作物,在世界范围内广泛栽培。茶树生长在不同的环境条件下,光是影响茶树生长发育的重要因素之一[1]。茶树利用光吸收的能量来促进光合作用,也通过监测光的光谱组成、强度(光通量速率)、方向和时空模式来获得关于周围环境的信息。茶树依靠这些信息对环境变化做出反应,调控生长和发育,以适应当地环境条件[2]。光合能力是茶树生长的关键驱动力,光合参数和叶片气孔开度一定程度上反映茶树的光合能力。
昼夜节律被定义为在大约24 h的振荡中发生的内源性生物过程,也被称为生物钟[3]。生物钟作为内源计时分子网络,可以测量环境中的每日和季节变化,并允许植物相应地调整生理和发育过程[4]。昼夜节律受制于周期性的环境信号,并且可以通过各种刺激(如光信号)来重置。因此,生物钟整合了环境信号,并协调了植物整个生命周期中的发育事件[5]。
bHLH家族转录因子的bHLH结构域高度保守,由大约60个氨基酸组成,有两个功能不同的区域,即碱性区域和HLH(helix-loop-helix)区域[6]。HLH结构域的主要功能为促进蛋白质间相互作用,并且能形成同源二聚体和异源二聚体复合物[7]。bHLH的N端基本区域介导与特定六核苷酸序列的高亲和力DNA结合,bHLH蛋白识别的核心DNA序列基序称为E-box(5′-CANNTG-3′),bHLH结构域碱性区域的3个残基是His/Lys-9、Glu-13和Arg-17,构成了典型的G-box结合区[8]。bHLH家族转录因子在植物生长发育过程中发挥着重要作用,其中包括光信号传导、果实和花发育以及气孔发育等[9]。越来越多的bHLH蛋白在植物中的功能得到了鉴定,调节对环境的反应是植物bHLH蛋白保留的一个原始功能,例如通过生物钟的组成部分控制对光的反应和相互作用[10]。
植物中的bHLH137最早在拟南芥中鉴定出来,随后在水稻、大白菜、蓝莓和番茄中鉴定到同源基因,如水稻OsbHLH80基因、大白菜BrabHLH139基因和蓝莓VcbHLH004基因[6, 11-13]。在拟南芥中,bHLH转录因子可以聚为12个亚组,AtbHLH137转录因子属于Ⅻ亚组,划分为32个亚家族,AtbHLH137转录因子属于25亚家族,预测DNA结合基序包含G结合基序、E-box结合基序和G-box结合基序,该亚家族成员参与植物体内油菜素甾体和脱落酸信号转导,调控花瓣形态发生[10, 14-15]。AtbHLH137属于DELLA蛋白应答基因,DELLA蛋白是受光调控的生长抑制因子,DELLA蛋白已被证明在植物体内直接与光敏色素作用因子(phytochrome-interacting factors,PIFs)相互作用,抑制其转录活性,在整合光和时钟信号以驱动日常生长节律方面起着关键作用[16-18]。目前鉴定出茶树bHLH家族转录因子主要参与茶树类黄酮合成和非生物胁迫。有研究筛选出7个bHLH家族转录因子基因参与茶树类黄酮生物合成途径[19]。此外有研究提出了茶树中与非生物胁迫相关的bHLH家族成员[9]。
茶树bHLH转录因子调控昼夜节律的表达情况和作用机理尚不清楚。本研究以茶树‘蒙山9号’为材料,克隆获得1个编码CsbHLH137转录因子的基因,对该基因编码的氨基酸序列进行了序列比对、亚细胞定位、理化性质、亲水性和疏水性等方面的分析,并研究了其进化树、二级和三级结构。对不同时间点的茶树叶片进行气孔开度分析和光合参数测定,通过实时荧光定量PCR技术研究了茶树CsbHLH137转录因子基因在昼夜节律中的响应情况,旨在为进一步研究茶树CsbHLH137转录因子对茶树生物钟的分子调控机制提供一定的参考。
1 材料和方法
1.1 试验材料与处理
供试材料为茶树‘蒙山9号’[Camelliasinensis(L.) O. Kuntze cv. Mengshan 9]两年生扦插盆栽幼苗,种植在南京农业大学作物遗传与种质创新国家重点实验室的实验大棚。
选取长势良好的‘蒙山9号’两年生扦插幼苗,茶苗在12 h光照和12 h黑暗条件下(12:00-24:00光照)的光培箱预培养2 d,从中午12:00开始取样,之后24 h每隔2 h随机选取健康植株,每株摘取一芽二叶初展叶片,每个处理设置3个生物学重复,提取RNA进行反转录成cDNA,用于实时定量的模板。随机选取6株长势一致的健康植株测定叶片光合参数,每株重复测定5次。将不同时间点采集的茶树叶片进行气孔切片制作。
1.2 测定指标与方法
1.2.1 叶片气孔切片分析采用指甲油印迹法测定叶片气孔开度[20]。每个处理随机选取长势一致的3株茶苗,测定第2片叶的气孔。先擦去叶片表面的灰尘,然后在叶片背面均匀涂抹指甲油,待指甲油自然晾干后,用透明胶带黏贴叶片下表皮,粘取指甲油层,用手指抹平胶带,使胶带与指甲油之间充分接触,无气泡,撕取粘有指甲油层的胶带,再贴至载玻片上,制成临时玻片作为样本,用Olympus光学显微镜(Olympus,Tokyo,Japan)观察气孔,测量其长度(纵径,即哑铃形保卫细胞的长度)与宽度(横径,即垂直于哑铃形保卫细胞的最宽值),最后计算气孔开度,测定气孔的面积用来表示气孔开度。气孔开度=π·ab,a=1/2气孔长度,b=1/2气孔宽度。
1.2.2 叶片光合参数测定使用Li-6400便携式光合仪(美国Li-COR公司)测定茶苗光合气体交换参数。测定指标包括叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等。测定条件控制为光强600 μmol·m-2·s-1、CO2浓度400 μmol·mol-1、叶室温度(25±1)℃,相对湿度70%~80%。
1.2.3 总RNA提取和cDNA合成茶树叶片总RNA的提取按照多糖多酚植物总RNA提取试剂盒说明书(上海浦迪生物科技有限公司)进行。RNA样品浓度采用NanoDrop ND 1000(上海谱元仪器有限公司)微量紫外分光光度计检测,RNA质量用1.2%凝胶电泳检测。参照HiScript II Q RT SuperMix for qPCR (+ gDNA wiper)试剂盒(南京诺唯赞生物科技有限公司)说明书将总RNA反转录成cDNA。
1.2.4CsbHLH137基因的克隆基于茶树基因组(http://tpdb.shengxin.ren/)数据[21],设计1对特异引物,上游引物CsbHLH137-QF序列为5′-ATGGCAACTTTTGCAAATTACCAACA-3′,下游引物CsbHLH137-QR序列为5′-TTATAAAATTGGGGTGTCCCAAAATG-3′。PCR扩增体系为20 μL,包含7 μL ddH2O、10 μL 2×PrimeSTAR Max Premix酶、1 μL cDNA模板和上下游引物各1 μL。PCR扩增程序:98 ℃预变性10 s;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸15 s,共35个循环;最后72 ℃延伸10 min。用1.2%琼脂糖凝胶电泳分离PCR产物并将其回收,与pMD19-T载体连接,转化至大肠杆菌感受态细胞。挑取阳性克隆菌液送至擎科生物公司测序。
1.2.5 基因表达量的测定参照Hieff qPCR SYBR Green Master Mix(No Rox)试剂盒(上海翊圣生物科技有限公司)的操作说明进行实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR),CFX96TMreal-time PCR system作为荧光定量PCR平台。采用相对定量的方法,以茶树actin为内参基因[22]。反应体系为20 μL:SYBR Mix 10 μL,上下游引物各1 μL,cDNA 1 μL,ddH2O 7 μL。扩增程序设置为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40个循环。使用2-ΔΔCT法计算相对表达量[23]。
1.2.6 生物信息学分析在NCBI网站(http://www.ncbi.nlm.nih.gov)预测序列保守域,并用BLAST进行序列同源性比较。利用DNAMAN 8.0软件进行氨基酸序列多重比对和亲/疏水性分析。登陆SMS(http://www.bio-soft.net/sms)和ExPASy(http://web.expasy.org/protparam)分析氨基酸序列组成及理化性质。利用FoldIndex网站(https://fold.weizmann.ac.il/fldbin/findex)分析氨基酸折叠无序化特性。蛋白亚细胞定位采用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/ bioinf/Cell-PLoc-2/)预测。拟南芥AtbHLH137转录因子蛋白全长序列登陆TAIR(https://www.arabidopsis.org)下载,并利用MEGA X软件构建系统进化树[24]。采用NetPhos 2.0(http://www.cbs.dtu.dk/services/NetPhos-2.0/)预测磷酸化位点。跨膜结构和信号肽分别利用TMpred(https://embnet.vitalit.ch/software/TMPRED_form.html)和SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP-4.1)进行预测。蛋白质二级结构预测采用SOPMA在线网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行。登陆Swiss-Model(http://www.Swissmodel.expasy.org)预测蛋白质三级结构,并利用PyMOL软件生成三级结构模型。使用STRING网站(https://string-db.org)预测茶树CsbHLH137转录因子与其他蛋白的相互作用。
1.2.7 数据处理对所测试验数据使用IBM SPSS Statistics 25.0软件进行差异显著性分析,采用Duncan’s多重比较法(P<0.05),使用GraphPad Prism 8绘制折线图。
2 结果与分析
2.1 茶树CsbHLH137转录因子基因的克隆
以茶树叶片cDNA为模板,通过引物CsbHLH137-QF和CsbHLH137-QR进行PCR扩增,得到1 000 bp左右的扩增片段。对扩增产物进行测序与分析,结果表明茶树CsbHLH137基因开放阅读框为1 023 bp,共编码340个氨基酸。CsbHLH137基因序列登录号为OL332046。
2.2 茶树CsbHLH137转录因子进化树分析
为探究茶树CsbHLH137转录因子的进化关系,选取拟南芥(Arabidopsisthaliana)、猕猴桃(Actinidiadeliciosa)、蓖麻(Ricinuscommunis)等12个物种的bHLH137的氨基酸序列,与茶树CsbHLH137转录因子氨基酸序列构建同源进化树(图1)。图1显示,CsbHLH137转录因子与猕猴桃(A.deliciosa)、蓝莓(V.corymbosum)等物种有较近的亲缘关系,与毛果杨(P.trichocarpa)、野生大豆(G.soja)等物种亲缘关系较远。
2.3 茶树CsbHLH137转录因子与其他植物相关氨基酸序列比对
茶树CsbHLH137转录因子保守域预测结果(图2,A)显示,bHLH_AtBPE_like保守结构域位于该转录因子第165~249氨基酸位点之间,CsbHLH137转录因子的N端基本区域介导与特定六核苷酸序列的高亲和力DNA结合,HLH区域形成同二聚体和异二聚体。将茶树CsbHLH137转录因子氨基酸序列与其他物种bHLH类转录因子氨基酸序列进行BLAST比对,结果显示,茶树与猕猴桃(A.deliciosa)、蓝莓(V.corymbosum)、葡萄(V.vinifera)等物种的bHLH类转录因子相似性为61.86%(图2,B)。
2.4 茶树CsbHLH137转录因子氨基酸组成及理化性质分析
运用ExPASy网站对茶树、拟南芥和猕猴桃等13个物种bHLH137转录因子蛋白的组成成分和理化性质进行分析[25]。由表1可知,bHLH137转录因子蛋白相对分子量在31.77~40.63 kD之间,蛋白残基数为286~364之间,理论等电点pI为5.59~8.75,茶树CsbHLH137转录因子蛋白平均疏水性约为-0.728。不同植物中各氨基酸种类所占比例不同,其中碱性氨基酸所占比例普遍高于酸性氨基酸,脂肪族氨基酸高于芳香族氨基酸,总平均疏水性(Grand average of hydropathicity)均为负值,不同物种bHLH137转录因子蛋白理化性质相近且属于亲水性蛋白。利用NetPhos 2.0对CsbHLH137蛋白磷酸化位点进行预测,结果表明,该多肽链0.5以上分值的氨基酸位点为20个,其中包含17个丝氨酸(S)和3个苏氨酸(T)磷酸化位点。
2.5 茶树CsbHLH137转录因子蛋白亚细胞定位预测、氨基酸亲疏水性及无序化结构分析
利用Cell-PLoc 2.0对茶树CsbHLH137转录因子蛋白亚细胞定位预测,结果显示CsbHLH137转录因子蛋白主要定位于细胞核。由此推断,茶树CsbHLH137转录因子蛋白主要在细胞核中发挥生物学作用。CsbHLH137转录因子蛋白氨基酸序列的亲水性和疏水性分析结果显示,该转录因子疏水性最强的位点是第199位谷氨酰胺(Gln),其次是第253位丙氨酸(Ala);亲水性最强的是第142位赖氨酸(Lys),其次为第103位精氨酸(Arg)和第104位赖氨酸(Lys);大部分氨基酸属于亲水性氨基酸。总平均疏水性为负值,表明CsbHLH137转录因子蛋白属于亲水性蛋白。利用FoldIndex对CsbHLH137转录因子进行氨基酸序列折叠无序化分析,结果表明,该转录因子存在4个氨基酸无序化区域,最长无序区数目为116,共包含206个氨基酸,无序化比例为60.59%,无序化特征明显(图3)。
2.6 茶树CsbHLH137转录因子信号肽、跨膜结构、二级和三级结构预测与分析
经信号肽预测分析可知,CsbHLH137转录因子mean S-score的值小于0.5,表明CsbHLH137转录因子蛋白不存在信号肽序列,可能不属于分泌蛋白。利用Tmpred在线网站进行跨膜结构预测,结果显示,CsbHLH137转录因子蛋白TM-螺旋长度在17~33之间,不存在由内至外螺旋和由外至内螺旋,由此推测CsbHLH137转录因子属于非跨膜蛋白,没有跨膜区域。
对茶树CsbHLH137转录因子二级结构进行预测,该转录因子的组成为α-螺旋有81个氨基酸,占比23.82%;延伸主链有39个氨基酸,占比11.47%;β-折叠有10个氨基酸,占比2.94%;随机卷曲有210个氨基酸,占比61.76%。因此,CsbHLH137转录因子主要由α-螺旋和随机卷曲组成,α-螺旋、延伸主链和随机卷曲贯穿于整个氨基酸链,β-折叠主要分布在氨基酸链的第170个氨基酸之后。采用Swiss-Model对CsbHLH137转录因子进行蛋白质三级结构建模分析,推测为同源二聚体,MITF/CLEAR box结构。其HLH结构域含有2个α-螺旋和3个β-折叠(图4),该转录因子三级结构以随机卷曲和α-螺旋为主,推测结果与二级结构相吻合。
2.7 茶树CsbHLH137转录因子蛋白相互作用网络
利用STRING在线网站,通过比对,以拟南芥AtbHLH137转录因子为模板构建了茶树CsbHLH137转录因子的蛋白相互作用网络。结果发现,CsbHLH137转录因子与光敏色素E(phytochrome E,PYE)作用较为直接,与R2R3-MYB基因家族转录因子MYB60存在共同表达的关系,同时与MYB转录因子MYB117、MYB105和MYB110关系密切。另外,二氢黄酮醇还原酶DFR与MYB转录因子MYB60、MYB89、MYB105、MYB110和MYB117构成一个复杂的蛋白互作网络,调控的转录网络可能在调节生物钟介导的生理反应中发挥重要作用(图5)。
2.8 不同时间点茶树叶片气孔开度及光合参数分析
不同时间点茶树叶片的气孔开度不同(图6)。与对照0 h相比,2 h和12 h显著促进叶片的气孔开度,分别高于对照34.99%和21.97%,4 h和18 h气孔开度显著降低,分别低于对照16.7%和17.95%。施加光照的12 h中,气孔开度呈现先上升后下降的趋势,在2 h的气孔开度为光照处理下的最大气孔开度。黑暗处理的12 h中,气孔开度呈现先下降后上升的趋势,在18 h的气孔开度为黑暗处理下的最小气孔开度。从表2可以看出,相较黑暗处理,光照处理对茶树叶片气孔开度的影响在调节气孔宽度方面更为明显。净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)是反映植物叶片光合作用最主要的指标。如图7所示,茶树叶片Pn、Gs和Tr均在4 h显著下降达到最低值,分别为对照的0.06、0.11和0.13倍,Ci在2 h显著下降达到最低,为对照的0.08倍。整体来看Gs、Ci和Tr在白天波动较大,从0 h开始显著降低,出现最低值后显著升高,之后在夜间维持较稳定状态,无显著变化。
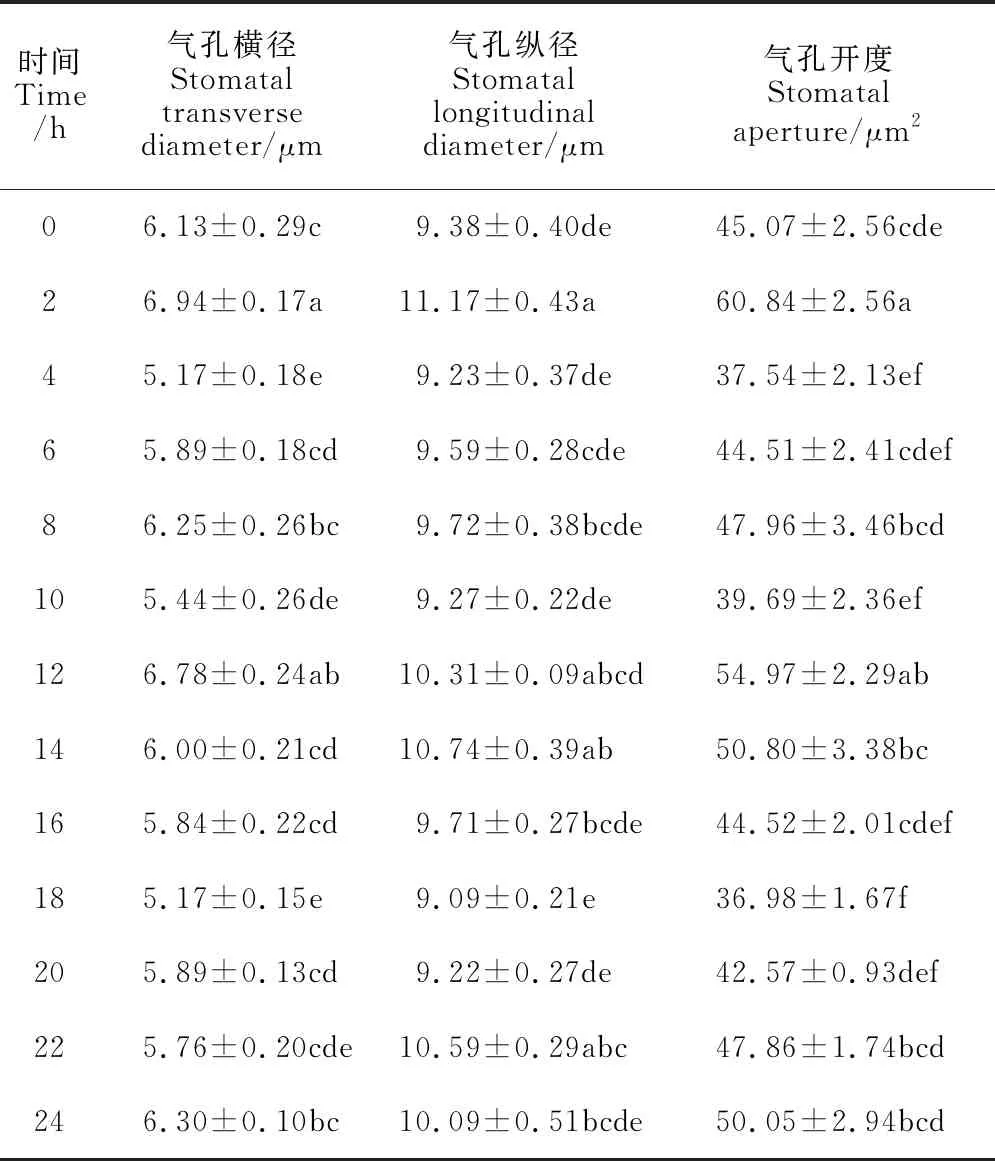
表2 不同时间点对茶树叶片气孔开度的影响
2.9 茶树CsbHLH137转录因子基因的表达分析
采用实时荧光定量PCR技术检测CsbHLH137转录因子基因在茶树的表达水平(图8)。CsbHLH137转录因子基因在一个生物钟周期中均有表达,在0、6和24 h的表达量显著高于其他时间段。在光照12 h/黑暗12 h条件下24 h内不同时间点CsbHLH137转录因子基因的动态检测结果显示,从0 h开始施加光照该基因的表达量降低,4 h的基因表达量为对照的0.23倍,从4 h开始表达量显著升高,在6 h达到最高值,之后下降,到16 h时降到最低水平,16 h的基因表达量为对照的0.14倍;进入黑夜后基本维持平稳的低表达水平,后随时间发生改变,在22 hCsbHLH137表达量显著提高,24 h的基因表达量为对照的0.84倍。从不同时间节点来看,在黑夜进入白天的分界点0 hCsbHLH137表达量最高。结果表明CsbHLH137转录因子基因在白天表达量高,在光照后6 h出现一个峰值,之后呈下降趋势,夜间表达量最低,整体表达呈节律性变化。
3 讨 论
3.1 植物中的转录因子及与生物钟调控
植物生物钟振荡器以大约24 h的固有周期运行,植物生理节律如气孔开度控制和光合作用的一个主要来源是转录本积累的昼夜节律调节,它影响到大约40%的拟南芥基因[26-29]。转录因子家族的节律性表达广泛地参与昼夜节律的调节,如MYB、bHLH和bZIP转录因子家族[30]。一直以来,昼夜节律机制相关的大多数分子成分在细胞核中作为转录调节因子发挥作用[31-32]。另外转录因子与植物生长发育和逆境胁迫响应密切相关[33-35]。
3.2 CsbHLH137与赤霉素GA信号传导
植物经历两种不同的生长发育过程,这取决于它们是在黑暗中生长(暗形态建成)还是在光存在下生长(光形态建成),这两条途径之间的过渡受到严格监管。来自拟南芥的研究表明,赤霉素GA是调节光形态发生的主要激素[36]。拟南芥AtbHLH137是GA信号传导途径关键基因RGA的下游靶基因,参与GA介导的发育过程调控[37]。DELLA蛋白是GRAS转录调控因子的一个亚家族,通过负调控赤霉素信号来抑制GA介导的反应[38]。AtbHLH137基因受到DELLA蛋白的强烈调控,DELLA蛋白诱导AtbHLH137转录因子作为GA信号的阻遏因子[17]。
3.3 CsbHLH137蛋白结构与互作
茶树CsbHLH137转录因子和其他多个物种进行序列比对,均存在HLH结构域,且一致性高达61.86%,说明茶树CsbHLH137转录因子基因在进化过程中相对保守。采用Swiss-Model对CsbHLH137转录因子进行蛋白质三级结构建模分析,其HLH结合域推测为同源二聚体,MITF/CLEAR box结构。在拟南芥中,AtbHLH137转录因子可以单独或作为异源二聚体成为GA信号的阻遏因子,茶树CsbHLH137转录因子因具有与其相似的结构域可能行使相同的功能[37]。
蛋白相互作用网络分析结果表明CsbHLH137转录因子与光敏色素作用较为直接,研究表明红光受体的作用与生物钟之间的直接联系已经建立[39]。一方面,光敏色素介导光信号向核心时钟的传递机制已确立;另一方面,大多数光调控过程都是由时钟调制的,这说明了光和时钟信号通路之间复杂的相互作用[40-43]。此外,研究表明植物昼夜节律的核心调控成分是主要由MYB相关转录因子组成[3]。CsbHLH137转录因子与MYB基因家族转录因子MYB60存在共同表达的关系,同时与其他MYB转录因子关系密切,表明CsbHLH137可能在生物钟介导的各种过程中发挥重要作用。
3.4 CsbHLH137基因表达与生物钟
本研究表明,茶树CsbHLH137转录因子基因在白天的表达量高且出现峰值,在夜间维持平稳的低表达水平,推测茶树CsbHLH137转录因子基因受到DELLA蛋白的调控,DELLA蛋白诱导CsbHLH137转录因子作为GA信号的阻遏因子调控光形态发生。研究表明DELLA蛋白的表达符合昼夜节律,其表达在白天达到高峰,在晚上表达水平较低[44]。DELLA蛋白受光控制,它的光调节为在一系列环境光条件下实施生长抑制[37]。相对于夜间,DELLA蛋白在白天更稳定,DELLA蛋白与GA受体蛋白的相互作用可以被核心时钟蛋白GI抑制,GI可以在光照条件下结合和稳定DELLA蛋白,调节DELLA蛋白的日节律积累模式[45-46]。通过对比茶树CsbHLH137转录因子基因在昼夜节律中的表达特性,推测CsbHLH137转录因子基因为DELLA蛋白的应答基因,在光照条件下DELLA蛋白表达水平高导致CsbHLH137表达上调并出现峰值,在黑暗条件下DELLA蛋白表达较低导致CsbHLH137夜间表达维持低水平状态。相较黑暗处理,光照处理在调节茶树叶片气孔宽度方面更为明显,光合参数Gs、Ci和Tr在白天波动较大,夜间维持较稳定状态的结果与CsbHLH137转录因子基因节律性表达情况相符,一定程度上表明,CsbHLH137转录因子基因可能受到DELLA蛋白调控,参与光形态建成。
本研究克隆了CsbHLH137转录因子基因并分析了其生物钟的表达情况,分析了茶树CsbHLH137转录因子基因对昼夜节律的响应,初步推测CsbHLH137转录因子基因作为DELLA蛋白应答基因参与茶树的光形态建成,但其在茶树中可能存在的作用机制仍需要进一步深入研究。
