左心耳封堵术后器械相关血栓形成的单中心回顾性研究
2022-04-06杨文杰陈艳红张勇华屈璐璐苏晞
杨文杰 陈艳红 张勇华 屈璐璐 苏晞
非瓣膜性心房颤动(房颤)是临床上常见的心律失常,其发生卒中的风险是非房颤患者的5.6倍,每年5%左右[1]。解剖学及外科手术相关数据证实,在非瓣膜性房颤患者中,90%心房血栓来源于左心耳[2]。目前,左心耳封堵术已经发展成为非瓣膜性房颤患者预防卒中的一种有效安全的替代治疗方案,尤其适用于存在长期口服抗凝药禁忌证或出血高危的患者,目前我国房颤指南予以Ⅱa类推荐[3]。
器械相关血栓形成是左心耳封堵术后的一种并发症,可能会增加血栓栓塞事件的风险。左心耳封堵术后器械相关血栓形成总发生率为3.5%。Amplatzer Cardiac Plug(ACP)和WATCHMAN两种封堵器的器械相关血栓形成发生率比较,差异无统计学意义(P=0.24)。器械相关血栓形成会增加4~5倍卒中的风险[4]。器械相关血栓形成与封堵器表面内皮化不完全相关。为确保术后封堵器表面完全内皮化、预防器械相关血栓形成,左心耳封堵术后应予以充分抗栓治疗,目前研究已证实,抗栓治疗是器械相关血栓形成的一种保护因素[5]。患者临床基线资料及左心耳解剖学特征可能会影响左心耳封堵术后器械相关血栓的形成。关于WATCHMAN左心耳封堵术后器械相关血栓形成的多因素Logistic回归分析显示,CHA2DS2-VASc评分较高及封堵器置入较深与器械相关血栓形成有关[6]。目前国内外有少量关于左心耳封堵术后器械相关血栓形成的研究报道,关于左心耳封堵术后器械相关血栓形成的影响因素及其临床预后尚处于研究阶段。本研究是一个单中心、回顾性研究,旨在探究左心耳封堵术后器械相关血栓形成的发生率、影响因素及其临床预后。
1 对象与方法
1. 1 研究对象
本研究是一个单中心、回顾性研究,从2014年5月至2018年6月共有308例患者在武汉亚洲心脏病医院心内科接受了左心耳封堵术并完成了术后45 d的经食管超声心动图(transesophageal echocardiography,TEE)检查。
纳入标准:年龄大于18岁,阵发性或持续性非瓣膜性房颤,CHA2DS2-VASc评分≥1分,同时具备下列情况之一:(1)存在长期口服抗凝药禁忌证,或不愿长期口服抗凝药者;(2)服用华法林,国际标准化比值(international normalized ratio,INR)达标的基础上仍发生卒中或血栓栓塞事件者;(3)出血高危,HAS-BLED评分≥3分者。且在我院完成术后45 d TEE复查。排除标准:(1)左心房内径>65 mm、术前TEE检查发现心内血栓或左心耳浓密自发显影、严重二尖瓣病变;(2)存在卵圆孔未闭合并房间隔瘤和右向左分流,升主动脉和(或)主动脉弓处存在复杂可移动和(或)破裂和(或)厚度>4 mm的动脉粥样硬化斑块者;(3)存在需抗凝治疗的除房颤外其他疾病者;(4)需要接受择期心外科手术者;(5)存在严重脑血管疾病者,如1个月内反复短暂性脑缺血发作或卒中、脑血管畸形、脑肿瘤等;(6)血小板减少症或凝血系统异常的患者;(7)预计生存期<1年的患者。分组方式以术后45 d TEE复查是否存在器械相关血栓形成作为分组依据,分为器械相关血栓组和无器械相关血栓组。
1. 2 资料收集
收集所有已完成左心耳封堵术并完成术后45 d TEE复查患者的基线资料,包括性别、年龄、高血压病、糖尿病、冠心病、心肌病、先天性心脏病、心力衰竭、卒中史、房颤类型、CHA2DS2-VASc评分、HAS-BLED评分、身体质量指数(body mass index,BMI)、左心房内径、左心室舒张末期内径、左心室射血分数、左心耳口径、左心耳体长等。
1. 3 左心耳封堵术
左心耳封堵术在全身麻醉、气管插管条件下进行,采用Seldinger’s法穿刺右侧股静脉,经股静脉入路置入Swartz L1长鞘,在TEE的指引下行房间隔穿刺,送入长导丝至左心耳内,将Swartz L1长鞘置换为14 F导引鞘,然后在右前斜30°及足位20°下进行左心耳造影,测量左心耳口径及左心耳体长。根据测量结果,选择合适的左心耳封堵器,用导管输送系统将封堵器送至左心耳口部,封堵器膨胀后即可封堵左心耳口部,再次造影及TEE观察封堵效果满意(左心耳开口完全封堵或装置周围残余分流≤5 mm),并经牵拉试验证实封堵器位置稳定,然后释放封堵器。
1. 4 住院期间管理及随访
手术结束后患者被送到心脏重症监护室行术后麻醉恢复。术后当天进行经胸超声心动图检查,以排除心包积液及装置相关栓塞事件的发生,术后2~3 d,如果无特殊事件发生,患者可以办理出院。
左心耳封堵术后,患者需服用华法林抗凝治疗,服用华法林期间,应维持INR在2.0~3.0。对于一些有华法林禁忌证或不愿服用华法林的患者,可服用新型口服抗凝药(novel oral anticoagulants,NOACs)。术后45 d随访复查TEE,以评估装置周围残余分流、器械稳定性及器械相关血栓形成情况。如果TEE证实左心耳完全封堵或装置周围残余分流大小在5 mm以内,且无器械相关血栓形成,可停用抗凝药,接着服用阿司匹林和氯吡格雷4.5个月,之后长期服用阿司匹林。
患者常规术后45 d门诊随访,询问临床病史包括有无卒中及出血事件等,并复查TEE、心电图等。术后6个月、1年、2年、3年、4年及5年予以门诊随访或电话随访,询问有无卒中及出血事件等病史。
1. 5 临床定义
器械相关血栓形成的定义:左心耳封堵术后,封堵器表面与循环血液接触可能会导致器械相关血栓形成,主要通过TEE或心脏增强CT来诊断。本中心主要通过TEE来诊断。器械相关血栓形成的TEE诊断标准参考PROTECT-AF研究[7],包括:(1)器械左心房面存在回声密度,且成像伪影无法解释;(2)与正常的器械结合表现不一致;(3)在TEE的多个平面可见;(4)与器械相接触;(5)有一定的活动度。
临床终点事件的定义:主要临床终点事件为卒中或系统性栓塞事件,次要临床终点事件包括全因死亡和出血事件。
1. 6 统计学分析
所有数据采用SPSS 16.0软件进行统计学分析。符合正态分布的连续变量数据用均数和标准差(±s)表示,不符合正态分布的连续变量数据用中位数(四分位数间距)表示,分类变量数据用频数和百分比表示。连续变量数据的比较根据其是否符合正态分布分为两种类型,其中符合正态分布的连续变量数据采用独立样本t检验,不符合正态分布的连续变量数据采用秩和检验。分类变量采用卡方检验。采用多因素Logistic回归分析器械相关血栓形成的独立危险因素。对于事件的时间,应用Prism软件进行Kaplan-Meier生存曲线分析。以P<0.05为差异有统计学意义。
2 结果
2014年5月至2018年6月共有308例患者行左心耳封堵术并完成了术后45 d TEE复查,其中7例患者有器械相关血栓形成(器械相关血栓组),301例患者无器械相关血栓形成(无器械相关血栓组)。器械相关血栓组中有6例(85.7%)患者置入WATCHMAN封堵器(波士顿科学公司,美国),1例(14.3%)患者置入ACP封堵器(圣犹达公司,美国);无器械相关血栓组中有263例(87.4%)患者置入WATCHMAN封堵器,38例(12.6%)患者置入ACP封堵器,两组患者置入不同封堵器品牌的差异无统计学意义。
2. 1 基线资料比较
器械相关血栓组患者均为持续性非瓣膜性房颤,均无心力衰竭病史,平均年龄为(67.3±6.0)岁,3例(42.9%)患者为女性,5例(71.4%)有高血压病史,2例(28.6%)有糖尿病史,4例(57.1%)有冠心病,与无器械相关血栓组相比,差异均无统计学意义(均P>0.05)。器械相关血栓组与无器械相关血栓组的平均CHA2DS2-VASc评分分别为(3.9±1.8)分和(3.2±1.6)分,差异无统计学意义(P=0.307)。器械相关血栓组与无器械相关血栓组相比,卒中史占比更高(85.7%比42.5%,P=0.058),HAS-BLED评分较高[(2.6±1.0)分比(1.9±1.1)分,P=0.078],但差异均无统计学意义。器械相关血栓组患者平均左心房内径为(51.0±4.9)mm,左心室射血分数56%(54%,56%),平均左心耳口径为(20.6±3.1)mm,左心耳体长33(30,44)mm,与无器械相关血栓组相比,差异均无统计学意义(均P>0.05,表1)。

表1 两组患者基线资料情况比较
2. 2 术中及术后45 d随访资料比较
器械相关血栓组患者均成功行左心耳封堵术。无器械相关血栓组,299例(99.3%)成功行左心耳封堵术,2例(0.7%)患者封堵术后出现大于5 mm的残余分流,其中1例患者术后即刻TEE示残余分流大小为8 mm,在术后45 d随访复查TEE,未再发现残余分流;另外1例患者术后即刻TEE示残余分流大小为11 mm,然而在术后45 d随访复查TEE时发现其残余分流大小仍然保持不变,该患者继续口服华法林抗凝治疗。术后即刻行TEE检查,器械相关血栓组有2例患者出现装置周围残余分流,且均小于5 mm,与无器械相关血栓组相比,差异无统计学意义(28.6%比26.2%,P>0.999)。
术后45 d复查TEE结果显示,器械相关血栓组有2例患者出现装置周围残余分流,且均为小于5 mm的残余分流,与无器械相关血栓组相比,差异无统计学意义(28.6%比47.2%,P=0.554)。在术后45 d的抗栓方案中,器械相关血栓组中有3例(42.9%)患者服用华法林,4例(57.1%)患者服用NOACs,无器械相关血栓组中有137例(45.5%)患者服用华法林,164例(54.5%)患者服用NOACs,两组患者术后45 d抗栓方案的差异亦无统计学意义(P>0.05,表2)。多因素Logistic回归分析显示,卒中史是器械相关血栓形成的独立危险因素(OR8.1,P=0.019)。

表2 两组患者术中及术后45 d 随访资料情况比较
2. 3 术后平均826 d随访资料比较
器械相关血栓组7例患者中,5例患者经抗凝治疗后血栓溶解,2例患者抗凝治疗效果欠佳,术后1年TEE复查仍存在器械相关血栓,后未再行TEE复查。其中1例患者在术后1年5个月自行停服抗凝药,根据术后2年的电话随访结果显示,该患者未发生血栓栓塞事件;另外1例患者,在术后1年6个月,不愿继续服用抗凝药,改为阿司匹林口服,根据术后4年的电话随访结果显示,该患者在术后1个月出现卒中事件,药物治疗后好转,此后未再发生血栓栓塞事件。
术后平均8 2 6 d 随访结果显示,共2 9 5 例(95.8%)患者参与了门诊或电话随访。器械相关血栓组无死亡事件,无器械相关血栓组有7例(2.4%)患者死亡(3例死于恶性肿瘤,2例为心原性死亡,1例死于脑出血,1例死于不明原因猝死)。器械相关血栓组无严重出血事件,无器械相关血栓组有1例(0.3%)患者出现脑出血并最终导致死亡。两组患者的全因死亡率、脑出血发生率、小出血发生率和总出血发生率比较,差异均无统计学意义(均P>0.05)。器械相关血栓组有1例(14.3%)患者出现卒中事件(术后1个月,药物治疗后好转),无器械相关血栓组有3例(1.0%)患者出现卒中事件(其中1例发生于术后1个月,药物治疗后好转;1例发生于术后9个月,药物治疗后好转;1例发生于术后2年9个月,药物治疗后未完全康复,遗留肢体偏瘫),与无器械相关血栓组相比,器械相关血栓组卒中发生率较高,但差异无统计学意义(P=0.092,表3)。然而Kaplan-Meier生存曲线分析结果显示,器械相关血栓形成与卒中事件发生密切相关(HR16.8,P<0.001,图1)
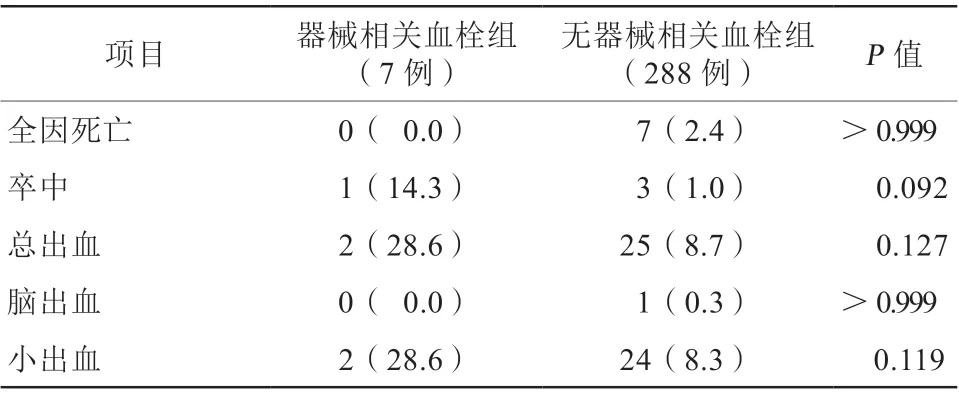
表3 两组患者术后平均826 d 随访资料情况比较[例(%)]

图1 器械相关血栓组与无器械相关血栓组卒中的生存曲线
3 讨论
器械相关血栓形成在左心耳封堵术后并不常见,但延迟器械相关血栓形成应引起重视。一篇纳入66项研究的Meta分析结果显示,左心耳封堵术后器械相关血栓形成总发生率为3.5%(351/10 153,区间为0~17%),器械相关血栓形成发生时间<90 d、90~365 d及>365 d的占比分别为42%、57%和1%,ACP和WATCHMAN两种封堵器的器械相关血栓形成的发生率差异无统计学意义(3.6%比3.1%,P=0.24)[4]。另一项来源于PROTECT-AF、PREVAIL、CAP、CAP2等4项前瞻性研究的数据分析结果显示,器械相关血栓形成总发生率为3.7%(65/1739),在术后45 d发生率为0.8%,而在术后6个月发生率为1.7%,术后1年发生率为1.8%[8]。一项来源于PROTECT-AF研究的平均2.5年随访数据结果亦显示,器械相关血栓形成总发生率为5.7%,且术后6个月和1年发生率较术后45 d高[7]。此外,个案报道1例患者在WATCHMAN左心耳封堵术后2年,发现一大的器械相关血栓形成,然而在规律的术后6个月和1年的TEE检查中并未发现器械相关血栓形成和残余分流的征象[9]。本研究结果显示,左心耳封堵术后45 d器械相关血栓形成的发生率为2.3%,术后6个月及术后1年的器械相关血栓发生率不明确(因多数患者行TEE检查会引起不适感,因此在术后6个月及术后1年,大多数患者不愿再行TEE检查)。此外,随访时发现,1例患者在术后1年6个月发现器械相关血栓形成,另外1例患者在术后5年发现器械相关血栓形成,2例患者在术后45 d均无器械相关血栓形成,且均未发生血栓栓塞事件。本研究结果与既往国外相关研究结果一致。左心耳封堵术后器械相关血栓形成并不常见,但应警惕一些延迟器械相关血栓形成。根据经典的PROTECT-AF研究,左心耳封堵术后45 d、6个月及1年应各随访1次TEE[10]。《中国左心耳封堵预防心房颤动卒中专家共识(2019)》[11]建议,左心耳封堵术后3个月及6个月应各随访1次TEE(若患者不耐受TEE,可用心脏增强CT替代)。但需警惕有少数患者在左心耳封堵术后1年后仍然出现器械相关血栓形成。关于左心耳封堵术后最佳TEE或心脏增强CT随访频次仍有待于相关研究进一步证实。
目前相关研究显示,器械置入后内皮化不完全和机体内凝血系统的反应性激活是左心耳封堵术后器械相关血栓形成的两大主要机制[12]。关于左心耳封堵术后封堵器表面内皮化相关研究主要来源于动物实验,尚无人体置入左心耳封堵器后封堵器表面内皮化的研究,仅有数例尸检报告结果。一项纳入9只狗的动物实验,在动物狗身上进行组织病理学研究发现,在WATCHMAN左心耳封堵器置入术后第3天,可见一薄层纤维覆盖在封堵器表面;在术后45 d,可见含内皮细胞、平滑肌细胞的新心内膜形成,覆盖在封堵器表面;在术后90 d,可见完整的新心内膜覆盖在封堵器表面。4例曾进行过左心耳封堵术患者的尸检结果显示,患者的封堵器口部均被心内膜覆盖(分别为术后139 d、200 d、480 d及852 d)[13]。另一项纳入10只狗的动物实验结果显示,在ACP左心耳封堵术后90 d,可见稳定、成熟的新心内膜并含分散向内生长的纤维连接组织覆盖在封堵器表面[14]。目前相关研究显示左心耳封堵术后封堵器表面完全内皮化时间可能在术后90 d。与动物狗相比,人类可能需要更长时间完成封堵器表面内皮化。此外,封堵器大小、个体间的差异,都可能导致延迟内皮化形成。不完全内皮化可能会导致器械相关血栓形成,进而增加血栓栓塞事件的风险。机体内凝血系统的反应性激活可能是导致器械相关血栓形成的另一大机制,左心耳封堵器主要由镍钛合金骨架和聚酯纤维覆膜构成,置入机体后伴随着体内凝血系统的反应性激活。一项观察性研究纳入43例患者,旨在观察左心耳封堵术后凝血功能的变化,研究结果显示,反应凝血激活标志物的凝血酶原片段1+2和凝血酶-抗凝血酶Ⅲ水平在术后显著升高,术后第7天达峰值,在术后第7~30天急剧下降,至术后180 d基本恢复至基线水平,提示左心耳封堵术后存在凝血系统的反应性激活[15]。因此左心耳封堵术后应充分抗凝治疗,预防器械相关血栓形成。关于左心耳封堵术后封堵器表面内皮化相关研究主要来源于动物实验,术后凝血系统的反应性激活来源于小样本量研究,且缺乏对照,关于左心耳封堵术后器械相关血栓形成的机制仍有待于更多的研究数据支持。
关于左心耳封堵术后器械相关血栓形成的预测因子,多项研究显示,卒中史会增加器械相关血栓形成的风险,然而,关于HAS-BLED评分与器械相关血栓形成的关系尚存争议。一项前瞻性研究的多因素分析结果显示,卒中史是器械相关血栓形成的预测因子(OR2.31,P=0.007)[8]。另一项前瞻性研究结果显示,与无器械相关血栓组相比,器械相关血栓组中血栓栓塞事件史更多[16]。一项多中心回顾性研究结果亦显示,卒中史是器械相关血栓形成的危险因素[17]。本研究结果亦显示,卒中史是器械相关血栓形成的独立危险因素,与国外相关研究结果相一致。关于HAS-BLED评分与器械相关血栓形成的关系尚存争议。多项研究结果显示,与无器械相关血栓组相比,器械相关血栓组的HAS-BLED评分较高,由于患者HAS-BLED评分较高,术后未给予抗凝药物,而是给予双联抗血小板药物治疗,不排除存在氯吡格雷药物抵抗可能[6,18]。然而,其他一些研究显示,HAS-BLED评分并不增加器械相关血栓形成的风险[8,17,19]。本研究结果亦显示,与无器械相关血栓组相比,器械相关血栓组的HAS-BLED评分较高,但差异无统计学意义(P=0.078)。本研究中所有患者在左心耳封堵术后均给予抗凝药物治疗(NOACs或者华法林)。关于HAS-BLED评分与器械相关血栓形成的关系尚有待于相关研究进一步去证实。
左心耳封堵术后残余分流的发生,理论上会增加器械相关血栓形成的风险,目前关于残余分流与器械相关血栓形成的关系尚存争议。一项来源于真实世界的观察性研究多因素分析结果显示,残余分流与器械相关血栓形成相关,且残余分流大小均在2~3 mm[18]。一项来源于外科手术数据研究结果显示,左心耳封堵术后残余分流>1 cm与器械相关血栓形成和血栓栓塞事件相关[20]。亦有研究结果显示,装置周围残余分流与器械相关血栓形成无关[6]。根据经典的PROTECT-AF研究,左心耳封堵术后残余分流<5 mm是允许范围内的残余分流,WATCHMAN及ACP左心耳封堵术后相关研究结果均显示,左心耳封堵术后残余分流<5 mm不会增加血栓栓塞事件的风险[19,21]。本研究结果显示,残余分流与器械相关血栓形成无关,可能与器械相关血栓组所有残余分流均<5 mm相关。目前临床上一致认可的是,左心耳封堵术后残余分流<5 mm是允许范围内的残余分流,超过该范围的残余分流可能会增加血栓栓塞事件的风险。关于左心耳封堵术后残余分流与器械相关血栓形成的关系尚有待相关研究进一步去证实。
关于器械相关血栓形成是否会增加系统性血栓栓塞事件的风险,目前尚处于研究阶段,不同研究报道结果不同。一项前瞻性研究结果显示,器械相关血栓形成会增加系统性血栓栓塞事件的风险(RR3.55,P<0.001),47.4%的血栓栓塞事件发生在发现器械相关血栓形成的1个月内,63.2%的血栓栓塞事件发生在发现器械相关血栓形成的6个月内[8]。另一项回顾性研究亦证实器械相关血栓形成会增加系统性血栓栓塞事件的风险[17]。一项纳入66项研究的Meta分析结果显示,器械相关血栓形成会增加4~5倍卒中风险[4]。另一项Meta分析亦显示,器械相关血栓形成会增加卒中的风险[22]。本研究结果亦显示,器械相关血栓形成与卒中事件发生密切相关(HR16.8,P<0.001),卒中事件发生在发现器械相关血栓形成前15 d(术后1个月)。然而,有一些研究结果显示,器械相关血栓形成并不增加系统性血栓栓塞事件的风险[19,23-24]。目前多数研究表明,器械相关血栓形成会增加系统性血栓栓塞事件的风险,多数发生在发现器械相关血栓形成后1个月内,目前临床上一致推荐,TEE或心脏增强CT一旦发现器械相关血栓形成,应积极给予抗凝治疗直至血栓溶解。
综上所述,左心耳封堵术后器械相关血栓形成并不常见,卒中史是器械相关血栓形成的独立危险因素,器械相关血栓形成会增加卒中的风险。本研究是一个单中心、回顾性研究,且事件发生率低,关于左心耳封堵术后器械相关血栓形成的影响因素及器械相关血栓形成是否会增加系统性血栓栓塞事件的风险及在发现器械相关血栓后多久易出现血栓栓塞事件尚存争议,尚有待于大样本量、多中心、前瞻性、随机对照研究去进一步明确。
利益冲突 所有作者均声明不存在利益冲突
