金纳米簇化学发光体外生物检测应用研究进展
2022-04-01夏天昊王云鹏戴晓茹凌世生乔旭升樊先平
夏天昊 王云鹏 戴晓茹 凌世生 陈 东 乔旭升* 樊先平
(1.浙江大学材料科学与工程学院 硅材料国家重点实验室,浙江 杭州 310027;2.杭州安旭生物科技有限公司,浙江 杭州 310011)
1 引 言
体外生物检测技术是指在生物体外利用特定的试剂和设备来检测生物体中某种或某一类物质的方法,是免疫分析的重要组成部分[1]。传统的体外生物检测使用荧光标记法[2],该方法需要借助外界光源,检测耗时较长。为提高检测效率,需要开发一种新的分析方法。化学发光(Chemiluminescence,CL)是指利用化学反应产生发光的现象[3],其中通电引发电化学反应而产生的化学发光又称为电化学发光(Electrochemiluminescence,ECL)[4]。普通的化学发光由反应试剂的混合即可引发,而电化学发光是由电极上生成的氧化型或还原型自由基与其他物质反应产生。在化学发光检测系统中,最常用的两种纳米材料是量子点和金属纳米颗粒,其中发光效率较高的量子点通常含有重金属元素,生物相容性较差[5];而金属纳米颗粒的发光效率偏低,难以满足精确检测的要求。基于化学发光原理,研发兼具生物相容性和高效发光性能的新型体外生物检测用发光材料,已成为当务之急。
金纳米簇(Gold nanoclusters,Au NCs)是指尺寸一般在2 nm 以下、由数个至数百个金原子所组成的团簇[6],拥有类似于量子点的量子限域效应和表面效应[7],具有荧光强度高、光稳定性强、表面活性高等特点[8-9]。虽然金纳米簇和金纳米颗粒都是由金单质连接表面配体构成,但前者的荧光性能要远远优于后者。现在,金纳米簇的化学发光现象也已得到证实[10],并广泛应用于血浆、尿液、组织液等的分析检测中,检测对象可以是氨基酸、多巴胺和各类小分子药物,也可以是蛋白质、DNA、RNA 等生物大分子,检测灵敏度(最低检测限)相比于传统的荧光标记法提高了数个数量级。
金纳米簇合成方法简单,生物相容性好,适合体外检测的实际应用。发展基于金纳米簇化学发光的新型体外生物检测技术,既能保证检测精度,也有利于提高检测效率。本文将阐述金纳米簇的制备方法、结构、性质及其化学发光原理,并结合近年来在体外生物检测方向的应用进展,总结该体系在实际应用中面临的关键问题与解决方案,最后对金纳米簇在体外生物检测领域的发展趋势做出展望。
2 金纳米簇合成方法、结构与性质
2.1 金纳米簇合成方法
金纳米簇的表面配体在合成过程中引入,配体主要分为小分子和大分子两类,它们将合成原料(一般使用HAuCl4)中的Au(Ⅲ)还原成Au(Ⅰ)或Au(0),并作为模板和保护层,借助结合锚点的作用来控制金纳米簇的粒径以及单个团簇所含的金原子个数。
以小分子有机物作为配体合成金纳米簇,能在表面形成保护层,从而将晶体生长固定在较小的尺寸。应用于生命科学领域的金纳米簇,配体多为含有硫元素的羧酸、氨基酸或多肽,如谷胱甘肽(GSH)[11-12]、硫辛酸(LA)[13]、N-乙酰-L-半胱氨酸(NAC)[14-15]、蛋氨酸(Met)[16]等。
大分子配体则能作为合成金纳米簇的模板,它们的结构中含有各类功能性基团,并带有一定量的电荷,包覆在金纳米簇的表面,限制其粒径。典型的蛋白质类配体是牛血清白蛋白(BSA),其多肽链中含有大量的巯基,能与金原子以化学键(Au—S)的方式直接相连,并且作为一种还原剂促进金单质的生成。Xie 等[17]于2009 年最早报道了合成BSA-Au NCs 的方法,所合成的颗粒中包含25 个金原子,能发射出红光。
一些高分子聚合物也可以作为合成金纳米簇的辅助模板,如聚酰胺-胺(PAMAM)[18]和聚乙烯亚胺(PEI)[19]。与上述两类配体不同,这些聚合物模板多为高度分支化的树枝状结构,虽然也能还原金元素,但更重要的作用是作为支架对尺寸较大的金纳米颗粒刻蚀,得到金纳米簇。
2.2 金纳米簇结构
金纳米簇中的金原子呈核壳结构排列,即少数原子组成核心,其余的原子围绕核心逐层包覆,形状接近于球形或多面体形[20-21]。表面配体是金纳米簇的重要组成部分,对其物理化学性质有重要的影响。表面配体的结构包含以下三要素[22](图1):首先,配体能与金原子以较强的共价键结合成锚点,这一部分通常含有C、P、S、Se四种元素之一;其次,配体的主体部分由烷基链、苯环或氨基酸链构成,通过共轭效应、空间位阻效应和电子转移来提高金纳米簇的化学稳定性[23];最后,配体上所连接的与环境直接接触的官能团,它们是金纳米簇功能化的关键,能改变其亲疏水特性,有的官能团还能提供与其他物质结合的位点,扩展其应用范围[24]。

图1 金纳米簇与表面配体结构(以巯基乙酸为例)[22]Fig.1 The structure of Au NCs and surface ligands(Mercaptohexanoic acid is used as an ligand example)[22]
2.3 金纳米簇性质
金纳米簇之所以受到世界各国学者们的关注,是因为这种材料集多种优良性质于一体,克服了传统纳米发光材料的诸多不足,应用前景广阔。金纳米簇具有下列特性:
(1)量子限域效应:金纳米簇的分子级尺寸使其拥有和量子点材料相似的性质,尤其是量子限域效应,能使金纳米簇中费米能级附近的电子能级离散[25]。这样,就能够通过调控金纳米簇的粒径来改变其荧光波长。
(2)表面效应:金纳米簇通常仅包含十几个至几百个金原子,这就意味着大部分原子位于金纳米簇表面。又由于表面结构一般会产生缺陷,位于表面的原子通常配位数不足,所以金纳米簇拥有比金纳米颗粒更高的活性,这也是其表面容易键合各种配体的原因[26]。
(3)生物相容性:具有生物活性的蛋白质、多肽、氨基酸、核酸等都能作为配体与金纳米簇表面活性位点结合[27],使金纳米簇与生物体环境接触时,不会产生明显的刺激作用。
(4)催化活性:金纳米簇的颗粒形状不规则,比表面积大,具有较高的表面能,在配体保护提高化学稳定性的同时,也能够加快化学反应速率,体现出极高的催化活性[28]。
(5)高量子产率与光稳定性:金纳米簇的能级结构使其容易接受外界所传递的能量而发光,量子限域特性又决定了其具有较高的量子产率(一般可达10%以上)[29-30],并且发光更加稳定,在较长时间内不会发生闪烁[31]。
3 金纳米簇化学发光原理
化学发光分为两种类型,第一类是化学反应生成物作为发光物质,吸收反应释放的能量跃迁至激发态,然后返回基态并发光;第二类是化学反应生成物作为中间体,吸收能量并将其转移给另一种荧光物质,该荧光物质跃迁至激发态再回到基态的过程发出可见光[32]。作为一种小尺寸的准零维材料,金纳米簇本身具有优异的发光特性,在一定条件下能够直接产生化学发光,也能作为化学反应能量转移的受体,同时独特的表面活性也赋予了其较强的催化性能,能促进传统化学发光体系中反应的进行,增加发光强度。以下将分别讨论金纳米簇在化学发光体系中所起到的不同作用和相应原理。
3.1 金纳米簇作为化学发光体
金纳米簇作为发光体的体系一般基于电化学反应,该过程需要借助共反应物的作用,常用的共反应物有三乙胺(TEA)[33]、三丙胺(TPrA)[34]、N,N-二乙基乙二胺(DEDA)[35]、过硫酸根离子[36]等。在电化学反应中,共反应物在电极上被氧化或还原成带电自由基,接着自由基与金纳米簇反应,转移电子与能量(部分体系中金纳米簇也可在电极上发生电子转移),使其能级跃迁至激发态,最后多余的能量以光子形式释放出来,即产生ECL 信号[33,36]。
近年来,研究者们对金纳米簇ECL 机理的阐述逐渐深入。Peng 等[37]以NAC-Au NCs 为研究对象,探讨了电化学反应的作用和价态对ECL 性能的影响,发现电化学还原反应能使金纳米簇中部分Au(Ⅰ)还原为Au(0),同时表面配体脱附,ECL 强度与Au(Ⅰ)的还原程度呈正相关,与表面配体无关,即表面层的Au(0)是金纳米簇中产生ECL 行为的主体。Hesari 等[38]归纳了TPrA 为共反应物时,不同原子数和电性的金纳米簇的ECL 规律(图2),证明了它们的发光来源于TPrA·自由基向金纳米簇的LUMO轨道转移电子,再通过HOMO-LUMO 能级跃迁释放能量,来实现近红外区域的ECL 发射。处于激发态的金纳米簇电性和带电量由电化学反应控制,其ECL 强度既与TPrA 浓度有关,又与电极电位有关。
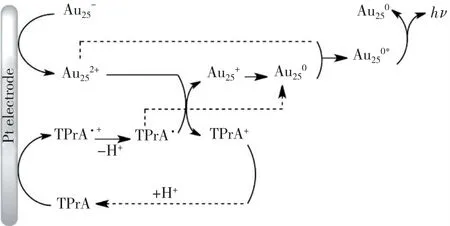
图2 Au25-/TPrA 体系可能的ECL 机理[38]Fig.2 Probable ECL mechanism of Au25-/TPrA system[38]
3.2 金纳米簇作为能量共振转移受体
化学反应所产生的能量被另外一种荧光物质吸收而产生发光的现象,属于能量共振转移(Resonance energy transfer,RET)的类型[39]。金纳米簇尺寸极小、活性高、能级不连续,在吸收化学反应释放的能量后易被激发,产生发光现象,即作为RET 受体。
Zhang 等[40]设计了一种基于氧化还原反应和RET 效应的CL 探针,BSA-Au NCs 和四氢呋喃过氧化物(THF-HPO)之间发生氧化还原反应,生成激发态中间体并产生CL 信号,接着BSA-Au NCs 又能接受中间体所传递的能量,提高发光强度;当金纳米簇中掺杂有Cu2+时,对发光的增强作用更加明显。Zhu 等[41]研究了金纳米颗粒功能化类石墨C3N4纳米片(Au-g-C3N4,发光波长为460 nm)与GSH-Au NCs(发光波长为610 nm)之间的ECL-RET 行为,发现金纳米簇修饰到固定有Au-g-C3N4的电极上时,最大发光强度所对应的波长由460 nm 变为610 nm,证实了金纳米簇为ECL-RET 受体,测量得到能量转移效率约为52.17%。
在RET 体系中,金纳米簇并非都起到增强发光的作用,有时也能使发光猝灭。Cheng 等[42]建立了一种基于CdTe 量子点和金纳米簇的ECLRET 传感器,其中CdTe 量子点固定在电极上,而金纳米簇与发夹DNA 相连接。他们的研究结果表明,使用连接酶将辅助性DNA 和microRNA固定在金纳米簇所连的发夹DNA 上时,金纳米簇与量子点之间的距离较大,RET 作用不明显,ECL 强度较高;而若仅仅将microRNA 固定于发夹DNA 上,二者之间的距离减小,RET 作用增强,ECL 强度降低。
3.3 金纳米簇作为化学发光增敏剂
传统的CL 体系多使用有机荧光化合物,如鲁米诺、异鲁米诺、吖啶酯、光泽精等,也有四价铈[Ce(Ⅳ)]、高锰酸钾等强氧化性无机物。这些化合物的研究与应用已有数十年历史,但它们都存在发光强度弱、量子效率不高、发光持续时间短等缺点,在物质检测领域的应用受限[43]。如果能够引入一种增强CL 作用的物质,将会使这些有机荧光物的发光信号更容易探测到,也能拓宽它们的应用范围。金纳米簇即是起到这种作用的理想增敏剂之一。
鲁米诺是最早应用的有机荧光化合物之一,在金纳米簇之前,尺寸较大的金纳米颗粒已被证实能对CL 反应中自由基的产生和电子转移过程起催化作用[44]。金纳米簇的催化作用和金纳米颗粒是类似的,Deng 等[45]研究了BSA-Au NCs 对鲁米诺-H2O2体系CL 性能的影响,结果表明加入的金纳米簇浓度适当时能够使该体系CL 强度提高数十倍。金纳米簇首先催化H2O2形成活性自由基,该自由基再进一步与鲁米诺发生反应,最终经过多步反应后形成发光体3-氨基邻苯二甲酸阴离子(3-APA*)。
除了鲁米诺之外,金纳米簇也能作为催化剂提高其他CL 体系的发光强度。He 等[46]发现了金纳米簇对NaHSO3-H2O2体系的催化作用,该体系原本化学发光十分微弱,由的氧化产物分解而来的发光体产率很低,而金纳米簇能够催化的氧化反应,使CL 能够直观地观测到,满足体外生物检测应用的要求。Yang等[47]则建立了碱性KMnO4-罗丹明B(RhoB)流动注射CL 体系,发现在加入金纳米簇后发光强度提高了数倍,而CL 光谱中没有出现新的峰,也没有发生峰位的改变。他们认为这可能是金纳米簇的催化作用所致,机理如下(ox 表示氧化态中间体):

3.4 金纳米簇聚集诱导发光效应
聚集诱导发光(AIE)现象是指发光分子在高浓度溶液中,由于聚集作用使分子内基团的旋转受到限制,分子运动损失的能量减少,以光子形式释放的能量增加,发光强度也随之增大的现象[48]。近年来,有不少研究证实,在CL 或ECL体系中,金纳米簇在一定条件下也具有AIE效应。
Zhang 等[49]发现,在双(2,4,6-三氯苯基)草酸酯(TCPO)-H2O2CL 体系中,GSH-Au NCs 能作为TCPO 与H2O2反应的RET 受体,吸收能量产生光信号。如果将反应体系中的水逐渐用乙醇取代,金纳米簇之间的相互作用力增大而引发聚集,GSH 配体的运动受限,产生AIE 现象(图3),使发光强度进一步提高。Jiang 等[50]以磷酸腺苷(AXP)为配体制备了金纳米簇,发现配体中的磷酸盐基团能与二价金属阳离子(Ca2+、Mg2+、Zn2+)稳定结合,形成水凝胶网络结构,限制金纳米簇在溶液中的自由运动,而产生AIE 现象,大幅提高ECL强度。
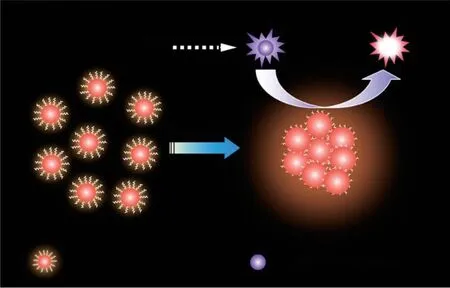
图3 Au NCs 在RET 和AIE 效应共同作用下的CL现象[49]Fig.3 The CL behavior of Au NCs under RET and AIE effect[49]
4 金纳米簇化学发光体外生物检测应用
生命体中的蛋白质、核酸和部分小分子活性物质往往含量较低,通过常规分析方法很难达到要求的精度,一般需要使用化学发光免疫分析法来检测。早在上世纪90 年代,雅培公司、拜耳公司所研制的商用CL 免疫分析仪就已投入使用,这类仪器采用鲁米诺或吖啶酯作为CL 系统,实现对激素、蛋白质、药物的检测。后来罗氏公司发展出Ru(bpy)为发光体的ECL 分析仪,应用于抗原、抗体和生物小分子的精确检测。金纳米簇的CL(或ECL)强度受其所处化学环境影响较大,因此可作为化学发光免疫分析系统的理想材料,尤其是在体外生物检测方面,已得到非常广泛的研究和应用。下面将按照应用领域展开讨论。
4.1 检测蛋白质
利用金纳米簇化学发光体系来检测蛋白质,可分为两种类型:第一种基于ECL 体系和抗原-抗体结合反应,即将两种不同的抗体分别固定在电极和金纳米簇上,待测蛋白质作为抗原与抗体偶联,形成免疫复合结构,进而改变金纳米簇的ECL 强度;第二种基于CL 体系,利用的是蛋白质与金纳米簇表面配体的反应,使金纳米簇的CL行为受到影响。
基于抗原-抗体反应的ECL 免疫分析主要应用于临床检测,检测系统的灵敏度至关重要,为此需要提高发光强度。解决思路之一是调整金纳米簇的发光波长,使其ECL 光谱峰值位于近红外(Near-infrared,NIR)区域。Yu 等[51]报道了一种以Met 为配体的金纳米簇,施加还原电位后表面平均价态有明显的降低,在共反应物三乙醇胺(TEOA)和氧化电位的作用下,能产生波长约为835 nm 的ECL 信号,发光强度比传统的BSA-Au NCs 高70 余倍。这种纳米簇的ECL 波长相比荧光波长有很大程度的红移,可能是由于两种发光的激发方式有差异,并且金纳米簇表面未完全钝化。他们使用这种金纳米簇构建夹心免疫传感器来检测甲胎蛋白(AFP),原理如图4 所示,当AFP与连接在电极和金纳米簇上的抗体特异性结合时,ECL 强度大大提高,成为检测依据。该传感器的检测限低至1.0×10-15g·mL-1,检测范围为3.0×10-15~1.0×10-10g·mL-1。
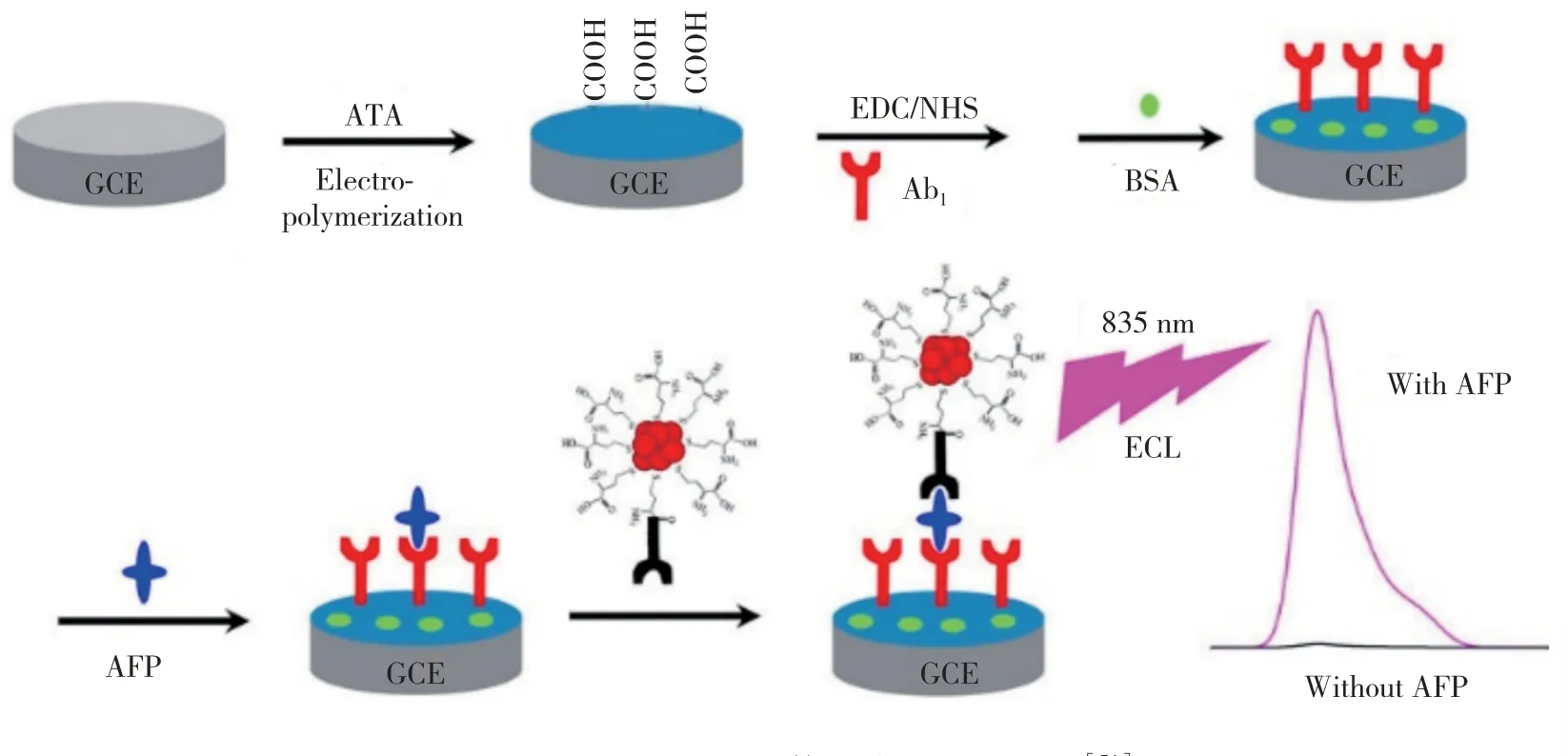
图4 Met-Au NCs ECL 体系检测AFP 原理[51]Fig.4 Mechanism of detecting AFP by Met-Au NCs ECL system[51]
另外一种方法是引入催化剂(或增敏剂),同时将共反应物与催化剂、金纳米簇偶联。Jia等[52]将Fe2O3纳米阵列作为ECL 催化剂,三(3-氨基乙基)胺(TAEA)作为共反应物,设计了一种用于检测蛋白片段CYFRA21-1 的ECL 传感器,并自行设计能与金纳米簇和TAEA 同时连接的多肽配体MYH-10。Fe2O3纳米阵列固定在电极上,与TAEA 分子偶联的同时提供空穴给TAEA 的HOMO 能级,促进TAEA 与金纳米簇的电子转移;同时减少空间位阻,使ECL 发射限于分子内。MYH-10 与待测物抗体连接后,利用抗原-抗体的结合实现检测。传感器发光信号稳定,具有超低的检测限(1.33×10-15g·mL-1)和较宽的线性检测范围(1.0×10-14~1.0×10-7g·mL-1)。
普通CL 体系检测大分子物质的应用较少,现有的报道中检测对象是起催化水解作用的酶。You 等[53]以TCPO-H2O2体系为能量供体,BSAAu NCs 为能量受体,建立了化学发光能量共振转移(CRET)体系,用于检测人体尿样中的胰蛋白酶。TCPO 被H2O2氧化后形成不稳定的中间体1,2-过氧环乙烷双酮,将能量传递给金纳米簇使其产生强烈的发光,胰蛋白酶又能水解BSA,降低CL 强度。该体系线性检测范围为1.0×10-8~5.0× 10-5g·mL-1,检测限为9.0× 10-9g·mL-1,且拥有良好的选择性。
此外,也有基于DNA 杂交链来检测特定蛋白质的ECL 传感器的报道。Zhou 等[54]设计了一种能同时检测MUC1 和CEA 的ECL 传感器(图5),将BSA-Au NCs 分别与敏化剂Cu2O@Cu 纳米颗粒和TiO2纳米片组装,再与发夹DNA(A3、B3)连接形成探针;然后将另外一组发夹DNA(A2、B2)固定在电极上,分别杂交与癌胚抗原(CEA)、粘蛋白1(MUC1)相连的发夹DNA(A1、B1)。检测过程中,A3、B3分别与A2和B2形成新的杂交结构,原有的A1和B1脱落,导致金纳米簇的ECL强度发生变化。实验结果表明,该ECL 传感器能实现阴极与阳极发光,其中阴极发光由TiO2纳米片催化,强度与CEA 浓度呈正比;阳极发光由Cu2O@Cu 纳米颗粒催化共反应物DEDA 的氧化而增强,强度与MUC1 浓度成正比。该传感器检测CEA 与MUC1 的灵敏度分别为4.3×10-13g·mL-1和5.8×10-15g·mL-1。

图5 BSA-Au NCs 阴极与阳极ECL 信号产生及传感器检测CEA 和MUC1 的原理[54]Fig.5 Cathodic and anodic ECL emission of BSA-Au NCs and mechanism of detecting CEA and MUC1[54]
表1 归纳了近年来基于抗原-抗体反应或DNA杂交反应的金纳米簇ECL 传感器检测蛋白质的相关报道。这些研究通过使用效率更高的共反应物[55]、引入其他类型的增敏剂[56-57]、引发链式反应[58]、构建ECL-RET 体系[40-59]等方法来提高金纳米簇的ECL 强度和检测灵敏度,实现对特定蛋白质的超灵敏检测。另外,还可使用直接连接抗体的金纳米簇搭建竞争性免疫分析平台[60]。
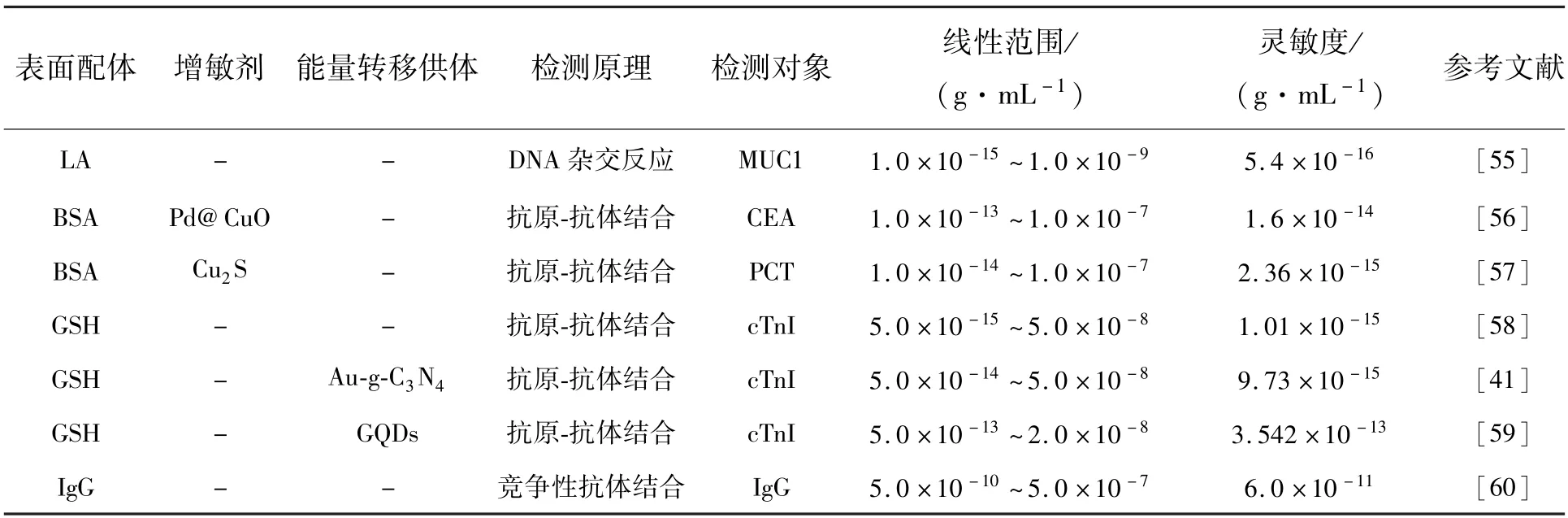
表1 金纳米簇ECL 免疫分析传感器检测蛋白质的应用Tab.1 Application of detecting protein by Au NCs ECL immunoassay biosensors
4.2 检测核酸
核酸分子中含有硫元素,经还原后可形成与金纳米簇结合的巯基,基于该原理和在4.1 节中提到的DNA 杂交反应,可建立检测核酸的ECL传感器。文献[42]即为典型案例,该传感器用于microRNA 的检测,灵敏度为2.17×10-14mol·L-1,线性检测范围为1.0×10-13~1.0×10-7mol·L-1。
Huo 等[61]提出一种基于双波长ECL-RET 的免疫分析传感器,如图6 所示。能量供体为固定在鲁米诺-层状双氢氧化物上的金纳米颗粒(Au NP-luminol-LDH),受体为修饰有DNA 的金纳米簇(Au NCs-DNA),其中供体的ECL 光谱与受体的吸收光谱存在较大面积的重叠区域,RET 效率高。当引入双链特异性核酸酶(DSN)和待测物microRNA 后,Au NCs-DNA 会从层状双氢氧化物表面脱落,这样Au NP-luminol-LDH 的ECL 会增强,而Au NCs-DNA 的发光减弱。通过监控440 nm 和620 nm 处发光强度的比值能实现对microRNA的检测,将待测物进行循环扩增后,检测范围为1.0×10-17~1.0×10-10mol·L-1,灵敏度可达9.4×10-18mol·L-1,其检测限在所报道的microRNA 免疫分析传感器中达到最低值。
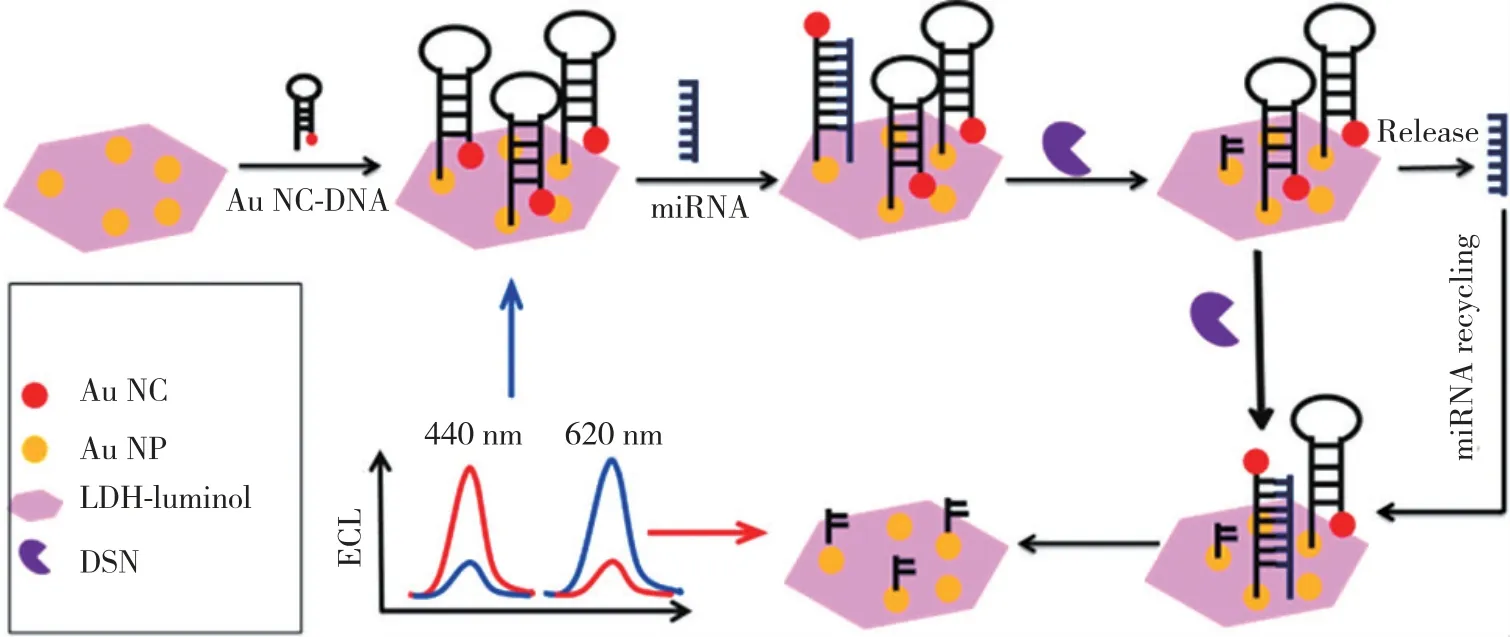
图6 microRNA 传感器的双波长ECL-RET 原理与检测原理[61]Fig.6 The dual-wavelength ECL-RET and detecting mechanism of microRNA biosensor[61]
Liu 等[62]以Met-Au NCs 为发光体、TEA 为共反应物,设计了一种用于检测人乳头瘤病毒亚型(HPV-16)DNA 的ECL 传感器,其中Met-Au NCs 与一段单链DNA 以Au—S 键连接,发光强度受到抑制。当环境中存在目标DNA 时,该DNA 能与含有RNA 片段的核酸切割酶(Cas12a-crRNA)中的碱基配对而交联,激活酶的切割能力,减小Met-Au NCs 上所连DNA 单链的长度,ECL 信号增强。该传感器的灵敏度为4.8×10-13mol·L-1。
4.3 检测药物和生物小分子
与蛋白质或核酸的检测不同,检测药物和生物小分子主要基于金纳米簇作为催化剂的CL 体系,对灵敏度的要求相对较低。小分子物质可与金原子或表面配体直接作用,通过促进或抑制催化过程来改变CL 强度。表2 总结了近年来检测小分子物质的CL 传感器的报道。
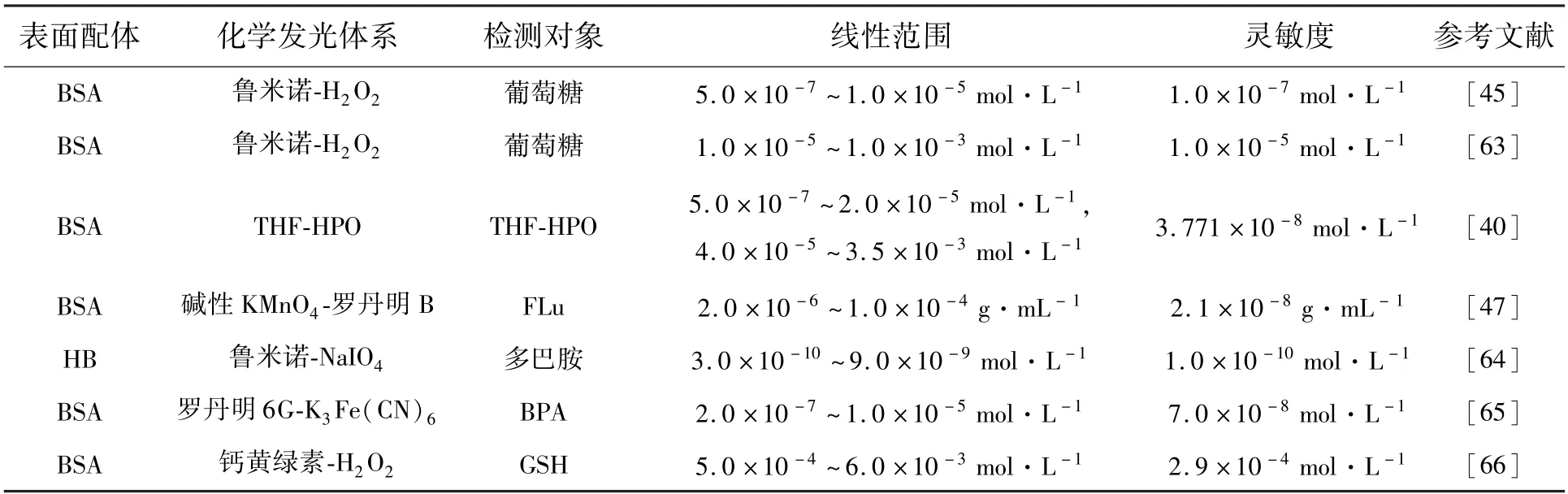
表2 金纳米簇CL 生物传感器检测小分子物质的应用Tab.2 Applications of detecting small molecules by Au NCs CL biosensors
传统的鲁米诺-H2O2体系存在灵敏度低、稳定性和选择性较差的问题,解决方法之一是使用能在水溶液中稳定的有机过氧化物代替H2O2来提供活性氧。Halawa 等[67]发现BSA-Au NCs 能够水解青蒿琥酯分子中的过氧键,并基于此建立CL 传感器。活性氧的存在能让鲁米诺的CL 强度显著增加,而GSH 能与金纳米簇以较强的共价键结合,抑制活性氧的产生,降低CL 强度,据此即可进行GSH 的线性检测,灵敏度能达到nmol·L-1数量级(线性范围为5.0×10-8~5.0×10-6mol·L-1,检测限为5.2×10-9mol·L-1)。
在金纳米簇的基础上,也可以引入其他增敏剂实现协同增敏作用。Yousefzadeh 等[68]将石墨烯量子点(GQDs)和金纳米簇加入到碱性KMnO4-罗丹明B 体系中,发现二者都能催化CL 反应的进行,RhoB 分子和活性中间体能吸附到金纳米簇表面,加快能量传递过程,GQDs也能起到类似的作用。若采用GQDs/金纳米簇复合体系,增敏效果比二者单独作用更明显。用该体系来检测西咪替丁(图7),线性检测范围为8.0×10-10~2.0×10-7g·mL-1,检测限为3.0×10-10g·mL-1。

图7 基于AuNCs 与GQDs 协同增敏作用的CL 传感器检测原理[68]Fig.7 Detecting mechanism of CL biosensor based on synergetic catalytic effects of Au NCs and GQDs[68]
在ECL 体系中,可借助酶的催化作用使待测物水解,生成能影响发光强度的物质,实现间接测量。Zhang 等[69]设计了一种基于酶促反应的ECL 传感器,以固定在CeO2纳米线上的金纳米簇为发光体,用于检测乙酰硫胆碱(ATCl)。环境中的乙酰胆碱酯酶(AChE)可催化ATCl 转变为硫代胆碱,硫代胆碱又能催化金纳米簇与共反应物之间的电子转移过程,提高发光效率,ECL 信号也得到明显的增强。该传感器的线性检测范围为5.0×10-10~4.7×10-4mol·L-1,检测限为1.7×10-10mol·L-1。
总之,金纳米簇在CL 和ECL 体系中的作用和检测对象并不完全相同。在金纳米簇参与的情况下,ECL 传感器比CL 传感器有更高的检测精度,这是因为外加电流能促进化学反应的电子转移,反应速率更快,从宏观上来看就是发光强度的提高。虽然近几年的研究中,金纳米簇CL 和ECL 传感器的检测灵敏度逐渐提高,发光效率得到突破,但与其他类型的免疫分析传感器相比,在稳定性和重现性方面研究仍然不够深入,实际应用中的抗干扰能力也有待进一步提高。
5 结论与展望
金纳米簇是一种具有量子效应的新型高效发光材料,表面配体是优化其性能的关键,配体以化学键形式与金纳米簇结合,并作为还原剂和模板限制颗粒尺寸,使金纳米簇在复杂的化学环境下保持稳定的性质,配体上的官能团又进一步使金纳米簇功能化。金纳米簇的化学发光主要有以下几类:作为化学发光体在通电条件下与共反应物转移电子而产生电化学发光;作为能量共振转移受体而产生发光;作为化学增敏剂催化其他试剂的化学发光;在化学发光或电化学发光体系中,金纳米簇在一定条件下也具有聚集诱导发光效应。金纳米簇化学发光可用于蛋白质、核酸和小分子等的体外生物检测,提高发光强度和检测灵敏度是实际应用中的重点,主要有以下进展:在蛋白质的检测中,施加还原电位能在金纳米簇的LUMO能级注入电子,引入增敏剂能使共反应物的HOMO 轨道上产生空穴,两种方案都能促进电子转移过程,增强ECL 信号;在核酸的检测中,将ECL光谱与金纳米簇吸收光谱重叠的发光体作为能量供体,可提高ECL-RET 效率,结合循环扩增技术,可大大降低检测灵敏度;在用于小分子物质检测的鲁米诺CL 体系中,以化学性质更稳定的有机过氧化物代替H2O2为活性氧来源,能提高光稳定性,同时CL 体系中还可以借助金纳米簇与量子点的协同增敏作用改善检测效果。
虽然已有多种改善金纳米簇化学发光体系发光效率、提高检测灵敏度的研究,但是要扩展其在体外生物检测中的商业化应用,仍然需要在以下方面深入探讨:
(1)在金纳米簇制备方面,除了要保证方法简单、制备成本低之外,还需要尽可能地提高其纯度,避免外来杂质的影响,同时修饰有配体的金纳米簇要做到尺寸均一、结构精确可控,能适应复杂的检测环境;
(2)在金纳米簇的CL 或ECL 机理方面,除了需要对发光过程和待测物对发光体系的影响进行解释,还需要进一步探究纳米簇浓度、溶液pH、溶剂种类、纳米簇表面配体种类、纳米簇尺寸与形状等因素对发光强度的影响,并从动力学角度分析解释;
(3)在体系的发光效率方面,可进一步结合最新的发光现象研究,如具有AIE 效应的金纳米簇是一个有潜力的发展方向。当然,仍然需要继续探索其他提高发光强度、灵敏度、稳定性、重现性和抗干扰能力的方法。
(4)在体外生物检测应用方面,除了要注重检测效果,还应研究含金纳米簇的试剂与市售化学发光免疫分析仪的适配程度,为实际应用打下基础。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210385.
