HPLC指纹图谱和多成分定量结合化学模式识别法评价不同产地胡桃楸叶质量
2022-04-01王添敏翟延君康廷国
宋 奇,刘 宏,王添敏,邸 学,张 慧,翟延君,康廷国
HPLC指纹图谱和多成分定量结合化学模式识别法评价不同产地胡桃楸叶质量
宋 奇,刘 宏,王添敏*,邸 学,张 慧,翟延君,康廷国
辽宁中医药大学药学院,辽宁 大连 116600
基于HPLC指纹图谱与多成分含量测定,结合化学模式识别法评价胡桃楸叶质量,为其深入研究和开发提供依据。采用HPLC法建立30批不同产地胡桃楸叶指纹图谱;通过中药色谱指纹图谱相似度评价系统(2012版)进行相似度评价;通过对照品比对指认了3种化学成分,并测定了样品中3种成分的含量;使用SPSS 25.0软件进行聚类分析、主成分分析和相关性分析。30批胡桃楸叶指纹图谱共标定了12个共有峰,指认的3个共有峰为绿原酸、金丝桃苷和异槲皮苷,指纹图谱相似度范围是0.827~0.995,具有较好的一致性;样品中绿原酸、金丝桃苷和异槲皮苷3种化学成分的质量分数分别为0.258~5.607 mg/g、0.113~3.974 mg/g和0.439~6.537 mg/g;聚类分析将样品分为3类,30批样品中28批样品聚为一类,铁岭鸡冠山乡(S3)、本溪东营坊乡(S6)的样品各自聚为一类;主成分分析用2个主成分进行综合评价,综合得分大于1的前6位分别为S3、S6、S12、S8、S24和S18;30批样品中3种成分的总含量与主成分综合得分存在明显相关性。建立的胡桃楸叶质量评价方法操作简便、结果可靠,绿原酸、金丝桃苷和异槲皮苷可以作为胡桃楸叶质量评价的指标性成分。
胡桃楸叶;指纹图谱;含量测定;化学模式识别;绿原酸;金丝桃苷;异槲皮苷;聚类分析;主成分分析;相关性分析
胡桃楸Maxim.为胡桃科胡桃属植物,又名核桃楸、山核桃,主要分布于我国东北、河北、山西以及朝鲜北部[1]。胡桃楸青果、皮、种仁等多个部位在《中华本草》和《中药大辞典》中有记载,其青果可止痛,用于胃、十二指肠溃疡,胃痛,外用治疗神经性皮炎;树皮、枝皮和干皮能清热解毒、止痢明目,用于治疗细菌性痢疾、骨结核、麦粒肿、目赤等;果仁具有敛肺定喘、温肾润肠的功效,用于体质虚弱、肺虚咳喘、肾虚腰痛、便秘等[2-3]。现代活性研究表明胡桃楸茎枝水提物、外果皮(青龙衣)乙醇提取液和树皮提取物均表现出抗肿瘤活性[4-6]。胡桃楸叶虽未在本草相关书籍中记载,但其资源丰富易得,近年来学者对胡桃楸叶的化学成分及生物活性研究越来越多。胡桃楸叶中主要含有萘醌类、二芳基庚烷类、黄酮类和有机酸类化合物[7-10]。胡桃楸叶的醋酸乙酯提取物、乙醇提取物能够抑制肿瘤细胞的增殖,水提取物和乙醇提取物能够抑制荷瘤小鼠肿瘤的生长,显示一定的抗肿瘤作用[11-14];同时,其乙醇提取物能减轻辐射对机体造成的免疫系统的损伤,提高辐射后机体受损的免疫能力及抗氧化能力,并对放射所致的小鼠造血功能损伤有一定的防护效应和明显的修复作用[15-16]。
目前,关于胡桃楸叶的质量标准及质量评价尚无相关研究报道,为了合理评价胡桃楸叶的质量,本研究在胡桃楸的主要产地东北地区收集了30批胡桃楸叶样品,采用高效液相色谱法建立了30批胡桃楸叶的指纹图谱,并测定了其中3个主要共有成分绿原酸、金丝桃苷和异槲皮苷的含量,结合聚类分析、主成分分析和相关性分析对胡桃楸叶的质量进行综合评价,为其质量评价和深入研究开发提供依据。
1 仪器与材料
1.1 仪器
FW100型高速粉碎机(天津泰斯特仪器有限公司);JA21002型精密电子分析天平(上海舜宇恒平科学仪器有限公司);Sartorius电子天平(德国赛多利斯科学仪器有限公司);TDZ4-WS型低速台式离心机(湖南湘仪实验室仪器开发有限公司);KQ5200DB型数控超声波清洗器(昆山市超声仪器有限公司);配有四元泵、自动进样器、柱温箱和DAD检测器的1260型安捷伦高效液相色谱仪(美国安捷伦公司)。
1.2 材料
对照品绿原酸(批号110753-200413)购自中国食品药品检定研究院,金丝桃苷(批号RA0504FA14)、异槲皮苷(批号P2956F3858)购自上海源叶生物科技有限公司,三者质量分数均≥98%。乙腈(色谱纯,德国默克公司);甲酸、甲醇(色谱纯,天津科密欧化学试剂有限公司);纯净水(大连娃哈哈饮用水有限公司);30批胡桃楸叶样品均为野外产地收集,经辽宁中医药大学翟延君教授鉴定为胡桃科胡桃属植物胡桃楸Maxim.的叶,样品信息见表1。
2 方法与结果
2.1 溶液制备
2.1.1 供试品溶液的制备 采集的新鲜胡桃楸叶,阴干,粉碎。取粗粉(过60目筛)约0.2 g,精密称定,置具塞离心管中,精密加入50%甲醇(含0.5%甲酸)10 mL,称定质量,超声(功率200 W、频率50 kHz)处理30 min,放冷,用50%甲醇(含0.5%甲酸)补足减失质量,离心(4000 r/min)5 min,取上清液,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.1.2 对照品溶液的制备 分别称取绿原酸、金丝桃苷和异槲皮苷3种对照品适量,精密称定,加入50%甲醇溶液(含0.5%甲酸)配制成质量浓度1.665 mg/mL的对照品贮备液,精密量取各对照品储备液1 mL于10 mL量瓶中,加入50%甲醇溶液(含0.5%甲酸)稀释至刻度,摇匀,得混合对照品溶液。保存于4 ℃冰箱中,备用。
2.2 色谱条件
Agilent Poroshell 120 SB-C18色谱柱(100 mm×2.1 mm,2.7 μm),预柱Agilent Poroshell 120 SB-C18(5 mm×2.1 mm,2.7 μm),柱温30 ℃,流动相0.1%甲酸水(A)-乙腈(B),梯度洗脱:0~5 min,5%~13% B;5~15 min,13%~16% B;15~25 min,16%~22% B;25~40 min,22%~30% B;40~42 min,30%~100% B;42~47 min,100% B;体积流量0.3 mL/min;指纹图谱检测波长为350nm,绿原酸含量测定检测波长为325 nm,金丝桃苷和异槲皮苷含量测定检测波长为350 nm;进样量5 μL。
表1 胡桃楸叶的样品信息
Table 1 Sample information of leavesof J. mandshurica
编号产地采收日期编号产地采收日期 S1辽宁省铁岭市西丰县2018-08S16辽宁省丹东市东港市2018-08 S2辽宁省铁岭市横道河子乡2018-08S17辽宁省营口市盖州市2018-08 S3辽宁省铁岭市鸡冠山乡2018-08S18辽宁省营口市盖州市2018-08 S4辽宁省本溪市小市镇2018-08S19辽宁省营口市盖州市2017-07 S5辽宁省本溪市桓仁县2018-08S20辽宁省朝阳市凌源市2018-08 S6辽宁省本溪市东营坊乡2018-08S21辽宁省朝阳市凌源市2018-08 S7辽宁省本溪市连山关镇2018-08S22辽宁省朝阳市喀左县2018-08 S8辽宁省鞍山市岫岩县2018-08S23辽宁省朝阳市北票市2018-08 S9辽宁省鞍山市千山区2018-07S24黑龙江省海伦市2018-08 S10辽宁省鞍山市千山区2018-09S25辽宁省抚顺市清原县南口前镇2018-08 S11辽宁省辽阳市辽阳县2018-08S26辽宁省抚顺市新宾县木奇镇2018-08 S12吉林省吉林市龙潭区2018-07S27辽宁省抚顺市新抚区2018-08 S13吉林省吉林市蛟河区2018-07S28辽宁省抚顺市抚顺县夹河乡2018-08 S14辽宁省丹东市东港市2018-07S29辽宁省抚顺市望花区2018-08 S15辽宁省丹东市东港市2018-08S30辽宁省抚顺市抚顺县兰山乡2018-08
2.3 指纹图谱方法学考察
2.3.1 精密度试验 取胡桃楸叶样品(S3),按照“2.1.1”项方法制备供试品溶液,按照“2.2”项色谱条件重复进样6次,以峰形对称且响应值大的2号色谱峰绿原酸为参照,测得各共有峰相对保留时间的RSD均小于0.25%,相对峰面积的RSD均小于1.72%,表明仪器精密度良好。
2.3.2 重复性试验 取胡桃楸叶样品(S3),按照“2.1.1”项方法平行制备6份供试品溶液,按照“2.2”项色谱条件进样分析,以2号色谱峰绿原酸为参照,测得各共有峰相对保留时间的RSD均小于0.07%,相对峰面积的RSD均小于4.80%,表明该方法重复性良好。
2.3.3 稳定性试验 取胡桃楸叶样品(S3),按照“2.1.1”项方法制备供试品溶液,分别于制备后的0、2、4、8、10、12 h按照“2.2”项色谱条件进样分析,以2号色谱峰绿原酸为参照,测得各共有峰相对保留时间的RSD均小于0.27%,相对峰面积的RSD均小于2.12%,表明供试品溶液在室温放置12 h内稳定性良好。
2.4 指纹图谱的建立和相似度分析
2.4.1 指纹图谱的建立 30批胡桃楸叶样品按“2.1.1”项方法制备成供试品溶液,按照“2.2”项色谱条件进样分析,记录色谱图。将得到的30批胡桃楸叶指纹图谱(图1)以AIA格式导入“中药色谱指纹图谱相似度评价系统(2012)”软件,以S1样品为参照指纹图谱,经多点校正和自动匹配后生成对照指纹图谱(图2),共标定12个共有峰。通过对照品比对指认2号峰为绿原酸,6号峰为金丝桃苷,7号峰为异槲皮苷。

图1 30批胡桃楸叶指纹图谱

2-绿原酸 6-金丝桃苷 7-异槲皮苷
2.4.2 相似度分析 以生成的对照指纹图谱为标准,计算30批胡桃楸叶样品的相似度,如表2所示,30批胡桃楸叶样品相似度范围是0.827~0.995,表明各产地胡桃楸叶的指纹图谱相对稳定。
表2 30批胡桃楸叶HPLC图谱的相似度
Table 2 Similarity for HPLC analysis of 30 batches of leaves of Juglans mandshurica
编号相似度编号相似度编号相似度 S10.970S110.974S210.979 S20.933S120.975S220.976 S30.932S130.967S230.972 S40.879S140.894S240.995 S50.948S150.874S250.903 S60.960S160.972S260.919 S70.950S170.965S270.827 S80.880S180.977S280.967 S90.879S190.992S290.907 S100.917S200.892S300.984
2.5 聚类分析
以30批样品中12个共有峰的峰面积为变量,导入SPSS 25.0软件,采用组间联接、平方欧式距离法进行系统聚类分析,结果如图3所示,当欧氏距离为7时,胡桃楸叶样品可聚为3类,大部分样品(共28批)聚为第1类,产自本溪东营坊乡的样品S6单独聚为第2类,采自铁岭鸡冠山乡的样品S3单独聚为第3类。
2.6 主成分分析
2.6.1 特征值和方差贡献率 以30批胡桃楸叶指纹图谱中12个共有峰的峰面积为变量,得到30×12阶数据矩阵,运用SPSS 25.0软件进行主成分分析,以主成分特征值>1为提取标准,得到2个主成分。第1主成分特征值为7.964,方差贡献率为66.368%;第2主成分特征值为1.405,方差贡献率为11.707%;2个主成分的累积方差贡献率为78.075%,可以代表指纹图谱中12个共有峰的大部分信息。
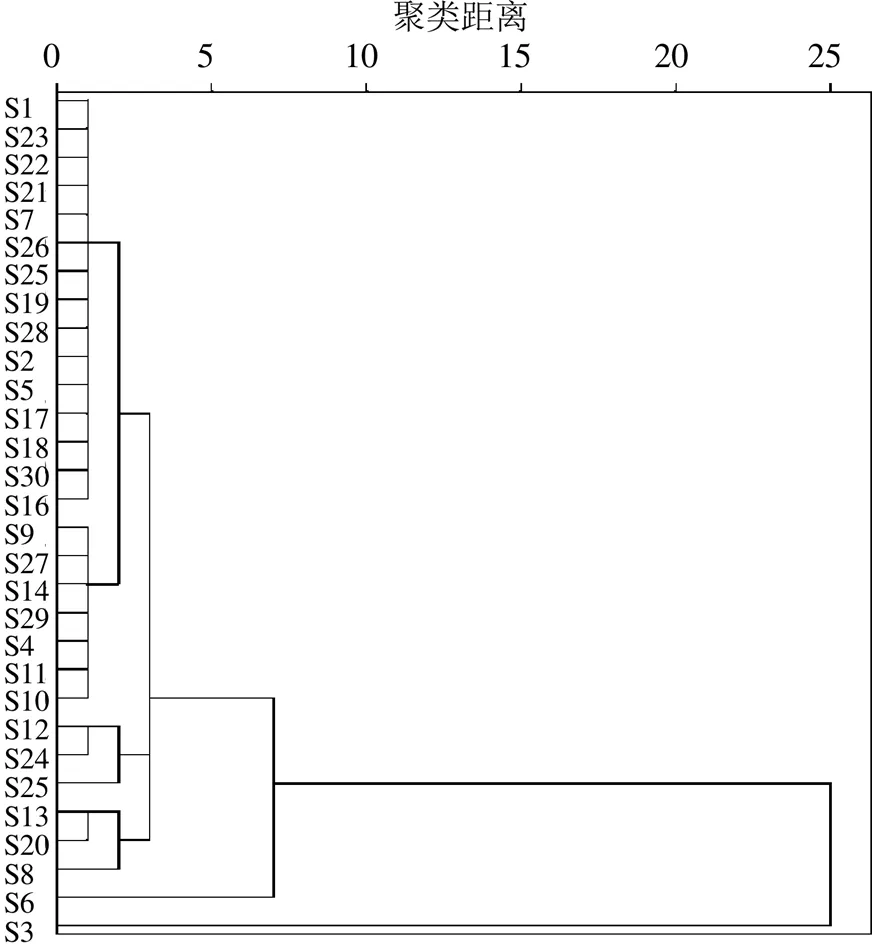
图3 胡桃楸叶的系统聚类分析图
2.6.2 因子载荷矩阵 因子载荷矩阵反映了各主成分与12个共有峰即原始变量之间的相关系数,结果由表3可知,第1主成分主要反映了色谱峰2~7、9~12的信息,第2主成分主要反映了色谱峰1、8的信息。
清华大学熊澄宇教授认为,“新媒体是一个不断变化的概念”,对于新媒体的概念,至今未有明确定论,国务院发展研究中心局长岳颂东提出:新媒体就是一种将信息传播给受众的载体,通过信息的传递从而对受众产生预期效应,它是一种媒介,当然,它采用的是当代最新的科技手段。上海文广新闻传媒集团总裁黎瑞刚认为,新媒体是继报刊、广播、电视等传统媒体之后发展起来的新的媒体形态,它通过互联网、无线通信网、有线网络等渠道以及电脑、手机、数字电视机等终端,向用户提供信息和娱乐的传播形态和媒体形态。
2.6.3 指纹图谱的综合评价 运用SPSS 25.0软件计算30批胡桃楸叶样品的主成分得分,以各主成分对应的贡献率为权重系数计算综合得分,并进行排序,结果见表4。综合得分较高的前6位分别为批次S3、S6、S12、S8、S24和S18,其综合得分均大于1,说明这6个批次的胡桃楸叶样品质量较好;样品S3和S6的综合得分较高,与其他样品差异较大,这与聚类分析结果一致。
表3 因子载荷矩阵
Table 3 Component matrix
共有峰编号载荷共有峰编号载荷 1212 10.568 0.608 70.905−0.252 20.783 0.389 80.480 0.682 30.963−0.104 90.820−0.208 40.956−0.046100.697 0.334 50.880−0.212110.727−0.302 60.949−0.218120.881−0.061
表4 30批胡桃楸叶的主成分因子得分和排序
Table 4 Factor scores and sorting of principal components of 30 batches of leaves of J. mandshurica
编号主成分1得分主成分2得分综合得分排序 S1−0.205 0.538−0.07312 S2−1.056 1.199−0.56020 S311.454−1.495 7.427 1 S4−2.355−1.307−1.71627 S5−0.455 1.275−0.15314 S6 5.072−0.517 3.306 2 S7−1.101−0.508−0.79021 S8 2.081−1.766 1.174 4 S9−2.421−0.056−1.61325 S10−1.861−0.197−1.25823 S11−2.691−0.910−1.89328 S12 2.334 2.901 1.889 3 S13 1.230 0.257 0.847 7 S14−2.712−1.192−1.93929 S15−0.291 3.009 0.15910 S16 0.576 0.651 0.459 9 S17 0.025 0.168 0.03611 S18 1.300 1.819 1.076 6 S19−0.109−0.237−0.10013 S20−0.505−1.095−0.46318 S21−0.824 0.107−0.53519 S22−0.320 0.271−0.18115 S23−0.406 0.381−0.22516 S24 1.570 0.335 1.081 5 S25−1.887−0.239−1.28024 S26−1.465−0.205−0.99622 S27−2.541−0.031−1.69026 S28−0.312−1.586−0.39317 S29−3.343−1.407−2.38330 S30 1.218−0.164 0.789 8
2.7 样品中3个成分的含量测定
2.7.1 线性关系考察 精密吸取“2.1.2”项下混合对照品溶液适量,用50%甲醇(含0.5%甲酸)分别稀释至5个不同质量浓度,得系列混合对照品溶液。在“2.2”项条件下进样分析,记录色谱图,以各对照品峰面积为纵坐标(),质量浓度为横坐标(),进行线性回归分析,结果见表5。
2.7.2 精密度试验 精密吸取“2.1.2”项下混合对照品溶液,在“2.2”项条件下连续进样6次,记录绿原酸、金丝桃苷和异槲皮苷的峰面积积分值,计算RSD值分别为0.19%、0.28%、0.28%,表明该仪器精密度良好。
表5 3个成分的线性回归分析结果
Table 5 Results of linear regression analysis for three constituents
成分回归方程r2线性范围/(μg·mL−1) 绿原酸Y=55.964 X-1.551 90.999 92.660~166.5 金丝桃苷Y=62.809 X+6.385 10.999 92.600~166.5 异槲皮苷Y=34.362 X+6.723 10.999 92.600~166.5
2.7.3 重复性试验 精密称取胡桃楸叶样品粉末6份(S3),按照“2.1.1”项方法制备供试品溶液,在“2.2”项色谱条件下平行进样分析,计算绿原酸、金丝桃苷和异槲皮苷的平均质量分数分别为5.986、4.242、6.978 mg/g。RSD值分别为1.88%、2.57%、4.03%,表明该方法重复性良好。
2.7.4 稳定性试验 精密吸取供试品溶液(S3),在“2.2”项条件下,分别于0、2、4、8、10、12 h进样分析,记录绿原酸、金丝桃苷和异槲皮苷的峰面积积分值,计算RSD值分别为0.46%、0.52%、0.53%,表明样品在12 h内稳定性良好。
2.7.5 加样回收率试验 精密称取胡桃楸叶样品0.05 g(S3),置具塞离心管中,平行6份,分别加入一定体积的对照品溶液,精密加入50%甲醇(含0.5%甲酸)5 mL,按照“2.1.1”项方法制备供试品溶液,在“2.2”项条件下平行进样分析,计算回收率和RSD值。结果绿原酸、金丝桃苷和异槲皮苷的平均回收率分别为102.56%、98.89%、100.87%,RSD值分别为2.30%、0.66%、2.00%。
2.8 3个成分含量与指纹图谱综合得分的相关性分析
为了明确所测3个成分含量是否可作为指标性成分用以评价胡桃楸叶的质量,采用SPSS 25.0软件对30批样品中绿原酸、金丝桃苷、异槲皮苷的总量和指纹图谱的综合得分进行相关性分析,结果表明两者的相关系数为0.983(双尾,<0.01);说明所测3个成分可以作为指标性成分对胡桃楸叶进行质量评价。
表6 30批胡桃楸叶中3个主要成分的含量
Table 6 Contents of three main constituents in 30 batches of leaves of J. mandshurica
编号质量分数/(mg·g−1)编号质量分数/(mg·g−1) 绿原酸金丝桃苷异槲皮苷总量绿原酸金丝桃苷异槲皮苷总量 S11.7010.8112.074 4.586S162.9430.7511.3565.050 S23.2410.4071.210 4.858S172.5610.5971.9635.121 S35.9864.2426.97817.206S183.5210.7381.6805.939 S40.5340.2931.570 2.397S192.6320.5682.0075.207 S53.8760.6261.465 5.967S200.8071.0883.4875.382 S65.7642.1494.21912.132S211.6970.6931.7864.176 S72.8510.4531.416 4.720S221.7340.7592.0154.508 S81.7381.8524.018 7.608S231.8570.7702.0844.711 S91.3250.1850.748 2.258S243.2590.9792.9427.180 S100.5730.4181.866 2.857S252.2890.2880.8423.419 S110.9850.2671.069 2.321S262.7550.2151.0954.065 S124.2371.0962.220 7.553S271.2840.1210.4711.876 S132.1591.0703.682 6.911S281.9980.6241.8314.453 S140.2800.1670.980 1.427S290.3150.2021.0331.550 S154.1210.3111.254 5.686S303.3490.5862.2796.214
3 讨论
本研究以胡桃楸叶为研究对象,收集了30批东北地区的胡桃楸叶样品进行指纹图谱和多成分含量测定研究,并通过相似度分析、聚类分析、主成分分析以及相关性分析综合评价胡桃楸叶的质量。实验中考查了不同浓度甲醇(30%、50%、70%、90%)及不同甲酸含量(不加甲酸、0.5%、1.0%)对提取结果的影响,最终选择含0.5%甲酸的50%甲醇溶液作为提取溶剂。根据DAD检测结果,指纹图谱选择350 nm作为检测波长,含量测定则以各成分的最大吸收波长(绿原酸325 nm,金丝桃苷和异槲皮苷350 nm)作为检测波长。
根据指纹图谱的相似度和聚类分析结果,大部分胡桃楸叶的指纹图谱具有较好的一致性,说明收集的东北地区胡桃楸叶样品质量较稳定。主成分分析和聚类分析显示,样品S3和S6综合得分较高,分别被单独聚为一类,两者12个共有峰峰面积的和分别为18 448.60、11 341.07,显著高于其它样品的平均值4 993.98,因此在聚类分析中各自被单独聚为一类,在主成分分析综合评价中也分别位于1和2名。这提示从化学成分分析上评价,两者的综合质量较好。但根据目前实验资料,仍不能明确造成两者与其他批次样品差异的具体原因。30批样品均为野外产地采集,树木胸径在10~40 cm,采集时间均在叶盛期,采集部位均为树冠较低分叉枝叶,加工方法均为自然阴干。除以上采集加工方法外,次生代谢产物的累积仍可能与树龄、生长环境以及病虫害等有关,由于本实验未着眼于研究影响胡桃楸叶质量的因素,因此本实验未收集树龄和生境的具体数据。要明确造成样品S3、S6与其他样品差异较大的原因以及影响胡桃楸叶质量的因素,仍需进一步研究。
指纹图谱中绿原酸、金丝桃苷和异槲皮苷在胡桃楸叶中的含量较高,色谱峰易辨别,且研究表明3种成分均具有抗肿瘤、抗氧化等生物活性[17-19],与胡桃楸叶的抗肿瘤[12]和抗氧化[15]活性吻合;同时根据化学模式识别结果,三者总含量与30个样品指纹图谱综合得分有明显相关性,即样品中三者含量越高,指纹图谱综合得分越高。因此,选择绿原酸、金丝桃苷和异槲皮苷作为胡桃楸叶质量评价的指标性成分是合理可靠的。
目前关于胡桃楸叶的活性和质量研究报道均较少,而胡桃楸叶作为一种可再生的药用资源,量大易获得,不会对原植物造成不可逆的伤害,其含有多种化学成分,具有很大的药用潜力,可以进行深入研究。本实验建立的胡桃楸叶指纹图谱以及含量测定方法可为胡桃楸叶的质量评价研究提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1999: 23.
[2] 国家中医药管理局《中华本草》编委会. 中华本草-9 [M]. 上海: 上海科学技术出版社, 1999: 36-39.
[3] 江苏新医学院. 中药大辞典(下册)[M]. 上海: 上海人民出版社, 1977: 26.
[4] 鞠晓畅, 陈晨, 邸学, 等. 胡桃楸茎枝水提物的急性毒性及体外抗肿瘤活性研究 [J]. 中南药学, 2019, 17(3): 360-364.
[5] 刘畅, 周晓棉, 孙非非, 等. 胡桃楸提取物的抗肿瘤作用 [J]. 沈阳药科大学学报, 2013, 30(10): 799-802.
[6] 杨爱华, 邹桂华, 赵英福, 等. 青龙衣提取液对胃癌细胞SGC-7901增殖抑制作用的影响 [J]. 实验室科学, 2020, 23(1): 36-37.
[7] 孙国东, 霍金海, 程团, 等. 基于UPLC-Q-TOF/MS技术的胡桃楸叶化学成分分析 [J]. 中药材, 2017, 40(5): 1123-1129.
[8] Wang T M, Liu J, Yi T,. Multiconstituent identification in root, branch, and leaf extracts ofusing ultra high performance liquid chromatography with quadrupole time-of-flight mass spectrometry [J]., 2017, 40(17): 3440-3452.
[9] 李英春. 核桃楸叶的化学成分及其抗肿瘤活性的研究 [D]. 长春: 吉林大学, 2007.
[10] Li G, Cui J M, Seo C S,. Two new diarylheptanoids from[J]., 2005, 26(11): 1878-1880.
[11] 宋华, 包永明, 张红梅, 等. 核桃楸叶提取液对肿瘤细胞的抑制作用 [J]. 大连轻工业学院学报, 2001, 20(2): 109-111.
[12] 罗猛, 乔琪, 牟璠松, 等. 胡桃楸活性成分时空动态及抗肿瘤活性初步研究 [J]. 植物研究, 2017, 37(6): 947-952.
[13] 王添敏, 俞文婕, 朱林峰, 等. 胡桃楸不同部位水提取物的体内抗肿瘤作用 [J]. 西北药学杂志, 2017, 32(5): 624-628.
[14] 王添敏, 俞文婕, 朱林峰, 等. 胡桃楸不同部位乙醇提取物的抗肿瘤作用研究 [J]. 时珍国医国药, 2017, 28(3): 570-572.
[15] 李岩, 李娟, 柳旺艳, 等. 胡桃楸叶提取物对辐射损伤小鼠的保护作用 [J]. 特产研究, 2009, 31(2): 42-44.
[16] 李岩, 李娟, 王德洁, 等. 胡桃楸叶乙醇提取物对放射损伤小鼠造血功能的影响 [J]. 特产研究, 2009, 31(3): 25-27.
[17] 王庆华, 杜婷婷, 张智慧, 等. 绿原酸的药理作用及机制研究进展 [J]. 药学学报, 2020, 55(10): 2273-2280.
[18] 杨诗婷, 王晓倩, 廖广辉. 金丝桃苷的药理作用机制研究进展 [J]. 中国现代应用药学, 2018, 35(6): 947-951.
[19] 陈燕, 詹羽姣, 李晨阳, 等. 异槲皮苷的生物活性研究进展 [J]. 中国现代中药, 2018, 20(12): 1579-1582.
Quality evaluation of leaves ofbased on combinative methods of HPLC fingerprint and multi-components determination and chemical pattern recognition
SONG Qi, LIU Hong, WANG Tian-min, DI Xue, ZHANG Hui, ZHAI Yan-jun, KANG Ting-guo
College of Pharmacy, Liaoning University of Traditional Chinese Medicine, Dalian 116600, China
To evaluate the quality of leaves ofbased on HPLC fingerprint and multi-component determination combined with chemical pattern recognition method for providing useful information for further study and utilization.The fingerprints of 30 batches of leaves offrom different producing areas were established by HPLC, and the similarity of the fingerprints was analyzed with Similarity Evaluation System for Chromatographic Fingerprint of Chinese Materia(2012). Three kinds of components were identified by comparison with reference substances and their content in samples were determined. The hierarchical clustering analysis (HCA), principal component analysis (PCA) and correlation analysis (CA) were performed by SPSS 25.0.Twelve common peaks were identified in 30 batches of leaves of. Three of the common peaks were identified as chlorogenic acid, hyperoside and isoquercitrin. The fingerprint similarities ranged from 0.827 to 0.995 with good consistency. The qulity score of chlorogenic acid, hyperoside and isoquercitrin in samples were 0.258—5.607 mg/g, 0.113—3.974 mg/g, and 0.439—6.537 mg/g, respectively. According to HCA, the samples were divided into three groups. A total of 28 of 30 batches were clustered into one group, and samples from Jiguan Town of Tieling City (S3) and Dongyingfang Town of Benxi City (S6) were clustered as one group respectively. Two principal components were selected and the comprehensive scores of each sample were achieved by PCA. The results of PCA showed that the top six comprehensive scores of S3, S6, S12, S8, S24 and S18 were bigger than 1. There was a significant correlation between the total content and the comprehensive scores of three components in the 30 batches of leaves of.The established method is simple to operate and reliable, the total content of chlorogenic acid, hyperoside and isoquercitrin can be used as an marker for the quality evaluation of leaves of.
leaves of; fingerprints; content determination ; chemical pattern recognition; chlorogenic acid; hyperoside; isoquercitrin; cluster analysis; principal component analysis; correlation analysis
R286.2
A
0253 - 2670(2022)07 - 2143 - 07
10.7501/j.issn.0253-2670.2022.07.025
2021-09-06
国家自然科学基金项目(81703658)
宋 奇,女,硕士研究生,研究方向为中药品质评价与药效物质基础。Tel: 15142435542 E-mail: 1142562290@qq.com
王添敏,女,硕士生导师,副教授,从事中药品质评价与药效物质基础研究。Tel: (0411)87586003 E-mail: wang_tm@163.com
[责任编辑 时圣明]
