果蝇造血器官淋巴腺的研究进展
2022-03-30李坤金丽华
李坤,金丽华
东北林业大学生命科学学院,哈尔滨150000
果蝇造血过程贯穿整个生命周期,在免疫响应和营养物质运输中发挥关键作用,其主要分为胚胎阶段和幼虫阶段[1]。胚胎阶段血细胞从头部中胚层运出,随后移动到全部胚胎;在幼虫阶段,淋巴腺是主要的造血器官。2 个阶段的血细胞均可保留至成虫时期,维持果蝇成虫的生命活动。除上述2 个阶段外,近年来,研究发现,果蝇成虫时期可能也存在造血器官。2015年,Ghosh等[2]发现果蝇成虫背部存在4 个由不同血细胞组成的细胞群,其具有一定的造血功能;然而,2019年,Sanchez 等[3]的研究表明,这些细胞群中血细胞不具有增殖能力,因此,成虫阶段的造血作用仍存在争议。
淋巴腺发育过程从胚胎时期开始并于三龄幼虫时期成熟,蛹期淋巴腺裂解,释放血细胞进入循环系统并保留至成虫期[4]。成熟淋巴腺中的前体血细胞类似于哺乳动物骨髓造血干细胞(hematopoietic stem cells,HSC),后端信号中心区细胞近似于干细胞微环境,成熟血细胞与哺乳动物髓系血细胞功能相似;并且,淋巴腺的稳态由一系列与哺乳动物高度保守的因子和信号通路调控,因此,淋巴腺已成为研究造血功能的重要模型[5]。本文总结了血细胞类型和功能、淋巴腺发育过程及调控淋巴腺稳态的几种典型信号通路,以期为淋巴腺血细胞的功能研究奠定一定的理论基础。
1 果蝇的3种血细胞类型及其功能
目前在果蝇中已鉴定出3 种形态功能不同的血细胞,包括浆细胞(plasmatocytes)、晶细胞(cystal cells)和薄层细胞(lamellocytes),分别具有产生抗菌肽、吞噬和促进伤口愈合等功能[6]。健康果蝇的淋巴腺可以产生2 种成熟血细胞,即浆细胞和晶细胞(图1),它们可以持续生存到蛹期和成虫期;此外,还存在另一种成熟血细胞,即薄层细胞,其只有在黄蜂寄生或病原体感染时才能被诱导产生[5]。
1.1 浆细胞
浆细胞类似于哺乳动物的巨噬细胞,直径为8~10 μm,相对较小,占血细胞总数的90%~95%,其细胞质较多,并含有丰富的溶酶体、内质网等[7]。浆细胞的主要功能为专一性噬菌、吞噬和降解死亡细胞及碎片和入侵的病原体。CD36 家族成员受体中的Crq 具有调节浆细胞识别凋亡细胞的功能[8]。除参与细胞免疫外,浆细胞分泌的抗菌肽(antimicrobial peptides,AMPs)和细胞外基质(extracellular matrix,ECM)蛋白,分别介导体液免疫反应或促进组织形成[9]。标记浆细胞的蛋白主要有血凝素(hemolectin,Hml)、过氧化物酶(peroxidasine,Pxn)、P1 抗原(NimC1)蛋白、Croquemort(Crq)蛋白、胶原蛋白(Collagen)和Eater蛋白等,可以根据浆细胞的分化程度选取不同的标记物进行鉴定[10]。
1.2 晶细胞
晶细胞直径为10~12 μm,略大于浆细胞,占血细胞总数的2%~5%,因含有介导黑色素形成的酚氧化酶原(prophenoloxidase,PPO)而具有黑化作用[11]。作为一种非吞噬性的血细胞,晶细胞通过释放与黑色素化相关的蛋白酶,以促进天然免疫和伤口愈合[12]。黑色素化是一种蛋白水解级联反应,晶体内含物中的PPO 能够活化游离血细胞中的酚氧化酶(phenol oxidase,PO),并催化酚类氧化成醌类,进而聚合成黑色素。黑色素与其产物,如过氧化氢、氮的氧化物等会直接导致微生物中毒[13]。
果蝇的3个独立基因PPO1、PPO2和PPO3编码PPO 酶,PPO3在薄层细胞中表达,PPO1 和PPO2在晶细胞中表达[13]。Notch 信号通路在晶细胞分化中起主要作用,Notch 及其下游效应物Lozenge(Lz)能够激活靶基因klumpfuss和pebbled/hindsight共同促进晶细胞分化[14]。晶细胞分化早期的标记物为Lz 或pebbled/Hindsight(Hnt),晚期标记物为酚氧化酶原(prophenoloxidase,ProPO)[15]。
1.3 薄层细胞
薄层细胞大而扁平,形状不规则,直径为15~40 μm,不具有吞噬能力,但通常含有比浆细胞更多的溶酶体和吞噬小泡[16]。一般情况下,薄层细胞不易在幼虫阶段观察到,但在免疫刺激(如黄蜂寄生、伤害或机械应力)下大量产生,其可包裹和杀死过大而无法被吞噬的异物。与浆细胞和晶细胞不同,薄层细胞仅可能在幼虫体内产生,对于胚胎或成虫期,即便是在黄蜂感染后也不会出现[17]。研究表明,许多信号通路参与了薄层细胞的分化,如Notch、JAK/STAT、JNK、Toll、EGFR 和ecdysone[18]。JNK 通路在决定薄层细胞命运中起关键作用,该途径的主要成分Basket(Bsk)、Msn、Puckered(Puc)、Hemipterous(Hep)、Kayak(Kay)和FOXO 均参与了这一过程[19]。标记薄层细胞的蛋白包括Atilla、β-PS 整合素(由myospheroid 编码)、α-PS4 整合素、Misshapen(Msn)、Puckered、PPO3、L2或L6[20]。
2 淋巴腺
2.1 淋巴腺的形成
在胚胎发育的第13 阶段,淋巴腺的前体在心源性中胚层表现为局部隆起[21]。这些淋巴腺前体向背侧迁移,形成与背侧血管相关的紧密细胞簇,最终形成包括位于背侧血管侧面的多个叶的成对链。在第13~16阶段,果蝇胚胎的T1~T3 3个体节中锌指蛋白Odd阳性的细胞簇合并形成早期淋巴腺,而腹部中的Odd 阳性细胞簇则形成心包细胞[22]。此时胚胎触足复合群基因(Antennapedia,Antp)的表达仅局限于T3体节的5~6个细胞内,这些细胞随着细胞簇被合并至早期淋巴腺的后端被称为后部信号中心(rear signal center,PSC)。一级淋巴腺的其余细胞由T1~T2区段产生的Odd阳性细胞簇发育而来[23]。
一龄和二龄早期幼虫的一级淋巴腺主要由表达Dome 的细胞组成。在这个阶段,淋巴腺中Dome 阳性的前体细胞开始堆积,细胞间接触紧密[24]。到二龄晚期,一级淋巴腺中出现表达Hml和Pxn 的细胞,表明血细胞开始分化,将形成二级和三级淋巴腺[25]。淋巴腺在三龄幼虫时逐渐成熟,一级淋巴腺被分为3个不同的区域,即髓质区(medullary zone,MZ)、皮质区(cortical zone,CZ)及后端信号中心区(posterior signal center,PSC)[26],分别行使不同的功能。在蛹期,MZ细胞增殖并分化为终末成熟血细胞,PSC 细胞在整个淋巴腺中扩散。在蛹形成后15 h 内,淋巴腺逐渐裂解至完全消失,并将血细胞全部释放于体腔中[27]。
2.2 淋巴腺的不同区域
三龄幼虫完全发育时,根据细胞形态和血细胞类型等,一级淋巴腺可分成MZ 区、CZ 区和PSC区3个区(图1)。MZ区位于一级淋巴腺内部中央区域,含有紧密相连的干细胞样前体细胞,可以产生组成CZ 区的3 种成熟血细胞,即浆细胞、晶细胞和薄层细胞(健康的幼虫体内极少)[28],且MZ区可由Dome、Tep4 和DE-cad 来定位[29]。CZ 区中成熟血细胞排列松散,可表达Hml、Lz、Pxn、P1 和Eater[30]。在MZ 和CZ 之间,有一个区域为中间前体血细胞(intermediate precursor blood cells,IPs),在这里细胞经历从前体细胞到特定成熟血细胞的转变,它们具有比成熟的浆细胞和晶细胞更高的有丝分裂活性[31]。淋巴腺另一个关键区域为PSC细胞,约由30个细胞组成,位于后部并与MZ前体血细胞相邻,在维持淋巴腺稳态方面起重要的调节作用[32]。PSC 细胞可被Serrate(Ser)、Col、Antp和Hedgehog(Hh)特异性标记[30]。淋巴腺的后叶由二级、三级和四级淋巴腺组成,类似于一级淋巴腺的MZ 区,由高表达DE-cad、Dome 和Col 的紧密堆积的前体血细胞组成[33]。
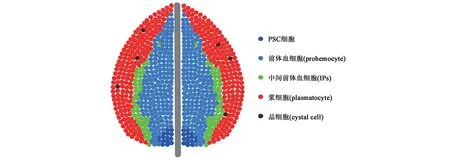
图1 三龄幼虫一级淋巴腺Fig.1 The primary lobe of lymph gland at third instar larval stage
3 淋巴腺发育过程中的信号调控
3.1 Notch信号
Notch信号是在发育、干细胞自我更新和组织分化过程中参与细胞命运调节的保守信号通路[34]。在果蝇幼虫造血过程中Notch 信号参与晶细胞的分化和淋巴腺的维持。Notch 的胞外结构域与位于相邻细胞膜上的配体蛋白Delta和Ser相互作用,Notch 蛋白裂解并释放Notch 胞内结构域(notch intracellular domain,NICD)进入细胞核,通过转录因子Suppressor of Hairless[Su(H)]激活下游靶基因的表达[35]。
果蝇有2 个Notch 配体,即Delta 和Ser。Delta维持MZ 区稳态[36],而Ser 在PSC 细胞中高度表达,通过调节Col的转录来维持PSC区细胞数量和信号转导[37]。Notch 在三龄幼虫一级淋巴腺中普遍表达[38]。在MZ 的前体血细胞中,Notch 通路促进未分化的血细胞向晶细胞分化,过表达Notch、Ser 或Su(H)可显著增加晶细胞数量并阻止浆细胞分化[39]。Runx 结构域转录因子Lz 是决定晶细胞命运的关键转录因子[40]。Srp 与Lz 相互作用,控制Lz转录并决定晶细胞命运。Lz与Notch信号协同作用,有选择地激活与晶细胞分化相关的靶基因,进一步确定晶细胞的命运,并阻止其向其他细胞分化[41];并且,Srp 和Lz 协同作用可上调Ush的表达,进一步调节晶细胞数量。Srp 和Lz 共同调控成熟晶细胞中的ProPO 表达[42-43]。除调控晶细胞命运外,Notch信号也调节细胞增殖。研究表明,Notch 或Su(H)突变体果蝇的淋巴腺明显小于野生型[44]。
3.2 JAK/STAT信号
果蝇的JAK/STAT 信号通路包括3 种细胞因子,即Upd1、Upd2 和Upd3,细胞因子受体[Domeless(Dome)]及下游的JAK(Hop)和STAT(Stat92E)。当细胞外配体与细胞表面受体结合后,Jak 激酶被激活。随后,高度保守的C 末端酪氨酸残基被磷酸化,激活胞质二聚体。磷酸化的二聚体转移至细胞核内,与基因组调控区域的特定位点结合,诱导靶基因的表达[45]。受体Dome 作为前体血细胞的一个常见标记物在MZ 中高度表达,并维持前体血细胞处于未分化状态[46]。
位于JAK/STAT途径下游的Ush促进MZ的Ecad 和Ptc 表达,进而阻止细胞过度分化[47]。在血细胞分化前,Ush 在所有未成熟细胞中表达,在细胞分化为成熟血细胞后其表达量降低。Ush 的单拷贝突变体中MZ 的E-cad 和Ptc 水平降低,导致淋巴腺浆细胞和晶细胞数量增加[48]。另一个抑制MZ 分化的下游因子为内体运输蛋白Arj[49]。Arj在胚胎、幼虫和成虫阶段的所有血细胞中表达[50],在整个淋巴腺也有表达,并与STAT 结合,促进其磷酸化而被激活[51]。
STAT还介导一个独立于Dome-JAK通路的平衡信号来维持前体血细胞稳态[52]。虽然Stat92E在整个一级淋巴腺中均有表达,但只在CZ区发挥维持前体血细胞稳态的功能[53]。进一步研究发现,CZ 区中的STAT 在PDGF/VEGF 受体(PDGF/VEGF receptor,PVR)信号的下游发挥作用,PVR被PSC区细胞的配体PVF1激活,进而促进腺苷脱氨酶相关生长因子(adenosine deaminase related growth factor,ADGF)的表达[54]。PVF-PVR-STAT信号级联在早期能够促进淋巴腺增殖,后期在非自主地维持MZ 中前体血细胞的稳态发挥重要作用[55]。
3.3 Hh信号
Hh信号十分保守,在发育和器官形成过程中可调节细胞增殖、迁移和分化。当Hh配体与跨膜受体Patched(Ptc)结合时,该通路被激活。解除了Ptc 对G 蛋白样受体Smo 向细胞膜移动的抑制作用,进而抑制Ci蛋白水解。全长Ci得以保留并转移至细胞核,调节基因表达[56]。
淋巴腺的Hh 信号对于维持MZ 前体血细胞稳态具有重要意义。Hh 在二龄和三龄幼虫淋巴腺的PSC 细胞中表达,其受体Ptc 和下游Smo、Ci在MZ 中高度表达。在hhTS突变体或在PSC 区中诱导hh RNAi 后,PSC 区的大小和形态不受影响,但成熟血细胞数量明显增加[57]。Ci和Smo功能受损或Ptc 异位表达的淋巴腺会出现MZ 中的前体血细胞数量减少的现象[58]。相反,Ptc过量表达或通过抑制负调控Ci转录活性的suppressor of fused(Sufu)激活MZ 中的Hh 信号后,前体血细胞大量增加,成熟血细胞明显减少。以上结果表明,Hh信号源于PSC细胞,在MZ中起着维持前体血细胞造血前体状态,并阻止其分化的作用[59-60]。
3.4 其他信号
Wg/Wnt信号在决定细胞命运、细胞增殖和稳态中起重要的调节作用。Wg 蛋白在整个淋巴腺中均有表达,能够维持MZ 完整性并抑制前体血细胞分化,在PSC 区中通过原癌基因dMyc调节PSC 细胞数量[61]。钙信号在PSC 和MZ 中均有表达,MZ 的钙信号传导是维持前体血细胞所必需的,在PSC区中能促进早期淋巴腺发育[62]。另外,FGF 信号通过Ht1、Ras/MAPK、转录因子Pnt 和Ush 促进淋巴腺的血细胞分化[63]。BMP/Dpp 信号在PSC 区中被特异性激活,通过抑制dMyc的表达来维持PSC细胞数量[64]。
来自背部血管的信号中,背部血管产生的Slit配体可激活PSC 中的Robo 信号,从而控制PSC 区的细胞数量和聚集。最新的研究表明,心肌细胞产生的FGF 通路配体bnl 可能不通过PSC 而直接作用于MZ 的前体血细胞,进而维持淋巴腺稳态[64]。除以上信号外,营养信号InR/TOR、Hippo通路、Toll 通路以及Jumu、Bag-of-marbles(Bam)、腺苷酸核糖基化因子1(ADP ribosylation factor 1,ARF1)等也在维持淋巴腺稳态中发挥重要作用[55]。
4 展望
果蝇是一种典型的模式生物,对遗传学研究具有重要作用。白血病是严重危胁人们生命安全的重大疾病,居我国肿瘤死亡率的第6位[65],其中急性髓系白血病是一类起源于髓系造血祖细胞的恶性增殖性疾病[66]。由于果蝇与哺乳动物造血系统在调节因子和信号转导通路之间存在相似性,因此,果蝇淋巴腺可作为研究哺乳动物造血疾病的理想模型。淋巴腺中含有未分化的前体血细胞和多种类型的成熟血细胞,有利于研究细胞谱系、造血干细胞的维持与分化等相关问题。近年来,研究发现在MZ 与CZ 之间还有一类特殊的IPs 细胞,状态处于前体血细胞和成熟血细胞中间,因此,对于淋巴腺血细胞的详细分类和相应的功能有待进一步研究。
许多经典的发育信号通路已被证明在淋巴腺造血过程中起着至关重要的作用,淋巴腺中的PSC 区作为信号中心为其他区域提供信号分子,维持果蝇正常的造血功能。MZ 的前体血细胞受Wg、JAK/STAT 等信号调节。MZ 的自主性调节信号及来自PSC 区(如Hh 信号)和CZ(如平衡信号)的非自主性调节信号,共同调节血细胞分化。Notch、Wg 和Lz 信号可协同调节血细胞向晶细胞方向分化。目前,关于调节幼虫造血稳态的研究已取得了巨大的进展,但这些调节信号之间的交叉部分仍未完全明确,有待进一步深入研究。
