基于网络药理学和动物实验探讨红曲治疗脑小血管病的作用机制
2022-03-30孙纪苏恒聊晓玉桂文琪方媛韩岚彭代银安徽中医药大学药学院合肥230000中药复方安徽省重点实验室合肥230000安徽道地中药材品质提升协同创新中心合肥230000安徽康和中药科技有限公司安徽亳州236000
孙纪,苏恒,聊晓玉,桂文琪,方媛,韩岚*,彭代银*(1. 安徽中医药大学药学院,合肥 230000;2. 中药复方安徽省重点实验室,合肥 230000;3. 安徽道地中药材品质提升协同创新中心,合肥230000;. 安徽康和中药科技有限公司,安徽 亳州 236000)
脑小血管病(CSVD)是直径介于40~200 μm的脑血管病变引起的综合征[1],临床表现为脑白质病变、脑微出血、腔隙性梗死等[2]。研究表明,CSVD与痴呆、卒中等疾病关系密切,约有45%的血管性痴呆和20%的缺血性卒中由CSVD引起[3]。西医治疗CSVD主要通过溶栓药、降压药、抗血小板等早期干预,效果不佳且不良反应较大。中医理论认为CSVD属“络病”范畴,治法为扶正祛邪,中药治络病效果显著,不良反应较少,已成为近年来的研究热点。
红曲(red yeast rice,HQ)为药食两用中药,生产历史悠久,药用记载始于《饮膳正要》[4]。2020年版《中国药典》[5]记载红曲为紫色红曲霉Monascus purpureusWent寄生于粳米发酵而得。其味甘,性温,无毒,归肝、脾经,有活血化瘀、通经活络功效。现代药理研究表明,红曲成分中MonacolinK及其衍生物、红曲色素、γ-氨基丁酸等具有显著的降血脂、降血压、神经保护、改善微循环等作用[6-7],提示红曲可作为治疗CSVD的潜在药物。
网络药理学是基于生物信息学、药理学等的综合性学科,通过构建生物分子互作网络,系统化诠释分子作用机制[8]。因此,本研究基于网络药理学研究方法构建红曲“药物-成分-靶点”网络,获取相关成分、靶点、通路信息,通过动物实验对网络药理学结果进行验证,探讨红曲治疗CSVD的物质基础和分子机制。
1 资料与方法
1.1 网络药理学
1.1.1 数据库及软件 TCMSP(https://tcmsp-e.com/)、SwissTargetPrediction数 据 库(http://www.swisstargetprediction.ch/)、GeneCards数 据库(https://www.genecards.org/)、OMIM数 据库(https://omim.org/)、CTD数据库(https://ctdbase.org/)、DisGeNET数据库(https://www.disgenet.org/)、Uniprot(https://www.uniprot.org/)、STRING 11.0数 据 库(https://string-db.org/)、DAVID 6.8数据库(https://david.ncifcrf.gov/home.jsp)、CytoScape 3.7.1软件。
1.1.2 红曲成分及作用靶点收集 通过PubChem、SwissTargetPrediction及文献收集红曲成分,根据里宾斯基五规则进行筛选。将红曲成分文件上传至SwissTargetPrediction数据库,选择物种为“Homo sapiens”,获取红曲作用靶点,并对靶点进行去重整合。
1.1.3 CSVD疾病靶点筛选 将“Cerebral Small Vessel Disease”输入GeneCards数据库、OMIM数据库、CTD数据库、DisGeNET数据库寻找CSVD疾病靶点。
1.1.4 交集靶点Venny分析 登入Venny 2.1网站,将CSVD疾病靶点信息输入List 1,红曲作用靶点输入List 2,获取交集靶点信息。
1.1.5 构建红曲“药物-成分-靶点”网络 利用CytoScape 3.7.1软件构建药物红曲“药物-成分-靶点”网络,通过CytoScape 3.7.1软件工具NetworkAnalyzer对网络进行拓扑参数分析,收集主要活性成分及靶点度值(degree)信息。
1.1.6 PPI网络构建 将“1.1.4”项下的交集靶点导入STRING 11.0数据库,限定物种为“Homo sapiens”,置信度区间大于0.4,构建PPI网络。利用CytoScape 3.7.1软件进行参数分析,以大于Degree均值为条件筛选关键靶点。
1.1.7 GO和KEGG富集分析 选择获取的关键靶点导入DAVID 6.8数据库,限定物种为“Homo sapiens”,获取GO、KEGG富集结果并进行可视化分析。
1.2 动物实验
1.2.1 仪器与试药 酶标仪(318MC,美国赛默飞世尔科技公司);石蜡包埋机(YB-7B,孝感市亚光医用电子技术有限公司);离心机(LC-4016,安徽中科中佳科学仪器有限公司);恒温振荡培养箱(BHWY-100BC,常州杰博森仪器有限公司);红曲(批号:210201,毫州市京皖中药饮片厂),经安徽中医药大学中药资源室鉴定为正品。TNF-α、IL-6、IL-1β试剂盒(睿信生物公司);尼莫地平(批号:200108,亚宝药业集团股份有限公司)。
1.2.2 动物 SPF级雄性大鼠,体质量 200~230 g[杭州医学院,生产许可证号:SCXK(浙)2019-0002,动物伦理编号:AHUCM-rats-2021051]。
1.2.3 红曲水提液的制备 取红曲原料药,粉碎,过筛,加入药物总量10倍的水煎煮1 h后,过滤并保留滤液,再加入药物总量8倍的水煎煮1 h,过滤并保留滤液;合并两次滤液,旋转蒸发浓缩成3 g·kg-1的提取液备用。
1.2.4 CSVD模型大鼠的复制 健康雄性SD大鼠200~230 g,麻醉后钝性分离右颈总动脉(common carotid artery,CCA)采用丝线于右侧CCA远、近心端进行永久性结扎,距离约1.5 cm左右,结扎完成后缝合皮肤,放回笼中饲养。7 d后永久性结扎左侧CCA,操作步骤同上。假手术组仅分离CCA,不进行结扎操作。大鼠出现癫痫、偏瘫等异常行为则判断模型复制成功。
1.2.5 实验分组与给药 大鼠随机分为6组,每组10只,分别为假手术组、模型组、红曲高剂量组(3 g·kg-1)、红曲中剂量组(1.5 g·kg-1)、红曲低剂量组(0.75 g·kg-1)、尼莫地平组(20 mg·kg-1),按体质量灌胃给药,假手术组、模型组灌胃等量生理盐水,每日一次,连续30 d。
1.2.6 Morris水迷宫实验 水迷宫为黑色圆形水池,等分为4个象限,平台置于象限中。将大鼠面向池壁从4个象限随机选择入水点,记录其在2 min内寻找并爬上平台所需时间,即逃避潜伏期;撤除平台,从平台所在象限对侧选入水点,观察其在2 min内穿越平台次数。实验为期5 d,前4 d用于训练大鼠,第5日进行实验。
1.2.7 海马CA1区病理观察 各组大鼠麻醉后,从胸膛部剪开暴露心脏,用4%多聚甲醛进行灌注,灌注完成后将大鼠断头取脑,随后用石蜡包埋、切片,于显微镜下观察海马CA1区。
1.2.8 指标检测 大鼠麻醉后腹主动脉取血,静置30 min,3000 r·min-1离心10 min,收集上层血清,根据试剂盒说明书进行检测。
1.2.9 Western blot实验 大鼠断头处死,迅速取出海马组织置于冰上,剪碎,按每20 mg组织加入150~250 μL裂解液的比例加入裂解液,匀浆直至完全裂解。裂解后的样品4℃、12 000 r·min-1离心15 min,取上清液,定量后贮存于-80℃冰箱用于蛋白测定,结果用Image J软件进行灰度分析。
1.3 统计分析方法
各组数据用SPSS 23.0软件进行分析,结果用“均数±标准差(±s)”表示,多组间数据采用单因素方差分析,两两比较采用LSD-t检验,P<0.05或P<0.01表示差异有统计学意义。
2 结果
2.1 网络药理学预测研究
2.1.1 红曲成分及作用靶点收集 经筛选共获得43种红曲主要成分,包含Monacolin类、红曲色素类、十氢萘衍生物、有机酸等;将红曲成分上传至SwissTargetPrediction数据库预测,去重合并共获得391个潜在作用靶点。
2.1.2 红曲作用靶点及CSVD疾病及预测“Cerebral Small Vessel Disease”作为检索信息输入GeneCards、OMIM、DisGeNET、CTD数据库寻找治疗CSVD疾病的靶点,去重合并后共获得1126个疾病靶点。
2.1.3 交集靶点收集 登入Venny 2.1网站,将1126个CSVD疾病靶点和391个红曲作用靶点信息输入列表,共获得交集靶点91个。
2.1.4 药物-成分-靶点网络 如图1所示,利用CytoScape 3.7.1软件构建“药物-成分-靶点”网络,运用软件内置工具NetworkAnalyzer对网络进行拓扑参数分析,收集活性成分度值(Degree)信息,结果显示Degree值排名靠前的成分有Monacolin K、Monacolin J、Ankaflavin等,提示上述成分可能在红曲治疗CSVD过程中起重要作用。

图1 红曲“药物-成分-靶点”网络图Fig 1 Red yeast rice “drug-component-target” network
2.1.5 PPI网络构建 将交集靶点导入STRING数据库,构建PPI网络,如图2所示。结果显示PPI网络有91个节点,752条边,平均Degree值为16.7,EGFR、MAPK1、ESR1、CLCX8等大于Degree均值关键靶点共计37个,提示这些蛋白可作为红曲治疗CSVD的关键靶点。

图2 PPI网络图Fig 2 Protein-protein interaction network
2.1.6 GO和KEGG富集分析 运用DAVID 6.8数据库进行GO和KEGG分析,GO分析结果涉及171个生物过程,33个细胞组分和51个分子功能,选取排名前10结果绘制条形柱状图,如图3所示;结果表明红曲中的活性成分可能通过参与神经炎症、细胞增殖、信号转导等过程发挥治疗CSVD作用。KEGG分析得到104个通路,选取排名前20通路绘制气泡图,如图4所示。去除与CSVD无关的通路,获得PI3K-Akt信号通路、RAS信号通路等。其中,PI3K-Akt信号通路的count值最大,表示该差异蛋白富集显著性较大。近年来的研究已证实PI3K-Akt信号通路在痴呆类脑血管病中的治疗是通过调节下游靶蛋白mTOR、GSK3β等的活性,介导神经元细胞凋亡、增殖过程,因此选择PI3K-AKT-mTOR通路作为机制研究对象。
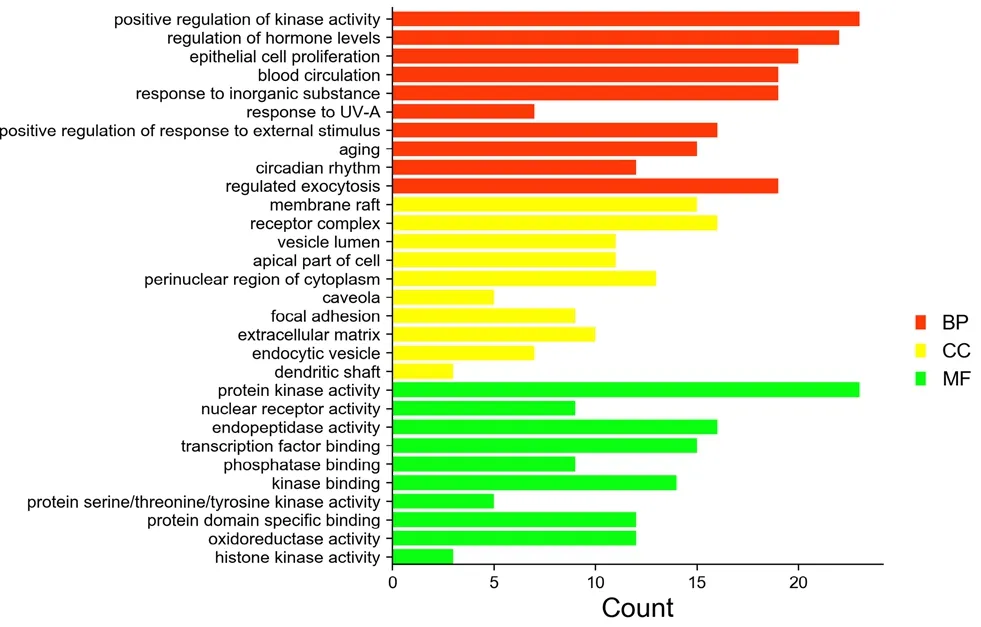
图3 GO富集分析Fig 3 GO enrichment analysis

图4 KEGG通路富集分析Fig 4 KEGG pathway enrichment analysis
2.2 动物实验
2.2.1 Morris水迷宫实验 如表1所示,与假手术组比较,模型组大鼠逃避潜伏期显著延长(P<0.01),撤去平台后穿越平台次数明显减少(P<0.01),表明模型复制成功;与模型组相比,红曲高、中剂量组及尼莫地平组逃避潜伏期显著减少,穿越平台次数明显增加(P<0.05或P<0.01),红曲低剂量组差异无统计学意义。
表1 红曲对CSVD 模型大鼠逃避潜伏期和穿越平台次数的影响( ±s,n=10)Tab 1 Effect of HQ on the escape latency and the number of crossing platforms in CSVD model rats ( ±s,n=10)

表1 红曲对CSVD 模型大鼠逃避潜伏期和穿越平台次数的影响( ±s,n=10)Tab 1 Effect of HQ on the escape latency and the number of crossing platforms in CSVD model rats ( ±s,n=10)
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。Note:Compared with the sham group,##P<0.01;compared with the model group,*P<0.05,**P<0.01.
组别 剂量 逃避潜伏期/s 穿越平台次数/次假手术组 - 14.37±5.39 8.30±1.42模型组 - 39.92±4.59## 2.10±1.37##红曲高剂量组 3 g·kg-1 24.16±5.29** 5.20±1.40**红曲中剂量组 1.5 g·kg-1 29.86±4.81** 4.50±1.96*红曲低剂量组 0.75 g·kg-1 37.27±7.80 2.70±1.55尼莫地平组 20 mg·kg-1 23.96±4.98** 5.40±1.80**
2.2.2 大鼠海马组织病理 如图5所示,假手术组大鼠海马CA1区细胞排列整齐,形态完整,可明显观察到核仁和胞浆;与假手术组相比,模型组大鼠海马CA1区细胞排列松散,细胞较为稀疏,细胞多呈不规则形,核仁和胞浆界限不清晰,提示造模成功;与模型组相比,红曲各剂量组及尼莫地平组大鼠海马CA1区细胞排列趋于规则、紧密,病变程度均有明显改善,表明红曲对CSVD模型大鼠的海马组织具有一定的保护作用。

图5 CSVD模型大鼠海马CA1区HE染色(×200)Fig 5 HE staining of CA1 area of hippocampus in CSVD model rats(×200)
2.2.3 指标测定 如表2所示,与假手术组相比,模型组大鼠血清中TNF-α、IL-6、IL-1β含量显著增高(P<0.01);与模型组相比,红曲高、中剂量组及尼莫地平组大鼠血清中TNF-α、IL-6、IL-1β含量显著降低(P<0.05或P<0.01),红曲低剂量组大鼠血清中TNF-α、IL-1β水平显著降低(P<0.05),IL-6水平无统计学意义。表明红曲能显著降低CSVD大鼠血清中炎症因子水平,显示出红曲具有良好的抗炎作用。
表2 红曲对CSVD大鼠血清中TNF-α、IL-6、IL-1β炎症因子的影响( ±s,n=10)Tab 2 Effect of HQ on TNF-α,IL-6 and IL-1β inflammatory factors in serum of CSVD rats ( ±s,n=10)

表2 红曲对CSVD大鼠血清中TNF-α、IL-6、IL-1β炎症因子的影响( ±s,n=10)Tab 2 Effect of HQ on TNF-α,IL-6 and IL-1β inflammatory factors in serum of CSVD rats ( ±s,n=10)
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。Note:Compared with the sham group,##P<0.01;compared with the model group,*P<0.05,**P<0.01.
组别 TNF-α/(ng·L-1)IL-6/(ng·L-1)IL-1β/(ng·L-1)假手术组 312.58±24.79 46.32±6.27 28.71±7.62模型组 491.52±39.89## 70.23±12.37## 42.37±4.36##红曲高剂量组 372.62±45.59** 54.41±10.77** 30.44±6.23**红曲中剂量组 394.23±20.35* 62.32±13.27** 32.25±5.27*红曲低剂量组 412.61±49.58* 68.45±5.86 34.36±5.86*尼莫地平组 336.65±25.95** 50.37±10.68** 31.25±4.68**
2.2.4 Western blot实验 蛋白电泳结果如图6所示。结果显示,与假手术组比较,模型组大鼠海马区PI3K、Akt、mTOR蛋白表达水平均显著降低(P<0.01);与模型组比较,红曲高、中剂量组及尼莫地平组PI3K、Akt、mTOR蛋白表达水平显著升高(P<0.01),红曲低剂量组PI3K、mTOR表达水平显著升高(P<0.05),Akt蛋白表达水平差异无统计学意义。结果表明红曲可通过调节PI3KAKT-mTOR通路,调控神经细胞增值、凋亡过程,发挥对于CSVD模型大鼠的治疗作用。
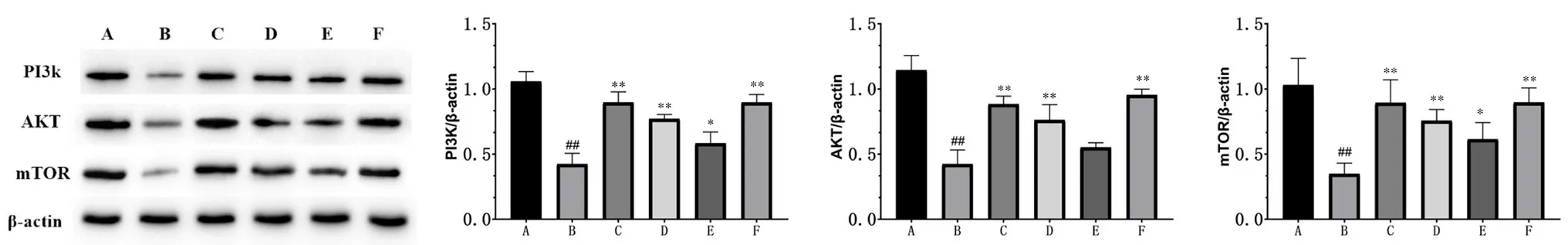
图6 各组大鼠海马区PI3K,Akt,mTOR蛋白表达水平图( ±s,n=3)Fig 6 Expression levels of PI3K,Akt and mTOR protein in the hippocampus of each group of rats( ±s,n=3)
3 讨论
CSVD是临床常见的脑血管疾病,与高血脂、高血压等危险因素关系密切[9]。中医理论尚未明确定义CSVD,通常认为其属于络病,病位在脑,由浊邪入血,入髓伤髓所致[10]。临床治疗CSVD应以活血化瘀、化浊益髓的中药为主[11]。红曲具有活血化瘀、健脾消食的功效,临床上常用的中成药血脂康、脂必妥均以红曲为主要成分,广泛用于治疗高血脂、动脉粥样硬化、心脑血管病等[12-14],可作为治疗CSVD的潜在药物。
本研究运用网络药理学方法筛选获得Monacolin K、Ankaflavin、GABA等43个红曲活性成分,PIK3CA、MTOR、MAPK1等1126个脑小血管病靶点;PPI网络分析共发现91个节点,752条边,平均Degree值为16.7,获得EGFR、MAPK1、ESR1等37个关键靶点;GO分析结果涉及171个生物过程、33个细胞组分、51个分子功能,主要涉及神经炎症、信号转导、细胞增殖等。研究表明,神经炎症在脑血管疾病的发展中起重要作用,降低相关炎症因子如TNF-α、IL-6、IL-1β等水平,可改善血脑屏障通透性,减轻脑组织损伤,促使大脑结构功能恢复正常[15-16]。KEGG分析结果得到104个通路,主要有PI3K-Akt、Rap1、RAS通路等,PI3K-Akt通路研究较为广泛,其在脑卒中、血管性痴呆等疾病的治疗中起着重要作用。Qi等[17]研究发现3-丁基苯酞(NBP)能通过激活PI3K/Akt信号通路抑制CSVD大鼠神经细胞凋亡,恢复细胞基本功能,提高大鼠学习记忆能力。Chen等[18]研究表明人参皂苷Rg1可通过PI3K/Akt/mTOR信号通路增加缺血性卒中后血管内皮生长因子的表达,促进脑内血管生成,改善脑血流量。
本研究选择不同剂量红曲干预CSVD模型大鼠,探究其作用机制,对网络药理学研究结果进行验证。Morris水迷宫实验结果显示,红曲能显著缩短CSVD大鼠的逃避潜伏期,增加穿越平台次数,表明红曲显著改善CSVD模型大鼠的短期学习记忆能力;HE病理切片结果显示红曲治疗组大鼠海马CA1区细胞形态完整、排列整齐,核仁和胞浆界限清晰,不同剂量红曲治疗组海马CA1区病变程度均有明显改善,高、中剂量效果较为明显;网络药理学GO分析结果表明,红曲治疗CSVD可能与神经炎症、细胞增殖、信号转导等生物过程相关,其中神经炎症在CSVD发展过程起重要作用。生化指标结果显示,不同剂量红曲治疗组可显著降低CSVD模型大鼠血清TNF-α、IL-6、IL-1β炎症因子水平,其效果呈剂量依赖性;网络药理学研究结果显示红曲中Monacolin类、红曲色素等为其活性成分,本研究结果中红曲能显著降低TNF-α、IL-6、IL-1β水平可能与上述成分有关。KEGG分析结果显示,涉及CSVD的有PI3K-Akt、RAS、Rap1信号通路等。研究表明PI3K-Akt信号通路可通过调节下游靶蛋白mTOR活性,参与自噬清除β淀粉样蛋白的沉积、恢复细胞功能等发挥神经保护作用[17-18];Western blot结果表明,与假手术组相比,模型组PI3K、AKT、mTOR蛋白水平显著降低;与模型组相比,红曲治疗组可不同程度增加PI3K、AKT、mTOR蛋白水平,提示红曲可通过上调PI3K/AKT/mTOR蛋白的表达,参与调控神经元细胞增殖、分化、凋亡等发挥治疗CSVD的作用。
综上,通过网络药理学和分子对接,构建红曲治疗CSVD的成分、疾病、作用靶点、相关通路之间的复杂网络关系,展现了中药多成分、多靶点、多途径的治疗优势。通过Morris水迷宫,海马组织HE染色,TNF-α、IL-6、IL-1β炎症因子检测,PI3K、AKT、mTOR蛋白测定等实验验证网络药理学预测结果,初步揭示了红曲治疗CSVD的药效机制,可为后期深入探究其治疗CSVD机制提供理论依据。
