化学修饰L02肝细胞膜生物亲和材料快速筛选大黄降血脂活性成分
2022-03-29边惠琴武晓玉夏鹏飞段文达杨飞霞李娇娇
边惠琴,武晓玉,2,3*,夏鹏飞,2,3,段文达,杨飞霞,李娇娇,赵 磊,2,3*
1甘肃中医药大学药学院;2甘肃中医药大学 甘肃省高校中(藏)药化学与质量研究省级重点实验室;3甘肃中医药大学 甘肃省道地药材质量标准化研究与推广工程实验室,兰州730000
传统中药活性成分筛选以活性追踪为主,其以单体组分为筛选对象,存在工作量大、操作繁琐、效率低等缺点。而与传统活性追踪法相比,细胞膜色谱(cell membrane chromatography,CMC)是近年发展迅速的一种生物亲和色谱技术,具有特异性识别和高效分离的特性。CMC基本原理是将细胞膜结合到硅胶载体表面制成固定相,细胞膜受体可与药物分子产生特异性结合,利用色谱分析法研究药物分子与细胞膜受体的相互作用规律[1,2]。CMC集合了色谱技术、细胞分子生物学及受体药理学的优点,实现了色谱柱内近似动态地模拟药物活性成分在体内的作用过程;相比于常用吸附剂(如:离子交换树脂、大孔吸附树脂等),CMC具有色谱分离与活性筛选相结合的优势,且操作方便、快速稳定、灵敏度高,尤其适用于中药等复杂体系的活性成分筛选。
细胞膜色谱制备时,根据细胞膜与硅胶载体的不同结合形式,可将其分为:物理吸附和化学修饰。物理吸附细胞膜生物亲和色谱是利用细胞膜自身的融合作用和硅胶表面硅羟基的吸附作用制备而成;这种作用力比较弱,细胞膜易从载体上脱落,导致色谱柱寿命短[3,4]。化学修饰细胞膜生物亲和色谱是硅胶和细胞膜以共价键结合;硅胶的硅醇基与硅烷偶联剂发生缩合反应引入氨基,氨基与戊二醛分子发生交联反应,硅胶表面即可得到一端游离的醛基官能团;细胞膜上含有大量氨基基团,在室温环境中易发生醛氨缩合反应,从而达到硅胶和细胞膜共价连接的目的。化学修饰细胞膜生物亲和色谱中载体硅胶与细胞膜共价键连接、比较稳定、细胞膜不易脱落,可延长色谱柱寿命[5,6]。
大黄是甘肃道地药材,为临床常用中药之一;具有抗菌、抗肿瘤、抗炎、抗病毒、降血脂等药理作用[7-9]。许多学者及课题组前期研究均证实了大黄降血脂作用,且本课题组利用高脂血症大鼠筛选出降血脂有效部位为30%乙醇提取液,但其具体药效物质基础尚不明确[10-12];课题组也制备了物理吸附L02肝细胞膜生物亲和色谱材料,但其细胞膜脱落较严重,使用次数有限。鉴于此,本实验制备APTES修饰硅胶为载体的L02肝细胞膜生物亲和色谱材料,利用细胞膜表面的靶点对大黄30%乙醇提取液中化学成分进行特异性吸附,HPLC分析吸附前后各化学成分色谱峰变化,以色谱峰峰面积变化率为依据,快速筛选大黄降血脂活性成分;并考察该材料的重复使用性能,为高通量筛选大黄降血脂药效物质基础提供新思路。
1 材料与方法
1.1 实验仪器
85-2型恒温磁力搅拌器(海司乐仪器有限公司);BSA224S电子天平(赛多利斯科学仪器(北京)有限公司);Waters Alliance型高效液相色谱仪(四元泵、自动进样器、柱温箱、PDA检测器);IMARK酶标仪(美国Bio-Rad公司);ALPHA-T红外光谱仪(布鲁克仪器有限公司);高速冷冻离心机(美国Beck-man-Coulter公司);JY92-ⅡDN细胞破碎仪(宁波新芝科技股份有限公司);DGX-9143BC-1型电热恒温干燥箱(上海福玛试验设备有限公司)。
1.2 实验试剂
硅胶(5 μm,批号:20190316,中国青岛美高化工有限公司);3-氨基丙基三乙氧基硅烷(APTES,批号:SLBB5978V)、油酸(批号:SLBRI87V)均购自SIGMA公司;磷酸盐缓冲溶液(批号:AQ29629583)、链霉素/青霉素(批号:20201116)、胰酶(批号:20210629)、1640培养液(批号:AG29643109)、胎牛血清(批号:21040702)、1M Tris-HCl溶液(批号:20190821)、BCA蛋白试剂盒(批号:20191022)、Na+、K+-ATP酶试剂盒(批号:20200629)均购于Solarbio公司;BSA蛋白粉(批号:3131053,购于YESEN公司);戊二醛(批号:EU2RDH1X,萨恩化学技术(上海)有限公司);甲醇、乙腈均为色谱纯(Merk公司);人L02肝细胞(普诺赛生命科技有限公司)。
1.3 L02肝脂肪变性细胞膜提取[13]
0.5 mmoL/L油酸刺激L02肝细胞,建立脂肪变性模型;利用差速离心法提取细胞膜,具体步骤如下:1 mL PBS洗涤L02肝脂肪变性细胞,弃去PBS;加1 mL 0.25%胰酶消化,轻轻吹打混匀,在镜下观察细胞全部脱落;再加1 mL PBS终止消化,160 × g、4 ℃下离心10 min,保留细胞沉淀;用1 mL PBS洗涤细胞沉淀2次。细胞沉淀在50 mM Tris-HCl溶液中溶胀30 min,在破碎功率720 W、破碎时间2 s,冷却间隔2 s的冰浴条件下,破碎3 min;细胞碎片混悬液在1 000 × g、4 ℃下离心10 min,保留上清液;上清液进一步在12 000 × g、4 ℃下离心20 min,即得细胞膜沉淀。
1.4 化学修饰L02肝细胞膜生物亲和材料的制备及表征[5]
称取硅胶2 g,在105 ℃活化2 h。
精密称取活化硅胶1 g,加100 mL甲苯、1 mL APTES,N2保护、110 ℃条件下加热回流12 h;反应结束后,5 000 × g离心3 min,甲苯冲洗沉淀;沉淀加50 mL 5%戊二醛甲醇溶液,常温下搅拌反应2 h,反应结束后,5 000 × g离心3 min,甲醇冲洗沉淀;50 ℃真空干燥,得APTES修饰硅胶。
取APTES修饰硅胶0.1 g置于圆底烧瓶中,加5 mL L02肝脂肪变性细胞膜混悬液,涡旋3 min, 10 Mbar、0 ℃条件下搅拌反应1 h;然后放入4 ℃冰箱中反应12 h。反应结束后,1 000 × g、4 ℃条件下离心10 min,保留沉淀;PBS洗涤沉淀,1 000 × g,4 ℃条件下离心10 min,即得化学修饰L02肝细胞膜生物亲和材料。采用扫描电镜和红外光谱对其表征,并测定细胞膜蛋白含量及Na+、K+-ATP酶活力。
1.5 吸附、解吸附
化学修饰L02肝细胞膜生物亲和材料加1 mL大黄30%乙醇提取液,轻轻吹打并涡旋震荡1 min,37 ℃孵育8 h;孵育液在1 000 × g,4 ℃下离心10 min,上清液即共孵育残液。
化学修饰L02肝细胞膜生物亲和材料加1 mL蒸馏水,轻轻吹打并涡旋震荡1 min,1 000 × g,4 ℃下离心10 min,上清液即洗涤液。
化学修饰L02肝细胞膜生物亲和材料加1 mL PBS溶液,37 ℃孵育6 h,孵育液在1 000 × g,4 ℃下离心10 min,上清液即解离液。
HPLC分析条件:ODS柱(15 mm ( 4.6 mm,μm);流动相:0.05%甲酸水(A),乙腈(B);梯度洗脱程序:0~10 min,5%→0% B;10~15 min,20% B;15~30 min,20%→30% B;30~50 min,30%→50% B;50~60 min,50%→85% B;60~65 min,100% B;柱温:30℃;流速:1.0 mL/min;检测波长:254 nm;进样量:10 μL。
1.6 重复使用性能评价
为了考察该材料的重复使用性能,对化学修饰L02肝细胞膜生物亲和材料进行6次吸附、解吸附实验,用细胞膜蛋白含量及Na+、K+-ATP酶活力来评价重复使用性能。具体过程如下:该材料加1 mL大黄30%乙醇提取液,涡旋混匀,37 ℃孵育8 h;孵育液1 000 × g,4 ℃下离心10 min,保留沉淀;沉淀加1 mL PBS溶液,37 ℃孵育6 h,孵育液在1 000 × g,4 ℃下离心10 min,保留沉淀;测定沉淀(解吸附后)的细胞膜蛋白含量及Na+、K+-ATP酶活力;重复测定6次。
2 结果与讨论
2.1 表征分析
硅胶、APTES修饰硅胶、化学修饰L02肝细胞膜生物亲和材料扫描电镜图见图1。

图1 扫描电镜图(×10 000)Fig.1 SEM images of silica gel (×10 000)注:a.硅胶;b.APTES修饰硅胶;c.化学修饰L02肝细胞膜生物亲和材料。Note:a.The silica gel;b.APTES modified silica gel;C.Chemical modification L02 liver membrane bioaffinity material.
图1a中硅胶表面光滑,APTES修饰硅胶(图1b)表面有一层絮状物,较图1a硅胶表面粗糙,推测为APTES烷氧基与硅胶硅羟基反应所致。图1c表面明显覆盖有一层细胞膜,说明APTES修饰硅胶上的游离醛基与细胞膜表面氨基发生醛氨缩合反应,细胞膜键合到硅胶表面,推断化学修饰L02肝细胞膜生物亲和材料制备成功。硅胶、APTES修饰硅胶、化学修饰L02肝细胞膜生物亲和材料红外光谱图见图2。
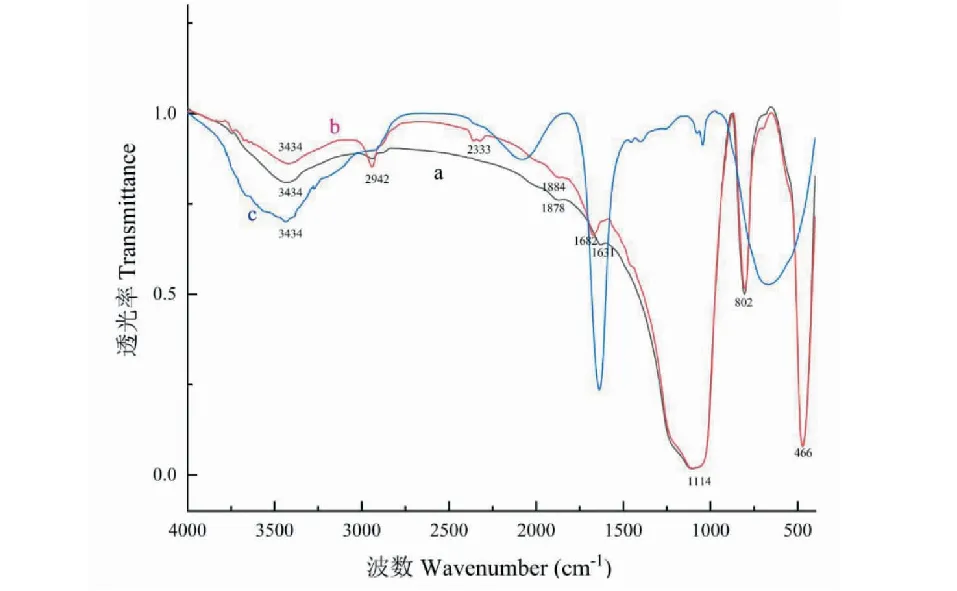
图2 红外光谱图Fig.2 FTIR spectrum 注:a.硅胶;b.APTES修饰硅胶;c.化学修饰L02肝细胞膜生物亲和材料。Note:a.The silica gel;b.APTES modified silica gel;C.chemical modification L02 liver membrane bioaffinity material.
图2a中3 434 cm-1处为Si-OH特征吸收峰,1 114 cm-1是Si-O-Si的反对称伸缩振动吸收峰,802 cm-1和466 cm-1为Si-O-Si摇摆振动和弯曲振动吸收峰。APTES修饰硅胶(图2b)在2 942 cm-1处出现氨基硅烷的N-H伸缩振动特征吸收峰,1 884 cm-1处出现N-H变形振动吸收峰[14]。图2c中3 442 cm-1吸收峰变宽,推测是Si-OH与细胞膜上-NH2蒂合所致,且802 cm-1和466 cm-1处Si-O-Si摇摆振动和弯曲振动吸收峰也消失,说明硅胶与细胞膜上氨基发生反应,所以化学修饰L02肝细胞膜生物亲和材料成功制备。
将硅胶、APTES修饰硅胶、化学修饰L02肝细胞膜生物亲和材料分别混悬于1 mL生理盐水中,利用细胞膜蛋白试剂盒及Na+、K+-ATP酶试剂盒测定细胞膜蛋白含量和Na+、K+-ATP酶活力,结果见表1。
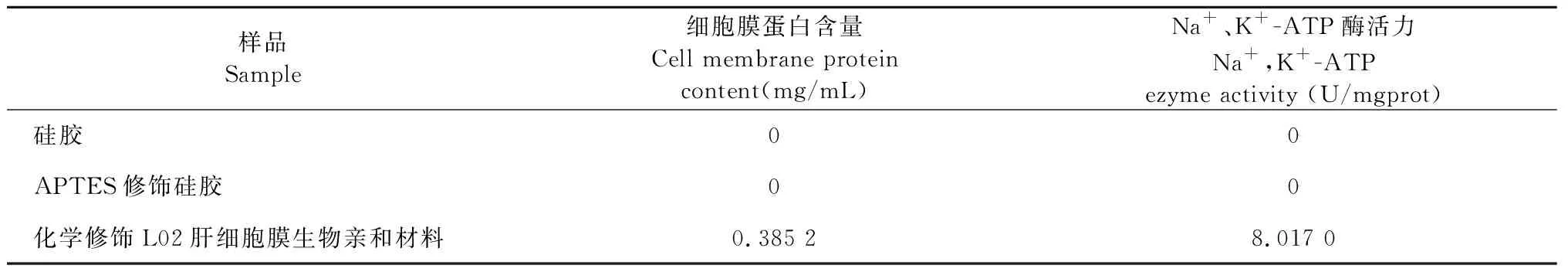
表1 细胞膜蛋白含量和 Na+、K+-ATP酶活力结果表(n=3)Table 1 Results of membrane protein content and Na+,K+-ATP activity(n=3)
由表1可知,硅胶和APTES修饰硅胶细胞膜蛋白含量及Na+、K+-ATP酶活力均为0;化学修饰L02肝细胞膜生物亲和材料由于引入细胞膜,其细胞膜蛋白含量为0.385 2 mg/mL,Na+、K+-ATP酶活力为8.017 0 U/mgprot,表明化学修饰L02肝细胞膜生物亲和材料具有活性。
2.2 降脂活性成分筛选[15]
大黄30%乙醇提取液、共孵育残液、混合对照品溶液、洗涤液、解离液的HPLC图见图3。
由图3a可知,大黄30%乙醇提取液中各化学成分色谱峰峰形对称,分离度良好,说明优化的色谱条件稳定可行。图3b可以看出化学修饰L02肝细胞膜生物亲和材料吸附后,部分化学成分色谱峰峰面积减小,说明该成分和材料发生了特异性吸附。通过与混合对照品溶液化学成分保留时间及紫外光谱学特征进行对比,初步确定1、2、4、5、7、8、9、10、11号色谱峰分别为芦荟大黄素-8-O-β-D-葡萄糖苷、大黄酸-8-O-β-D-葡萄糖苷、大黄酚-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚;3、6号色谱峰为未知成分。图3d洗涤液中没有出现色谱峰,说明特异性吸附成分与化学修饰L02肝细胞膜生物亲和材料结合牢固。图3e解离液中色谱峰极小,分析原因可能是特异性吸附成分和细胞膜上受体相结合,进入到细胞膜内部,进而造成解离液中色谱峰较小。
将6份共孵育残液进样分析,考察色谱峰峰面积的稳定性,结果见表2。
由表2可知,共孵育残液中11个色谱峰峰面积RSD值均小于1%,表明在优化色谱条件下,化学成分峰面积大小稳定。
通过测定大黄30%乙醇提取液、共孵育残液中各化学成分峰面积,按照公式1计算色谱峰峰面积变化率,以峰面积变化率大于15%为依据,筛选特异性吸附成分,结果见表3。
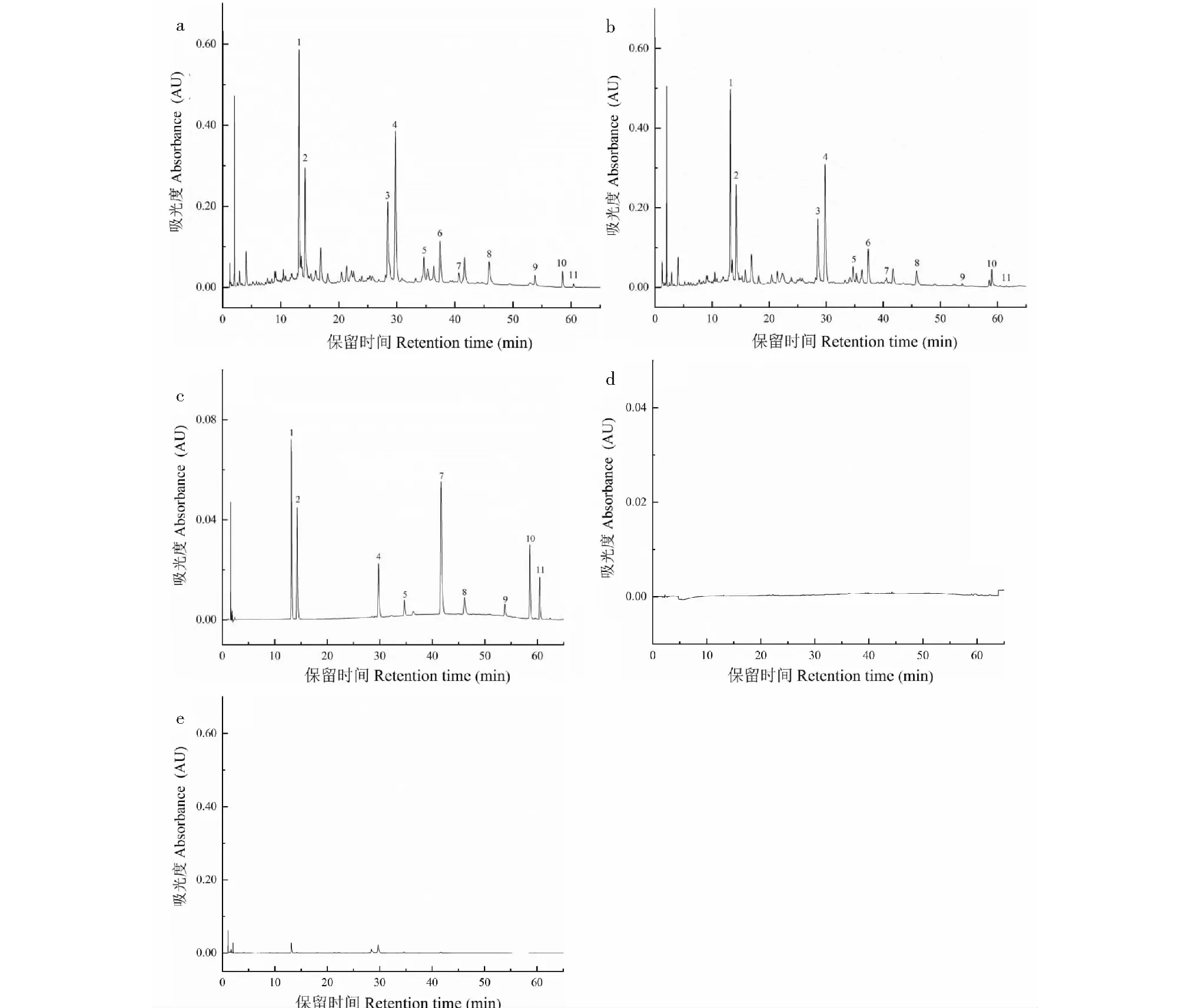
图3 HPLC色谱图Fig.3 HPLC chromatograms 注:a.大黄30%乙醇提取液;b.共孵育残液;c.混合对照品溶液;d.洗涤液;e.解离液。 Note:a.30% ethanol extract of Rheum palmatum L.;b.Co-incubate residual liquid;c.Reference solution;d.Washing liquid;e.Desorption solution.
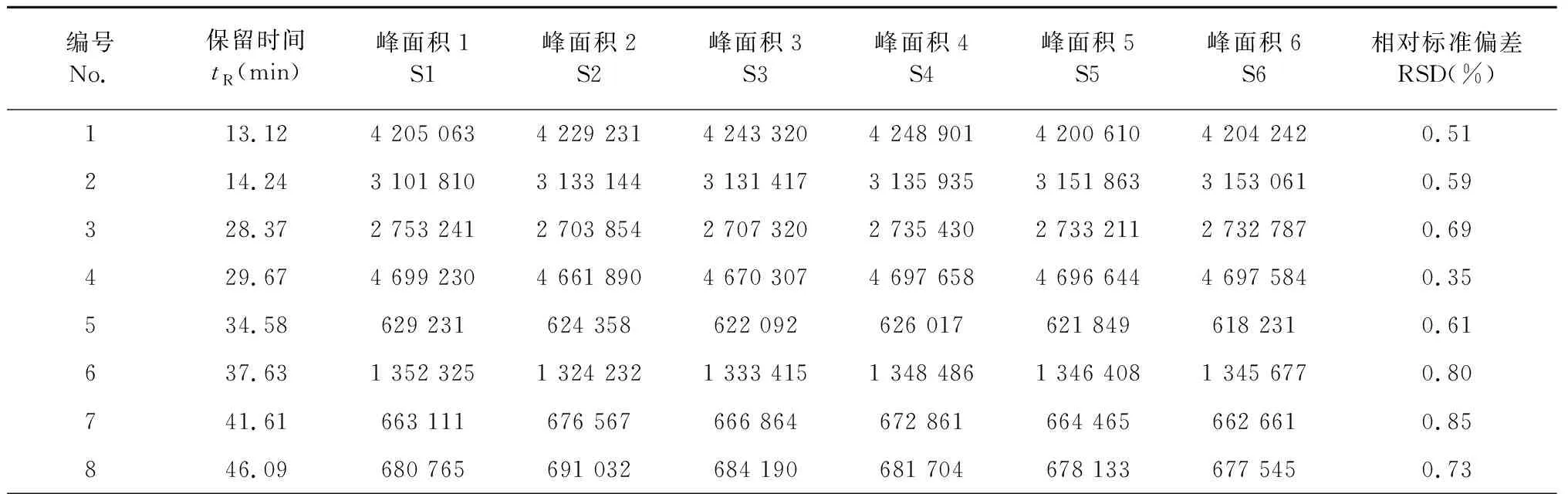
表2 共孵育残液峰面积变化表(n=6)Table 2 Peak area change of co-incubate residual liquid (n=6)
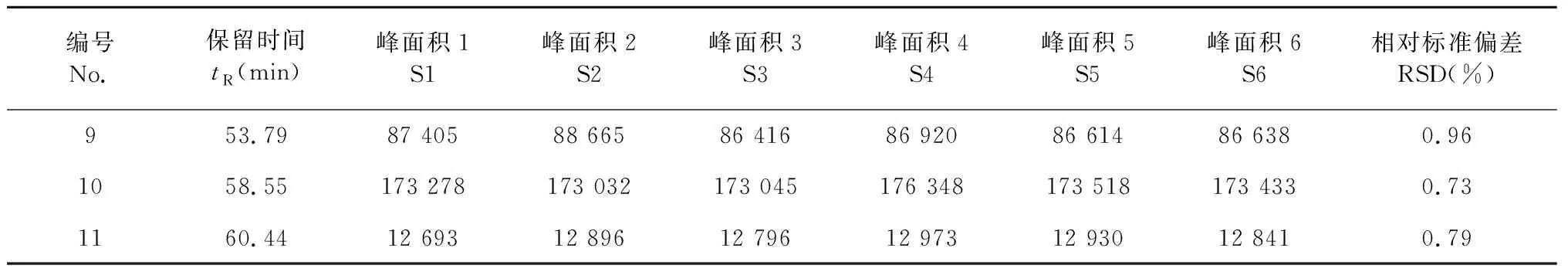
续表2(Continued Tab.2)

表3 化学修饰L02肝细胞膜生物亲和材料吸附差异结果表 Table 3 Results of adsorption difference of chemically modified L02 liver membrane bioaffinity material
由表3可知,大黄30%乙醇提取液中有11个色谱峰峰面积变化率大于15%,说明化学修饰L02肝细胞膜生物亲和材料对11种化学成分发生特异性吸附,包括4个蒽醌糖苷、2个未知成分(3号和6号色谱峰)及5个蒽醌苷元。1~ 4号色谱峰变化率虽较7~11号小,但实际峰面积差值远比7~11号大;造成其变化率小的原因在于:峰面积变化率计算公式中,大黄30%乙醇溶液峰面积在分母位置,峰面积大进而导致变化率小。结合峰面积变化率及峰面积差值,11种活性成分中1~4号色谱峰是主要的特异性成分,即芦荟大黄素-8-O-β-D-葡萄糖苷、大黄酸-8-O-β-D-葡萄糖苷、大黄酚-8-O-β-D-葡萄糖苷及未知成分1可作为潜在活性成分进行降血脂活性验证。
为进一步验证对解离液中特异性吸附成分进入细胞膜内部的推测,将化学修饰L02肝细胞膜生物亲和材料加1 mL PBS溶液,超声10 min(超声功率16 kHz),1 000 × g,4 ℃下离心10 min,收集上清液,HPLC色谱图见图4。
由图4可看出,采用超声法对化学修饰L02肝细胞膜生物亲和材料表面细胞膜进行破碎后,PBS溶液中出现被特异性吸附的11个化学成分色谱峰,证实上述推断合理性。
2.3 重复使用性能评价
化学修饰L02肝细胞膜生物亲和材料进行6次吸附实验后,细胞膜蛋白含量及Na+、K+-ATP酶活力结果见图5。
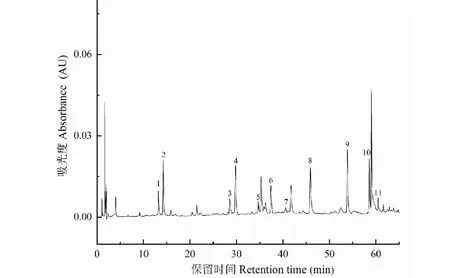
图4 化学修饰L02肝细胞膜生物亲和材料超声破碎液HPLC色谱图Fig.4 HPLC chromatogram of ultrasonic crushing solution of chemically modified L02 liver membrane bioaffinity material
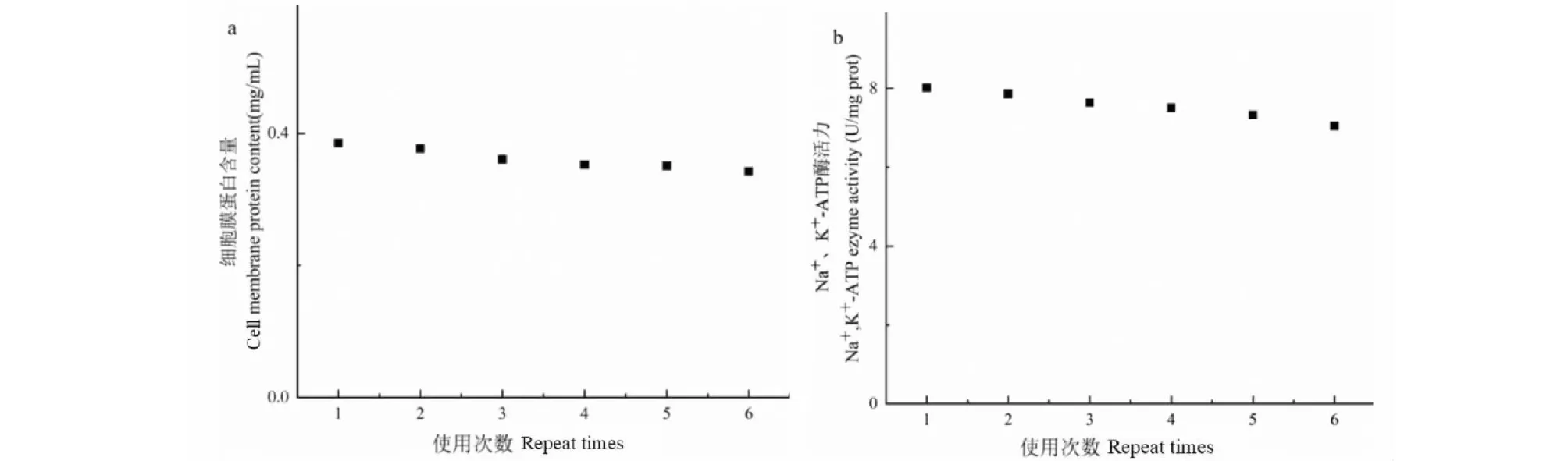
图5 化学修饰L02肝细胞膜生物亲和材料重复使用性能评价Fig.5 Effect of the regeneration cycles on the chemically modified L02 liver membrane bioaffinity material注:a.细胞膜蛋白含量;b.Na+、K+-ATP酶活力。Note:a.Cell membrane protein content;b.Na+,K+-ATP ezyme activity.
由图5可知,化学修饰L02肝细胞膜生物亲和材料重复使用6次,细胞膜蛋白含量下降11.1%,Na+、K+-ATP酶活力下降12.1%,两者均未发生显著降低,说明该材料重复使用性能良好。
3 结论
硅胶与APTES、戊二醛依次发生交联、缩合反应,通过共价键将硅胶和细胞膜进行连接,制备APTES修饰硅胶为载体的L02细胞膜生物亲和材料,扫描电镜和红外光谱均证明制备成功。APTES修饰L02细胞膜生物亲和材料对大黄30%乙醇提取液进行吸附,结果显示11个成分可被特异性结合;包括4个蒽醌糖苷、5个蒽醌苷元及2个未知成分,其中芦荟大黄素-8-O-β-D-葡萄糖苷、大黄酸-8-O-β-D-葡萄糖苷、大黄酚-8-O-β-D-葡萄糖苷及未知成分1是主要的特异性成分,可作为潜在活性成分进行降血脂活性验证。但由于细胞膜表面靶点众多,本材料仅适用于降血脂活性成分的初步筛选;且后期需要利用LC-MS/MS对2个未知成分进行初步结构鉴定。相比于物理吸附L02细胞膜生物亲和材料,该材料通过引入化学共价键,一定程度上避免了细胞膜的脱落,延长使用次数,可用于大黄降血脂活性成分的快速筛选,该材料也可为其他降血脂活性成分的快速筛选提供参考。
