AT1R-Crim1信号通路在乳鼠肥大心室肌细胞Kir2.1mRNA和蛋白表达调控中的作用
2022-03-29霍照美杨英杨龙何炯红夏桂玲郭楚娴
霍照美 杨英 杨龙△ 何炯红 夏桂玲 郭楚娴
(1.贵州医科大学,贵州 贵阳 550025;2.贵州省人民医院心内科,贵州 贵阳 550002)
心肌异常肥大导致的心室重构是慢性充血性心力衰竭(CHF)发生、发展最主要的病理生理机制[1]。恶性室性心律失常导致的心脏性猝死是CHF患者主要的死亡原因[2]。心室肌细胞离子通道重构是导致细胞动作电位时程改变,进而引发恶性室性心律失常的重要病理生理学基础[3]。调控心肌肥大的信号因子众多,半胱氨酸丰富跨膜成骨蛋白调控因子(Crim1)作为血管紧张素受体1型(AT1R)下游信号通路参与大鼠心室肌细胞肥大的负性调控[4]。并且,Crim1过表达能够抑制致肥大因子诱导的心室肌细胞膜瞬时外向钾电流(Ito)的改变[5]。但是,目前关于AT1-Crim1信号通路参与肥大心室肌细胞离子通道重构的报道极少。内向整流钾电流(Ik1)参与动作电位复极后期进程,对稳定心肌细胞静息电位、保障心脏复极储备具有重要作用。编码Ik1离子通道α亚基的Kir2.1基因突变可导致长、短QT综合征[6]。本研究旨在探讨AT1-Crim1信号通路在肥大心室肌细胞Kir2.1 mRNA和蛋白表达中的作用。
1 材料与方法
1.1试剂与仪器 血管紧张素Ⅱ(AngⅡ)和氯沙坦(Los)购自Sigma公司。胰蛋白酶、Ⅱ型胶原酶、高糖DMEM培养基、特优级胎牛血清(FBS)、5-溴脱氧尿嘧啶核苷(5-BrdU)均为Gibco公司产品。兔抗鼠Crim1抗体购于北京博奥森公司。兔抗鼠Kir2.1抗体购自美国abcam公司。山羊抗兔FITC-IgG抗体、BCA蛋白质定量试剂盒购自北京中杉金桥公司。携带Crim1基因的重组腺病毒(Ad-Crim1)、腺病毒空载体(Ad-null)购自上海ThermoFisher SCIENTIFIC公司。TransStart®Top Green qPCR SuperMix、TransStart® First-Strand cDNA Synthesis SuperMix购自北京全式金生物技术有限公司。其余试剂均为进口分装或国产分析纯。PCR仪(MJ Research);荧光显微镜(Leica公司);Bio-Rad化学发光仪、Bio-Rad 550酶标仪(Bio-Rad公司)。
1.2实验动物 清洁级SD大鼠1 d龄乳鼠40只,雌雄不限,由广东省实验动物学会提供,动物实验证书编号15276。 本研究通过贵州省人民医院伦理委员会审批,伦理审查批件编号(2020)076号。
1.3实验方法
1.3.1乳鼠心室肌细胞分离与培养 分离乳鼠左心室,保留室间隔,酶解法分离细胞,差速贴壁结合BrdU抑制成纤维细胞而获得纯化心室肌细胞[5]。
1.3.2细胞干预分组 细胞培养24 h,更换无血清DMEM培养基,分组干预。干预试剂包括:腺病毒空载体(Ad-Null),Crim1基因重组腺病毒载体(Ad-Crim1),血管紧张素Ⅱ(AngⅡ,终浓度0.1 μM),氯沙坦(Los,终浓度10 μM)。对照组:加入MOI=50对应量的腺病毒空载体,感染6 h后换成2倍体积新鲜无血清无双抗DMEM,继续培养至48 h。AngⅡ组:加入MOI=50对应量的腺病毒空载体,感染6 h后换成2倍体积新鲜无血清无双抗DMEM,感染24 h后加AngⅡ,继续培养至48 h。Los+AngⅡ组:加入MOI=50对应量的腺病毒空载体,感染6 h后换成2倍体积新鲜无血清无双抗DMEM,感染24 h后加AngⅡ、Los,继续培养至48 h。Crim1组:加入MOI=50对应量的Ad-Crim1,感染6 h后换成2倍体积新鲜无血清无双抗DMEM,继续培养至48 h。Crim1+AngⅡ组:加入MOI=50对应的Ad-Crim1,感染6 h后换成2倍体积新鲜无血清无双抗DMEM,转染24 h后加AngⅡ,继续培养至48 h。Crim1+Los+AngⅡ组:加入MOI=50对应的Ad-Criml,感染6 h后换成2倍体积新鲜无血清无双抗DMEM,转染24 h后加AngⅡ、Los,继续培养至48 h。
1.3.3肥大刺激有效性鉴定 RT-qPCR测定心室肌细胞β-MHC的mRNA表达。结晶紫染色细胞,拍照,软件测量细胞面积大小。
1.3.4RT-qPCR检测mRNA水平 Trizol法提取细胞总mRNA,按TransStart®Top Green qPCR SuperMix、TransScript® First-Strand cDNA Synthesis SuperMix的说明书步骤检测并计算各基因的mRNA相对表达量。引物序列见表1。

表1 各基因的引物序列
1.3.5Western蛋白质免疫印迹检测 提取细胞总蛋白,测定蛋白浓度。取40 μg总蛋白上样,电泳后转移蛋白至NC膜上,5%脱脂牛奶封闭1 h。加兔抗大鼠GAPDH抗体(1:1 000),兔抗大鼠Kir2.1抗体(1:1 000)或兔抗大鼠Crim1抗体(1:1 000),4 ℃孵育过夜。充分漂洗后,加入辣根过氧化酶标记的Ⅱ抗室温孵育1 h。充分漂洗后显影、摄片并进行条带灰度定量测定。

2 结 果
2.1各组乳鼠心室肌细胞β-MHC mRNA表达水平和细胞面积比较 各组间β-MHC mRNA表达水平总体比较差异有统计学意义(F=72.229,P<0.001);AngⅡ组和Crim1组β-MHC mRNA表达水平较对照组明显升高(P均<0.001);Los+AngⅡ组(P=0.008)、Crim1+AngⅡ组(P<0.001)和Crim1+Los+AngⅡ组(P<0.001)β-MHC mRNA表达值皆较AngⅡ组明显下降;Crim1+Los+AngⅡ组β-MHC mRNA表达值较Los+AngⅡ组明显下降(P<0.001)。各组心室肌细胞表面积总体比较差异有统计学意义(F=75.730,P<0.001);AngⅡ组细胞表面积较对照组明显增大(P<0.001);Los+AngⅡ组、Crim1+AngⅡ组和Crim1+Los+AngⅡ组细胞表面积皆较AngⅡ组明显减小(P均<0.001);Crim1+Los+AngⅡ组细胞表面积较Los+AngⅡ组明显下降(P=0.039)。见表2。
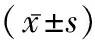
表2 各组心室肌细胞β-MHC mRNA表达水平和细胞表面积的比较
2.2Ad-Crim1、Los抑制AngⅡ刺激导致的心室肌细胞Crim1的mRNA和蛋白表达下调 各组心室肌细胞Crim1 mRNA表达值进行比较差异有统计学意义(F=710.507,P<0.001);AngⅡ组Crim1 mRNA表达水平较对照组明显降低(P<0.001),而Crim1组较对照组明显升高(P<0.001);Los+AngⅡ组(P=0.003)、Crim1+AngⅡ组(P<0.001)和Crim1+Los+AngⅡ组(P<0.001)Crim1 mRNA表达值皆较AngⅡ组明显增加;Crim1+Los+AngⅡ组Crim1 mRNA表达值较Los+AngⅡ组明显增加(P=0.035)。各组心室肌细胞Crim1蛋白表达值比较差异有统计学意义(F=198.967,P<0.001);AngⅡ组Crim1蛋白表达水平较对照组明显降低(P<0.001),而Crim1组较对照组明显升高(P<0.001);Los+AngⅡ组(P=0.008)、Crim1+AngⅡ组(P<0.001)和Crim1+Los+AngⅡ组(P<0.001)Crim1蛋白表达值皆较AngⅡ组明显增加;Crim1+Los+AngⅡ组Crim1 mRNA表达值较Los+AngⅡ组明显增加(P=0.005)。见表3。
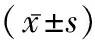
表3 各组心室肌细胞Crim1和蛋白表达水平的比较
2.3Ad-Crim1、Los抑制AngⅡ刺激导致的心室肌细胞Kir2.1的mRNA和蛋白表达下调 各组心室肌细胞Kir2.1 mRNA表达值比较差异有统计学意义(F=53.823,P<0.001);AngⅡ组Kir2.1 mRNA表达水平较对照组明显降低(P<0.001),而Crim1组较对照组明显升高(P<0.001);Crim1+AngⅡ组和Crim1+Los+AngⅡ组Kir2.1 mRNA表达值皆较AngⅡ组明显增加(P均<0.001);Crim1+Los+AngⅡ组Kir2.1 mRNA表达值较Los+AngⅡ组明显增加(P=0.007)。各组心室肌细胞Kir2.1蛋白表达值进行比较差异有统计学意义(F=52.330,P<0.001);AngⅡ组Kir2.1蛋白表达水平较对照组明显降低(P<0.001),而Crim1组较对照组明显升高(P<0.001);Los+AngⅡ组(P=0.004)、Crim1+AngⅡ组(P<0.001)和Crim1+Los+AngⅡ组(P<0.001)Kir2.1蛋白表达值皆较AngⅡ组明显增加;Crim1+Los+AngⅡ组Kir2.1蛋白表达值较Los+AngⅡ组明显增加(P=0.004)。见表4。
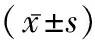
表4 各组心室肌细胞Kir2.1 mRNA和蛋白表达水平的比较
3 讨 论
心肌肥大、心衰患者室性心律失常风险显著增加,其机制之一是存在心室电重构[7]。离子通道重构是这些心脏电生理变化的重要基础。心肌肥大的发生机制涉及众多信号转导通路。骨形态发生蛋白(BMPs)属于转化生长因子-β(TGF-β)超家族成员。在压力负荷和AngⅡ诱导的心肌肥大中BMP4表达上调,而BMP4的表达能诱导心肌细胞肥大、凋亡和心肌纤维化,并能增强AngⅡ所诱导的心肌肥大效应[8]。Crim1是一种在心脏高表达的胚胎基因[9]。它拥有vWF-C型富含半胱氨酸重复片段(CRR)的跨细胞膜结构[10],其结构类似于BMPs抑制剂Chordin,这样的结构使其成为TGF-β亚家族的调控分子[11]。Crim1通过CRR片段与BMP4、BMP7结合,对BMPs起抑制作用[12]。Crim1广泛存在于胚胎各组织器官,并影响这些器官的发育,包括调控心脏的发育[13]。
我们的前期研究[14]发现,在腹主动脉缩窄大鼠心室肥大模型,心室肌组织中Crim1蛋白表达下调,AT1R阻滞剂替米沙坦干预可抑制Crim1蛋白表达下调和心室肥大。在牵张刺激诱导的培养乳鼠肥大心室肌细胞模型,Crim1的mRNA和蛋白表达下调;AT1R特异性阻滞剂Los干预显著抑制心室肌细胞肥大,并抑制致肥大因素诱导的Crim1 mRNA和蛋白表达下调[4]。通过携带Crim1基因的病毒感染促进培养心室肌细胞Crim1蛋白表达,明显抑制机械力牵张和苯肾上腺素刺激的细胞肥大;并且明显抑制苯肾上腺素刺激的心室肌细胞Ito的改变[5]。以上研究结果显示,Crim1作为AT1R下游信号通路参与大鼠心室肌细胞肥大的负性调控,并可能参与心室肌细胞膜离子通道重构的调控。本研究通过致心肌细胞肥大因子AngⅡ刺激构建心室肌细胞肥大模型。给予AT1R特异性阻滞剂Los干预,能显著抑制AngⅡ刺激诱导的心室肌细胞肥大效应及Crim1 mRNA和蛋白表达下调,并抑制AngⅡ刺激诱导的心室肌细胞Kir2.1 mRNA和蛋白表达下调。给予Ad-Crim1感染心室肌细胞促Crim1 mRNA过表达干预,显著上调Crim1蛋白表达、下调肥大基因β-MHC的mRNA表达;并明显抑制AngⅡ刺激诱导的心室肌细胞肥大及Kir2.1 mRNA和蛋白表达下调。Los和Ad-Crim1联合干预较Ad-Crim1单独干预能更显著抑制AngⅡ刺激心室肌细胞诱导的上述效应。该结果显示,Crim1作为AT1R下游因子参与心室肌细胞肥大及Kir2.1 mRNA和蛋白表达的调控,但其并非AT1R调控心室肌细胞肥大和Kir2.1表达的唯一的下游信号因子。
综上所述,AT1R-Crim1信号通路参与AngⅡ诱导的乳鼠肥大心室肌细胞Kir2.1 mRNA和蛋白表达的调控。
