KCTD11对宫颈癌HeLa细胞增殖的影响及分子机制
2022-03-29谭兴民
张 激 ,谭兴民
四川省中西医结合医院:1.肿瘤科;2.妇科,四川成都 610041
宫颈癌是最常见的妇科恶性肿瘤之一,其发病率及病死率在女性恶性肿瘤中均高居第四位,仅2020年全球新增宫颈癌患者60余万例,新增死亡患者30余万例,且发病呈现年轻化趋势[1]。研究表明人乳头瘤病毒(HPV)的感染与多数宫颈癌病例的发生密切相关,但环境因素及基因突变均可能诱导宫颈癌的发生和发展[2-3]。近年来,基因异常表达与宫颈癌发生的关系正在成为临床关注和研究的热点,探讨具有价值的宫颈癌治疗靶点,对于临床治疗,提升女性健康具有十分重要的意义。
含钾通道四聚结构域蛋白11(KCTD11)能够参与多种细胞生理活动,如细胞转移及凋亡等[4-5]。研究表明,KCTD11的表达与前列腺癌、肝癌及神经管细胞瘤的发生密切相关[6-7],但其在宫颈癌中的作用及机制尚不明确。本研究分析了KCTD11在宫颈癌中的表达情况,探讨KCTD11对宫颈癌细胞增殖的影响及机制,旨在为宫颈癌的基因治疗提供理论依据。
1 材料与方法
1.1 材料 宫颈癌HeLa 细胞与人胚肾细胞系HEK293FT 细胞购自中国医学科学院。DMEM 培养基、胎牛血清、青霉素/链霉素、胰蛋白酶购自美国Gibco公司。细胞总RNA 提取试剂Trizol、反转录试剂盒及定量试剂购自日本Takara公司。MG132 购自MCE公司。KCTD11抗体及Tubulin抗体购自北京博奥森公司,Flag、Myc、CDK2、CDK4、CDK6、CCND3及CCNE2 抗体购自美国CST 公司。Myc、CDK2、CDK4、CDK6、CCND3、CCNE2、KCTD11 及GAPDH 定量引物购自华大基因。慢病毒包装质粒pLP1、pLP2及VSVG,染色质免疫沉淀技术(ChIP)检测试剂盒购自赛默飞生命科学公司。RIPA 裂解液、蛋白酶体抑制剂PMSF等常规生化试剂购自上海生工公司。
1.2 方法
1.2.1 MTT 测定 取生长状态良好的细胞,经过胰酶消化后添加培养基重新成悬,并利用细胞计数板进行计数处理后,将细胞加入96孔板,每孔1 000个细胞。放置培养箱中24 h后,每孔添加MTT 溶液25 μL,培养2 h后,移除培养基,每孔添加200 μL DMSO,水平摇床孵育10 min后,于560 nm 波长条件下测定各组细胞吸光度(A560),共测定7 d,绘制成生长曲线。
1.2.2 Western blot检测蛋白表达 取所需测定细胞,经过胰酶消化,磷酸盐缓冲液(PBS)清洗后,收集细胞沉淀,并添加适量的含蛋白酶体抑制剂的RIPA裂解液,冰上裂解30 min后,离心收集上清液。利用BCA 试剂盒测定各组蛋白浓度,根据浓度计算上样量,每组上样50 μg蛋白。各组蛋白经高温变性后,于10% PAGE 胶中进行电泳,并将蛋白转印到PVDF膜上。使用5%脱脂牛奶室温封闭2 h后,孵育一抗(4 ℃过夜),次日回收一抗,TBST 清洗后,室温孵育二抗2 h。使用TBST 清洗,利用化学发光试剂检测相关蛋白信号。
1.2.3 实时荧光定量PCR(RT-qPCR) 经胰酶消化,PBS清洗后的细胞沉淀,依据RNA 提取试剂盒步骤提取总RNA(默克生物,货号:12183018A),经过质量检测及浓度测定后,将其反转为cDNA。后采用RT-qPCR 进行检测,每组3 个复孔。引物序列见表1。

表1 定量引物序列
1.2.4 ChIP分析 过表达融合Flag标签KCTD11蛋白的HeLa细胞经过1%甲醛溶液固定后,利用细胞刮刀收集细胞沉淀,并加入裂解液,于适合的超声条件下,将其染色质打断到200~1 000 bp。离心取上清液,并加入Flag抗体或IgG,4 ℃旋转过夜。次日,加入磁珠,并依照试验步骤,添加缓冲液进行清洗纯化。清洗纯化后的磁珠-抗体-染色质片段,经过剥离液处理后,利用核酸回收试剂盒进行纯化回收后,利用Myc启动子引物进行RT-qPCR,并分析试验结果,具体试验步骤参照碧云天ChIP 分析试剂盒,货号:P2078。
1.2.5 细胞周期检测 取各组细胞经过胰酶消化后,使用PBS清洗两次,收集细胞沉淀。使用75%乙醇重新成悬细胞,直至完全成悬成单个细胞,放置于-20 ℃冰箱,固定24 h。固定完成后,离心收集细胞沉淀,使用预冷PBS清洗3次,用PBS重新成悬,加核糖核酸酶(RNAase)37 ℃处理30 min,加入500 μL PI常温避光染色30 min,使用流式细胞仪分析各组细胞的细胞周期分布情况。
1.2.6 数据库分析 本研究使用UALCAN 数据库(网址:http://ualcan.path.uab.edu/index.html)分析KCTD11在宫颈癌中的表达及与宫颈癌分级间的关系,首先选定“TCGA analysis”栏,于“Enter gene symbol”中输入“KCTD11”,在“TCGA dataset”中选定宫颈癌后,点击“Explore”即可得到分析结果。
本研究使用GEPIA 2 数据库(网址:http://gepia2.cancer-pku.cn/#survival)分 析KCTD11 与 细胞周期蛋白表达相关性,选择“Expression analysis”中“Correlation analysis”,在gene栏中输入需要分析的两个基因名,肿瘤类型中选择宫颈癌,并点击“Plot”即可得到分析结果,根据数据库进行分组,分为正常组织(n=3)和宫颈癌组织(n=305)。
1.2.7 短发夹RNA(shRNA)载体构建 取shRNA上游和下游各10 μL,设置一个对照(shNeg组)及两个试验组,即shKCTD11-1#组与shKCTD11-2#组,加入双蒸水80 μL于1.5 mL 离心管中。另取烧杯,装适量沸水,将离心管放置烧杯内,使其自然退火降温。取退火shRNA 5 μL,酶切后加入PLKO.1载体1 μL,使用T4 连接酶系统室温连接过夜后,转化涂板,挑取单克隆进行测序。收到测序结果后,与shRNA 序列进行比对,选取100%匹配的菌株提取质粒,即得到构建好的shRNA 载体。
1.3 统计学处理 所有数据均采用SPSS20.0 和Graphpad Prism 5.0软件进行分析。正态分布的计量资料以表示,多组间比较使用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 KCTD11在宫颈癌中的表达 利用在线数据库(http://ualcan.path.uab.edu/index.html)比较KCTD11在宫颈癌组织和正常组织中的表达情况,结果表明KCTD11在宫颈癌组织中的表达水平显著高于其在正常组织中的表达水平(P<0.05),见图1。

图1 KCTD11在宫颈癌中的表达分析
2.2 敲低KCTD11对宫颈癌细胞增殖情况的影响shKCTD11-1#组及shKCTD11-2#组细胞中KCTD11的mRNA 和蛋白表达水平显著低于shNeg组(P<0.001),见图2。与shNeg组相比,shKCTD11-1#组及shKCTD11-2#组细胞增殖能力显著降低(P<0.001),见图3。同时下调KCTD11,会导致细胞周期阻滞于G0/G1期(P<0.05),见图3。

图2 RT-qPCR 和Western blot检测各组细胞中KCTD11的表达
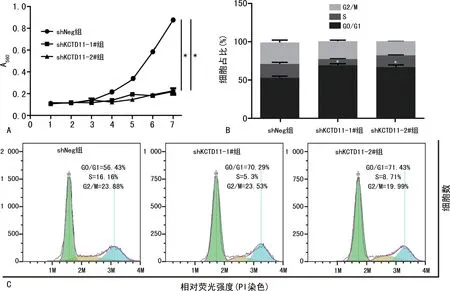
图3 KCTD11对宫颈癌细胞增殖的影响
2.3 KCTD11的表达与多种周期蛋白表达的关系 分析数据库数据(http://gepia2.cancer-pku.cn/#index)发现,KCTD11的表达与原癌基因Myc及多种细胞周期蛋白(CDK2、CDK4、CDK6、CCND3及CCNE2)表达呈正相关,见图4。

图4 KCTD11与Myc、CDK2、CDK4、CDK6、CCND3和CCNE2表达量的关系
2.4 抑制KCTD11 对细胞周期蛋白表达水平的影响抑制 KCTD11 后,shKCTD11-1# 组及sh-KCTD11-2#组细胞中原癌基因Myc及多种细胞周期蛋白(CDK2、CDK4、CDK6、CCND3及CCNE2)的mRNA 及蛋白表达水平显著低于shNeg 组(P<0.001),见图5。
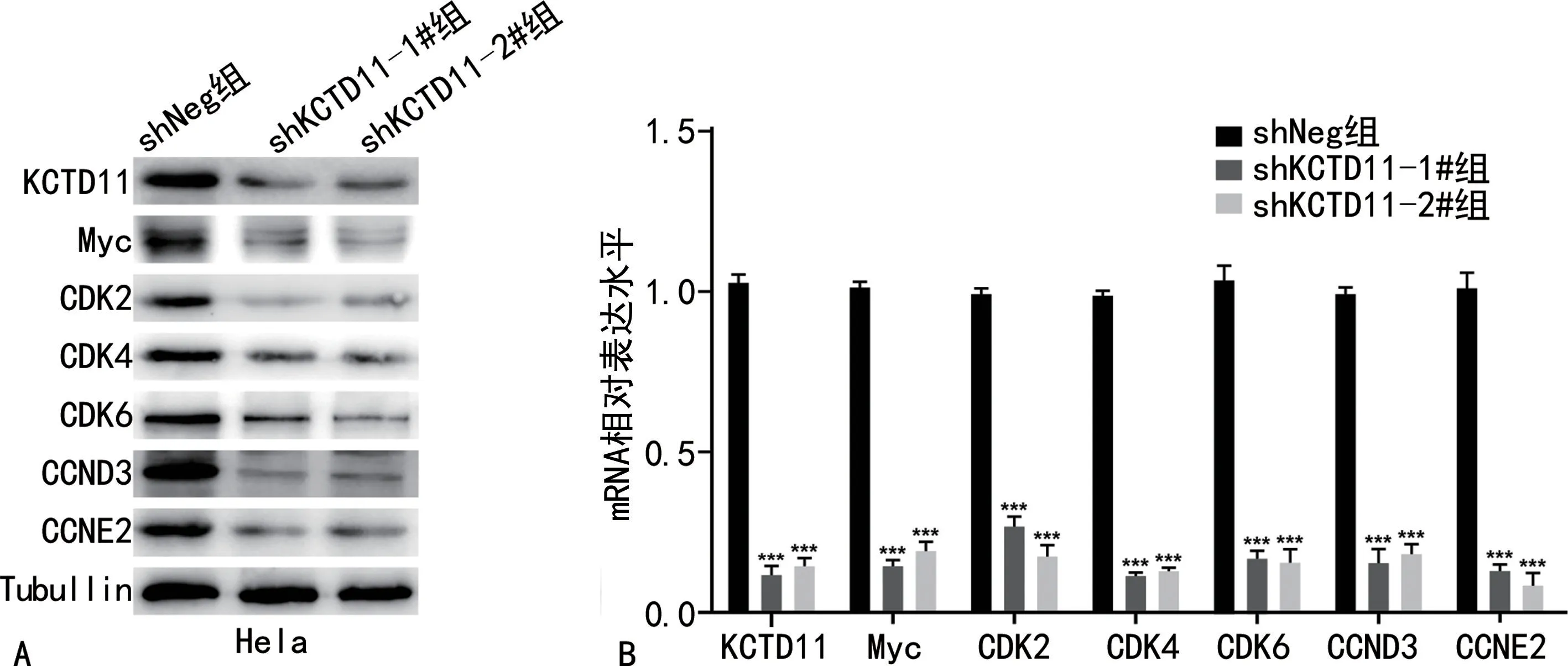
图5 KCTD11对细胞周期相关蛋白表达的影响
2.5 KCTD11转录激活Myc 在宫颈癌细胞周过表达融合Flag标签的KCTD11蛋白,利用Flag抗体进行ChIP 分析。结果表明,KCTD11能够结合到原癌基因Myc的启动子上,从而激活Myc的表达,见图6。

图6 KCTD11对Myc表达的影响
3 讨论
KCTD11是KCTD 家族成员之一。KCTD 蛋白家族在细胞内,往往与Cullin3蛋白相互结合[8],参与基因的转录调控或泛素化调控过程,与多种肿瘤的发生和发展密切相关[9]。KCTD11作为该家族蛋白成员之一,早期研究主要着重于其与Hedgehog信号通路的关系,在细胞和生物体发育过程中发挥着十分重要的作用[10]。近年来,有研究表明KCTD11的表达与肿瘤的发生密切相关,如前列腺癌、肝癌及神经管细胞瘤等,并发现其能直接激活Hippo信号通路[6-7]。
本研究由分析KCTD11在宫颈癌中的表达及其与宫颈癌级别的关系入手,发现KCTD11在宫颈癌组织中表达显著升高,KCTD11可能与宫颈癌的发展密切相关。为进一步探究KCTD11在宫颈癌中的作用,本研究在宫颈癌细胞中对KCTD11进行了敲低处理,结果表明敲低KCTD11能够阻滞宫颈癌细胞的细胞周期,进而抑制宫颈癌细胞的增殖。分析数据库数据发现,KCTD11的表达与包含原癌基因Myc在内的多种细胞周期蛋白呈正相关,同时Western blot及RT-qPCR 结果表明,下调KCTD11 会导致Myc、CDK2、CDK4、CDK6、CCND3 及CCNE2等多个基因的mRNA 及蛋白表达显著下调。
Myc作为目前研究最为广泛的原癌基因之一,参与肿瘤细胞的增殖、代谢重编程、迁移和侵袭等多种生理过程,与多种肿瘤的发生和发展密切相关[11-14]。作为转录因子,其能够直接转录激活多种细胞周期蛋白的表达,如CDK2、CDK4、CDK6 及CCND3 等[15-17]。本研究发现,敲低KCTD11,会抑制Myc及多个细胞周期蛋白的表达,且数据库数据表明KCTD11的表达与Myc表达呈正相关。因此,推测KCTD11可能通过调控Myc的表达,进而调控细胞周期蛋白的表达。为验证这一假设,本研究在HeLa细胞中过表达融合Flag标签的KCTD11蛋白,并利用Flag标签抗体进行ChIP分析。结果表明KCTD11 能够结合到Myc的启动子上,从而激活Myc的表达。
综上所述,本研究表明KCTD11能够通过转录激活Myc的表达,上调细胞周期蛋白的表达,从而促进宫颈癌的进展,抑制KCTD11的表达可作为宫颈癌治疗的潜在靶点。
