发酵大豆膳食纤维对母猪肠道菌群的调节作用
2022-03-28郭泳静刘果冯孔龙宋明月戴伟杰黄早成曹庸
郭泳静,刘果,冯孔龙,宋明月,戴伟杰,黄早成,曹庸*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东省天然活性物工程技术研究中心,广东广州 510642)(2.广东惠尔泰生物科技有限公司,广东广州 511356)
随着当代社会物质的高度发展,高血脂、糖尿病、高血压等慢性病的发病率越来越高。20世纪60年代,Trowell等[1,2]首先列举了这些慢性病的特征,并论证了膳食纤维在这些慢性疾病中的重要作用,使人们开始重新认识膳食纤维的生理功能。20世纪末,西方国家开始高度重视膳食纤维的研究开发与应用。食品、医药等相关行业做了大量的研究,发现摄入膳食纤维能够改善多种生理健康功能,如减少餐后血糖,降低胰岛素反应[3,4];降低胆固醇水平,预防心脑血管疾病[5];增加饱腹感,减轻体重[6]等。近期研究发现,膳食纤维能够调节肠道微生物群使其向有益的方向转变[7-9],从而调节代谢反应,增加对人体有益的代谢产物如短链脂肪酸、胆汁酸等的产生[10,11]。
哺乳动物胃肠道包含500~1000种细菌,约有1014个细菌细胞。这些微生物群的基因约是哺乳动物基因组中基因数的100倍,并可能为哺乳动物增加许多宿主缺乏的生物活性。例如,在肠道中定殖的微生物能够降解各种宿主自身无法消化分解的多糖,并提供各种代谢物,如胆汁酸、胆碱和短链脂肪酸等对宿主健康至关重要的小分子活性物质[11]。越来越多研究[12-14]表明,膳食纤维与肠道菌群的相互作用和其代谢物短链脂肪酸是发挥其生理活性功能的关键。
我国的酱油行业市场需求稳定,容量大,产量大。据中国调味品协会统计,2017年我国酱油产量已接近8.6×106t[15]。酱油渣是酱醪抽油或压榨后剩下的深棕色残渣,作为酱油制作过程中的主要副产物,产量很大。酱油渣中存在丰富的营养成分,酱油发酵时原料中仅有蛋白质、淀粉被部分利用,酱油渣中仍含有定量的粗蛋白、粗脂肪、膳食纤维、亲脂性维生素和黄酮类小分子活性物等营养成分[16-19]。但未处理的酱油渣盐含量高达 10%~25%,食用易引起食盐中毒[20];且未被发酵利用的油脂中所含的大量不饱和脂肪酸极易在高湿、高酸环境中变质为过氧化脂质,有很强的细胞毒性,无法直接作为动物饲料[21]。
由此,本研究采用一种特殊的发酵大豆膳食纤维-酱油渣来源的低盐、低油、无异味的食品级膳食纤维,表征其对母猪肠道菌群及其产物短链脂肪酸的调节作用,对该特殊膳食纤维的生理活性进行研究,为其作为动物饲料及食品原料提供一定的科学依据,以期实现酱油渣的高值化开发与资源的回收利用,推动社会可持续发展。
1 材料与方法
1.1 试验动物与材料
发酵大豆膳食纤维由惠尔泰生物科技有限公司提供,总膳食纤维含量占 67.77%,不溶性膳食纤维占61.77%,剩余6.00%为可溶性膳食纤维。不溶性膳食纤维中的纤维素含量占总物质的37.37%、半纤维素和木质素分别占17.67%和1.34%[22]。
母猪按体重、体况相近均衡分布的原则随机分为2组(对照组和剂量组),在相同且受控环境条件下饲养。实验经华南农业大学动物伦理委员会批准,伦理号20110107-1。
母猪基础饲料的主要成分有玉米 60.10%、麦麸18.00%、豆粕11.00%、豆油3.70%和大豆皮2.20%等,参照NRC-2012猪的饲养标准进行配制。
1.2 试验方法
1.2.1 动物实验分组及饲养
选用妊娠期母猪,随机分为对照组(CK)和剂量组(DF),各组3只母猪。剂量组饲喂含5%发酵大豆膳食纤维的饲料,对照组为不含发酵大豆膳食纤维的普通饲料。持续饲喂20 d后收集各组母猪粪便,存放于-80 ℃冰箱中,用于分析母猪肠道菌群及短链脂肪酸含量。
1.2.2 16S rDNA高通量测序分析
16S rDNA高通量测序分析由上海生工科技有限公司完成,实验具体流程如下:样品中DNA的提取及采用琼脂糖凝胶电泳检测DNA的完整性。PCR扩增:采用细菌V3-V4区通用引物341F-805R,并引入Illumina桥式PCR兼容引物,PCR结束后进行琼脂糖凝胶电泳进行检测。将PCR扩增产物DNA纯化回收,在Illumina Miseq™平台上上机测序。
原始测序序列经由在Illumina Miseq™平台上机检测后得到的原始图像数据文件经CASAVA碱基识别处理得到。后期数据处理流程为:数据处理与统计:原始序列拼接、质控过滤、去除嵌合体和非特异性扩增序列。OUT聚类;将处理后的序列根据其距离进行聚类,在 97%的相似水平下将其分成 OTU(operational taxonomic units,操作分类单元),并制作韦恩图。物种分类及差异分析:对处理后的优质序列进行物种分类,计算各样本在不同分类水平上的序列丰度,绘制物种丰度饼图;分别采用Welch’s t-test和LEfSe筛选两组样本间在各分类水平上的差异物种并做图。Alpha多样性和Beta多样性分析:Alpha多样性用于反映微生物群的丰富度和均一度,通过计算ACE、Chao、Shannon、Simpson、Coverage等指数来评价;而各样本间的差别采用 Beta多样性分析进行度量,采用主成分分析(principal component analysis,PCA)进行评价。
1.2.3 粪便短链脂肪酸含量测定
参考Garcia等[23]的方法,取500 mg粪便于5 mL研磨离心管中,加入1.0 mL 1%磷酸溶液,放入同等体积的1 mm研磨珠,在珠磨机中研磨2 min。观察研磨彻底后加入1 mL乙酸乙酯,用vortex涡旋振荡,使体系充分混匀。离心取上层有机试剂层于-20 ℃冰箱备用。上机分析前,加入4-甲基戊酸作为内标,用于纠正每次注射样品量间的变化和仪器响应的微小变化。每个样品进行3次独立重复提取实验。
气相色谱采用极性毛细管柱DB-WAX,氦气载气浓度 1 mL/min,质谱检测器扫描范围在 30~250m/z之间,离子源、四极杆和界面温度分别为 230 ℃、150 ℃和280 ℃。采用分流模式,设置分流比为50:1,进样量5 μL,进样口温度250 ℃。跑样时柱温起始温度90 ℃跑3 min,然后15 ℃/min升温至150 ℃,150 ℃下维持3 min,最后2 ℃/min升温至160 ℃并在此温度下维持2 min。总运行时间为17 min。
1.3 统计学分析
采用软件Ecxel 2016和SPSS Statistics 26对数据进行统计分析及差异比较,p<0.05为数据间具有显著性差异,p<0.01表示差异极显著。软件GraphPad Prism 8用于进行菌群丰度与短链脂肪酸之间的Spearman相关性分析,并绘制相关性热图。
2 结果与讨论
2.1 对母猪肠道菌群的调节
2.1.1 OUT分类和Alpha多样性分析
如图 1,用韦恩(Venn)图统计两组样品中共有和独有的OUT数目。CK和DF组母猪肠道菌群共有的OUT数为1491,而CK组和DF组中分别独有479个和422个OUT。喂食发酵大豆膳食纤维和喂食普通饲料的母猪相比,其肠道菌群中有小部分的细菌种类发生了改变,且细菌OUT数即物种数减少。
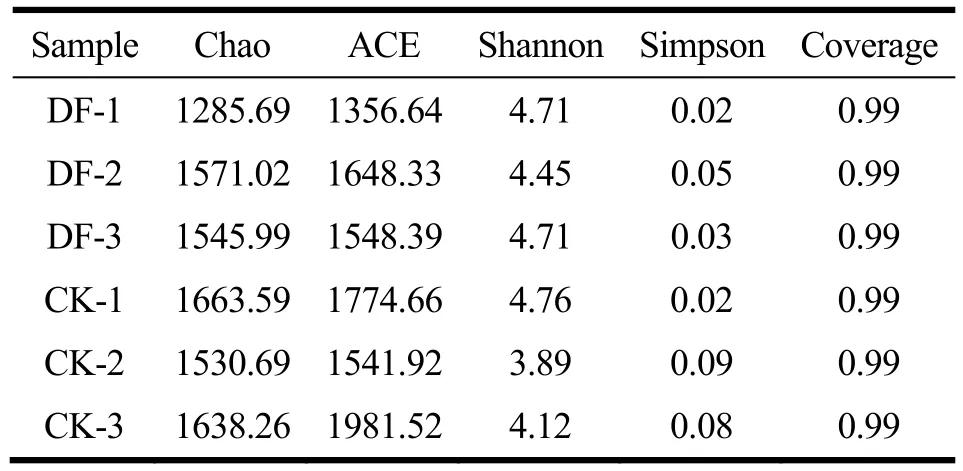
表1 母猪的肠道菌群Alpha多样性指数Table 1 Alpha diversity index of fecal microbiota
图2中随着抽取序列数的增加,各Alpha指数的稀释性曲线均趋向平坦,且表 1中各样本的覆盖率(Coverage)均达到99%,说明样品中序列没有被测出的概率极低,此次测序深度能够代表样本中大多数物种,可反映样本的真实情况。群落生态学中,单样品的多样性分析(即Alpha多样性)主要由丰富度(richness)和均一度(evenness)两个因素来衡量,丰富度指样品中的物种数;均一度用于衡量样品中不同物种的相对丰度。常用一系列的统计学分析指数来进行评估。本研究分别采用Chao和ACE指数估计肠道菌群物种总数,Chao和ACE指数越大,群落的丰富度越高;而Shannon和Simpson指数可对微生物的丰富度和均匀度进行综合考量[24,25],该研究中Shannon指数越大,群落的多样性越高,而Simpson指数越小,群落的多样性越高。
各样品的Alpha多样性指数和组间的Alpha指数箱式图分别见表1和图3。DF组与CK组相比,Chao和Ace指数相对较小,反应DF组的肠道菌群物种总数即OUT数目更少,与图1Venn图中所示结果相符合;而Shannon指数较大,Simpson指数较小,说明DF组的菌群多样性增大,但其丰富度较小,故推测DF组母猪肠道菌群的均一度增大,即各物种的个体分布相对更均匀。但以上两组间数据无显著性差异。有相关文献指出[26],喂食含4%木质纤维素的饲料使鸡的肠道菌群各项Alpha指数均显著增大,因此,摄入膳食纤维均能提高菌群的多样性,但与该研究中菌群丰富度降低的结果相悖。以上结果可能原因为:摄入含发酵大豆膳食纤维的饮食后,促使母猪肠道菌群中特定发酵该类碳水化合物的微生物向有利方向转变,使其相对丰度更高,从而使其他菌种的生长受到抑制甚至消亡,因此肠道菌群的丰富度降低,而均一度增加。
2.1.2 菌群结构分析
本研究分别从门水平和属水平对母猪的肠道菌群结构进行讨论分析。图4为门水平上两组样本的肠道菌群相对丰度饼图,表2为DF和CK组菌群在主要门水平上的相对丰度及差异分析(相对丰度>0.1%)。测序得到的OUT序列分属细菌域的16个门,其中相对丰度大于0.1%的有10个门:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、螺旋体菌门(Spirochaetes)、疵微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、广古菌门(Euryarchaeota)、念珠菌门(Candidatus Saccharibacteria)、浮霉菌门(Planctomycetes)和纤维杆菌门(Fibrobacteres),以及无法确定分类的细菌(unclassified)。两组间各门的相对丰度略有差异,但不存在显著性(p>0.05)。
菌群中Firmicutes丰度最高,Bacteroidetes次之,为母猪粪便肠道菌群中的优势菌门,二者丰度占总序列的 90%左右,但略有浮动,与相关研究结果一致[27,28]。在本研究中,DF组和CK组间各菌门的相对丰度无显著性变化,可能原因有:①DF组摄入发酵大豆膳食纤维含量相对较少,且CK组普通饲料的原料中也含有一定量的膳食纤维,饲料营养结构相近,母猪的肠道菌群结构难以发生根本性的变化;②有研究发现,猪的肠道菌群随年龄增长而趋向同质化[28],因此成年母猪的肠道菌群自身较稳定。

表2 DF和CK组菌群在主要门水平上的相对丰度及差异分析Table 2 Relative abundance of CK and DF at the phylum level and differential analysis (%, X±SD, n=3)
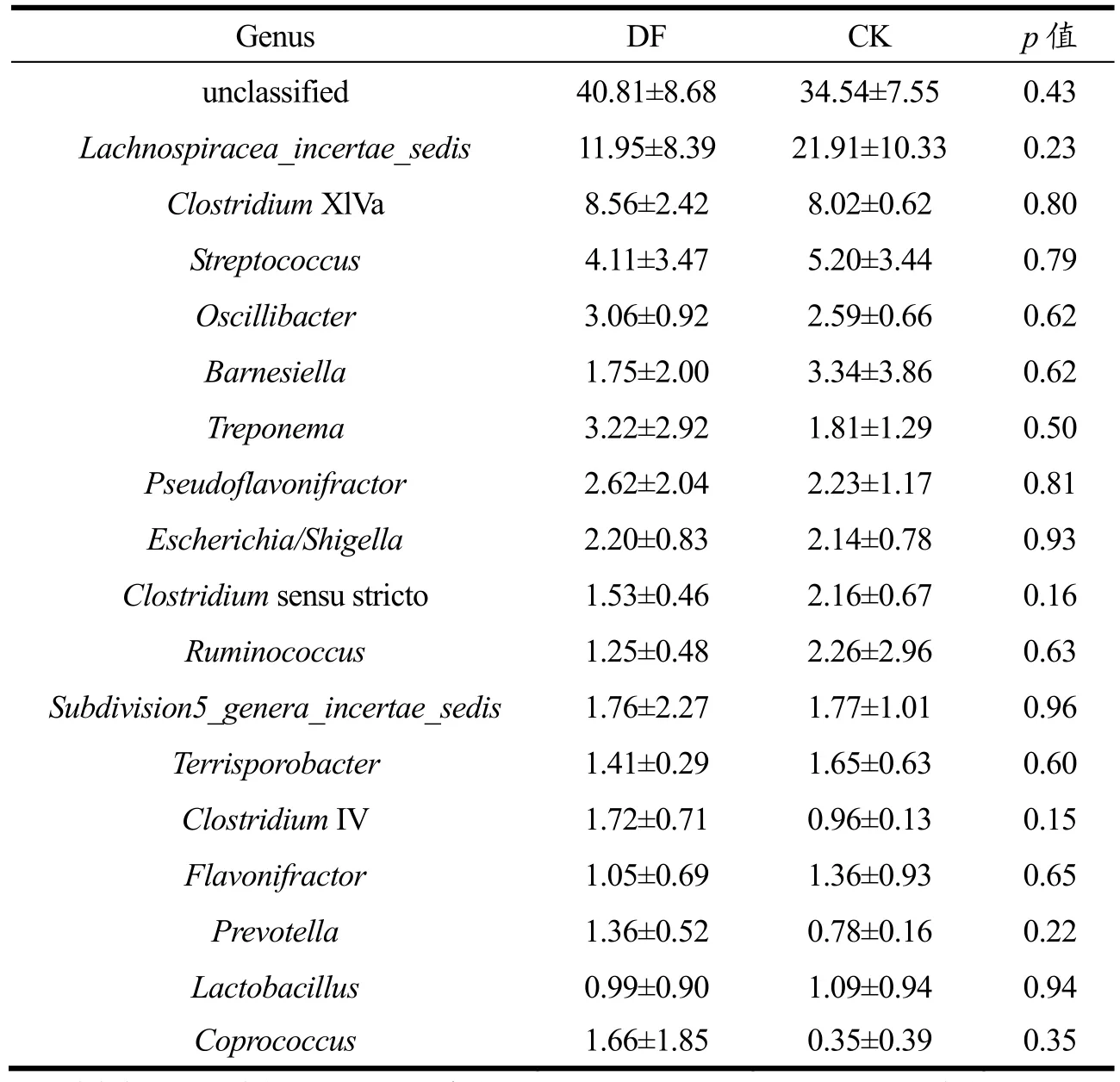
表3 DF和CK组菌群在主要属水平上的相对丰度及差异分析Table 3 Relative abundance of CK and DF at the genus level and differential analysis (%, X±SD, n=3)
图5为属水平上两组样本的肠道菌群相对丰度饼图,表3选取各组间相对丰度大于1%的各菌属进行相对丰度及差异分析。OUT序列进行分类后分别属于153个属,DF组和CK组各有约41%和35%的序列无法确定分类(unclassified)。两组共有的主要属(相对丰度>1%)有15种,分别为Lachnospiracea_incertae_sedis、梭状芽孢杆菌XlVa属(ClostridiumXIVa)、链球菌属(Streptococcus)、颤杆菌克属(Oscillibacter)、巴恩斯氏菌属(Barnesiella)、密螺旋体菌属(Treponema)、Pseudoflavonifractor、大肠杆菌/志贺菌属(Escherichia/Shigella)、梭状芽孢杆菌属(Clostridiumsensu stricto)、瘤胃球菌属(Ruminococcus)、Subdivision5_genera_incertae_sedis、土孢杆菌属(Terrisporobacter)和Flavonifractor。
另外DF组中梭状芽孢杆菌IV属(ClostridiumIV)、普雷沃氏菌属(Prevotella)和粪球菌属(Coprococcus)的相对丰度均大于 1%,但在 CK组中相对丰度小于1%。乳酸杆菌属(Lactobacillus)在CK组肠道细菌中相对丰度占1.09%,DF组中仅占0.99%。在属水平上,各样本的肠道细菌约有 27.86%~47.73%的序列无法确定分类,占比最大。其次相对丰度较大的依次为Lachnospiracea_incertae_ sedis,ClostridiumXlVa 和Streptococcus,三者均为Firmicutes中菌属。
Clostridium中包含有潜在的益生菌,ClostridiumXIVa、ClostridiumIV中的部分芽孢杆菌菌株已被报道可减轻炎症及过敏性疾病[29,30]。Prevotella作为Bacteroidetes的成员,其中某些菌株在人体中被证实能够诱导产生胰岛素抵抗效应,是一种潜在的益生菌[31]。前期研究[32-34]表明,纤维素和半纤维素的添加能够促进Clostridiumcluster和Prevotella的生长,与本文研究结果一致。DF组中ClostridiumXIVa、ClostridiumIV和Prevotella的相对丰度均增大,可能是发酵大豆膳食纤维中纤维素和半纤维素的摄入为这些菌群提供了可发酵底物。
2.1.3 菌群丰度差异分析
本研究分别采用Welch’s t-test和LEfSe进行组间物种差异分析。在属水平上,DF组Slackia丰度显著高于CK组(p<0.05),但其在DF组中的相对丰度仅占0.01%,为Actinobacteria中的一个菌属。其中部分菌株如Slackia isoflavoniconvertens为人类粪便中分离出的少数具有形成雌马酚特征的菌株,其代谢底物为大豆异黄酮的两种苷元形式-大豆苷元和染料木素,并将其转化为雌马酚和5-羟基雌马酚[35,36]。有学者发现,未成熟木瓜的膳食纤维经人体粪便体外发酵后,Slackia的丰度增加,而成熟木瓜的膳食纤维无明显变化[37]。综上,Slackia丰度的增加的可能原因有:组成膳食纤维的部分分子量大的组分作为底物促进其丰度增加;该发酵大豆膳食纤维中可能仍含有在酱油发酵过程中未被利用的大豆异黄酮及其苷元,但有待进一步实验进行验证。
图7为LEfSe分析的进化分支图和柱状图。与CK组相比,DF组中丰度较高的物种有:ClostridiumIV和δ-变形菌纲(Deltaproteobacteria)。其中Clostridium IV在前文已进行相关表述说明。Deltaproteobacteria为变形菌门下的一个菌纲,该菌纲中有许多产H2S的硫酸盐还原细菌[37],有研究认为H2S可能导致炎症性肠病和结肠癌[38,39],近期研究表明H2S是胃肠道黏膜防御、修复上皮损伤的重要介质,能够防止非甾体类消炎药导致的肠道生态失调并促进炎症消退[40],且Deltaproteobacteria在人体中被发现可能与成年人的压力和焦虑情绪相关[41]。本研究中 Deltaproteobacteria的上调可能是摄入发酵大豆膳食纤维后肠道菌群结构变化而引起的,为维护肠道稳态而生成的一种肠道内部防御机制。
2.1.4 PCA主成分分析
图8为所有样本基于OUT的PCA图,并选取了能够最大程度反映样品间差异的两个坐标轴(即PC1和 PC2),第一主成分贡献 77%,第二主成分贡献为10%,二者共贡献87%。图中方形点代表DF组,圆形点代表CK组,各点间的距离代表样本间肠道菌群的结构差异。DF组的各样本分布较集中,而CK组的各样本间距较分散。结果表明,将 5%母猪饲料替换为发酵大豆膳食纤维后,母猪的肠道菌群结构发生一定程度趋向性的变化。CK组的各样本聚类较分散,可能是喂食普通饲料的个体自身健康状况、年龄等其他因素造成的。
2.2 粪便短链脂肪酸含量分析
2.2.1 标准曲线的建立

表4 各SCFAs的标准曲线方程Table 4 Equation of standard curve for tested short-chain fatty acids
以4-甲基戊酸为内标,采用GC-MS分别测定母猪粪便中的乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸含量。通过与标准品的质谱图和保留时间进行比较、以及质谱数据库的使用对样品中的SCFAs进行鉴定。表4为各待测短链脂肪酸的标准曲线方程。除乙酸外,其余各短链脂肪酸标准曲线的决定系数(coefficient of determination,R2)均为 0.99,线性拟合程度很高。乙酸的标准曲线R2仅为0.979,可能原因是溶剂乙酸乙酯能分解为乙酸和乙醇,且该反应为可逆反应,会导致体系中的乙酸含量不稳定,造成实验误差。因此用乙酸乙酯作为溶剂难以对乙酸进行准确定量。
2.2.2 样品中的短链脂肪酸含量分析
表5为CK组和DF组母猪粪便中的短链脂肪酸含量测定结果。除丁酸外的其他短链脂肪酸含量在DF组中均有增加,但差异并不显著(p>0.05)。仅丁酸含量在DF组中显著增加(p<0.05)。
对在粪便中得到的短链脂肪酸含量,其说明含义是有限的,该结果无法表征结肠近端发酵和短链脂肪酸吸收的动态过程[42]。有学者总结,影响短链脂肪酸的两大关键因素为膳食纤维的种类和肠道转运速率,并认为加入缓慢发酵的膳食纤维后,原本在结肠近端快速发酵的膳食纤维产生的短链脂肪酸会被大量转移到结肠远端,由此在粪便中检测出差异性[43]。近期研究发现,经纤维素酶处理和碱性(化学)处理后的菜籽粕均形成了大量的可溶性低聚纤维素,可显著增加与膳食纤维降解相关微生物功能的丰度和直链短链脂肪酸的含量[44]。本研究中发酵大豆膳食纤维的纤维素和半纤维素含量高达50%以上,为缓慢发酵纤维;而更易发酵的可溶性膳食纤占 6.10%。综上推测可能是酱油发酵过程中微生物酶的作用,使组成这些大分子碳水化合物的一部分化学键断裂,更容易被肠道内的相关微生物代谢,且延缓了可溶性膳食纤维在结肠中的发酵过程,从而使更多短链脂肪酸在结肠末端产生,并有一部分从粪便中表征出。
在肠道末端,肠道菌群发酵膳食纤维产生的短链脂肪酸可以通过扩散或转运进入细胞,并作为胃肠道细胞的重要能量来源,调节免疫反应及维持黏膜稳态[45,46]。其中乙酸和丙酸影响饱腹感和肠道转运,并能通过循环系统直接影响脂肪组织、大脑和肝脏,特别是丙酸盐能被肝细胞利用进行糖异生转化为葡萄糖[47]。而丁酸可诱导粘蛋白合成,使上皮细胞之间的连接收紧,并抑制组蛋白脱乙酰基酶类的活性,从而防止肠道炎症和肠漏综合征,预防结肠癌[47,48]。此外,拟杆菌门中某些细菌如拟杆菌属会将乳酸转化为其他短链脂肪酸如乙酸、甲酸或丙酸,这些脂肪酸的大量堆积会损害肠道内壁[48]。DF组中丁酸含量的显著提高说明发酵大豆膳食纤维可促进丁酸的产生,保护肠道内壁并预防肠道炎症和结肠癌。
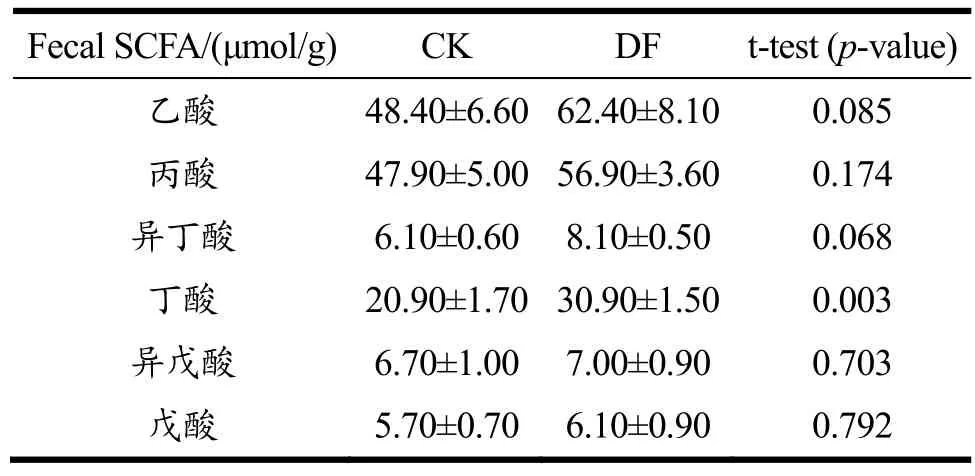
表5 CK和DF组母猪粪便中的SCFAs含量Table 5 SCFAs content in sows’ feces of CK and DF group(X±S, n=3)
2.3 肠道菌群与短链脂肪酸相关性分析
图9为在属水平上的肠道微生物群和短链脂肪酸间的相关性分析热图,图中仅列出具有显著相关性的微生物属。乙酸和丙酸与各菌属间呈现出相似的相关性趋势,均与成显著的正相关关系,和Escherichia/Shigella、Paraeggerthella显著负相关。此外,乙酸和Anaerosporobacter显著负相关,丙酸和Cellulosibacter显著正相关,和Anaerobacter、Butyrivibrio显著负相关。而丁酸和Succinivibrio、罗斯氏菌(Rothia)、假单胞菌(Pseudomonas)成显著正相关关系。
许多研究表明,Terrisporobacter为人体中的潜在致病菌[49,50],且该菌属在CK组中的相对丰度更高,因此该菌属和乙酸及丙酸的正相关关系实际存在可能性不大。已有研究表明Rothia可产生短链脂肪酸[51]。Pseudomonas在人体中被认为是致病菌,但在植物中能够利用各种不同的有机和无机化合物,并产生次级代谢物如嗜铁素和有机酸[52],且在本研究中其相对丰度几乎为零,因此该菌属可能仅微量地贡献了肠道中总短链脂肪酸的含量,在其他可能的有害方面对肠道菌群结构影响几乎无影响。
3 结论
本文以一种酱油渣来源的发酵大豆膳食纤维为研究对象,初步判断该发酵大豆膳食纤维在一定程度改变了母猪的肠道菌群结构,并促使肠道微生物群产生了更多对机体有益的短链脂肪酸,尤其是丁酸,进而保护肠道内壁,预防肠道炎症及结肠癌。但关于发酵大豆膳食纤维对机体及其肠道菌群代谢的具体通路和作用机理仍有待进一步深入研究。
