肝癌细胞来源外泌体对肿瘤相关M2型巨噬细胞极化的影响
2022-03-28徐植红姚纪友陆敏强
姚 涛,徐植红,姚纪友,夏 雨,陆敏强,兰 天,刘 冰
1 广东药科大学 药学院,广州 510006;2 华南理工大学附属第二医院/广州市第一人民医院 肝胆二科,广州 510180
尽管手术、放/化疗、免疫治疗和靶向治疗部分提高了肝细胞癌(HCC)的临床疗效,但HCC仍是全球癌症相关死亡的第四大原因[1]。根据世界卫生组织[2]预测,到2030年将有超过100万患者死于HCC。HCC形成的具体发病机制目前尚不清楚[3]。近年来研究[4]证明巨噬细胞在肿瘤的恶性生长中发挥重要作用,巨噬细胞功能异常调节与HCC有关,M2型巨噬细胞对包括HCC在内的多种恶性肿瘤的侵袭转移有促进作用[5]。最近研究[6]表明,肿瘤免疫微环境中的M2型巨噬细胞促进了HCC的侵袭转移。但现有研究多集中于巨噬细胞如何调控肿瘤的侵袭转移,而对肿瘤细胞驯化巨噬细胞的机制尚未明确,阻碍了靶向巨噬细胞抗肿瘤策略的发展。
外泌体是一种能够在细胞间进行物质交换和信息交流的胞外囊泡。癌细胞和M2型巨噬细胞之间的串扰已被广泛研究,然而,肿瘤细胞如何激活M2型巨噬细胞的机制在HCC中仍不清楚。因此,本研究通过超速离心的方法提取外泌体,研究来源于HCC细胞的外泌体对巨噬细胞极化的影响,探讨其在巨噬细胞极化过程中的作用。
1 材料与方法
1.1 细胞系 Hep G2细胞株、L02细胞株、人源单核细胞巨噬细胞(THP-1)购自上海中国科学院细胞培养中心。
1.2 试剂和仪器
1.2.1 主要试剂 DMEM、RPMI 1640(美国Gibco公司);胎牛血清、胰蛋白酶(美国Hyclone公司);TSG101、CD63(英国Abcam公司);Arg-1、CD163(美国CST公司);佛波酯(美国Sigma公司);HRP标记羊抗兔、抗鼠二抗(美国Promega公司);β-actin抗体(北京TransGen Biotech公司);BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司);SYBR Green Supermix(美国Bio-Rad公司);TAKALA逆转录试剂盒(大连TAKALA公司)。
1.2.2 主要仪器 LC480荧光定量PCR仪(型号:Roche LC 48032qw,瑞士Roche公司);超净工作台(型号:BCM-1000A,美国AIRTECH公司);CO2培养箱(型号:4111,美国Thermo Fisher Scientific公司);高速离心机(型号:Beckman Optima L-100XP,美国Beckman Coulter公司);高速离心管(批号:P00128MPI,美国Beckman Coulter公司);微型蛋白电泳转印系统(型号:PowerPac Basic,美国Bio-Rad);化学发光仪(型号:3300029-7Q,上海勤翔科学仪器有限公司);纳米激光粒度仪(型号:Litesizer 500,奥地利Anton Paar公司)。
1.3 方法
1.3.1 细胞培养 所有细胞实验操作过程都严格在超净台无菌环境下进行,细胞培养条件:温度37 ℃,CO2含量5%以及饱和湿度培养箱环境。Hep G2细胞在含有10%胎牛血清的DMEM中培养,THP-1细胞在含有10%胎牛血清的RPMI-1640培养基中培养。
1.3.2 外泌体提取分离 采用超速离心法从Hep G2细胞培养基中分离出外泌体。将生长状态良好的Hep G2细胞平铺在细胞培养皿中,细胞贴壁过夜后去除含有10% 胎牛血清的DMEM培养基,并使用无血清培养基维持细胞,48 h后收集细胞培养基。采用差速离心法依次以1000×g离心10 min,3000×g离心20 min,10 000×g离心30 min取上清,用0.22 μm的膜过滤。最后,将上清液置于固定角转子中,以4 ℃ 100 000×g离心70 min,弃去上清,PBS重悬备用。
1.3.3 HCC细胞来源外泌体表征
1.3.3.1 透射电子显微镜(TEM)检测 用1%戊二醛固定外泌体,将20 μL含外泌体的上清液滴在铜网上,室温下放置5 min,用滤纸条吸取铜网一侧多余液滴。取2%的磷钨酸溶液10 μL滴于腊盘上,将铜网放置于染液表面静置5 min后用滤纸将多余的染料溶液吸收并丢弃。在室温下干燥后,将铜网放在样品槽中,在TEM下观察并拍照。
1.3.3.2 纳米激光粒度仪分析外泌体粒径 将外泌体用适量PBS稀释置于比色皿,纳米激光粒度仪Litesizer 500分析外泌体粒径。
1.3.3.3 蛋白免疫印迹 加入含有蛋白酶抑制剂的裂解液重悬外泌体,提取总蛋白进行蛋白免疫印迹分析。将提取蛋白加入聚丙烯酰胺凝胶电泳中分离后,将其转移到PVDF膜上,5%脱脂牛奶封闭1 h。TSG101和CD63一抗在 4 ℃ 冰箱中孵育过夜。二抗室温孵育1 h,采用化学发光法显色拍照。
1.3.4 HCC细胞外泌体诱导巨噬细胞M2极化
1.3.4.1 巨噬细胞模型的构建 在小皿种植密度为7.5×105个/皿THP-1细胞,加入15 ng佛波酯(PMA)诱导24 h贴壁后实时荧光定量PCR(qRT-PCR)检测CD68表达。
1.3.4.2 qRT-PCR检测CD68表达 CD68引物序列,上游引物:5′-CACGCAGCACAGTGGACATTCT-3′,下游引物:5′-TGGGGCAGGAGAAACTTTGCC-3′;GAPDH引物序列,上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′均由广州锐博公司设计与合成。按照常规Trizol法提取细胞总RNA,测定提取总RNA浓度,按照RNA反转录试剂盒说明书进行反转录,条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃保持。逆转录后qRT-PCR反应程序如下:95 ℃预变性10 min;变性(95 ℃,28 s),复性(55 ℃,28 s),延伸(74 ℃,35 s)反应40个循环,CD68表达水平采用 2-ΔΔCt计算。
1.3.4.3 外泌体诱导巨噬细胞 将PMA诱导的人单核巨噬细胞,分别用PBS和正常肝细胞分泌的外泌体(L02-Exo)作为阴性对照,Hep G2细胞分泌的外泌体(Hep G2-Exo)低(10 μg)、中(20 μg)、高(30 μg)剂量和阳性对照IL-4+IL-13 20 ng/mL分别孵育诱导成功的巨噬细胞,检测M2型巨噬细胞标志蛋白Arg-1、CD163。
1.4 统计学方法 采用GraphPad Prism 8和Image J软件进行作图和统计学分析。符合正态分布的计量资料两组间比较采用t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 外泌体的表征
2.1.1 外泌体形态特征 通过TEM对超速离心法提取到的外泌体进行鉴定,Hep G2和L02细胞来源外泌体均拍到了圆形或椭圆形囊泡结构,电镜下囊泡大小为100 nm左右(图1)。
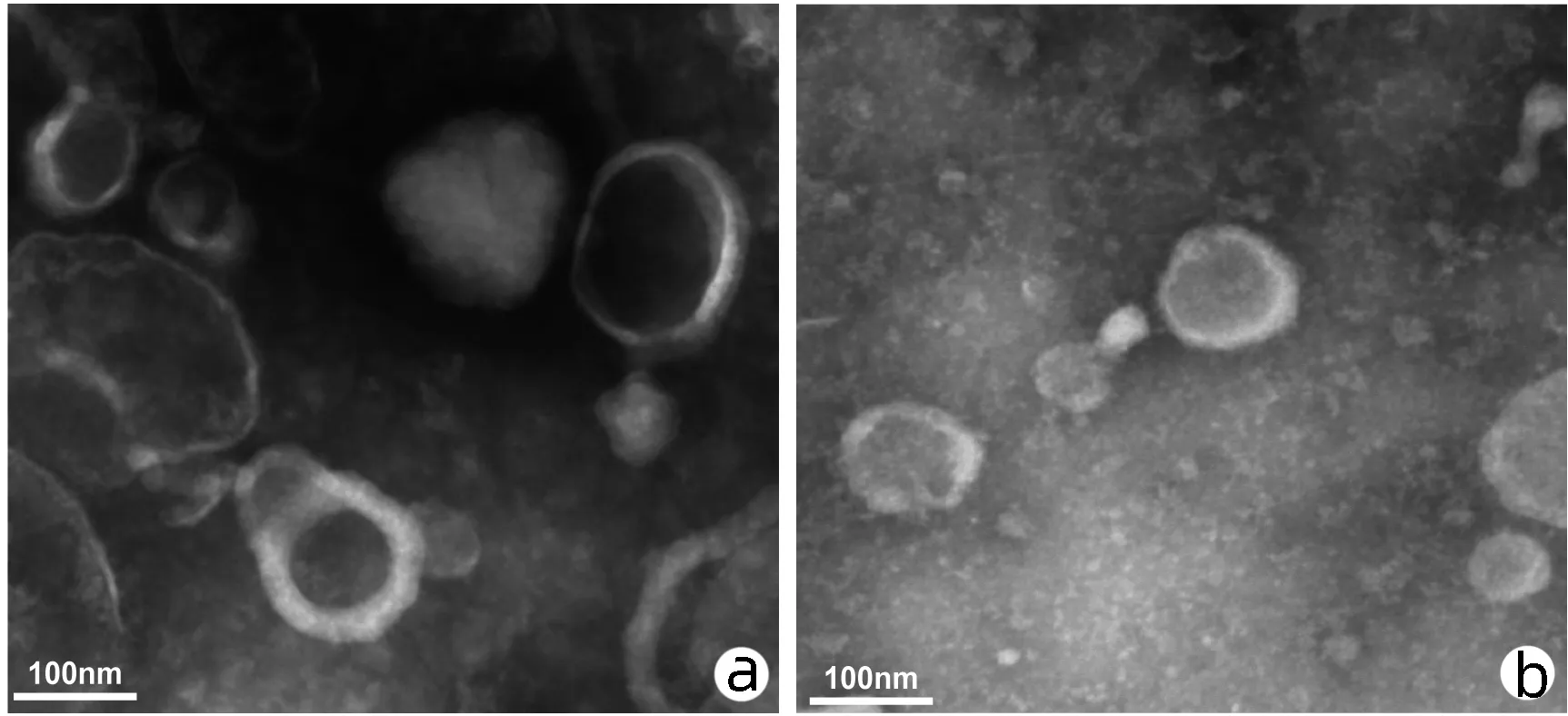
注:a,Hep G2-Exo;b,L02-Exo。
2.1.2 外泌体粒径分布 通过动态光散射粒度仪对外泌体进行粒径大小的检测,超速离心法提取得到的外泌体其粒径大小为(172.65±2.34)nm (图2),该结果符合外泌体的正常粒径大小。
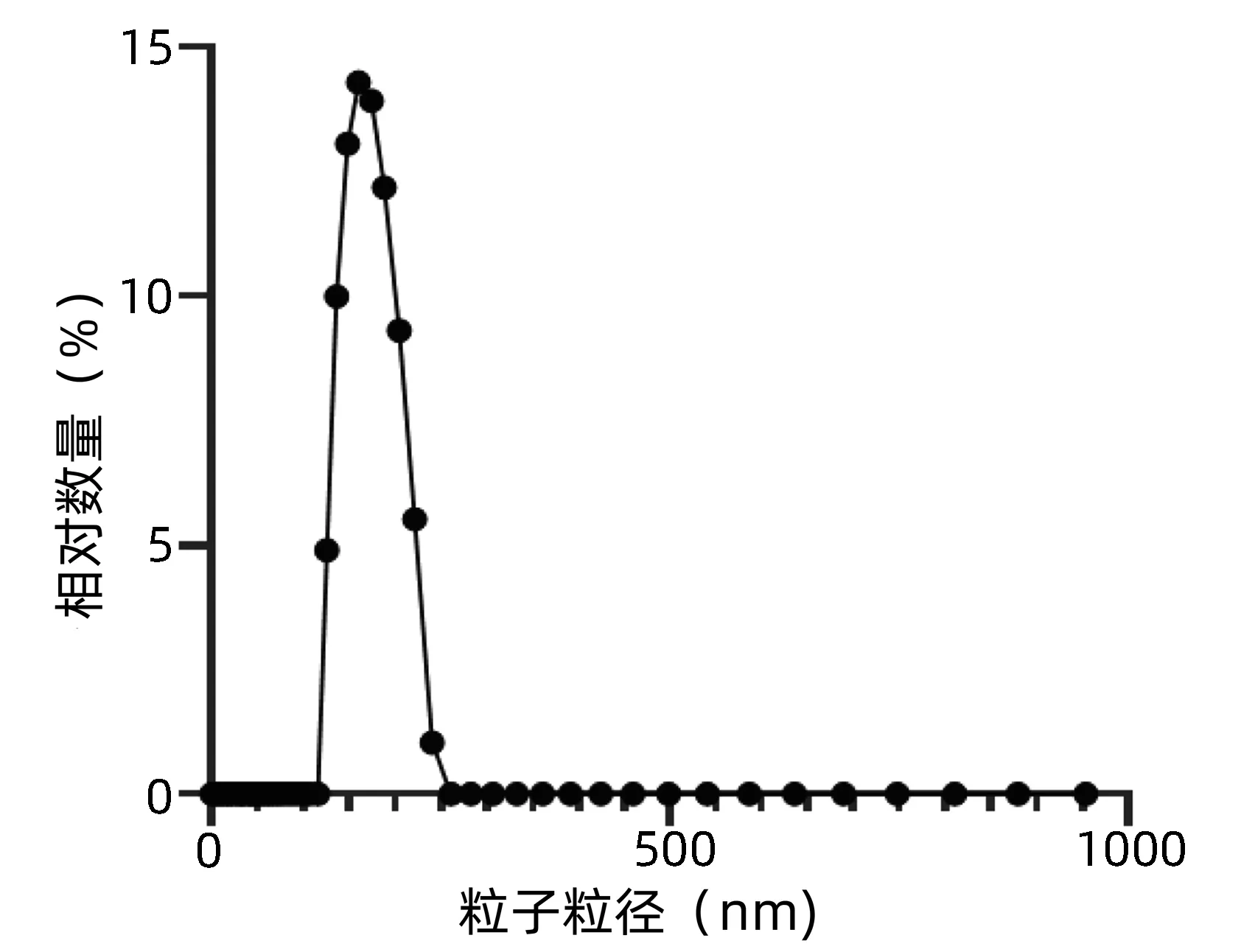
图2 外泌体粒径分布图
2.1.3 外泌体标志蛋白CD63和TSG101表达水平 CD63和TSG101均在所提外泌体中表达,且表达丰度较高,而在超速离心后的上清液中没有检测到表达,说明经提取后上清液已不含外泌体,进一步验证了该方法能从细胞培养上清液中高效提取外泌体(图3)。
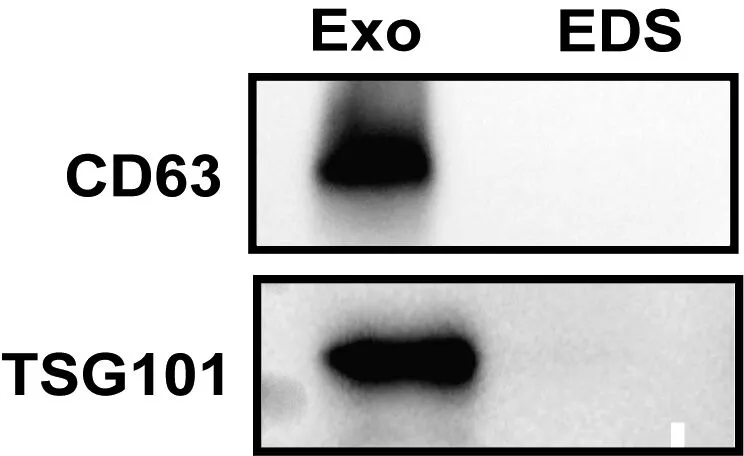
注:EDS,超速离心分离外泌体后的上层液体。
2.2 PMA诱导THP-1细胞的CD68表达水平 通过qRT-PCR检测了PMA诱导THP-1细胞标志物CD68的表达情况。结果显示,相比对照组,经PMA诱导的巨噬细胞中CD68表达水平显著增加(6.67±0.98 vs 1.00±0.25,t=11.20,P<0.001)。
2.3 标志蛋白Arg-1、CD163的表达水平 通过HCC细胞来源的外泌体诱导巨噬细胞模型(M0),并检测M2型巨噬细胞的标志物。结果显示,相比对照组(L02来源外泌体),HCC细胞来源外泌体(低、中、高3种剂量)诱导巨噬细胞M0后,M2型巨噬细胞标志蛋白Arg-1、CD163表达均高于对照组,差异均有统计学意义(P值均<0.05)(图4)。

图4 蛋白免疫印迹法检测M2型巨噬细胞标志蛋白Arg-1、CD163表达
3 讨论
HCC是一种原发性肝脏恶性肿瘤,是目前全球第四大常见的癌症相关死亡原因,发病率不断上升,预后不良。由于现有的治疗方法有限,因此迫切需要开发新的治疗方法。
肿瘤微环境是指肿瘤的发生、生长及转移与肿瘤细胞所处的内外环境,由细胞成分和非细胞成分构成,细胞成分包括肿瘤细胞和免疫细胞、内皮细胞、癌相关成纤维细胞等非肿瘤细胞成分,非细胞成分主要是指细胞外基质以及各种细胞因子[7]。巨噬细胞作为组成肿瘤微环境的主要细胞成分之一,对肿瘤细胞的生长和增殖发挥重要的作用[8]。巨噬细胞可在多种细胞因子的作用下分化成不同亚型[9]。它可以分泌促血管生成因子和各种细胞因子介质,促进肿瘤细胞的生长、侵袭和肿瘤相关的血管生成。
外泌体是由细胞分泌到细胞外环境粒径为30~200 nm的小膜泡[10],首次被Harding和Pan等发现[11-12]。此外,外泌体参与了细胞间的通讯,通过向邻近的细胞或组织转移信号调节微环境和免疫系统,进而参与调节正常或异常的生物过程[13-14]。外泌体不仅能启动目标细胞的下游信号,而且还能将遗传物质转移到下游细胞,为细胞间的交流提供了新的机制[12]。
此前,针对肿瘤治疗和预后评估的思路大多局限在肿瘤细胞本身。近年来,肿瘤微环境尤其是巨噬细胞在肿瘤治疗和预后评估等临床行为中的价值受到了越来越多的关注。现有研究也表明,肿瘤来源的外泌体通过激活巨噬细胞的M2极化而促进肿瘤的发生和发展。Qian等[15]发现,低氧胶质瘤来源的外泌体中的miRNA-1246可以通过STAT3和NF-κB途径靶向TERF2IP,进而诱导M2巨噬细胞的极化。低氧环境下,HCC细胞来源外泌体促进了肿瘤的增殖、迁移和侵袭[16]。Zhao等[17]发现,肿瘤来源的外泌体中的miRNA-934能诱导巨噬细胞M2的极化,促进结直肠癌的肝转移。外泌体与HCC的发生发展有着重要联系,Fang等[18]发现HCC细胞来源的miRNA-1247-3p外泌体靶向作用于B4 GALT3,促进成纤维细胞激活并分泌 IL-6和IL-8等促炎细胞因子,促进癌症的进展和HCC的肺转移。此外,外泌体也具有成为药物载体以及治疗靶点的潜能。Lou等[19]发现间充质干细胞分泌的外泌体可以明显提高HCC细胞对5-氟尿嘧啶的敏感性。因此,研究HCC外泌体对巨噬细胞的影响,有助于阐明HCC发生发展的生物学过程,对HCC的诊断、治疗和预后具有重要意义。
外泌体的提取分离方法有多种,包括超速离心法、超滤法、尺寸排斥色谱法和基于微孔板的磁免疫捕获法,其中超速离心法被认为是外泌体提取的金标准[20]。本研究通过超速离心法提取外泌体,并经由TEM、动态光散射分析仪和蛋白免疫实验进行了外泌体的鉴定。通过上述方法提取的外泌体呈现典型“茶托样”杯形或类圆形囊泡结构;其粒径分布于30~200 nm,符合外泌体的粒径分布标准;免疫印迹结果显示外泌体标志蛋白CD63和TSG101表达阳性,进一步证明了该提取方法科学有效。
在研究外泌体对巨噬细胞极化的影响中,笔者采用PMA诱导THP-1细胞的方法[21]构建巨噬细胞模型(M0),巨噬细胞模型标志物的qRT-PCR分析表明模型诱导成功,将提取的外泌体刺激M0型巨噬细胞,通过免疫印迹分析,发现与L02细胞外泌体对照组(L02-Exo)相比,HCC来源的外泌体诱导的M2型巨噬细胞相关标识蛋白CD163和Arg-1表达显著提高,综合上述证据可以明确HCC外泌体能有效促进巨噬细胞发生M2型极化。以往的研究大多集中于癌细胞来源的外泌体与M2型巨噬细胞之间的串扰,但肿瘤细胞如何激活巨噬细胞发生M2型极化的机制在HCC中仍不清楚。而在本研究中,发现HCC细胞来源的外泌体能够有效促进巨噬细胞M2型极化,可能是HCC发生发展的一种新机制。这不仅加深了对HCC外泌体调节巨噬细胞功能的认识,也揭示了HCC细胞与天然免疫之间复杂的相互作用关系。但是受限于本研究中采用的体外研究方法,仍需要更多的体内实验验证这一作用,以及HCC外泌体中的哪些基因参与巨噬细胞调控,还有待进一步研究。加强对HCC外泌体的基本特征及其对巨噬细胞调节作用的了解,有助于今后更好地阐明HCC的发病机制,为其临床应用奠定理论基础。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:姚涛、徐值红参与课题设计,资料分析,撰写论文;姚纪友、夏雨参与收集数据,修改论文;刘冰、兰天、陆敏强负责课题设计,数据资料分析,指导撰写文章并最后定稿。
