1596例结核分枝杆菌表型药敏检测与快速分子检测结果分析
2022-03-27张亚会潘稚芬王蔚彭草云吕晓东
张亚会 潘稚芬 王蔚 彭草云 吕晓东


[摘要] 目的 比較结核分枝杆菌表型药敏与快速分子检测结果的一致性。方法 回顾性分析2017年1月至2020年12月浙江省嘉兴市第一医院确诊的1750例涂阳肺结核患者痰液、肺泡灌洗液等标本,同时进行结核菌表型药敏及快速分子检测,对两种检测结果的一致性进行比较,并对不一致的原因进行分析。结果 1750例患者按流程操作共检测得到结核分枝杆菌菌株1596例(91.20%),其中1542例利福平(RFP)两种方法检测结果一致(敏感1478例,耐药64例),一致率为96.62%;54例RFP不一致(3.38%)。1520例异烟肼(INH)两种方法检测结果一致(敏感1465例,耐药55例),一致率为95.24%;76例INH不一致(4.76%)。利福平(RFP)ropB基因突变位点分子检测检出率为94.79%(91/96),表型药敏检出率为93.02%(80/86)。异烟肼(INH)katG、inhA基因突变位点分子检测检出率为95.79%(91/95),表型药敏检出率为87.91%(80/91)。分析两种检测结果不一致的原因有检测标本不一致、检测技术局限性、不同突变类型、静默突变、异质性耐药及其他耐药机制。结论 结核分枝杆菌表型药敏与分子检测结果的一致性高,差异无统计学意义,临床上扩大分子药敏作为初始诊断工具,可取得早诊治、早防控的效果;当检测结果不一致时,应及时分析原因,建议有条件的结核病定点医院使用两种检测方法平行检测以提高精准度。
[关键词] 结核分枝杆菌;体外药敏试验;表型药敏;分子检测;一致性分析
[中图分类号] R446.5 [文献标识码] B [文章编号] 1673-9701(2022)05-0138-06
[Abstract] Objective To compare the consistency of phenotypic drug sensitivity and rapid molecular detection results of Mycobacterium tuberculosis. Methods Sputum and bronchoalveolar lavage fluid(BALF) samples from 1750 patients with smear-positive pulmonary tuberculosis diagnosed in the First Hospital of Jiaxing from January 2017 to December 2020 were retrospectively analyzed. Tuberculosis phenotypic drug sensitivity and rapid molecular detection were performed simultaneously. The consistency of the two detection results was compared. And the causes of inconsistency were analyzed. Results A total of 1596 cases (91.20%) of Mycobacterium tuberculosis strains were detected in 1750 patients according to the process, of which 1542 cases had consistent detection results in rifampicin (RFP) between the two methods (1478 sensitive and 64 resistant), with a concordance rate of 96.62%. Fifty-four cases RFP had inconsistent results (3.38%). The detection results of isoniazid(INH) in 1520 cases were consistent between the two methods (1465 sensitive and 55 resistant), with a concordance rate of 95.24%. Seventy-six cases INH were inconsistent (4.76%). The detection rate of the rifampicin (RFP) ropB gene mutation site was 94.79% (91/96), and the detection rate of phenotypic drug sensitivity was 93.02% (80/86). The detection rate of isoniazid (INH) katG and inhA gene mutation sites was 95.79% (91/95) and the detection rate of phenotypic drug sensitivity was 87.91% (80/91). The reasons for inconsistency between the two test results were as follows: inconsistency of test samples, limitation of detection technology, different mutation types, silent mutation, heterogeneous drug resistance, and other drug resistance mechanisms. Conclusion The consistency of phenotypic drug sensitivity and molecular detection results of Mycobacterium tuberculosis is high, and the difference is not significant. Expanding molecular drug sensitivity as an initial diagnostic tool in clinical practice can achieve the effect of early diagnosis and early treatment prevention and control. When the detection results are inconsistent, the causes should be analyzed in time, and it is recommended that conditional tuberculosis designated hospitals use parallel detection with two detection methods to improve the accuracy.
[Key words] Mycobacterium tuberculosis; In vitro drug sensitivity test; Phenotypic drug sensitivity; Molecular detection; Consistency analysis
结核病是由结核分枝杆菌(mycobacterium tuberculosis,M.tb)引起的呼吸道传染性疾病[1]。耐多药结核病[2](multidrug-resistant tuberculosis,MDR-TB)的流行是结核发病率居高不下的重要原因[3],也是世界性的公共卫生问题[4]。耐药结核病的诊断主要依靠体外药物敏感性试验(drug susceptibility testing,DST)。根据WHO指南[5],耐多药/利福平耐药结核病(rifampicin resistant tuberculosis,MDR/RR-TB)的发现首先需要细菌学确认,进一步行快速分子检测、痰培养或基因测序检测结核菌耐药情况[6]。因此,正确判读快速分子检测与表型药敏检测结果,选择精准方案及疗程具有十分重要的意义。本研究收集2017年1月至2020年12月浙江省嘉兴市第一医院临床诊断为结核病患者的痰液、肺泡灌洗液等标本1750份,行快速分子检测[7]及表型药敏试验[8],现报道如下。
1 材料与方法
1.1 病例及菌株来源
入选病例菌株均来自2017年1月至2020年12月浙江省嘉兴市第一医院结核门诊及住院的涂阳肺结核患者痰液、肺泡灌洗液标本,行快速分子检测(Xpert MTB/RIF、基因芯片)及结核菌培养(罗氏固体培养及液体BACTEC MGIT960培养)并进行药敏试验,共计1750例。
1.2 方法
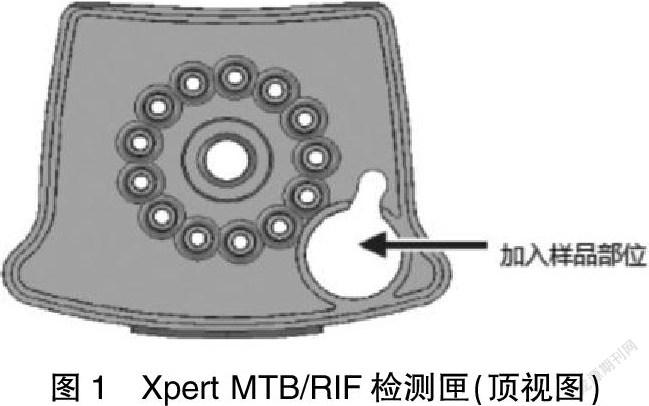
1.2.1 Xpert MTB/RIF检测系统 痰样本前处理。收集1~4 ml痰液样本置于一次性的防漏容器中,在Xpert MTB/RIF检测匣侧壁标记样本序号(ID)。打开装有痰液样本的容器,加入痰液样本2倍体积的样本试剂(sample reagent,SR)。盖上盖子,剧烈摇动10~20次或涡旋震荡至少10 s。将混合好的样本在20~30℃孵育15 min。在孵育进行到5~10 min时,再次剧烈摇动装有痰液样本的容器10~20次或涡旋震荡至少10 s。视样本性状,将1~2倍体积的4%氢氧化钠(NaOH)加入前处理管中,旋紧处理管的螺旋盖,在涡旋振荡器上振荡1 min左右直至痰样本充分液化,将前处理管置于生物安全柜内,室温静置15 min;将45 ml磷酸缓冲盐溶液(phosphoric acid buffer salt solution,PBS)加入液化好的痰液中,旋紧螺旋盖,将前处理管在3000 r/min离心20 min;去上清,加入2 ml PBS。将样品加入检测匣后,打开检测匣的盖子,将处理后的样品由检测匣的加样孔缓慢加入。见图1。关闭检测匣的盖子,开始检测,GeneXpert Dx软件自动读取信息进行自动检测。
1.2.2 基因芯片检测系统 采用DNA 微阵列芯片法进行菌种鉴定,使用博奥生物分枝杆菌菌种鉴定试剂盒,具体步骤如下。①从固体培养基上挑取菌落于含核酸提取液的核酸提取管中;液体培养基内吸取≥1个麦氏浊度的菌悬液10~20 μl于含核酸提取液的核酸提取管中;使用Extractor 36核酸快速提取仪振荡5 min,95℃水浴5 min,5000 r/mim离心1 min,得到的核酸放置-20℃暂存。②在标本制备区内进行PCR扩增反应、芯片杂交、芯片的洗涤与干燥等步骤,甩干后扫描。③使用晶芯微阵列芯片扫描仪LuxScan10K-B和相应软件进行信号的读取及结果判读。阳性判断值:对于IC(分枝杆菌属)探针和结核分枝杆菌探针通过ROC方法确定其阳性判断值。对于其他16种非结核分枝杆菌检测探针均通过百分位数法确定其阳性判断值。当探针信号值大于或等于该探针的阳性判断值,则该探针判读为阳性;当探针信号值小于该探针的阳性判断值,则该探针判读为阴性。试剂盒中各探针的阳性判断值已整合到相应判读软件中,由软件自动对样品检测结果进行判别。
1.2.3 临床结核分枝杆菌的培养及体外药敏试验 (1)结核分枝杆菌固体培养。①前处理方法:痰液中加2~4倍量2%NaOH,振荡器振荡5~10 min,或置室温30 min、其间振荡2~3次,使痰液化。取前处理液化后痰液0.1 ml,无菌操作接种于培养基斜面上,每份标本同时接种两支酸性改良罗氏培养基,置37℃孵育。对培养阳性的菌株进行分枝杆菌菌群鉴定,在试剂瓶中加入对硝基苯甲酸(PNB)和噻吩二羧酸肼(TCH)试剂,观察菌株生长指数,如继续生长为非结核分枝杆菌,如生长受到抑制则为结核分枝杆菌。②药物敏感性检测:选择4种常用的一线抗结核药物(异烟肼、利福平、链霉素、乙胺丁醇)进行体外药物敏感试验,抗结核药物浓度分别为异烟肼0.1 mg/L、利福平1.0 mg/L、链霉素1.0 mg/L、乙胺丁醇5.0 mg/L,采用WHO/国际防痨与肺部疾病联合会《耐药检测指南》推荐的比例法[9]。(2)结核分枝杆菌960液体培养。①培养管准备:MGIT营养添加剂(0.5%甘油,0.5%牛血清白蛋白,0.2%葡萄糖,140 mmol/L NaCl,OADC)为15 ml液体试剂,可直接使用,在每一根培养管中加入800 μl MGIT营养添加剂备用。②样本准备:挑取1~2 ml脓性痰液部分至标记的50 ml离心试管中;加等量的2% N-乙酰半胱氨酸-氢氧化钠-枸橼酸钠前处理液;漩涡震荡20 s;静置15 min;加无菌PBS(pH= 6.8)至约50 ml,盖紧盖子;离心3000 r/min,15 min;倒掉上清液;添加1~3 ml PBS以中和pH值至6.8。③样本接种:将上述预处理好的样本接种500 μl至MGIT培养管中。④MGIT培養管装载至BACTECMGIT 960 System全自动分枝杆菌检测/药敏系统孵育培养。
1.3 统计学方法
采用SPSS 13.0统计学软件进行数据处理,计数资料以[n(%)]表示,组间比较采用χ2检验(或Mc Nem),P<0.05为差异有统计学意义。通过Kappa检验分析两种方法一致性(Kappa>0.75,一致性较好;0.40~0.75,一致性一般;<0.40,一致性较差)。
2 结果
2.1 分子DST检测与表型DST药敏检测结果分析
2.1.1 两种检测方法耐药性检测结果一致率 1750例标本按流程操作共检测到结核分枝杆菌菌株1596例,阳性率为91.20%,非结核分枝杆菌(NTM)154例(8.80%)。其中快速分子DST检测出利福平(RFP)耐药菌株98例,耐药率为6.14%(98/1596),表型DST藥敏检测出利福平(RFP)耐药菌株88例,耐药率为5.51%(88/1596);两种方法均检出利福平(RFP)敏感1478例,均耐药64例,共1542例利福平(RFP)检测结果一致,一致率为96.62%。快速分子DST检测出异烟肼(INH)耐药95例,耐药率为5.95%(95/1596),表型DST药敏检测出异烟肼(INH)91例,耐药率为5.70%(91/1596),两种方法异烟肼(INH)均敏感1465例,均耐药55例,共1520例异烟肼(INH)分子DST检测与表型DST药敏检测结果一致,一致率为95.24%。见表1。两种方法共检测出耐多药肺结核(MDR-TB)患者34例,耐多药率为2.13%(34/1596)。
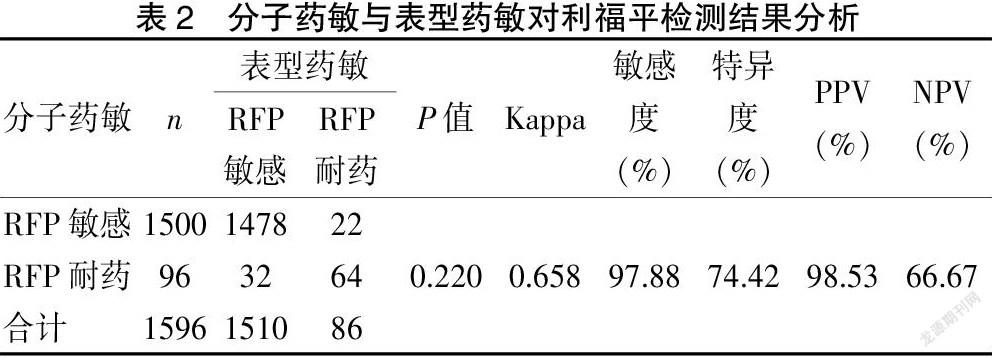
2.1.2 分子检测与表型药敏对利福平检测结果分析 54例患者利福平(RFP)分子DST检测与表型DST药敏结果不同,分子DST检测利福平(RFP)耐药而表型DST敏感32例;分子DST检测利福平(RFP)敏感而表型DST耐药22例,不一致率为3.38%;利福平分子检测结果敏感度为97.88%,特异度为74.42%。见表2。
2.1.3 分子检测与表型药敏对异烟肼检测结果分析 76例患者异烟肼(INH)分子DST检测与表型DST药敏结果不同,分子DST检测异烟肼(INH)耐药而表型DST敏感40例,分子DST检测敏感而表型DST耐药36例,不一致率为4.76%。分子检测对异烟肼检测结果敏感度为97.34%,特异度为60.44%。见表3。
2.2 分子检测基因突变位点与表型药敏检测结果分析
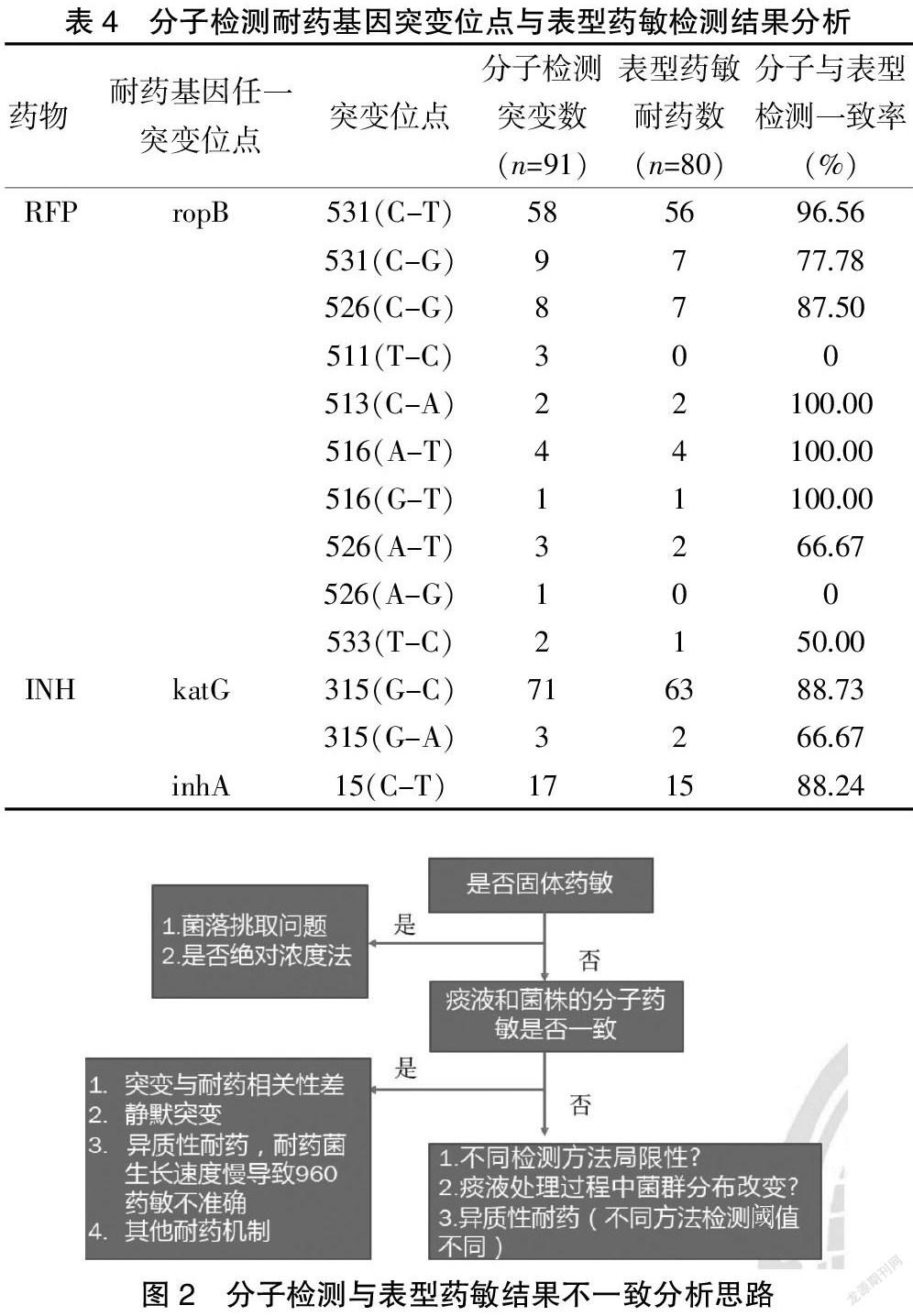
利福平(RFP)耐药检测中,快速分子DST检测ropB基因突变检出率为94.79%(91/96),表型DST药敏利福平耐药检出率为93.02%(80/86),其中位点531(C-T)、513(C-A)、516(A-T)、516(G-T)突变位点的检出一致率高(96.56%~100.00%);而526(A-G)、511(T-C)位点分子检测出阳性,表型DST药敏检测未显示;533(T-C)、531(C-G)、526(A-T)位点的一致符合率为50.00%、77.78%、66.67%;利福平(RFP)突变位点分子与表型DST药敏一致率为87.91%(80/91)。
异烟肼(INH)检测中,快速分子DST检测katG、inhA基因突变位点的检出率为95.79%(91/95);表型药敏DST异烟肼耐药检出率为87.91%(80/91);其中katG315(G-C)、inhA15(C-T)位点的一致率较高,分别为88.73%、88.24%,但仍然发现尚有10例不一致;katG 315(G-A)有1例分子与表型DST药敏结果不一致。见表4。初始分子检测与表型药敏结果不一致分析思路见图2。
3 讨论
2020年全球结核病报告显示,2019年,全球有近50万人罹患利福平耐药(RR-TB)结核病,其中78%患有耐多药(MDR-TB)。随着分子诊断技术的临床应用,2019年发现并登记MDR/RR-TB患者较2018年增加了10%,但其治疗成功率仅为57%[5]。因此,提高细菌学确诊的结核病患者比例,扩大细菌学确诊的结核病患者耐药检测比例,提高治愈率,是遏制耐药结核病传播的重要措施。
Xpert MTB/RIF检测系统是以实时荧光定量PCR技术为基础,ropB基因为靶基因,检测周期仅2 h,是目前WHO推荐的RFP耐药的检测方法[11]。本研究结果显示,快速分子检测ropB基因突变检出率为94.79%(91/96),与李妍等[12]研究痰标本中Xpert MTB/RIF敏感度高达97.5%、特异度为95%~99%相一致。
基因芯片技术是将MTB的DNA扩增产物与固定在芯片上的探针杂交、扫描芯片及判读结果,现已广泛应用于临床耐药性的检测及基因组的比较分析。杨映晖等[13]研究显示,基因芯片检测MDR-TB的敏感度与特异度分别为64.62%和97.75%。本研究结果显示,异烟肼(INH)快速分子检测中,katG、inhA基因突变位点的检出率为95.79%(91/95),与相关文献研究结果一致[14]。
本研究通过对2017年1月至2020年12月确诊的1750例涂阳肺结核患者呼吸道标本中检测到的1596例结核分枝杆菌菌株结果进行分析,快速分子DST检测技术与表型DST药敏检测的利福平、异烟肼一致率分别达96.62%、95.24%,差异无统计学意义(P>0.05)。提示在临床上可通过扩大分子检测技术作为初始诊断工具,将所有肺结核患者的初次痰标本、肺泡灌洗液等呼吸道标本纳入分子检测初始诊断范围,加大在基层医院的推广应用,才能确保所有诊断为耐药(MR-TB)、耐多药(MDR/RR-TB)的患者早期纳入治疗,改变耐药结核纳入治疗率低的现状。2019年全球纳入治疗的患者比例仅占估算MDR/RR-TB患者数的38%[15]。研究发现,嘉兴市的耐多药率仅为2.13%,低于浙江省耐多药结核发病率[10],证实了嘉兴市扩大分子初始检测策略遏制耐药结核传播的有效性。
本研究结果还显示,虽是同一标本平行检测,也存在着分子检测与表型药敏检测结果不一致的现象,尚有54例利福平(3.38%),76例异烟肼(4.76%)检测结果不一致,给临床个体治疗方案的选择带来困惑,也是现阶段耐药结核治愈率低的因素之一。WHO报告显示,2019年全球耐药结核病治疗成功率仅为57%[5]。因此,需认真查找分子DST检测与表型DST药敏检测结果不一致的原因,及时分析,调整每一例耐药结核患者的治疗方案,尽早尽快实施个体化精准诊疗策略,才能提升治愈率。
本研究涉及到的54例利福平,76例异烟肼患者,针对两种检测结果不一致的原因分析如下:①检测标本是否一致。仔细查找发现2例患者分子检测与表型培养的标本不是同一个检测标本;1例患者标本因条形码扫码差错而出现偏差,予重新留取痰标本进行平行检测。②检测技術的局限性。Xpert MTB/RIF、基因芯片快速分子检测可检测到结核分枝杆菌的核酸,但无法区别活菌还是死菌;本研究发现其中1例分子检测敏感,表型药敏显示耐药,原因是操作过程中标本处理不充分,氢氧化钠时间过长,消化过程中发生了结核分枝杆菌核酸(RNA)降解。1例肺泡灌洗液Xpert MTB/RIF检测阳性,表型培养阴性,查找原因发现支气管镜检查消毒清洗不彻底有死菌残留存在,而Xpert MTB/RIF检测DNA敏感度高所致。另外,还需分析在检测过程中是否存在分子检测系统的故障、温度的错误、试剂盒储存不合理等因素。表型固体培养存在绝对浓度法偏差较大、选取菌落时操作不当等因素。液体960自动培养时吡嗪酰胺(PZA)药敏菌株过量,在代谢过程产生大量氨类物质,从而使整个液体培养环境的pH值升高,导致PZA失去杀菌能力而造成假阳性结果。可能导致其药敏试验结果重复性差,造成PZA分子与表型药敏结果不一致。③不同突变类型与耐药相关性。从突变位点分析,发现1例快速分子检测利福平(RFP)基因ropB位点526(A-G)突变、3例利福平(RFP)511(T-C)位点分子检测阳性,而表型药敏检测并不耐药;1例利福平(RFP)基因533(T-C)、2例531(C-G)、1例526(A-T)位点突变不一致,提示基因突变位点不同,与表型药敏试验的相关性也是不同的。郭晶等[16]研究显示,基因突变在不同年龄组人群中存在一定的差异。个别突变位点还应当结合临床治疗情况进行观察与分析,不同突变位点应当结合患者的药敏试验结果与整体治疗情况进行个体化治疗。④静默突变。沉默子突变只是改变核苷酸位点而不改变编码蛋白质性质,此时Xpert MTB/RIF检测结果表现为利福平假阳性,表型培养药敏敏感;这些Xpert MTB/RIF检测假阳性患者给予一线抗结核药物仍然有成功治愈的可能,临床需谨慎甄别。⑤异质性耐药。异质性耐药[17]是指在临床同一类患者体内分离出结核分枝杆菌样本中同时存在敏感和耐药菌株,敏感和耐药菌株共同感染或敏感株部分亚群发生耐药突变所致。当存在异质性耐药的MTB中耐药亚群比例高于分子检测的敏感度时,临床检测出并判断为耐药;当耐药亚群比例低于分子检测敏感度时,就会判读为敏感,导致部分MTB的分子检测与表型耐药检测结果不一致。本研究结果显示,有22例快速分子检测利福平(RFP)敏感,表型药敏检测耐药,分子检测假敏感可能与异质性耐药有关。分子检测需达到≥20%以上的耐药亚群时才能检测出,而表型药敏可检测出1%的耐药菌株。异质性耐药反映了MTB群体从部分耐药向全体耐药转变的中间过程[18]。⑥基因突变以外的其他耐药机制引起的MTB耐药。另外2例异烟肼(INH)、利福平(RFP)分子检测敏感但表型药敏耐药不一致的原因不明,可能存在药物外排泵、MTB细胞壁增厚难以穿透、抗结核药物失活等由基因突变以外的其他耐药机制所致[19]。
综上所述,分子DST检测及表型DST药敏诊断技术的应用,给“终结结核病策略”[20]提供了诊断工具,给临床耐药结核病的治疗带来了诊断“金标准”。建议在有条件的定点医院结核病实验室可使用两种检测方法平行检测以提高精准度;当临床检测中发现初始分子检测与表型药敏结果不一致时,应认真分析原因、及时调整治疗方案、实施个体化精准诊疗策略,提高耐药结核患者的治愈率。
[参考文献]
[1] 唐神结,高文,陈昶,等.临床结核病学[M].北京:人民卫生出版社,2011:3-4.
[2] 唐神结,许绍发,李亮.耐药结核病学[M].北京:人民卫生出版社,2014:62-65.
[3] 任坦坦,陆普选,邓国防,等.2020WHO全球结核报告:全球与中国关键数据分析[J].新发传染病电子杂志,2020, 5(4):280-284.
[4] 高静韬,刘宇红.2020年世界卫生组织全球结核病报告要点解读[J].河北医科大学学报,2021,42(1):1-6.
[5] Global tuberculosis report 2020.Geneva:World Health Organization;2020(https://www.who.int/tb/ publications/global_report/en/,accessed 15 October 2020).
[6] Global tuberculosis report 2019.Geneva:World Health Organization;2019(https://www.who.int/tb/ publications/global_report/en/,accessed 29 July 2020).
[7] 中华人民共和国国家卫生和计划生育委员会.肺结核诊断标准(WS 288—2017)[J].新发传染病电子杂志,2018,3(1):59-61.
[8] 郭海萍,逄宇.全面落实肺结核诊断国家行业标准提高分子技术诊断耐药结核病能力[J].结核与肺部疾病杂志,2020,1(2):103-105.
[9] 赵雁林,王黎霞,成诗明,等.结核分枝杆菌药物敏感性实验标准化操作程序及质量保证手册[M].北京:人民卫生出版社,2013:140.
[10] 柳正卫,何海波,王晓萌,等.浙江省第三次结核病耐药性监测结果分析[J].中华预防医学杂志,2011,45(2):171-173.
[11] Wang G,Wang S,Yang X,et al.Accuracy of Xpert MTB/RIF Ultra for the diagnosis of pleural TB in a multicenter cohort study[J].Chest,2020,157(2):268-275.
[12] 李妍,张天华,鲜小萍,等.Xpert MTB/RIF检测技术诊断肺结核和肺外结核的价值[J].中国防痨杂志,2015, 37(6):586-589.
[13] 杨映晖,伍定辉,苏伟明,等.基因芯片法在结核分枝杆菌耐药基因快速诊断中的应用价值[J].中国防痨杂志,2020,42(11):60-64.
[14] 孙正松,曾方林,戴洁,等.基因芯片检测结核分枝杆菌耐药基因效能分析[J].国际检验医学杂志,2018,39(22):57-59.
[15] 罗一婷,翁榕星,周芳,等.2019WHO全球结核报告:全球与中国关键数据分析[J].新发传染病电子杂志,2020, 5(1):47-50.
[16] 郭晶,曾谊,林霏申,等.结核分枝杆菌表型及基因型一致性与患者预后的相关性研究[J].国际呼吸杂志,2018, 38(20):1574.
[17] 何容芳,唐仕萍,谢鑫,等.耐多药结核病发生危险因素的Meta分析[J].四川医学,2020,41(3):245-251.
[18] 袁陽.结核分枝杆菌异质性耐药的检测及其临床意义[D].遵义:遵义医学院,2018.
[19] 宋婧,车南颖.结核分枝杆菌耐药机制和检测方法的研究进展[J].中国医药导报,2018,15(29):29-34.
[20] 刘健雄,钟球."终止结核病"面临的挑战与应对策略[J].中国防痨杂志,2020,42(4):14-16.
(收稿日期:2021-03-18)
