转录组和iTRAQ技术联合揭示玉米根系的耐旱机制
2022-03-26白明兴庄泽龙姬祥卓彭云玲
白明兴,庄泽龙,姬祥卓,彭云玲
(甘肃农业大学农学院,甘肃省干旱生境作物学重点实验室/甘肃省作物遗传改良与种质创新重点实验室, 甘肃 兰州 730070)
干旱作为全球最重要的非生物胁迫之一,极大地影响了作物的生长发育和产量。玉米作为我国主要的粮饲兼用作物,是典型的干旱敏感作物,各生育期需水量较大[1-3]。研究表明,干旱缺水不仅严重影响玉米的生长发育,造成玉米大幅减产,而且会阻碍玉米叶片对CO2的吸收,进而影响其光合性能[4-5]。此外,干旱胁迫会导致植物体内活性氧(ROS)不断积累,ROS在植物生长发育中有着十分重要的作用,正常条件下主要参与调节植物的生长发育,维持动态平衡状态[6];当遭受非生物胁迫时,植物体内的ROS快速积累,多余的ROS不能及时清除,动态平衡遭到破坏,从而影响植物的发育[7]。活性氧是氧分子没有完全还原的产物,其毒性很强,在非生物胁迫下,它不仅可以破坏细胞的结构和功能,而且是信号转导的重要调节因子[8]。由于ROS具有极高的氧化活性,植物体内蛋白质、磷脂和核酸很容易被氧化,造成细胞中蛋白质降解和核酸裂解,以及磷脂过氧化产生丙二醛,破坏细胞膜结构[9]。且大量研究也表明,ROS 作为信号分子在植物细胞防御响应和细胞程序性死亡等方面扮演着极其重要的角色[10]。当植物遭受轻度干旱胁迫时,会导致植物体内活性氧清除启动一系列复杂的清除反应[11],促使超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等酶活力提高,保护植物免受环境胁迫的危害。根系作为植物吸收和运输土壤中水分及养料的主要器官,在遭遇非生物胁迫时,根系一般最先感受到逆境胁迫,从而改变根系的形态以及分布以适应不利环境。因此,深入剖析玉米苗期根系对干旱胁迫的分子基础及响应机制,对改善干旱和半干旱地区作物的早期生长状况及促进全球粮食生产安全有着极其重要的作用[12]。
近年来,随着全基因组测序的快速发展,不同学者在研究植物抗逆性方面也逐渐采用转录组和蛋白质组学技术来揭示逆境胁迫中植物的生理、生化和分析响应机制,从而挖掘大量与抗逆相关的基因。ZENDA等[13]为了揭示不同玉米自交系对干旱胁迫的耐受性,采用耐旱自交系YE8112和干旱敏感自交系MO17进行比较转录组分析,通过分析获得了一些耐旱基因和调控干旱胁迫的主要途径,阐述了不同玉米自交系对干旱胁迫的响应机制,并依据目前研究构建了玉米幼苗抗旱的分子模型。LIU等[14]通过对两个杂交品种(耐旱ND476和旱敏ZX978)在干旱胁迫下进行转录组分析发现,玉米对干旱胁迫的适应是一种品种特异性的反应,也是一种阶段性的反应过程,并且该研究也挖掘了一些调控玉米干旱胁迫反应的品种特异性基因和生育期特异性基因。CHEN等[15]通过对两份耐盐性不同的玉米自交系根系进行蛋白质组学分析发现,当遭遇盐胁迫时,不同耐盐性自交系差异表达蛋白(DEPs)间虽存在明显差异,但是不同自交系间对盐胁迫的响应也存在一些相同的趋势。JIANG等[16]利用iTRAQ(Isobaric tags for relative and absolute quantification)技术发现玉米幼苗在干旱胁迫下存在多重转录后调控和翻译后修饰,并提出在干旱胁迫下玉米幼苗会通过提高其抗旱性来应对干旱的策略。ZHENG等[17]采用耐旱材料28M和旱敏感材料753F从基因调控水平揭示了287M抗旱性的机制,表明287M和753F的抗旱性差异可能与清除ROS能力、信号相互作用网络和某些转录因子有关。HAO等[18]利用RNA测序技术对耐旱性不同的两自交系根系干旱相关基因进行全基因组鉴定和比较分析,并表明玉米的抗旱性与ABA信号通路、海藻糖生物合成、活性氧清除和转录因子相关基因的表达模式有关。以上研究试图从某一组学水平去解析一些生物学现象,不能深入剖析其响应机理。例如,转录组只能关注一些关键编码转录本的表达量变化,而不能了解其转录调控以及对蛋白翻译的影响。因此,利用多组学联合分析剖析一些生物学问题十分必要。转录组和蛋白质组学可以从两个不同层面反映基因的表达情况,所以要了解转录组与蛋白质组的相互调控作用,需要对mRNA 与蛋白质的表达进行同步监测。关联分析的目的之一是实现数据互补,得到生物体更加完整的表达信息。
因此,为了进一步剖析玉米幼苗对干旱胁迫的响应机制,本研究以耐旱自交系昌7-2和干旱敏感自交系TS141的苗期根系为试验材料,结合转录组测序和iTRAQ技术探究不同玉米自交系对干旱的响应机制并筛选一些耐旱候选基因,为进一步了解玉米耐旱的分子机制提供新的思路。
1 材料与方法
1.1 材料处理
用耐旱自交系昌7-2(Chang 7-2)和干旱敏感自交系TS141为试材,对两自交系分别进行蒸馏水(CK)和20%PEG(D)处理。挑选整齐、一致的种子用0.5%NaClO表面灭菌10 min并用无菌蒸馏水洗涤5次。将种子浸泡在处理溶液中24 h后点播在营养钵(15 cm×13 cm)中,消毒蛭石(溶液∶蛭石=1∶5 v·m-1)用与各处理相同的处理溶液搅拌均匀,每钵10粒,试验设置3次重复。将材料置于人工气候箱,昼夜温度分别为25℃、20℃,光照和黑暗时间分别为16、8 h,光照强度为600 μmol·s-1·m-2。对相应材料每隔1 d加入50 mL蒸馏水,每3 d施加50 mL对应处理液,处理12 d后收集根系样品进行转录组测序和蛋白质组学测序。
1.2 转录组测序和蛋白质组测序分析
转录组测序参照CHEN等[19]的方法,对两不同玉米自交系处理后12 d的幼苗根系进行总RNA提取,并进行转录组测序。测序所获得的原始读段(Raw reads)进行过滤,得到干净读段(Clean reads),后续分析都基于Clean reads,并采用HISAT和RSEM软件以第三版B73玉米参考基因组对Clean reads进行比对(Version ZmB73_5a.59)(http://ftp.maizesequence.org/)和基因表达水平检测。通过RPKM计算12个样品的基因表达(每百万Kbp读数)方法,其测序的数据已提交到NCBI的SRA(登录号:PRJNA698088)。为了提高DEG数据的准确性,差异基因筛选标准采用|log2FC(Fold change)|≥1且FDR≤0.001。而蛋白质组测序的具体方法及相关数据来自ZENG等[20]。采用WEGO软件[21]对筛选出的DEGs在GO数据库中的功能注释进行分类。通路显著性富集分析基于KEGG(Kyoto encyclopedia of genes and genomes)公共数据库(http:/iwww.genome.jp/kegg/pathway.html)进行,对显著富集的通路进行鉴定。其中把Q value≤0.05的Pathway定义为在DEGs中显著富集的Pathway。
1.3 关联分析
干旱胁迫下,利用LAN等[22]的方法计算了昌7-2和TS141蛋白质水平与转录水平的Pearson相关系数,确定蛋白质与mRNA的相关性,并对每个品种关联了两个生物学重复,其中Chang 7-2 D1vsCK1比较组表示耐旱自交系昌7-2转录组和蛋白组第一个生物学重复所关联的结果,Chang 7-2 D2vsCK2比较组表示耐旱自交系昌7-2转录组和蛋白组第二个生物学重复所关联的结果;而TS141 D1vsCK1和TS141 D2vsCK2比较组分别表示旱敏感自交系TS141中两个重复的关联结果。
1.4 qRT-PCR(Quantitative real time-PCR)验证
采用RNA提取试剂盒获取两自交系不同处理下幼苗根系的总RNA,随后利用FastKing RT Kit(天根生物技术,北京,中国)对提取的总RNA反转录为cDNA,备用。利用NCBI(https://www.ncbi.nlm.nih.gov/)官网进行引物设计,本试验根据不同基因的表达量共设计了9个基因的特异性PCR引物对转录组数据和蛋白数据进行验证,实时荧光定量(qRT-PCR)分析的具体方法参考CHEN等[19],所选基因的相对表达水平通过2-ΔΔCT方法计算,并以Actin基因的表达水平进行归一化,每个处理使用3个生物重复。
2 结果与分析
2.1 转录组和蛋白质组数据分析
2.1.1 转录组测序分析 采用BGISEQ-500测序平台对两份玉米自交系根系样品进行RNA-Seq测序。结果表明测序样品平均产生116025890.2条Raw reads,经过剔除低质量的Reads后, 每个样品平均得到107905100.5条高质量的Clean reads。采用HISAT软件将获得的Clean reads与玉米参考基因组B73(http://ftp.maizesequence.org/)进行比对,结果表明不同样品在参考基因组中的平均比对率约68.77%。此外,以|log2Ratio(FC, Fold Change)|≥1,Pvalue≤0.001作为两样品间差异表达基因(DEGs)的筛选条件对不同样品间进行差异表达基因筛选,结果表明,在昌7-2中鉴定出7483个DEGs,其中3162个DEGs上调表达,4321个DEGs下调表达;在TS141中鉴定出6829个DEGs,其中3290个DEGs上调表达,3539个DEGs下调表达(图1)。
2.1.2 蛋白质组数据分析 采用iTRAQ技术对抗旱性不同的两自交系幼苗根系进行蛋白质组学分析,结果共产生了97374张光谱、39371个肽以及30148个独特的肽,最终鉴定到7723个蛋白质。当蛋白质丰度比达到0.83倍以下或1.2倍以上,且P<0.05时,认为该蛋白是两个不同样品间的差异表达蛋白(DEPs)。结果表明,在Chang 7-2-DvsCK中鉴定出1243个DEPs,其中572个DEPs上调表达,671个DEPs下调表达;TS141-DvsCK中鉴定出419个DEPs,其中172个DEPs上调表达,247个DEPs下调表达(图1)。

图1 干旱处理下两玉米自交系的DEGs和DEPs
2.2 转录组和蛋白质组学关联性分析
2.2.1 转录组和蛋白质组差异表达基因与差异表达蛋白的关联分析 对转录组和蛋白质组数据进行关联分析,当某一个蛋白质在转录组水平有表达量时,被认为关联到。关联结果表明(表1),在鉴定、定量和显著差异表达3个方面,Chang 7-2 D1vsCK1中7612个基因在mRNA和蛋白质水平被同时鉴定,并定量到7609个基因,有157个DEGs 同DEPs关联。Chang 7-2 D2vsCK2中7621个基因在mRNA和蛋白质水平被同时鉴定,并定量到7619个基因,有98个DEGs 同DEPs关联。TS141 D1vsCK1中7609个基因在mRNA和蛋白质水平被同时鉴定,并定量到7606个基因,有76个DEGs 同DEPs关联。TS141 D2vsCK2中7619个基因在mRNA和蛋白质水平被同时鉴定,并定量到7616个基因,有116个DEGs 同DEPs关联。

表1 鉴定、定量和显著差异中被关联的基因和蛋白质数量
2.2.2 转录组和蛋白质组相关性分析 基于mRNA水平和蛋白质水平的表达结果,使关联到的基因在mRNA表达水平和蛋白质水平上存在多种类型,即mRNA和蛋白表达趋势相同、mRNA和蛋白表达趋势相反、mRNA表达有差异而蛋白表达无差异、mRNA表达无差异而蛋白表达有差异以及mRNA和蛋白表达均无差异5种关联类型。本研究发现,Chang 7-2 D1vsCK1、Chang 7-2 D2vsCK2、TS141 D1vsCK1和TS141 D2vsCK2等4个比较组中所关联到DEGs和DEPs的相关性系数分别为0.3063、0.2208、0.2295和-0.0203(图2)。其中,mRNA和蛋白表达趋势相同的基因分别为98(重复基因2个)、64、55(重复基因2个)、62个(重复基因1个)(表2),去除组内重复基因后分别为96、64、53、61;而mRNA和蛋白表达趋势相反的基因分别为59(重复基因1个)、34(重复基因2个)、21(重复基因1个)、54个(表2), 去除组内重复基因后分别为58、32、20、54。

图2 显著差异蛋白质和显著差异基因表达关联图
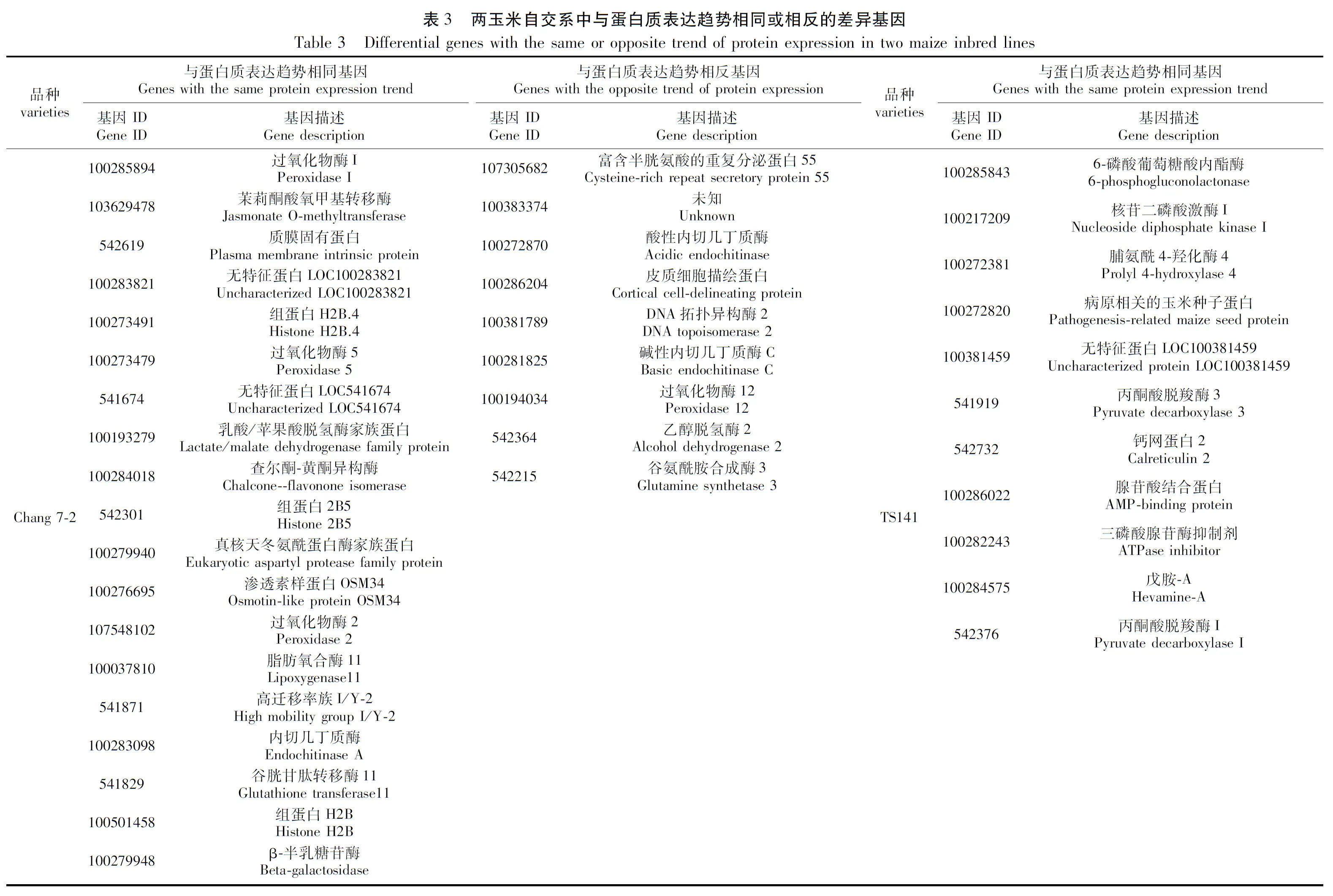
为了进一步剖析两自交系在干旱胁迫下基因表达的调控情况,对每个自交系D1vsCK1和D2vsCK2的关联结果进行了整合,以获得在干旱胁迫下稳定表达的基因信息。结果表明,Chang 7-2的D1vsCK1和D2vsCK2样品中mRNA和蛋白表达趋势相同的基因有19个(表3;图3A),mRNA和蛋白表达趋势相反的基因有9个(表3;图3B);TS141 D1vsCK1和D2vsCK2中mRNA和蛋白表达趋势相同的基因有11个(表3),mRNA和蛋白表达趋势相反的基因在两次重复中没检索到较为稳定表达的基因(图3B)。
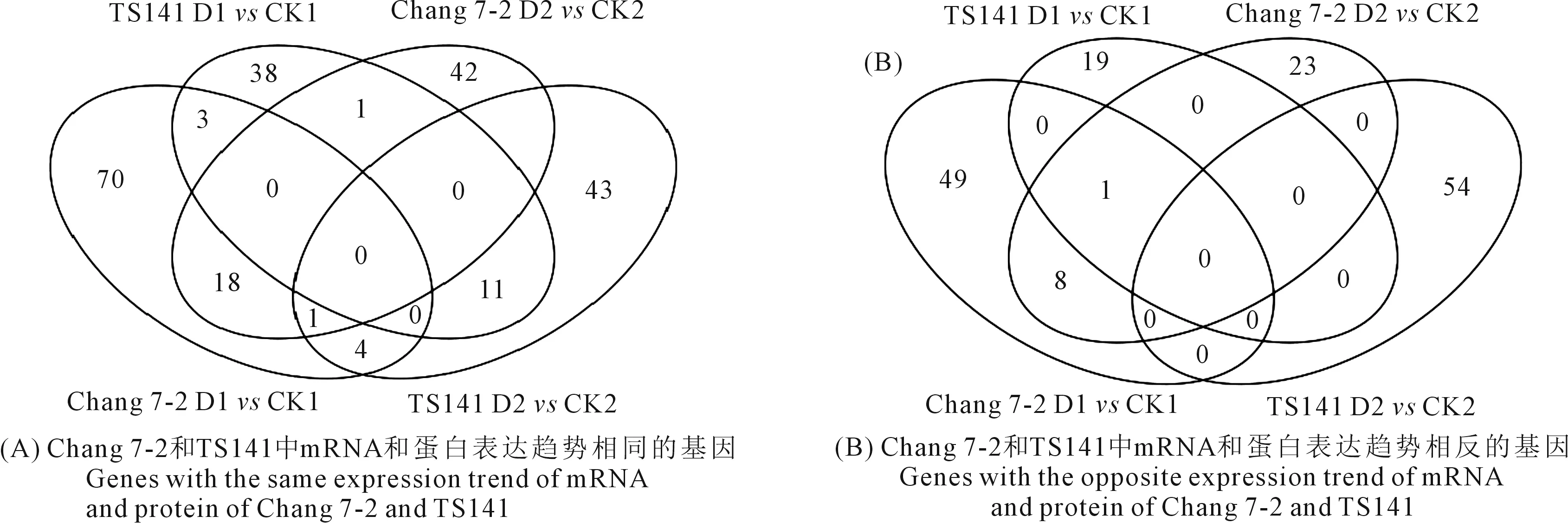
图3 两玉米自交系在不同处理下DEGs和DEPs的Venn图
2.2.3 GO富集关联分析 对两个组学中差异表达蛋白和基因进行GO功能注释分析,结果表明Chang 7-2 D1vsCK1、Chang 7-2 D2vsCK2、TS141 D1vsCK1和TS141 D2vsCK2等4个比较组的GO功能富集总体分为细胞成分(Cellular component, C)、分子功能(Molecular function, F)和生物过程(Biological process , P),而干旱处理下,比较组Chang 7-2 D1vsCK1和Chang 7-2 D2vsCK2所关联DEGs/DEPs的主要细胞组分包括细胞内非膜-b(Intracellular non-membrane-b)、非膜结合细胞器(Non-membrane-bounded organel)、细胞外围(Cell periphery);生物学过程主要有氧化-还原过程(Oxidation-reduction process)、胁迫反应(Response to stress)、碳水化合物代谢过程(Carbohydrate metabolic proce);分子功能主要包括金属离子结合(Metal ion binding)、阳离子结合(Cation binding)、氧化还原酶活性(Oxidoreductase activity)。比较组TS141 D1vsCK1和TS141 D2vsCK2所关联到的DEGs/DEPs主要细胞组分包括Intracellular non-membrane-b、Non-membrane-bounded organel和核糖核蛋白复合物(Ribonucleoprotein complex);分子功能主要包括Oxidoreductase activity和Metal ion binding;其生物学过程主要有胁迫反应(Response to stress)和刺激反应(Response to stimulus)。此外,我们还发现两玉米自交系幼苗根系所关联到的DEGs/DEPs均富集到胁迫响应(Response to stress)过程,即遭遇干旱胁迫后,其幼苗根系会立即对干旱胁迫做出响应,并通过促进根系内过氧化物酶活性、氧化还原酶活性等多种酶活性来抵御干旱。
2.2.4 Pathway富集关联分析 利用KEGG pathway数据库对Chang 7-2 D1vsCK1、Chang 7-2 D2vsCK2、TS141 D1vsCK1和TS141 D2vsCK2等4个比较组的转录组和蛋白质组数据以及所关联到的DEGs/DEPs进行通路富集分析,结果表明,差异基因和差异蛋白在各代谢通路中富集显著性分为3大类:转录组与蛋白质组都显著富集、转录组与蛋白质组任意一个组学数据显著富集和转录组与蛋白质组均无显著富集。而我们仅对转录组与蛋白组两个组学都显著富集的通路进行了分析,发现4个比较组所关联到的DEGs/DEPs主要富集的通路包括苯丙素的生物合成(Phenylpropanoid biosynthesis)、次生代谢产物的生物合成(Biosynthesis of secondary metabolites)和核糖体(Ribosome)(表4)。由此发现,玉米幼苗在应对干旱胁迫时会发生一系列复杂的代谢活动,而苯丙素的生物合成、次生代谢产物的生物合成和核糖体等相关代谢通路可能是根系响应干旱胁迫的主要通路。
2.2.5 qRT-PCR验证 为了验证干旱胁迫下两玉米自交系转录组和蛋白质组数据对干旱胁迫响应的可靠性,我们通过qRT-PCR验证了在干旱处理下昌7-2和TS141中表达水平不同的9个基因(表5、图4)。我们发现这9个基因在两个自交系中的基因表达水平与RNA-Seq和iTRAQ结果呈现相同趋势,这表明两组学测序数据是可靠的。
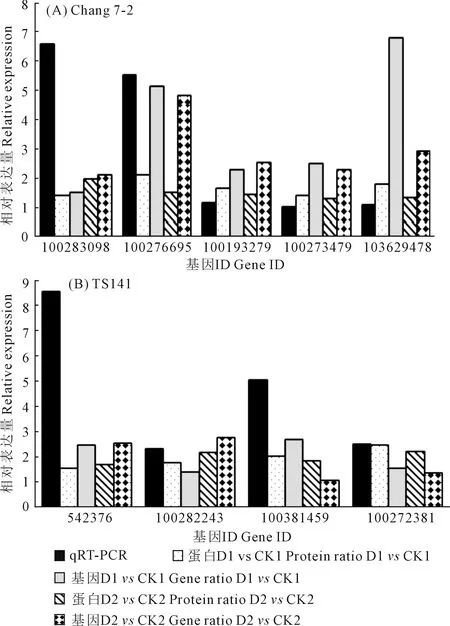
图4 qRT-PCR验证所选基因的相对表达量
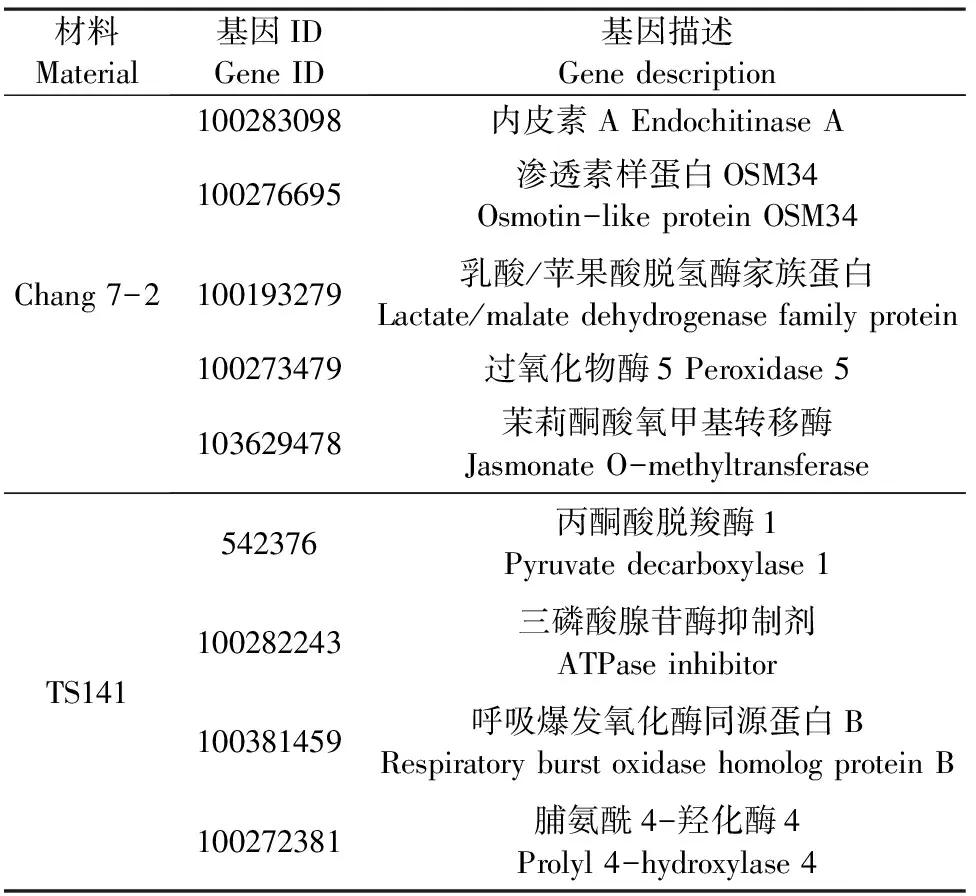
表5 用于qRT-PCR分析的基因
3 讨 论
为了进一步剖析不同玉米自交系对干旱胁迫的响应机制,采用耐旱自交系昌7-2和干旱敏感自交系TS141作为试验材料,在干旱处理12 d后对其幼苗根系进行转录组学分析和蛋白质组学分析,并对其根系差异基因与差异蛋白组表达趋势相同的部分基因进行了进一步分析。
3.1 耐旱玉米自交系昌7-2根系对干旱的响应机制
Jasmonate O-methyltransferase作为催化茉莉酸合成MeJA最重要的限速步骤[23],是MeJA合成途径遗传改造的最重要位置。研究表明,茉莉酸类化合物作为信号分子参与调控植物的生长发育与代谢途径,响应低温、干旱和盐等多种非生物胁迫[24]。此外,茉莉酸类物质在植物对逆境防御及胁迫传递信号等方面有着极其重要的作用。MA等[25]和WU等[26]研究结果也表明,茉莉酸甲酯缓解物质通过调节小麦(Triticumaestivum)和甘蓝(Brassicaoleracea)气孔运动及相关基因表达来调节干旱缺水对作物所带来的损伤,提高植物的抗旱性。本研究在昌7-2中也发现一个编码Jasmonate O-methyltransferase的基因(103629478)在转录组和蛋白质组中均上调表达,推测其在干旱胁迫下通过调节幼苗根系的气孔开度抗氧化酶活性来抵御干旱。
几丁质酶(Endochitinase)是一种能够将几丁质分解成几丁质单糖—N-乙酰基葡萄糖的酶,几乎在植物各器官中都有分布。有研究表明,当植物遭受干旱、低温、冻害及重金属离子等多重胁迫时,其组织内几丁质酶的活性会快速升高并水解病原菌细胞壁的几丁质,抑制病原菌在植物体内的生长繁殖[27]。近年来,关于几丁质酶基因的研究在不同植物中也不断被报道,陈鹏等[28]通过对小麦进行干旱胁迫后发现,随着干旱胁迫程度的增加,其体内几丁质酶的活性也在不断上升,复水处理后又逐渐恢复至正常水平,表明在干旱胁迫下几丁质酶可以提高植物抗旱性。MUOKI等[29]通过对茶树进行环境胁迫后发现,几丁质酶基因Chi与Thaumatin蛋白可共同响应干旱胁迫,进而促进茶树的抗旱性,减弱干旱对茶树的损害。在本研究中,我们也发现当昌7-2在遭遇干旱胁迫后其根系内几丁质酶相关基因出现差异上调表达。
此外,当昌7-2遭受干旱胁迫时,其体内与热激蛋白(100283821,Hsp20)、渗透蛋白(100276695,Osmotin-like protein OSM34)及过氧化物酶(100285894、100273479、541674、107548102)相关基因及蛋白也发生上调或下调表达。研究表明,热激蛋白作为植物响应非生物胁迫的重要蛋白之一,在植物耐寒耐旱、保护植物相关蛋白完成正确的折叠、翻译和聚集及结构功能方面发挥着重要作用[30],目前已发现多种类型热激蛋白,例HSP60、HSP70和HSP90等家族[31-32]。另外,干旱胁迫下,渗透调节蛋白基因和过氧化物酶(POD)对植物应对逆境胁迫有非常重要的作用。Osm基因(即ProBA基因)是一种可增强植物细胞抗渗透胁迫能力的蛋白质,其主要功能为在逆境胁迫下促进脯氨酸在细胞内的合成和累积[33],而在逆境胁迫下不同类型的POD相互作用可有效清除植物体内活性氧。因此,我们推测昌7-2受到干旱胁迫后,其幼苗根系会通过调节体内热激蛋白和渗透蛋白相关基因上调,同时通过调控不同类型的过氧化物酶上或下调来减轻干旱所带来的损伤。
3.2 玉米干旱敏感自交系TS141根系对干旱的响应机制
当对TS141进行干旱处理后,我们发现其mRNA和蛋白表达趋势相同的基因主要编码6-磷酸葡萄糖酸内酯酶(100285843)、核苷二磷酸激酶I(100217209)、脯氨酸-4-羟化酶(100272381)及丙酮酸脱氢酶(541919、542376)等一系列基因上、下调表达来减轻其对干旱胁迫的响应,而这些基因的功能多数与糖酵解生成丙酮酸的途径相关联。丙酮酸脱羧酶(Pyruvate decarboxylase, PDC)是一种以焦磷酸硫胺素为辅酶的羧基裂解酶,是发酵途径中的关键酶。PDC通过与PDH竞争代谢丙酮酸参与植物体内能量代谢和物质代谢,响应植物多种非生物胁迫,如缺氧、高盐及低温等[34-35]。研究表明,在逆境胁迫下丙酮酸对植物的呼吸作用有交替作用,而植物保持较高的交替呼吸本身便是一种抗逆机制,对植物抗旱等方面具有重要意义[36-37]。因此,我们推测当TS141感受到干旱胁迫后,主要通过诱导其糖酵解途径来促进根系进行交替呼吸,进而抵御干旱所带来的损伤。
4 结 论
本研究以两份耐旱性不同的玉米自交系昌7-2和TS141为试材,对其幼苗进行12 d干旱胁迫后进行转录组分析和蛋白质组学分析,以剖析不同自交系对干旱胁迫的响应机制及其抵御反应。结果表明,当玉米幼苗根系遭遇干旱胁迫后,为抵御干旱胁迫其体内会发生一系列生理生化反应,且不同自交系的根系在转录和翻译变化方面也存在明显的差异。此外,在干旱胁迫下,我们在昌7-2和TS141中分别鉴定了19、11个mRNA和蛋白表达趋势相同的基因、9和0个趋势相反的基因,并且这些基因主要涉及苯丙素的生物合成、次生代谢产物的生物合成和核糖体等代谢通路,可为今后了解玉米耐旱性的分子机制提供一定的参考。
