家蝇微生物感染对RNA干扰GNBP3基因的作用
2022-03-24吴建伟
胡 亚,罗 嫚,吴建伟
(1. 毕节市第一人民医院,贵州毕节 551700;2. 毕节市中医院,贵州毕节 551700;3. 贵州医科大学,贵阳 550004)
随着免疫抑制剂及广谱抗生素的大量使用,真菌感染尤其是白色念珠菌引起的机会性感染逐年增加,已严重威胁着人类生命健康(Marchettietal., 2004; Alastruey-Izquierdoetal., 2013; Yuetal., 2013)。宿主的免疫反应抵御白色念珠菌的入侵,而对于宿主-病原菌相互作用的免疫应答反应还缺乏适合的动物模型。因此,利用合适的动物模型深入研究真菌感染后宿主的免疫应答变化及其调控机制是非常必要的。先天免疫系统是宿主抵御病原入侵的第一防线,昆虫的先天性免疫系统具有高效抵御微生物病原侵害的效能,应用昆虫作为实验模型的实验结果不受获得性免疫应答的干扰,因此,大蜡蛾蜡螟Galleriamellonella、家蚕Bombyxmori、黑腹果蝇Drosophilamelanogaster、象鼻虫Bollweevil等昆虫已成为研究病原微生物与宿主之间先天免疫的重要模型(Pollardetal., 2012; 徐颖, 2012; Afonso-Barrosoetal., 2013; Huetetal., 2013; Rader and Guillemin, 2013; Rivas-Santiagoetal., 2013)。
昆虫体液免疫在其先天性免疫中起关键作用(Kounatidis and Ligoxygakis, 2012)。昆虫机体受微生物入侵后,体液中的分泌型模式识别受体(PRR, Pattern Recognition Receptor)对病原微生物的病原相关分子模式(PAMPs, Pathogen associated molecular patterns)进行识别,通过信号通路进行转导和调控,最终促使脂肪体细胞合成抗菌肽,抗菌肽分泌到血淋巴中杀死入侵的病原体(Kurata, 2014; 胡亚等, 2016)。研究发现,抗菌肽的表达主要由Toll信号通路和IMD信号通路控制(Lemaitre and Hoffmann, 2007; 修江帆等, 2014),其中真菌与大多数革兰氏阳性菌激活Toll信号途径,革兰氏阴性菌激活IMD信号通路(Sony and Yonggyun, 2010; Choetal., 2012; Kleino and Silverman, 2014),抵御并消除病原微生物对机体的损伤,这一复杂的过程是基于昆虫体液免疫模式识别微生物的病原相关分子。
在Toll受体介导的信号通路中,真菌感染靶生物时,机体启动免疫防御主要依赖于体液免疫系统对外源微生物的非特异性识别。真菌细胞壁中的β-1,3葡聚糖作为基本功能单位,可直接与靶生物体液中的革兰氏阴性菌结合蛋白-3 (GNBP3, Gramnegative bacteriabinding protein 3)的功能结构域相互作用,从而完成免疫系统对侵入体液中真菌的识别(Mishimaetal., 2009),如在果蝇(Matskevichetal., 2010; Fullaondoetal., 2011)、黄粉虫(Leeetal., 2009)中,GNBP3结合β-1,3葡聚糖,然后迅速活化Toll信号通路上游的一系列信号级联传递,最终启动抗菌肽的转录,参与抗真菌防御(胡亚等, 2016)。
家蝇Muscadomestica是世界性昆虫,隶属于昆虫纲双翅目环裂亚目蝇科家蝇属,孳生环境复杂,是重要的媒介昆虫之一(魏川川等, 2015),其体表可携带多种病原体而自身很少受害,说明家蝇比其它昆虫可能具有更强大的先天免疫系统(修江帆等, 2014; 王宇等, 2015; 彭传林等, 2015)。目前国内学者研究已表明,家蝇能够产生attacin、cecropin、defensin、diptericin等多种常见抗真菌多肽(Wangetal., 2003; Liangetal., 2006; Liuetal., 2011; Jinetal., 2013)。家蝇基因组和Jeffrey等( 2014)的研究结果表明GNBP3是信号通路上游的模式识别受体,参与昆虫先天性免疫应答反应对真菌的识别,其能够识别真菌细胞壁中的β-1,3葡聚糖,完成免疫系统对侵入体液中真菌的识别,从而宿主对真菌产生免疫抵抗,且根据本课题组前期家蝇转录组分析表明,GNBP3是家蝇迄今为止唯一的一个GNBP基因编码的真菌模式识别受体(胡亚等, 2016),而有关GNBP3在家蝇感染后的表达情况及抗菌肽的表达情况,国内外尚未见相关研究报道,GNBP3在家蝇先天性免疫系统中发挥什么作用还不清楚。
RNA干扰(RNA interference, RNAi)可调节大多数动植物基因表达和用于研究抗病毒防御的发生(Fireetal., 1998),已成为功能基因组学、生物医学和农业应用的重要工具(Price and Gatehouse, 2008; Kurreck, 2009)。一旦宿主细胞对dsRNA产生反应,其胞质中的核酸内切酶Dicer将dsRNA切割成多个具有特定长度和结构的小片段RNA(siRNA),siRNA再与体内一些酶(包括内切酶、外切酶、解旋酶等)结合形成RNA诱导的沉默复合物(RISC),RISC与基因表达的mRNA的同源区进行特异性结合,从而诱发宿主细胞降解mRNA(Siomietal., 2011)。因此,本研究采用RNA干扰技术沉默家蝇GNBP3基因,以微生物感染家蝇幼虫,研究家蝇幼虫GNBP3对真菌感染的功能作用,并评价真菌感染后对下游抗菌肽水平的影响。
1 材料与方法
1.1 材料
1.1.1菌种与实验昆虫
家蝇是由贵州医科大学病原生物学教研室长期饲养。饲养温度为 25~28℃,相对湿度为70%~80%,光照周期为12 h光照/12 h黑暗循环。家蝇幼虫RNA干扰模型的饲养温度是20~25℃,饲以麦麸、热灭活酵母、水等。大肠杆菌Escherichiacoli、金黄色葡萄球菌Staphylococcusaureus、白色念珠菌CanidiaAlbicans由贵州医科大学病原生物学教研室保存。
1.1.2主要试剂及仪器
SYBR Premix Ex TaqTM II (Perfect Real Time)试剂盒、rTaq酶、分子量标准DNA marker DL2000、质粒快速提取试剂盒、总RNA提取试剂TRIzol Reagent、DNA凝胶回收试剂盒质粒、PrimeScriptTMOne Step RT-PCR Kit试剂盒、DEPC水(焦碳酸二乙酯)均购自Takara公司;MEGAscriptR RNAi Kit合成试剂盒(美国);所用引物由上海生工生物工程公司合成。ABI PRISM 7300 Fast real time PCR System(美国);核酸定量分析仪(GeneQuant公司);PCR扩增仪(德国Eppendorf公司);显微解剖镜(尼康);显微超微量注射仪(美国);超净工作台(苏州净化设备有限公司)。
1.2 方法
1.2.1引物设计与合成
根据NCBI公布的家蝇基因组GNBP3基因预测序列、内参基因RPS18和抗菌肽基因defensin、cecropins、diptericin的基因序列,运用Primer 5.0软件设计内参RPS18基因、GNBP3基因和抗菌肽基因的q-PCR引物及GNBP3基因和GFP基因的dsRNA合成引物。引物由生工生物工程(上海)股份有限公司合成,其序列如下(表1)。

表1 本文中所使用的引物
1.2.2双链RNA的制备
1.2.2.1 基因PCR扩增及线性DNA片段合成
以课题组保存的家蝇质粒为模板进行PCR扩增,扩增条件:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min。反应结束后用1%琼脂糖凝胶电泳鉴定及回收纯化。以纯化PCR产物为模板,引物为含有T7启动子的GNBP3引物,PCR扩增条件:94℃ 5 min;94℃ 30 s ,56℃ 30 s,72℃ 30 s,30个循环;72℃ 10 min(罗嫚, 2017)。2%琼脂糖凝胶电泳检测。然后用DNA凝胶回收试剂盒纯化PCR产物,并进行浓度测定。
1.2.2.2 dsRNA的初步合成
以上述纯化PCR产物为模板,定量为1 μg进行dsRNA的合成,将无RNase的PCR小管(200 μL)置于冰盒上,Linear template DNA 1~2 μg,CTP Solution 2.0 μL,UTP Solution 2.0 μL,ATP Solution 2.0 μL,GTP Solution 2.0 μL,10×T7 Reaction Buffer 2.0 μL,T7 Enzyme Mix 2.0 μL,Nuclease-free Water至20.0 μL。轻轻混匀后瞬时离心,37℃孵育6 h(最佳孵育时间根据基因长度而定)。
1.2.2.3 去除DNA和ssRNA及纯化dsRNA
加入反应体系dsRNA(1.2.2.2)20 μL,Nuclease-free Water 21 μL,10×Digestion Buffer 5.0 μL,DNase I 2.0 μL,RNase I 2.0 μL,总体积为50 μL。轻轻混匀后瞬时离心,37℃孵育1 h(不得超过2 h)。加入dsRNA 50 μL,10×Binding Buffer 50 μL,Nuclease-free Water 150 μL,100% Ethanol 250 μL,总体积至500 μL进行纯化并测定浓度,-20℃冰箱保存备用。
1.2.3dsRNA注射家蝇幼虫
根据预实验结果,选择家蝇2龄幼虫,幼虫体表依次用75%酒精及灭菌水进行擦拭,然后用干净纸巾吸干幼虫体表的水分(罗嫚, 2017)。对家蝇2龄幼虫利用显微超微量注射仪注射dsRNA(定量为2 μg),设立GNBP3RNA干扰实验组,同时注射dsGFP作为对照组,并设立空白对照组,每组100头幼虫,将其饲养于20℃恒温培养箱中。参照钟鸣研究结果(钟鸣, 2014),设立干扰时间点分别为24 h、48 h和72 h,收集样本以确定最佳干扰时间点,记录RNA干扰后家蝇幼虫的死亡和化蛹等生理学特性,进行3次重复实验。
1.2.4微生物感染
以白色念珠菌、大肠杆菌及金黄色葡萄球菌作为感染源,通过喂食途径感染RNA干扰24 h后并饥饿6 h的家蝇幼虫(dsGFP组和dsGNBP3组),细菌感染浓度为1×108CFU/mL,设置为感染组,感染过程参照王宇对家蝇幼虫经口途径饲喂白色念珠菌感染模型的建立(王宇, 2016; 罗嫚, 2017)。同时设置未感染对照组,感染后6 h进行各标本的收集,-80℃保存备用。每组进行3个重复实验。
1.2.5样本总RNA的提取及cDNA合成
对所有收集标本,按照Takara公司TRIzol说明书提取总RNA。取总RNA进行琼脂糖凝胶电泳,同时测定A260/280比值及浓度。以1 μg总RNA为模板进行cDNA的合成,合成的cDNA保存于-80℃冰箱中备用。
1.2.6荧光定量PCR检测
取家蝇2龄幼虫RNA干扰不同时间点(24 h、48 h和72 h)(dsGFP对照组、dsGNBP3实验组和空白对照组)cDNA(1 ∶10稀释)为模板,以GNBP3为目的基因,RPS18为内参基因,使用ABI PRISM 7300 (ABI, USA)进行荧光PCR,确定最佳干扰时间,每个样品重复3次,每组3个重复。同样取家蝇微生物(大肠杆菌、白色念珠菌、金黄色葡萄球菌)感染样本(PBS对照组及感染组(dsGFP组和dsGNBP3组))cDNA(1 ∶10稀释)为模板,以defensin、cecropins、diptericin为目的基因,RPS18为内参基因,按照q-PCR试剂盒说明进行RT-PCR反应,以检测抗菌肽基因表达情况,进行3×3重复实验。反应体系为:2×SYBR premixEX Taq II 10 μL、上游引物+下游引物1.6 μL、ROX Reference Dye (50×) 0.4 μL、cDNA 1.0 μL, 加无RNA酶的水(RNase Free dH20)补足至20 μL。反应条件为:95℃预变性30 s; 95℃ 5 s, 60℃ 34 s, 40个循环。反应结束后,确认real-time PCR的溶解曲线和扩增曲线。
1.2.7数据处理及分析
采用RPS18作为内参照,用RPS18的拷贝数作为校正基数,按目的基因表达量=2-△△Ct计算各细菌感染样本中目的基因mRNA的相对表达含量(胡亚等, 2016)。采用Graphpad prism 6统计软件进行统计分析,应用组间t检验进行分析,P<0.05时差异有统计学意义。
2 结果与分析
2.1 GNBP3基因RNA干扰效率检测
采用q-PCR方法检测RNA干扰后GNBP3mRNA相对表达量。通过对家蝇2龄幼虫注射GNBP3dsRNA(2 μg)并收集注射后24 h、48 h和72 h样本,以检测GNBP3mRNA的表达情况。结果表明,RNA干扰GNBP324 h后,较GFPRNAi对照组和空白对照组,GNBP3基因表达量下降了大约90%,最佳的干扰效果在48 h时(图1)。此实验表明在干扰后24 h时GNBP3基因取得了较好的抑制作用,为进一步实验提供了依据。
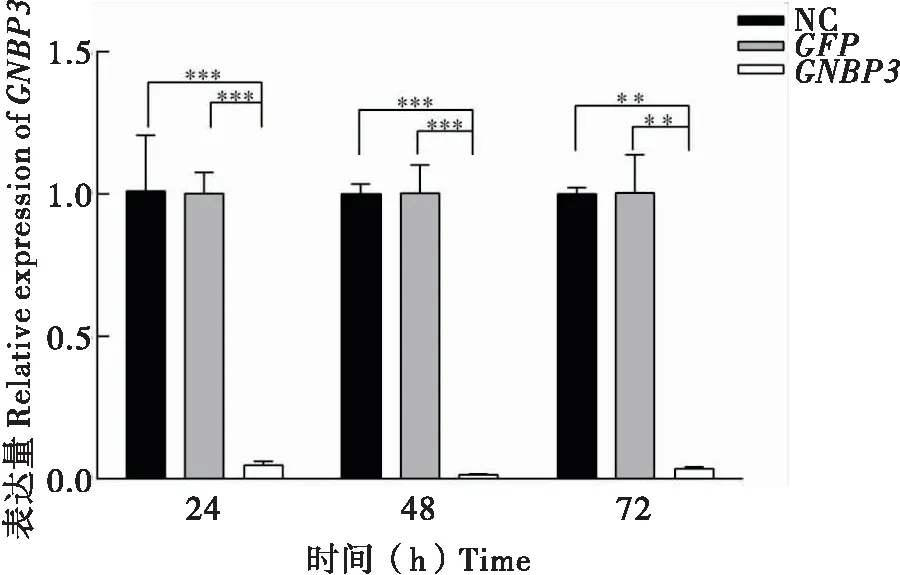
图1 注射dsRNA后GNBP3基因的相对表达量Fig.1 Relative gene expression of GNBP3 over time by dsRNA treatment注:NC,空白对照组;GFP,dsGFP对照组;GNBP3,dsGNBP3实验组;*,P<0.05;**,P<0.01;***,P<0.001。Note: NC, Normal control; GFP, dsGFP control group; GNBP3, dsGNBP3 experience group.
2.2 RNA干扰后检测家蝇生理学指标
通过对家蝇幼虫注射dsGNBP3已达到沉默GNBP3基因的目的,检测GNBP3基因在RNA干扰后是否会影响家蝇幼虫的化蛹及存活等生理学指标,以探究其在家蝇中所起的重要作用。结果显示,与对照组相比,家蝇幼虫在RNA干扰后的存活率随时间的变化逐渐降低,最终存活率低于50%(图2)。除此之外,家蝇幼虫的化蛹率也显著降低(图3)。
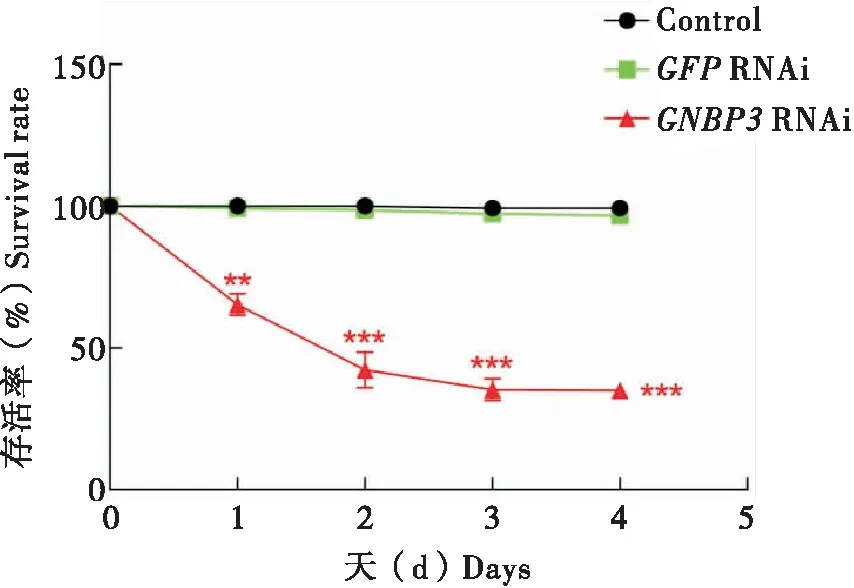
图2 RNA干扰后家蝇幼虫存活率Fig.2 Survival rate of housefly larvae after RNA interference注:*,P<0.05;**,P<0.01;***,P<0.0001。下图同。Note:The same below.
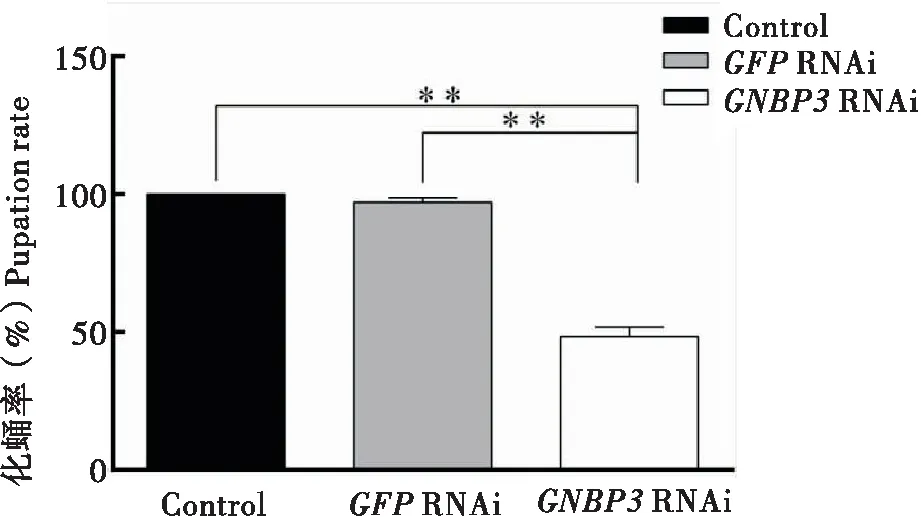
图3 RNA干扰后家蝇幼虫化蛹率Fig.3 Pupation rate of housefly larvae after RNA interference
2.3 RNAi家蝇GNBP3基因后抗菌肽基因的表达情况
以白色念珠菌、大肠杆菌和金黄色葡萄球菌作为感染源,通过喂食感染家蝇RNA干扰模型(dsGFP组和dsGNBP3组),通过q-PCR方法检测抗菌肽基因的表达情况。结果显示,在GFPRNAi组和GNBP3RNAi组之间,对于不同微生物感染其抗菌肽基因(cecropins、defensin、diptericin)表达情况各有差异。
对家蝇cecropins基因的表达量进行分析后发现,在未感染组中,RNA干扰GNBP3后cecropins的表达量显著性降低;而白色念珠菌感染后,cecropins的表达与未感染组呈相似的趋势(图4-A,P<0.0001);但是,大肠杆菌和金黄色葡萄球菌感染后,在GNBP3RNAi后cecropins的表达量显著提高(图4-A,P<0.05)。
对家蝇diptericin基因的表达量进行分析后发现,在未感染组中,RNA干扰GNBP3后diptericin的表达量显著性降低(图4-B,P<0.0001);而大肠杆菌和白色念珠菌感染后,在GNBP3RNAi后diptericin的表达量显著提高(图4-B,P<0.05);但金黄色葡萄球菌感染后其表达在两组间无统计学意义(图4-B,P>0.05)。
对家蝇defensin基因的表达量进行分析后发现,在未感染组中,RNA干扰GNBP3后defensin的表达量显著性降低(图4-C,P<0.05);而白色念珠菌、大肠杆菌及金黄色葡萄球菌感染后其表达在两组间均无统计学意义(图4-C,P>0.05)。这说明GNBP3基因在家蝇先天性免疫应答中起着重要作用,推测与其它免疫途径协同调节家蝇免疫应答。
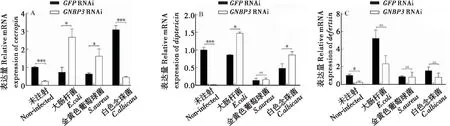
图4 RNAi GNBP3后家蝇抗菌肽基因的表达情况Fig.4 Housefly AMP genes expression after RNAi of GNBP3注:A,天蚕抗菌肽;B,双翅肽;C,防御素。Note: A, Cecropins; B, Diptericin; C, Defensin.
3 结论与讨论
革兰氏阴性菌结合蛋白-3 (GNBP3)作为昆虫先天性免疫病原识别因子,参与昆虫先天性免疫应答,其能够识别真菌细胞壁中的β-1,3葡聚糖完成免疫系统对侵入体液中真菌的识别(Mishimaetal., 2009; Matskevichetal., 2010; Fullaondoetal., 2011)。家蝇Muscadomestica孳生于杂乱菌丛的环境中传播疾病,是重要的媒介昆虫,其有效的免疫防御系统得到很多研究者的关注,而对于家蝇GNBP3基因及其感染后表达水平的研究未见报道(胡亚等, 2016)。近年来,基因敲除技术逐渐成为研究基因功能必不可少的工具,但传统的基因敲除很难获得功能缺失的实验个体,RNAi技术是一种利用特异双链RNA引起目的基因沉默的方法,在基因功能分析的研究领域应用得尤为广泛。
本研究通过RNA干扰技术沉默家蝇GNBP3基因,检测GNBP3基因的干扰效率及家蝇幼虫在干扰后的生理学指标(化蛹率及存活率),对已确定家蝇GNBP3基因干扰模型进行微生物感染(以白色念珠菌、大肠杆菌及金黄色葡萄球菌作为感染源),通过q-PCR方法检测抗菌肽基因(cecropins、defensin及diptericin)的表达情况。经过前期预实验,对各龄期家蝇幼虫进行dsRNA注射,以确定dsRNA注射的最佳龄期及浓度,注射家蝇1龄幼虫后,由于此期家蝇幼虫个体小,体壁薄,及针刺刺激,其死亡率达到100%,注射家蝇3龄幼虫后,由于家蝇幼虫受到外界刺激,使得其化蛹时间提前,无法完成后续实验,对各龄期幼虫注射浓度为1 μg时,并未达到干扰效果。对家蝇2龄幼虫注射dsGNBP3(定量为2 μg),结果显示,在干扰后24 h时家蝇GNBP3基因已达到有效沉默,其干扰效率达到90%左右,在48 h时沉默效果达到最佳,但72 h时沉默效率有复苏的情况,均具有统计学意义(P<0.05);其次,RNA干扰家蝇GNBP3基因后,家蝇幼虫的存活率逐渐降低达50%以上,同时化蛹率降低,均具有统计学意义(P<0.05)。这说明家蝇GNBP3基因能够影响家蝇幼虫的生长发育,推测干扰家蝇GNBP3基因后,扰乱了家蝇幼虫体内的菌群平衡状态,造成其死亡率增高及化蛹推迟现象。RNA干扰家蝇GNBP3基因24 h后并饥饿6 h幼虫,再进行微生物感染6 h,抗菌肽基因的表达各有差异。对于未感染组,GNBP3RNAi组抗菌肽基因(defensin、cecropins及diptericin)的表达较GFPRNAi组呈显著性降低(P<0.05)。GFP是一种理想的报告基因,对宿主的生理并无影响,同时它可以显示生物体一个或多个基因的表达状况,所以GFPRNAi后对家蝇幼虫没有影响却可以显示GNBP3基因和抗菌肽基因的表达情况,在未感染时GFPRNAi后GNBP3基因正常表达,抗菌肽基因也正常表达,当GNBP3RNAi后使抗菌肽基因呈现低表达状态,就此GNBP3基因的表达得到有效抑制,从而调节了抗菌肽基因的表达,这说明GNBP3基因参与了家蝇先天性免疫应答,在先天性免疫中有着至关重要的作用,可诱导抗菌肽基因的表达。白色念珠菌感染时,家蝇cecropins基因在GNBP3RNAi后的表达量显著性降低(P<0.05),diptericin基因在GNBP3RNAi后的表达量显著性提高(P<0.05),而家蝇defensin基因的表达在两组间(GFPRNAi和GNBP3RNAi)差异不显著(P>0.05)。大肠杆菌感染时,家蝇cecropins基因及家蝇diptericin基因在GNBP3RNAi后的表达量显著性提高(P<0.05),而家蝇defensin基因的表达在两组间(GFPRNAi和GNBP3RNAi)差异不显著(P>0.05);金黄色葡萄球菌感染时,家蝇cecropins基因在GNBP3RNAi后的表达量显著性提高(P<0.05),而家蝇defensin基因及家蝇diptericin基因的表达在两组间(GFPRNAi和GNBP3RNAi)差异不显著(P>0.05)。GNBP3基因能够激活Toll信号通路上游信号级联传递,启动下游抗菌肽基因的转录表达,使抗菌肽对微生物发挥查杀作用。通过对家蝇幼虫GNBP3RNA干扰模型在微生物感染下,各抗菌肽基因表达情况的研究,发现白色念珠菌感染家蝇时cecropins基因低表达,说明沉默的GNBP3导致由β-1,3葡聚糖激活的Toll通路基因不能被激活,酚氧化物酶活性降低,不能启动下游抗菌肽的应答反应,这说明家蝇GNBP3基因能够识别真菌以启动下游抗菌肽对真菌的查杀,在抗真菌免疫中起到一定作用。然而每种抗菌肽都有不同的活性谱,defensin一般情况下只对革兰氏阳性菌起作用;diptericin对革兰氏阴性菌有较强杀伤作用;cecropins对革兰氏阳性和阴性菌都有广谱的抗菌活性(Lietal., 2012; 罗嫚, 2017),造成不同微生物感染状态下各抗菌肽基因表达的差异性,白色念珠菌感染家蝇时diptericin基因高表达,大肠杆菌感染家蝇时cecropins及diptericin基因呈高表达,金黄色葡萄球菌感染家蝇时cecropins基因高表达,说明干扰GNBP3基因后并不能影响所有抗菌肽基因的表达反应,可能同时存在其它抗菌途径能够诱导抗菌肽的产生,呈现协同调节的作用,共同完成家蝇先天性免疫系统对真菌的识别及免疫应答,而对于家蝇先天性免疫系统对真菌的免疫应答机制需进一步研究。此次研究将为今后家蝇先天性免疫系统对真菌的免疫应答研究提供依据和参照,为进一步探讨家蝇先天性免疫系统提供新的思路。
