过表达/干扰表达miR-122对HBV稳转优势单克隆株HepGA14表达功能的影响*
2022-03-24郑世榜李永强廖思娜廖小莉
郑世榜,李永强,廖思娜,邱 华,廖小莉
(广西医科大学附属肿瘤医院,南宁 530021)
乙型肝炎病毒(HBV)是一种噬肝DNA 病毒,可引起急性或慢性肝损伤[1]。当前,中国仍有慢性HBV感染者约7 000万例,每年因HBV相关性肝硬化、肝癌、肝衰竭死亡的患者达30 万人[2-3]。由于抗病毒药物核苷(酸)类似物、干扰素尚不能清除肝细胞内的HBV 病毒复制的模板cccDNA(covalently closed circular DNA),因此,探寻治愈HBV 及相关疾病的靶点或药物是当前研究的热点之一。
microRNA 是一种新发现的宿主与乙肝病毒(HBV)相互作用的新机制。前期研究表明,miR-122 作为肝脏中最特异、最丰富的microRNA,参与肝脏发育、分化和稳态以及代谢功能;在调控HBV复制及HCC中发挥关键性作用[4]。本课题组前期成功筛选的HBV 全基因组1.3 倍体HBV 稳转优势单克隆株HepGA14能为HBV相关肝硬化和肝癌的发病机制探索、治疗靶点发现和候选药物筛选等方面提供新的研究工具[5]。基于此,为系统探索miR-122与新的HBV 体外感染与复制模型HepGA14 上HBV表达活性的关系及调控机制,本研究采用miR-122 过表达/干扰表达慢病毒质粒干预后,观察HBVDNA、HBsAg、HBeAg 等标志物表达功能的变化,现将结果报道如下。
1 材料与方法
1.1 材料
HepG2 细胞、293T 细胞购自上海诺百生物科技有限公司;HBV全基因组1.3倍体HBV稳转优势单克隆株HepGA14 细胞由课题组前期构建[5];PDS019_pL 和PDS165_pL6.3-GFP-U6-TuD2 载 体购自上海溪照生物科技有限公司,内切酶、GeneRuler DNA Ladder、Rnase Inhibitor和T4 DNA连接酶均购自美国Thermo 公司;质粒小抽试剂盒以及凝胶回收试剂盒购自美国Axygen公司;0.05%Trypsin和lipofectamine 2000 购自上海玉博生物科技有限公司;胎牛血清购自法国Biowest 公司;Opti-MEM 购自美国GIBCO 公司;引物Oligo、Trizol Reagent、荧光染料SYBR Green I、oligo dT/Random primer/特异性引物、逆转录酶SuperScriptIII Reverse Transcriptase、Platinum Taq DNA Polymerase、100mM dNTPs、DEPC H2O 购自美国invitrogen 公司;基因序列、引物合成、测序交由上海诺百生物科技有限公司完成;HBeAg、HBsAg 检测试剂盒购自上海东寰生物科技有限公司。
1.2 方法
1.2.1 细胞培养 293T 细胞、HepG2 和HBV 全基因组1.3 倍体HBV 稳转优势单克隆株HepGA14 细胞培养在含10%小牛血清的DEME培养基中。
1.2.2 miR-122 过表达载体构建 miR-122 的成熟序列来自Sanger microRNA序列数据库(miRBase),设计miR-122 的过表达Oligo,正向引物PDS19-miR122-F:5'-CACCGTGGAGTGTGACAATGGTGTTTGCGAACAAACACCATTGTCACACTCCA-3',反向引物PDS19-miR122-R:5'-AAAATGGAGTGTGACAATGGTGTTTGTTCGCAAACACCATTGTCACACTCCAC-3',酶切位点为BsmBI。以含有待扩增序列的DNA 为模板进行PCR 扩增。25 μL 反应体系:10×PCR Buffer 2.5 μL,Primer F/R 1 μL,Taq DNA polymerase 0.25 μL,(10 mmol/L)dNTPs 0.25 μL,Nuclease free water 18 μL。PCR 反应条件:95 ℃预变性5 min,循环:95 ℃变性20 s;67 ℃退火20 s,72 ℃延伸15 s,共35 个循环,72 ℃延长3 min,4 ℃保存。经退火后,重组至PDS019_pL 载体中,测序验证。退火反应体系:10×Oligo Annealing Buffer 2 μL,引 物F(200 μmol/L)5 μL,引物R(200 μmol/L)5 μL,ddH2O 8 μL。退火反应条件:95 ℃5 min,72 ℃5 min,自然降温至PCR 的Block 温度(25 ℃)。
1.2.3 miR-122干扰载体构建 设计miR-122的干扰Oligo,正向引物PDS165-shmiR122-F:5'-CAACCAAACACCATTGTCACACTCCA-3',反向引物PDS-165-shmiR122-R:5'-CTTGTGGAGTGTGACAATGGTGTTTG-3'。正向引物酶切位点为BsmBI,反向引物酶切位点为BveI。以含有待扩增序列的DNA 为模板进行PCR 扩增。25 μL 反应体系以及PCR 反应条件同“1.2.2项”。经退火后,重组至PDS 165_pL6.3-GFP-U6-TuD2 载体中,测序验证。退火反应体系以及退火反应条件同“1.2.2项”。
1.2.4 miR-122 过表达和干扰慢病毒包装和滴度测定 构建好的miR-122 过表达/干扰慢病毒载体分别与包装质粒(packaging mix)共转染293T细胞,包装慢病毒,收集病毒液,48 h 后测定慢病毒活性滴度。RT-qPCR 反应体系:ddH2O 6.55 μL、10×PCR buffer 1 μL、Mg2+(50 mmol/L)0.4 μL、dNTPs(10 mmol/L)0.2 μL、Primer F/R(10 μmol/L)0.5 μL、Probe(FAM)(10 μmol/L)0.25 μL、Taq 酶(5 U/μL)0.1 μL、Template 1 μL、Total volume 10 μL;RT-qPCR反应条件:95 ℃10 s、60 ℃30 s,40个循环。
1.2.5 miR-122 过表达和干扰慢病毒侵染HBV 1.3D-HepG2细胞及抗生素筛选
(1)慢病毒侵染HBV全基因组1.3倍体HBV稳转优势单克隆株HepGA14 最佳MOI 值:含8µg/mL polybrene 的完全培养液重悬靶细胞,按每孔第2 天细胞密度60%~70%的数量接种于96 孔板的各孔,设1个复孔。取出阴性对照病毒液,冰上融化,慢病毒MOI=0、2、5、10、30、60、120、240,向每孔加入病毒液。培养6 h 后,更换成完全培养液后继续培养至24 h~96 h;荧光显微镜下观察细胞荧光表达,明确最佳MOI,并拍摄白光和荧光视野下照片。(2)抗生素筛选:对数生长期的HepGA14细胞,以5×105/孔密度接种于12孔板;培养孔换上新配制的完全培养基+8 µg/mL ploybrene 的感染培养基,按照MOI 测定值的病毒液侵染HepGA14 细胞,培养4~6 h,更换完全培养基,继续培养24~72 h,加入梯度为0 μg/mL、2 μg/mL、4 μg/mL、6 μg/mL、8 μg/mL、10 μg/mL 的抗生素进行筛选;根据细胞状态确定抗生素筛选周期,培养和冻存筛选成功的稳转细胞系。
1.2.6 RT-qPCR 检测miR-122 表达量 使用Hep-GA14 稳转细胞和同样细胞数的HepG2 细胞沉淀,抽提总RNA,逆转录得cDNA 放-20 ℃备用保存。采用RT-qPCR 法对miR-122 进行扩增。反应体系共25 μL:SYBR Premix Ex TaqⅡ(2×)12.5 μL,cDNA(50 ng/μL)2 μL,正向 反向引物(10 μmol)各1 μL,ddH2O 8.5 μL。反应条件为:95 ℃预变性5 s;95 ℃变性30 s;60 ℃退火30 s;72 ℃延伸15 s;40 个循环;添加溶解曲线。miR-122正向引物序列为:5'-ACACTCCAGCTGGGTGGAGTGTGACAATGG-3',反向引物序列为:5'-TGGTGTCGTGGAGTCG-3';U6 正向引物序列为:5'-GCTTCGGCAGCACATATACTAAAAT-3',反向引物序列为:5'-CGCTTCACGAATTTGCGTGTCAT-3'。采用2-△△CT法进行相对表达水平定量分析。实验重复3次。
1.2.7 RT-qPCR检测miR-122过表达和干扰慢病毒侵染HBV 全基因组1.3 倍体HBV 稳转优势单克隆株HepGA14的miR-122表达量 miR-122过表达和干扰慢病毒分别以MOI 值=30 侵染HepGA14 稳转细胞,48 h 后收集部分细胞,qPCR 检测miR-122 表达水平,检测方法同“1.2.6项”,实验重复3次。
1.2.8 ELISA 检测上清HBsAg 和HBeAg 水平 收集细胞上清,操作按试剂盒说明书进行,实验重复3次。
1.2.9 RT-qPCR检测上清HBV DNA表达量 提取细胞沉淀的总RNA,采用RT-qPCR 检测HBV DNA的表达水平,HBV DNA 的检测引物的正向引物为5'-CTCGTGGTGGACTTCTCTC-3',反向引物为:5'-CAGCAGGATGAAGAGGAA-3',以18S rDNA 为内参,扩增引物为引物18S-F(序列5'-GAATTGACGGAAGGGCACCAC-3')和18S-R(序 列5'-AAGAACGGCCATGCACCACCA-3')。采用2-△△CT法进行相对表达水平定量分析,实验重复3次。
1.3 统计学方法 采用SPSS 22.0统计软件对数据进行统计分析,计量资料以均数±标准差()表示,组间比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 miR-122 过表达载体构建 获得测序正确的miR-122 过表达慢病毒载体CL1044-PDS19_miR122。测序结果完全符合,无突变,表明miR-122过表达慢病毒载体构建成功,见图1。

图1 CL1044-PDS19_miR122 载体的测序图谱
2.2 miR-122 干扰载体构建 获得测序正确的miR-122 干扰慢病毒载体CL1043-PDS160_shmiR122。测序结果完全符合,无突变,表明miR-122干扰慢病毒载体构建成功,见图2。
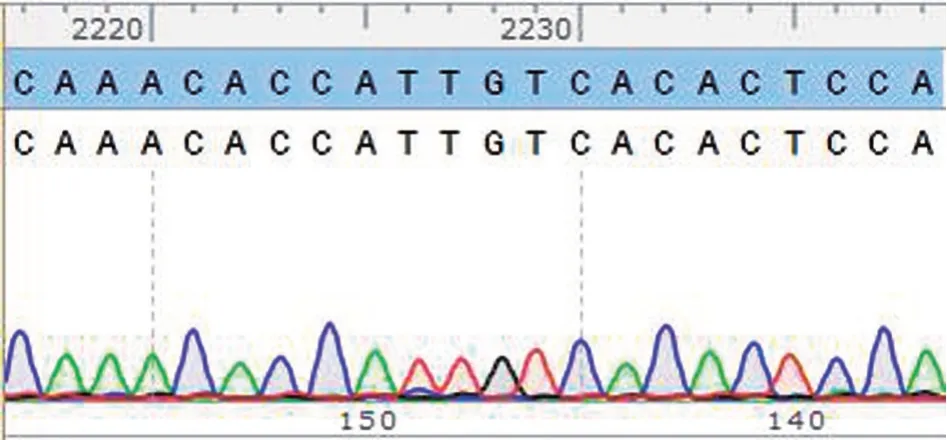
图2 CL1043-PDS160_shmiR122 载体的测序图谱
2.3 慢病毒滴度及侵染HBV 全基因组1.3 倍体HBV 稳转优势单克隆株HepGA14 细胞的MOI 测定 浓缩后的慢病毒侵染293A细胞,48 h后抽提细胞基因组。测定病毒滴度为3.24×108TU/mL。MOI=30~60时,综合分析细胞状态较好,阳性比例达到85%以上,符合后续实验要求,见图3。选取MOI=30进行后续实验。
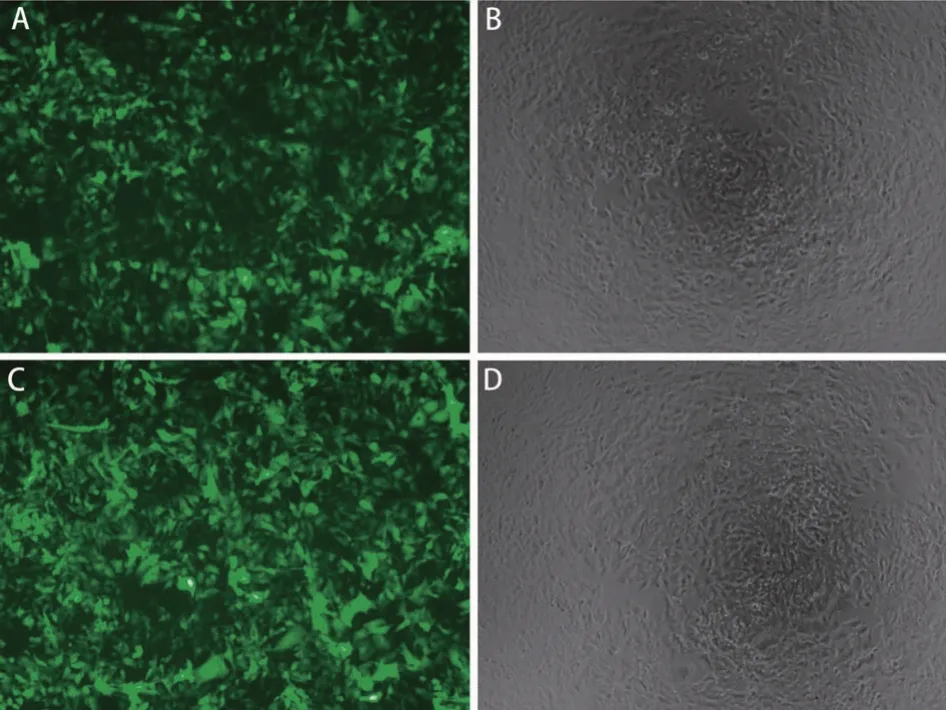
图3 慢病毒侵染HepGA14 细胞的侵染效率
2.4 HepG2和HBV1.3D-HepGA14细胞miR-122表达量 HBV1.3D-HepGA14细胞来源于HepG2 并稳定含有转染的HBV 全长基因组(ayw 亚型)。本研究使用HBV1.3D-HepGA14 细胞作为HBV 复制的模型系统,因为它能组成性表达乙型肝炎表面(HBsAg)抗原和E(HBeAg)抗原,并且还支持HBV复制,HBx、cccDNA、HBVDNA 的表达丰度更高[5]。结果发现,HBV1.3D-HepGA14 细胞(0.244±0.005)比在HepG2 细胞(1.000±0.018)中miR-122 的水平下降了70%多(t=71.467,P<0.000 1),见图4。表明HBV 复制和感染的存在可能导致miR-122 表达下降。
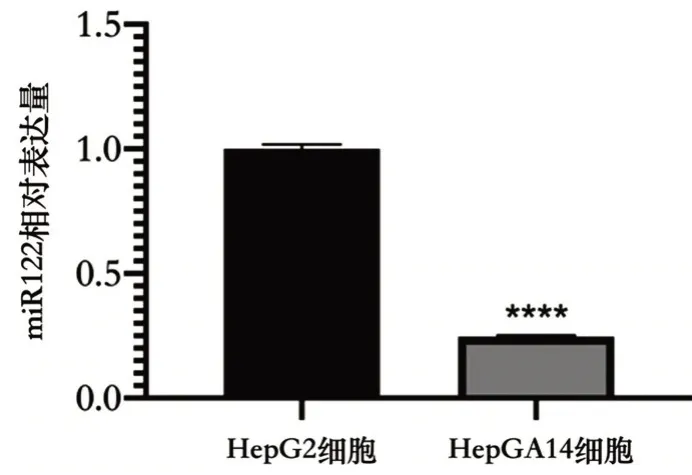
图4 RT-PCR 检测HBV1.3D-HepGA14 细胞中miR-122 RNA的表达情况
2.5 miR-122 过表达/干扰慢病毒侵染HBV1.3DHepGA14 细胞稳转细胞 miR-122 过表达/干扰慢病毒侵染HepGA14 稳转细胞可上下调miR-122 表达。与HepGA14(对照组)比较,HepGA14-VL1044(过表达组)miR-122可上调达到779倍(t=-22.878,P<0.000 1),HepGA14-VL1043(干扰组)干扰效率可到55.03%(t=30.125,P<0.000 1),见图5。
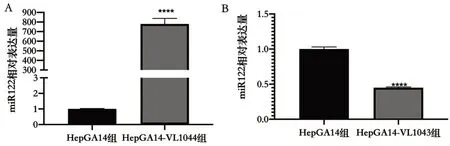
图5 miR-122 过表达/干扰慢病毒侵染HBV1.3D-HepGA14细胞稳转细胞
2.6 过表达和干扰miR-122对HBVDNA复制、HBsAg 表达和HBeAg 表达的影响 与对照组Hep-GA14 细胞相比,过表达miR-122 后HBV DNA(t=95.925,P<0.000 1)、HBeAg(t=92.338,P<0.000 1)、HBsAg(t=60.706,P<0.000 1)的表达均下降。干扰miR-122 后HBV DNA(t=-45.084,P<0.000 1)、HBeAg(t=-22.512,P<0.000 1)、HBsAg(t=-44.146,P<0.000 1)的表达均上升。RT-qPCR 检测细胞上清HBV DNA表达结果和ELISA法检测3种细胞上清HBsAg和HBeAg表达,结果见图6。
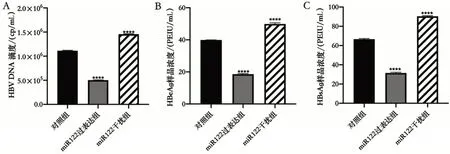
图6 过表达和干扰miR-122对HBVDNA复制、HBsAg表达和HBeAg表达的影响
3 讨论
目前,我国乙型肝炎病毒(简称乙肝)的患病率仍高于其他国家的平均水平。而临床指南一线推荐的两大抗病毒用药干扰素和核苷(酸)类似物都无法干预到超螺旋结构cccDNA(HBV 基因组物质),这成为了慢性乙型肝炎难以治愈的主要原因[6]。然而,乙肝患者体内持续存在的HBV病毒,是发展为原发性肝癌(HCC)的最主要的危险因素。因此,寻找以及研究灵敏的分子标志物有助筛选早期的乙肝患者,给予合适的治疗,延缓疾病的进展,是目前临床亟待解决的关键问题。
乙型肝炎病毒属于嗜肝DNA病毒科,其感染人体肝脏后常引起微小RNA 表达的变化。miR-122作为肝脏独有的含量最高的微小RNA,占肝脏微小RNA 总量的近70%[7]。其在调节肝细胞分化、增殖、凋亡以及代谢方面中起着关键的作用。研究发现,与健康对照组相比,HBV 感染患者肝脏中miR-122 表达显着下调,且随着miR-122 的表达水平下降,肝细胞内的HBV 病毒载量和坏死性炎症会增加[8]。然而,Ji等[9]发现miR-122在HBV感染患者的血清中显著上调,且可抑制Huh7 和HepG2 细胞中乙肝病毒的复制。因此,分析miR-122对HBV 复制作用具有重要意义,有助于提高乙肝病毒感染以及相关疾病患者的疗效。
本课题组在前期已经成功筛选出HBV 全基因组1.3倍体HBV稳转优势单克隆株HepGA14,较传统的HepG2.2.15 细胞株,可更加稳定、高效地表达反映HBV 的复制/感染情况的标志物:HBsAg、HBeAg、HBx、HBVDNA、cccDNA 等。本研究将构建的miR-122的过表达载体CL1044-PDS19_miR122/CL1043-PDS160_miR122干扰载体转染优势单克隆株HepGA14,并成功建立过表达/干扰miR-122 的HepGA14 细胞系,为研究miR-122 相关作用机制提供了良好基础。检测结果表明,miR-122 过表达后对HepGA14的HBsAg和HBeAg的合成和分泌产生明显抑制作用,且显著下调HBV DNA的滴度,而干扰miR-122后能明显促进HepGA14细胞的HBsAg、HBeAg的表达及上调HBV DNA滴度。表明在细胞水平上miR-122 能够调控HBV 的复制。本研究的结果与Chen等[10]团队的研究结论相符。此外,本研究以HepG2、HBV1.3D-HepGA14为研究模型,通过检测其miR-122 表达,证实了在乙肝病毒感染的情况下,肝细胞中miR-122 表达受到了下调。miR-122 是HCC 的重要肿瘤抑制因子,与转移和不良预后相关[11]。Hsu 等[12]研究发现miR-122 的缺失使小鼠易患肝细胞癌。Li 等[13]发现miR-122 在HCC 中低表达,而将miR-122 过表达后会抑制肝癌细胞的侵袭、增殖和迁移能力。Wu[14]研究团队发现,miR-122可以通过调节I型干扰素(IFN)的表达来保护肝细胞免受HBV感染。但miR-122 对HBV复制作用尚存有争议。QIU等[15]学者发现miR-122可显著下调HO-1的表达,间接促进HBV核心蛋白的表达,进而增强HBV复制。然而,miR-122被证明通过降低细胞周期蛋白G1 的表达来间接干扰HBV 的复制,从而导致p53 介导的HBV 转录受到抑制[8]。miR-122还被证实可影响核心蛋白mRNA的稳定性和翻译,以及前基因体(pgRNA)的稳定性,从而抑制HBV基因的表达/产生[10]。因此,鉴于miR-122在肝脏中的广泛作用,miR-122调控HBV的确切机制有待进一步研究。
目前,调节miRNA表达是辅助治疗乙型肝炎以及相关疾病的一个有前景的前沿领域,可与经典抗病毒治疗相结合,使患者获得更大的收益。本实验成功建立稳定过表达/干扰miR-122 的HBV 稳转优势单克隆株HepGA14细胞系,并确定miR-122在细胞水平上对HBV 复制具有一定的调控作用。但是其如何调控HBsAg、HBeAg、HBV-DNA 表达及抗HBV 机制尚未清楚,需要进一步的探索。基于目前研究结果,构建的过表达/干扰miR-122的HepGA14细胞模型能为新型抗HBV 药物的开发提供有力的工具,具有积极的研究意义。
