乙肝相关性慢加急性肝衰竭合并细菌感染患者Treg/Th7细胞免疫表达的研究
2022-03-24谭年花陈斌彭杰朱文芳张茜茜
谭年花 陈斌 彭杰 朱文芳 张茜茜




〔摘要〕 目的 观察乙型病毒性肝炎(简称乙肝)相关性慢加急性肝衰竭(hepatitis B virus related acute-on-chronic liver failure, HBV-ACLF)合并细菌感染患者外周血调节性T细胞(regulatory T cell, Treg)和辅助性T细胞17(helper T cell 17, Th17)细胞计数及相关细胞因子免疫表达。方法 选择96例HBV-ACLF患者,依据感染情况分为有细菌感染组与无细菌感染组。采用流式细胞术检测患者外周血Treg、Th17细胞计数,细胞因子微球检测技术检测转化生长因子-β(transforming growth factor-β, TGF-β)、白介素-10(interleukin-10, IL-10)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-17A(interleukin-17A, IL-17A)、白介素-23(interleukin-23, IL-23)表达,实时荧光定量PCR检测叉状头状转录蛋白3(forkhead box protein 3, Foxp3)、维甲酸相关孤核受体-γt(retinoid-related orphan nuclcar receptor-γt, ROR-γt) mRNA表達,及检测相关炎症指标[C反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)、内毒素(lipopolysaccharide, LPS)]水平。结果 有细菌感染组Treg细胞计数与无细菌感染组比较,差异无统计学意义(P>0.05)。与无细菌感染组比较,有细菌感染组Th17细胞计数明显升高(P<0.01);有细菌感染组CRP、PCT、LPS水平均显著升高(P<0.01,P<0.05);有细菌感染组Th17、TNF-α、IL-17A、IL-23、ROR-γt mRNA表达均明显上调(P<0.01,P<0.05);有细菌感染组Foxp3 mRNA、IL-10表达均明显下调(P<0.01,P<0.05)。有细菌感染组恶化率(83.33%)显著高于无细菌感染组(11.11%)(P<0.01)。结论 HBV-ACLF患者随着病程进展,感染风险增加,其感染后存在Th17细胞优势化现象,具体机制可能与Th17细胞过度增值分化导致炎症反应失控,加重肝组织炎症反应相关。
〔关键词〕 乙型病毒性肝炎;肝衰竭;调节性T细胞;辅助性T细胞17;细菌感染
〔中图分类号〕R259 〔文献标志码〕B 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.03.023
〔Abstract〕 Objective To observe the cell count of regulatory T cell (Treg) and helper T cell 17 (Th17) cell and the expression of related cytokines in peripheral blood of patients with hepatitis B virus related acute-on-chronic liver failure (HBV-ACLF) combined with bacterial infection. Methods 96 patients with HBV-ACLF were divided into bacterial infection group and non-bacterial infection group according to the infection. Flow cytometry was used to detect the cell count of Treg and Th17 in peripheral blood. The expression levels of transforming growth factor-β (TGF-β), interleukin-10 (IL-10), tumor necrosis factor-α (TNF-α), interleukin-17A (IL-17A) and interleukin-23 (IL-23) were detected by cytometric bead array. The expression of forkhead box protein 3 (Foxp3) and retinoid-related orphan nuclcar receptor-γt (ROR-γt) mRNA were detected by real-time fluorescent quantitative PCR, and the levels of C-reactive protein (CRP), procalcitonin (PCT) and lipopolysaccharide (LPS) were detected. Results There was no significant difference in Treg cell count between the bacterial infection group and non-bacterial infection group (P>0.05). Compared with the non-bacterial infection group, Th17 cell count in bacterial infection group was significantly increased (P<0.01), CRP, PCT and LPS were significantly increased in the bacterial infection group (P<0.01, P<0.05). The expression of Th17, TNF-α, IL-17A, IL-23 and ROR-γt mRNA in the bacterial infection group were all up-regulated (P<0.01, P<0.05), Foxp3 mRNA and IL-10 expression were significantly down-regulated in bacterial infection group (P<0.01, P<0.05). The deterioration rate in the bacterial infection group (83.33%) was significantly higher than that in the non-bacterial infection group (11.11%) (P<0.01). Conclusion Patients with HBV-ACLF have an increased risk of infection with the progression of the disease, and there is a phenomenon of Th17 cell dominance after infection. It may be related to the excessive value-added differentiation of Th17 cell, which leads to the uncontrolled inflammatory response and aggravates the inflammatory response of liver tissue.
〔Keywords〕 viral hepatitis B; liver failure; regulatory T cell; helper T cell 17; bacterial infection
慢加亚急性肝衰竭(acute-on-chronic liver failure, ACLF)是在慢性肝病基础上出现以肝功能急性失代偿为特征的临床综合征,预后差,病死率高[1]。其发病机制与宿主免疫损伤、缺血缺氧及再灌注损伤密切相关,我国则有80%以上是乙型病毒性肝炎(简称乙肝)相关性慢加急性肝衰竭(hepatitis B virus related acute-on-chronic liver failure, HBV-ACLF)[2-3]。HBV-ACLF患者由于免疫功能紊乱(过度炎症反应与免疫功能障碍重叠)、肠道细菌失调、肠道菌群/产物易位等病理生理特征,极易感染[4-5]。合并感染作為肝衰竭最常见的不良事件之一,是导致肝衰竭重症化的重要原因,大大增加了重症监护病房入院率和短期死亡率[6]。西医治疗上目前除了抗感染、退热、免疫调节等对症治疗,尚无其他疗效确切的药物,并且因受损脏器的特殊性,大大限制了临床用药。而临床与实验研究表明通过传统中医辨证论治,也能达到较好的疗效,认为细菌感染的病理因素无外乎热、毒与血瘀,病机表现为(热)毒、瘀、虚,与肝衰竭湿热、血瘀、脾虚的基本病机相合,可予以清热凉血、解毒化瘀,兼以补虚治疗,再配合通腑泄浊、祛邪外出以截断挽逆,控制病势进展[7-8]。因此,利用现代分子生物学再结合传统中医辨证,多维度认识肝衰竭发病机理,形成其中西医结合诊疗的新理念,已是临床治疗趋势。
肝衰竭患者出现感染可能主要与两种损伤机制相关:(1)机体过度的免疫应答损伤正常组织,增加易感率;(2)感染性生物直接损伤组织[9]。然而在HBV-ACLF背景下,血液免疫细胞亚群的计数、免疫细胞表面蛋白的表达和转录谱特征还未得到系统研究。起源于CD4+T细胞的调节性T细胞(regulatory T cell, Treg)和辅助性T细胞17(helper T cell 17, Th17)是ACLF发病后适应性免疫反应中最具代表的T细胞亚群之一[10]。Treg细胞受叉头状转录蛋白3(forkhead
box protein 3, Foxp3)调控,通过分泌转化生长因子-β(transforming growth factor-β, TGF-β)、白介素-10(interleukin-10, IL-10)等抑炎细胞因子,发挥抑制炎症作用,Th17细胞在维甲酸相关孤核受体-γt(retinoid-related orphan nuclcar receptor-γt, ROR-γt)的调控下,通过分泌肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-17A(interleukin-17A, IL-17A)、白介素-23(interleukin-23, IL-23)等促炎细胞因子,加重炎症反应[11]。二者在ACLF发病过程中的炎症调控作用是近年国内外研究的热点[12-14],其具体表达与肝衰竭患者的感染风险增加是否有关,目前研究较少。因此,本研究以HBV-ACLF患者为研究对象,通过观察HBV-ACLF合并感染患者外周血炎症指标、Treg、Th17细胞计数及相关细胞因子免疫表达,有助于为ACLF炎症反应调控的研究提供全新视角和新思路。
1 资料与方法
1.1 一般资料
选取2018年3月至2019年3月收住于湖南中医药大学第一附属医院肝病科/传染性疾病科的HBV-ACLF患者共96例,依据患者是否合并细菌感染,分为有细菌感染组42例和无细菌感染组54例。依据ACLF病程分期,有细菌感染组分别有7例早期患者、13例中期患者、22例晚期患者,主要分布在疾病晚期。在性别年龄分布上,42例有细菌感染组中男性31例,女性11例,年龄(48.34±18.51)岁,54例无细菌感染组中男性41例,女性13例,年龄(45.62±16.33)岁。各组在性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经湖南中医药大学第一附属医院医学伦理委员会批准(批准号:HN-LL-20170720)。所有患者皆被告知参与研究的相关内容,充分知情后自愿签署知情同意书。
1.2 诊断标准
HBV-ACLF诊断参照《肝衰竭诊治指南(2012年版)》的诊断标准[15]。细菌感染诊断标准[16]:血、尿、粪便、腹水、胸水等病原学检测明确提示细菌培养阳性者;或病原微生物学培养阴性,但临床上有可疑感染灶的相应症状和体征,外周血相关炎症指标白细胞和(或)中性粒细胞、C反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)升高,以及X线、CT等影像学检查提示有感染者。预后判断标准依据患者出院时情况及在院死亡作为判断节点,分为好转及恶化[17]。(1)好转:患者肝衰竭症状、体征基本消失或有明显好转,且肝功能指标明显好转(血清胆红素以及谷丙转氨酶降低50%以上);(2)恶化:症状、体征均无好转,甚至出现病情恶化及脏器衰竭等生命体征不稳定表现,或者医治无效死亡。
1.3 纳入标准
(1)符合乙肝相关性慢性肝病基础上导致的HBV-ACLF诊断标准;(2)年龄18~65岁;(3)患者病历资料全面者;(4)入组患者皆自愿参加,并签署知情同意书。
1.4 排除标准
(1)乙肝相关性慢性肝病基础上合并其他病因如甲肝、戊肝、丙肝、EB病毒、巨细胞病毒及自身免疫性肝病、药物性肝损伤等导致的肝衰竭;(2)合并有某些致死性并发症如脑水肿、消化道大出血等;(3)合并真菌感染者;(4)妊娠或哺乳期妇女;(5)合并原发性肝癌或其他肿瘤者;(6)近3月服用免疫抑制剂、激素者。
1.5 观察指标
1.5.1 外周血Treg、Th17细胞计数 采用美国BD公司C6型流式细胞仪检测外周血Treg、Th17细胞计数,取患者外周血约2 mL分离单个核细胞后,依次进行细胞刺激活化、表面标记染色、固定破膜等,具体检测方式参照CD4、CD25、IL-17A、Foxp3试剂盒,试剂盒均购自美国BD公司,批号分别为555346、555432、560486、560045。
1.5.2 炎症因子IL-10、TGF-β、TNF-α、IL-17A、IL-23的表达 取患者空腹外周血约2 mL,分离留取上清液,采用美国BD公司C6型流式细胞仪,用细胞因子微球检测技术检测炎症因子IL-10、TGF-β、TNF-α、IL-17A、IL-23的表达,具体检测方式参照IL-17A、TNF-α、TGF-β、IL-10、IL-23试剂盒,试剂盒均购自美国BD公司,批号分别为560383、560112、560429、558274、558245。
1.5.3 实时荧光定量PCR检测转录因子Foxp3、ROR-γt mRNA水平 采用美国Applied Biosystems公司7500型荧光定量PCR仪检测外周血Treg、Th17细胞相关转录因子Foxp3、ROR-γt mRNA表达,具体检测方式参照ROR-γt、Foxp3多克隆抗体试剂盒,试剂盒均购自美国ABclonal公司,批号分别为A10240、A8024。基因的引物由GENELIFE公司利用Primer Express 2.0软件设计,上海Sangon公司合成完成。内参β-Actin引物序列:正向引物序列为GCACTCTTCCAGCCTTCCTTCC,反向引物序列为GCGGATGTCCACGTCACACTTC,长度为93 bp。Foxp3引物序列:正向引物序列为AAGAACGCCATCCGCCACAAC,反向引物序列为TCCAGCTCATCCACGGTCCAC,長度为92 bp。ROR-γt引物序列:正向引物序列为AGCGGCAACAGCAGCAACAG,反向引物序列为CAGGCAGGTCAGGCGAGGAG,长度为132 bp。
1.5.4 酶联免疫吸附试验检测CRP、PCT及鲎试剂法检测内毒素(lipopolysaccharide, LPS)水平 采用德国Roche Diagnostics Gmbh公司cobas 8000和cobas e 411型电化学发光全自动免疫分析仪分别检测CRP、PCT的表达,具体操作步骤参照试剂盒操作说明书进行,试剂盒购自罗氏诊断公司,批号分别为20152401562、20162404451。采用湛江博康海洋生物公司BET-24A型细菌内毒素分析仪以鲎试剂法检测LPS表达,具体操作步骤参照说明书进行,试剂盒购自湛江博康海洋生物公司,批号为17051014。
1.6 统计学方法
所有数据采用SPSS 25.0软件进行数据统计处理。计数资料以率或构成比表示,采用χ2检验;等级资料行秩和检验;计量资料以“x±s”表示,进行正态性检验及方差齐性检验,符合正态性分布和方差齐性釆用独立样本t检验,不符合正态性分布和方差齐性,采用两个独立样本非参数检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者CRP、PCT、LPS水平
有细菌感染组CRP、PCT、LPS水平均明显高于无细菌感染组(P<0.01,P<0.05)。见表1。
2.2 两组患者Treg、Th17细胞计数
有细菌感染组Treg细胞计数与无细菌感染组比较,差异无统计学意义(P>0.05)。有细菌感染组Th17细胞计数明显高于无细菌感染组(P<0.01)。见表2、图1-2。
2.3 两组患者IL-10、TGF-β、TNF-α、IL-17A、IL-23表达
两组TGF-β表达比较,差异无统计学意义(P>0.05)。有细菌感染组IL-10表达明显低于无细菌感染组(P<0.05);有细菌感染组Th17细胞相关细胞因子TNF-α、IL-17A、IL-23表达均明显高于无细菌感染组(P<0.01,P<0.05)。见表3。
2.4 两组患者Foxp3、ROR-γt mRNA表达
有细菌感染组Foxp3 mRNA表达低于无细菌感染组(P<0.01),有细菌感染组ROR-γt mRNA表达高于无细菌感染组(P<0.01)。见表4。
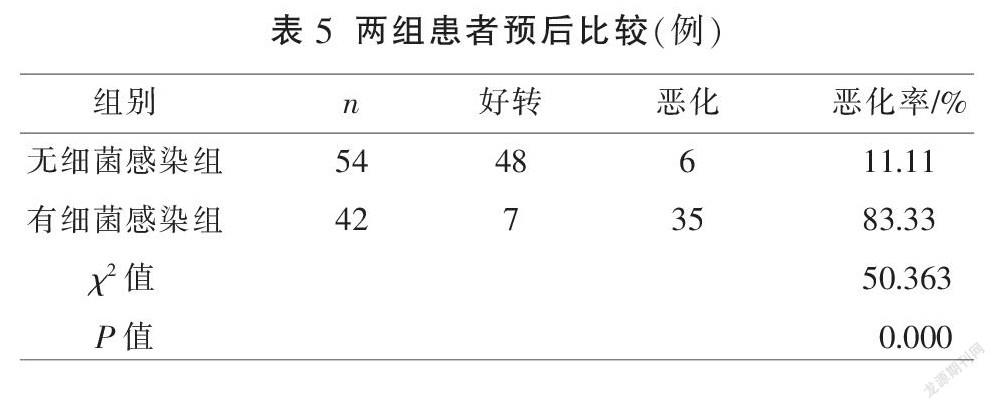
2.5 两组患者预后
有细菌感染组恶化率(83.33%)显著高于无细菌感染组(11.11%)(P<0.01)。见表5。
3 讨论
感染作为ACLF急性事件之一,是其发展过程中导致病情加重甚至死亡最常见的原因之一[18],本研究中合并感染患者占43.75%,这与国内外多数研究占30%~50%基本相符。随着肝衰竭病程进展,机体在依次经受早、中期阶段病毒介导的免疫炎症反应调节作用和晚期阶段LPS介导的炎症反应调节作用后,自身防御机制受损加重,由于肝内网状内皮系统受损,巨噬细胞功能下降,白细胞黏附、趋化及吞噬功能降低、补体合成不足,导致机体对细菌的易感性增加,出现炎症免疫损伤[19]。而且ACLF晚期患者由于肠壁瘀血水肿、缺血缺氧,加上氧化应激、炎症趋化因子等使肠黏膜损伤造成肠道机械屏障、生物、化学及免疫等屏障障碍,出现“肠泄漏现象”,肠源性内毒素血症的发生率高达93.3%~100%,这种“LPS-巨噬细胞-细胞因子风暴”机制的启动是患者发生内源性感染的主要内在因素,在此过程中大量炎症介质瀑布样释放入血,而机体相应的内源性炎症拮抗机制未作出有效应对,最终导致全身炎症反应综合征甚至多器官功能衰竭[20]。同时随着肝衰竭进展,内源性抗炎介质大量释放,引起代偿性抗炎症反应综合征,大量炎症因子消耗与抗炎因子释放,最终导致免疫麻痹发生,从而加剧了各种感染的易感性[21],其中以自发性腹膜炎最为常见,其次为肠道感染、肺部感染、胆道感染、尿路感染等[16],是ALCF患者死亡的独立危险因素[22]。
正如中醫学的正气学说,肝主疏泄,主藏血,为调节气血的场所和枢纽,它的生理结构和特性使疫病之毒更易入血,乙肝病毒性肝炎相关的慢加急性肝衰竭就是属中医学“疫毒内伏血分”范畴。伏邪发病,正虚是必要条件,也就是说在机体正气不足为本,即免疫失衡的情况下伏邪易于暴发。而HBV-ACLF患者属于临床危重病证,邪气盛而正气亏损严重,“邪之所凑其气必虚”,细菌则好比“伏邪”,当机体正虚时伺机引发感染,因此治疗上也强调细菌感染虚注意固扶正气,正气足则邪不可干,从而避免新生内生之邪,使得感染复杂化。
课题组前期实验已发现Treg/Th17细胞与内毒素血症二者有着密切复杂的关系,二者在肝衰竭患者病程发展中发挥重要的作用,机体合并细菌感染后,Th17细胞在相关因子的刺激下增值分化,通过分泌相关炎症细胞因子、趋化因子、集落刺激因子如TNF-α、IL-17A、IL-23等从而诱导单核/巨噬细胞、内皮细胞向病灶内转移,促进免疫反应,进而加重炎症反应;而Treg细胞呈现一种负反馈调节作用,通过增值分化能抑制过强的免疫反应以减轻炎症损伤,但不足以抗衡Th17所介导的炎症反应,因此,在感染状态下,其相关抑炎因子IL-10、TGF-β反而呈下调趋势[23-24]。但是,ROR-γt和Foxp3分别作为Th17和Treg细胞的特异性转录因子,研究结果发现合并细菌感染的肝衰竭患者ROR-γt mRNA表达与Th17细胞计数皆上升;而Foxp3 mRNA表达下降,与Treg细胞计数趋势相反。由此,我们推测在合并有细菌感染的条件下,Treg细胞可以使Foxp3的表达下调,从而削弱其抑制Th17介导下的免疫炎症反应的功能[25],而导致这种现象出现的关键因素是机体中高水平的炎性细胞因子,在这种炎症性内环境里许多前炎性细胞因子能明显降低Treg细胞的功能而导致其功能的缺陷,不能有效抑制炎症反应。这种Treg/Th17细胞免疫平衡关系与肝衰竭细菌易感性的联系,正是中医学正邪相争致病之理,充分了解其病程中Th17/Treg失衡偏移的方向及炎症反应也有利于为中医辨证分析提供一个客观化实验指标,更大程度上发挥中医药干预治疗疾病的优势作用。
因此,本研究中通过观察比较HBV-ACLF合并与未合并细菌感染患者Treg/Th17细胞及相关细胞因子的表达变化,发现合并细菌感染患者Th17细胞及相关因子TNF-α、IL-17A、IL-23及其特异性转录因子ROR-γt的表达明显高于无细菌感染患者(P<0.05,P<0.01),提示在HBV-ACLF整个发病过程中存在Th17细胞优势化现象,其表达水平在一定程度上反应了机体的免疫功能状态,且与HBV-ACLF合并感染患者的预后密切相关,具体机制可能与Th17细胞过度增值分化介导炎症级联反应导致炎症反应失控,加重肝组织炎症反应相关。通过干预促进恢复Treg/Th17细胞的动态平衡,降低炎症因子表达,改善肝衰竭患者炎症反应失衡状态,可有望降低感染事件发生,为肝衰竭治疗提供全新视角和思路。
参考文献
[1] 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南(2018年版)[J].实用肝脏病杂志,2019,22(2):164-171.
[2] 吕建林,毛德文,柳琳琳,等.中西医结合治疗慢加急性肝衰竭的临床研究进展[J].中西医结合肝病杂志,2021,31(11):1047-1050.
[3] BAJAJ J S, O'LEARY J G, LAI J C, et al. Acute-on-chronic liver failure clinical guidelines[J]. The American Journal of Gastroenterology, 2022, 117(2): 225-252.
[4] ZACCHERINI G, WEISS E, MOREAU R. Acute-on-chronic liver failure: Definitions, pathophysiology and principles of treatment[J]. JHEP Reports: Innovation in Hepatology, 2021, 3(1): 100176.
[5] 陈渊渊,孟忠吉.系统性炎症在慢加急性肝衰竭发病机制中的作用[J].中西医结合肝病杂志,2021,31(10):951-955.
[6] YANG L L, WU T Z, LI J, et al. Bacterial infections in acute-on-chronic liver failure[J]. Seminars in Liver Disease, 2018, 38(2): 121-133.
[7] 中国中西医结合学会.慢加急性肝衰竭中西医结合诊疗专家共识[J].北京中医药,2021,40(9):946-955.
[8] 吕 超,毛德文,石清兰,等.毛德文“毒邪-毒浊致病”学说治疗肝衰竭经验撷菁[J].辽宁中医杂志,2021,48(11):35-38.
[9] 蔡明豪,谢 青.慢加急性肝衰竭研究迈入新阶段[J].肝脏,2019,24(1):4-6.
[10] 李彦霖,杨雪亮,刘小静,等.免疫细胞在慢加急性肝衰竭中的调控作用[J].中国肝脏病杂志(电子版),2020,12(2):42-46.
[11] ZHANG W Q, LIU X, ZHU Y C, et al. Transcriptional and posttranslational regulation of Th17/Treg balance in health and disease[J]. European Journal of Immunology, 2021, 51(9): 2137-2150.
[12] LIU Y M, FAN L D, CHENG Z, et al. Fecal transplantation alleviates acute liver injury in mice through regulating Treg/Th17 cytokines balance[J]. Scientific Reports, 2021, 11(1): 1611.
[13] 曾 丹,王衛政.Th17和Treg细胞在慢加急性乙型肝炎肝衰竭患者外周血中的表达及临床价值[J].肝脏,2020,25(4):419-422.
[14] WANG F X, SUN W W, XIAO Q, et al. Peripheral T lymphocytes predict the severity and prognosis in patients with HBV-related acute-on-chronic liver failure[J]. Medicine, 2021, 100(5): e24075.
[15] 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南(2012年版)[J].实用肝脏病杂志,2013,16(3):210-216.
[16] 陈 斌,张 丽,彭 杰,等.乙型肝炎相关性慢加急性肝衰竭细菌感染临床特点及中医证候回顾性分析[J].中国实验方剂学杂志,2020,26(2):39-44.
[17] 贺 凡.血清甲胎蛋白及NLR在165例慢加急性肝衰竭患者的临床转归分析[D].重庆:重庆医科大学,2018.
[18] SARIN S K, CHOUDHURY A, SHARMA M K, et al. Correction to: Acute-on-chronic liver failure: Consensus recommendations of the Asian Pacific association for the study of the liver (APASL): An update[J]. Hepatology International, 2019, 13(6): 826-828.
[19] HINDSON J. Predicting development of ACLF[J]. Nature Reviews Gastroenterology & Hepatology, 2020, 17(9): 531.
[20] 高方媛,王宪波.肠源性内毒素血症在肝衰竭发生发展中的作用[J].临床肝胆病杂志,2014,30(8):825-828.
[21] 陈 广,陈 韬,宁 琴.肝衰竭合并感染热点难点问题探析[J].临床肝胆病杂志,2018,34(9):1842-1846.
[22] 杨淑娟,田 臻,何英利,等.慢加急性肝衰竭发病诱因及其对预后的影响[J].临床肝胆病杂志,2020,36(1):128-131.
[23] 陈 斌,彭 杰,张 涛,等.清温并用法对慢加急性肝衰竭大鼠结肠组织调节性T淋巴细胞/辅助性T淋巴细胞17细胞因子的影响[J].湖南中医药大学学报,2019,39(5):573-577.
[24] 陈 斌,丁秀丽,彭 杰,等.清温并用法对慢加急性肝衰竭肠源性内毒素血症大鼠结肠组织Foxp3, ROR-γt表达的影响[J].中国实验方剂学杂志,2020,26(2):19-25.
[25] GENG J, YU S J, ZHAO H, et al. The transcriptional coactivator TAZ regulates reciprocal differentiation of Th17 cells and Treg cells[J]. Nature Immunology, 2017, 18(7): 800-812.
