LncRNA-H9靶向miR-45-5p通过JAK2/STAT3调节大鼠脑血管平滑肌细胞增殖和迁移
2022-03-24龚翠兰杨仁义傅馨莹周德生
龚翠兰 杨仁义 傅馨莹 周德生



〔摘要〕 目的 探討LncRNA-H19靶向miR-145-5p通过JAK2/STAT3信号通路调节TNF-α诱导大鼠脑血管平滑肌细胞(vascular smooth muscle cell, VSMC)增殖和迁移。方法 培养VSMC,对照组的细胞正常培养,TNF-α组的细胞用100 ng/mL TNF-α处理;将si-NC、si-H19、miR-NC、miR-145-5p mimics转染至TNF-α诱导的VSMC,分别记为TNF-α+si-NC组、TNF-α+si-H19组、TNF-α+miR-NC组、TNF-α+miR-145-5p组;将si-H19和anti-miR-NC、si-H19和anti-miR-145-5p共转染至TNF-α诱导的VSMC,记为TNF-α+si-H19+anti-miR-NC组、TNF-α+si-H19+anti-miR-145-5p组。RT-qPCR法检测LncRNA-H19和miR-145-5p表达水平;MTT法检测细胞增殖能力;Transwell法检测细胞迁移能力;荧光素酶报告实验检测LncRNA-H19和miR-145-5p的靶向关系;Western blot法检测细胞周期蛋白D1(Cyclin D1)、p21、基质金属蛋白酶2(matrix metallo proteinase 2, MMP-2)、基质金属蛋白酶9(matrix metallo proteinase 9, MMP-9)、磷酸化JAK2(phosphorylated JAK2, p-JAK2)、磷酸化STAT3(phosphorylated STAT3,p-STAT3)蛋白表达水平。结果 与对照组比较,LncRNA-H19在TNF-α组中的表达水平显著升高,miR-145-5p在TNF-α组中的表达水平显著降低(P<0.01)。与TNF-α+si-NC组比较,TNF-α+si-H19组H19表达水平显著降低,OD值、Cyclin D1、细胞迁移数、MMP-2及MMP-9蛋白表达水平显著降低,P21蛋白表达水平显著升高(P<0.01)。与TNF-α+miR-NC组比较,TNF-α+miR-145-5p组miR-145-5p表达水平显著降低,OD值、Cyclin D1、细胞迁移数、MMP-2及MMP-9蛋白表达水平显著降低,P21蛋白表达水平显著升高(P<0.01)。与TNF-α+si-H19+anti-miR-NC组比较,TNF-α+si-H19+anti-miR-145-5p组OD值、Cyclin D1、细胞迁移数、MMP-2及MMP-9蛋白表达水平显著升高,P21蛋白表达水平显著降低(P<0.05)。与TNF-α+si-NC组比较,TNF-α+si-H19组p-JAK2、p-STAT3蛋白表达水平显著降低(P<0.05);与TNF-α+si-H19+anti-miR-NC组比较,TNF-α+si-H19+anti-miR-145-5p组p-JAK2、p-STAT3蛋白表达水平显著升高(P<0.05)。结论 干扰LncRNA-H19表达、上调miR-145-5p表达可抑制TNF-α组的VSMC增殖和迁移,其与阻断JAK2/STAT3信号通路的磷酸化有关。
〔关键词〕 LncRNA-H19;miR-145-5p;JAK2/STAT3信号通路;TNF-α;血管平滑肌细胞;增殖;迁移
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.03.005
〔Abstract〕 Objective To investigate the LncRNA-H19 targeting miR-145-5p through JAK2/STAT3 signaling pathway to regulate TNF-α-induced rat cerebral vascular smooth muscle cell (VSMC) proliferation and migration. Methods Culture VSMC, cells in the control group were cultured normally, cells in the TNF-α group were treated with 100 ng/mL TNF-α; si-NC, si-H19, miR-NC, miR-145-5p mimics were transfected into TNF-α-induced VSMC, which were marked as TNF-α+si-NC group, TNF-α+si-H19 group, TNF-α+miR-NC group, TNF-α+miR-145-5p group; si-H19 and anti-miR-NC, si-H19 and anti-miR-145-5p were co-transfected into TNF-α-induced VSMC, and denoted as TNF-α+si-H19+anti-miR-NC group, TNF-α+si-H19+anti-miR-145-5p group. RT-qPCR was used to detect the expression levels of LncRNA-H19 and miR-145-5p; MTT was used to detect cell proliferation; Transwell was used to detect cell migration; luciferase reporter assay was used to detect the targeting relationship between LncRNA-H19 and miR-145-5p; Western blot was used to detect Cyclin D1, p21, matrix metallo proteinase 2 (MMP-2), matrix metallo proteinase 9 (MMP-9), phosphorylated JAK2 (p-JAK2), phosphorylated STAT3 (p-STAT3) protein expression levels. Results Compared with the control group, the expression level of LncRNA-H19 was significantly increased while miR-145-5p was significantly decreased in TNF-α group (P<0.01). Compared with the TNF-α+si-NC group, the H19 expression level in the TNF-α+si-H19 group was significantly reduced, and the OD value, Cyclin D1, cell migration number, MMP-2 and MMP-9 protein expression levels were significantly reduced, and the P21 protein expression level was significantly increased (P<0.01). Compared with the TNF-α+miR-NC group, the expression level of miR-145-5p in the TNF-α+miR-145-5p group was significantly decreased, while levels of OD value, Cyclin D1, cell migration number, MMP-2, MMP-9 protein were significantly decreased, and the expression level of P21 protein increased significantly (P<0.01). Compared with TNF-α+si-H19+anti-miR-NC group, the expression levels of OD value, Cyclin D1, cell migration number, MMP-2, MMP-9 protein were increased significantly in TNF-α+si-H19+anti-miR-145-5p group, and the expression level of P21 protein decreased significantly (P<0.05). Compared with the TNF-α+si-NC group, the p-JAK2 and p-STAT3 protein expression in the TNF-α+si-H19 group were significantly reduced (P<0.05); compared with TNF-α+si-H19+anti-miR-NC group, p-JAK2 and p-STAT3 protein expression in TNF-α+si-H19+anti-miR-145-5p group were significantly increased (P<0.05). Conclusion Interfering the expression of LncRNA-H19 and up-regulating the expression of miR-145-5p can inhibit the VSMC proliferation and migration of TNF-α group, which is related to blocking the phosphorylation of JAK2/STAT3 signaling pathway.
〔Keywords〕 LncRNA-H19; miR-145-5p; JAK2/STAT3 signaling pathway; TNF-α; vascular smooth muscle cell; prolif⁃eration; migration
血管平滑肌细胞(vascular smooth muscle cell, VSMC)是构成血管壁组织结构及维持血管张力的主要细胞,具有表型重塑的特征,其生物学行为的改变(如各种原因引起的增殖、凋亡等)可引起高血压、动脉粥样硬化和血管再狭窄等血管重塑性疾病[1-3]。长链非编码RNA(long non-coding RNA, LncRNA)是长度大于200个核苷酸的非编码RNA,无蛋白质编码功能,生物学性能发挥作用可调节细胞的增殖和凋亡[4-5]。microRNA(miRNA)是一类长度约19~24 nt的非编码单链RNA,通过碱基互补配对的方式与靶基因的3’-UTR区部分或完全互补,剪切靶基因的转录产物或者抑制转录产物的翻译,从而起到转录后调控靶基因表达的作用[6-7],其中miRNA-145在VSMCs中特异性高表达,可特异性抑制kruppel样因子4(kruppel like factor 4, KLF4),对VSMCs表型变化及分化具有重要作用[8],JAK2-STAT3信号通路是参与细胞增殖、迁移、代谢、血管再生的重要信号途径,多种因子及药物可通过激活此通路促进血管内皮细胞新生,改善缺血[9-10]。本实验主要探讨LncRNA-H19靶向miR-145-5p通过JAK2/STAT3信号通路调节TNF-α诱导大鼠脑VSMC增殖和迁移。
1 材料与方法
1.1 实验动物
10~12周龄雄性SPF级SD大鼠40只,体质量250~280 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2019-0004,合格证号:4307272011011151067,饲养于湖南中医药大学第一附属医院实验动物中心(昼夜交替12 h,温度21~26 ℃,湿度40%~50%),实验经湖南中医药大学第一附属医院动物实验伦理委员会批准(20201010-8)。
1.2 材料、试剂与主要仪器
TNF-α试剂盒(上海生博生物医药科技有限公司,批号:430904);胎牛血清(批号:SN201909)、DMEM培养基(批号:200101)均购自美国Sigma公司;四甲基偶氮唑盐比色法(methyl thiazolyl tetrazolium, MTT)试剂盒(上海拜力生物科技有限公司,批号:PH0533);RNA提取试剂盒(批号:SD1412)、反转录试剂盒(批号:AKA1709)、荧光定量试剂盒(批号:AK1301)均购自TaKaRa Bio公司;MMP-9(批号:ab48392)、P21(批号:ab91527)、Cyclin D1(批号:ab186738)均购自北京百奥莱博科技有限公司;RIPA蛋白裂解液(批号:J150003)、二辛可宁酸(bicinchoninic acid, BCA)试剂盒(批号:GUC0066)均购自赛默飞世尔科技(中国)有限公司;Transwell小室(美国BD公司,批号:6225968);双荧光素酶报告基因检测试剂盒(上海善然生物科技有限公司,批号:20160831);Power PacTM Basic基础电泳仪(电源)(型号:1645050)、化学凝胶成像分析仪(型号:Chemi DocTM XRS+)、荧光定量PCR仪(型号:CFX96TM)均购自美国 Bio-Rad公司;台式高速冷冻型微量离心机(型号:D3024R,中国DragonLab公司)。
1.3 大鼠脑VSMC培养
取3~4只雄性SD大鼠,麻醉后处死,迅速取出整脑,在解剖显微镜下分离大脑基底动脉,将其反复剪碎后置于细胞培养瓶中,加入含20%胎牛血清和1%青链霉素的DMEM培养液,在37 ℃、5% CO2培养箱中培养,待组织块与瓶底黏附后将培养瓶轻轻翻转平放,继续培养3 d可见细胞爬出,换液后继续培养10 d时观察到组织块周围细胞相互融合且融合度达80%左右,进行传代,取培养3代后细胞用于实验。
1.4 细胞处理与分组
培养大鼠脑VSMC,对照组的细胞正常培养,TNF-α组的细胞用100 ng/mL TNF-α处理;将si-NC、si-H19、miR-NC、miR-145-5p mimics转染至TNF-α诱导的大鼠脑VSMC,分别记为TNF-α+si-NC组、TNF-α+si-H19组、TNF-α+miR-NC组、TNF-α+miR-145-5p组;将si-H19和anti-miR-NC、si-H19和anti-miR-145-5p共转染至TNF-α诱导的大鼠脑VSMC,记为TNF-α+si-H19+anti-miR-NC组、TNF-α+si-H19+anti-miR-145-5p组。
1.5 RT-qPCR法检测LncRNA-H19和miR-145-5p表达水平
细胞培养48 h后,提取总RNA,用反转录试剂盒将RNA反转录成cDNA,按照荧光定量试剂盒说明进行实验,每个样品设3个重复,循环条件为95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s;72 ℃ 30 s,共40个循环;60 ℃延长5 min。LncRNA-H19和miR-145-5p分别以GAPDH和U6为内参。采用2-△△Ct法计算相对表达量。所需引物序列见表1。
1.6 MTT法检测细胞增殖能力
在各组细胞培养至48 h时,每孔分别加入5 mg/mL的MTT溶液20 μL,于培养箱中继续孵育4 h后弃去上清液,每孔加入150 μL二甲基亚砜,振荡反应10 min使沉淀溶解,用酶標仪于波长490 nm处检测OD值。细胞存活率=实验组OD值/对照组OD值×100%。
1.7 Transwell法检测细胞迁移能力
调整各组细胞浓度为5×104个/mL,Transwell上室加入100 μL细胞悬液,下室加入500 μL含10% FBS培养基。培养24 h后,4%多聚甲醛固定30 min,0.1%结晶紫染色15 min。倒置显微镜观察,随机选取5个视野,拍照并计数。
1.8 Western blot法检测蛋白表达水平
根据蛋白提取试剂盒提取各组细胞总蛋白,检测蛋白浓度后进行变性处理,取30 μg蛋白样品进行SDS-PAGE反应,转膜,封闭,分别加入一抗(稀释比例MMP-9为1∶1000,P21为1∶3000,Cyclin D1为1∶2000),4 ℃孵育24 h,TBST洗涤,分别加入二抗(山羊抗兔1∶10 000),室温孵育1 h,暗室内曝光显影,应用ImageJ软件分析各条带灰度值。
1.9 荧光素酶报告实验检测LncRNA-H19和miR-145-5p的靶向调控关系
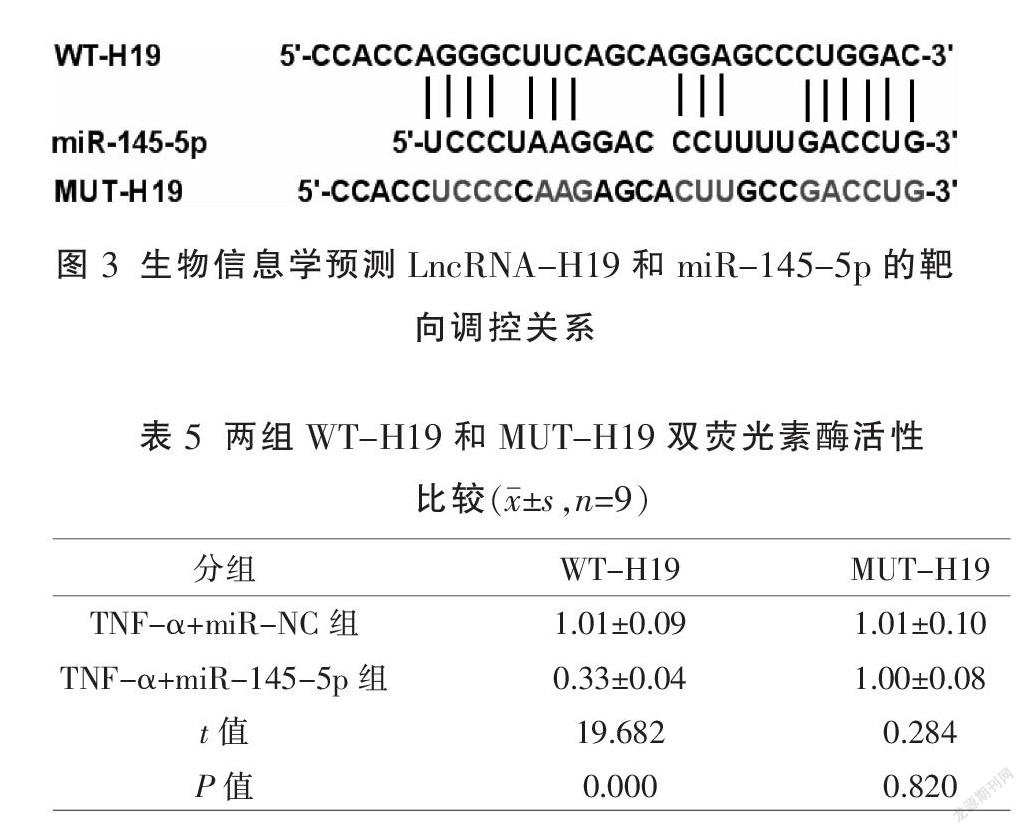
采用生物信息学预测出LncRNA-H19和miR-145-5p的靶向关系,含有结合位点的LncRNA-H19野生型(WT)或突变型(MUT)片段被克隆到pGL3荧光素酶载体中,分别命名为WT-H19或MUT-H19,将WT-H19或MUT-H19与miR-NC或miR-145-5p mimic一起转染,48 h后,使用双重荧光素酶报告基因检测系统进行荧光素酶活性检测。
1.10 统计学分析
采用SPSS 22.0统计软件分析实验数据,计量资料以“x±s”表示,各组数据若满足正态分布和方差齐时,组间比较采用方差分析,方差不齐则用秩和检验,同组比较采用成组t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 LncRNA-H19和miR-145-5p在TNF-α诱导VSMC中的表达水平比较
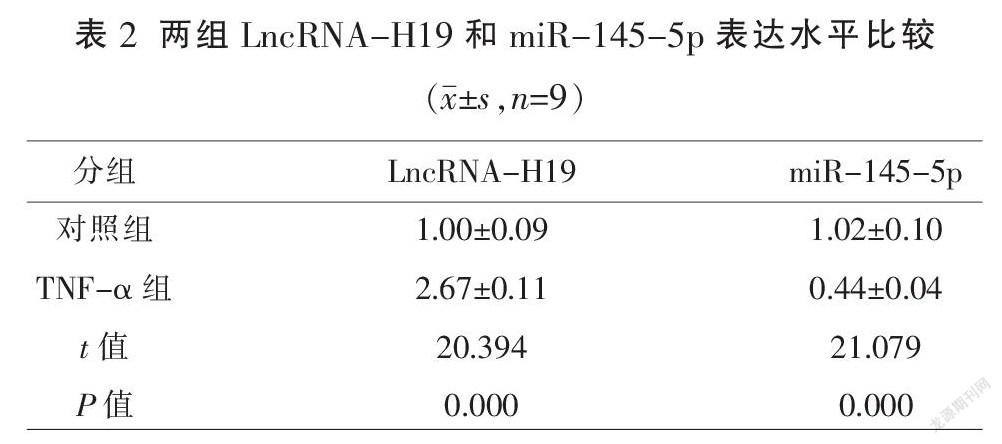
与对照组比较,LncRNA-H19在TNF-α组中的表达水平显著升高,miR-145-5p在TNF-α组中的表达水平显著降低(P<0.01)。见表2。
2.2 抑制H19对TNF-α诱导VSMC中的增殖和迁移相关蛋白的影响
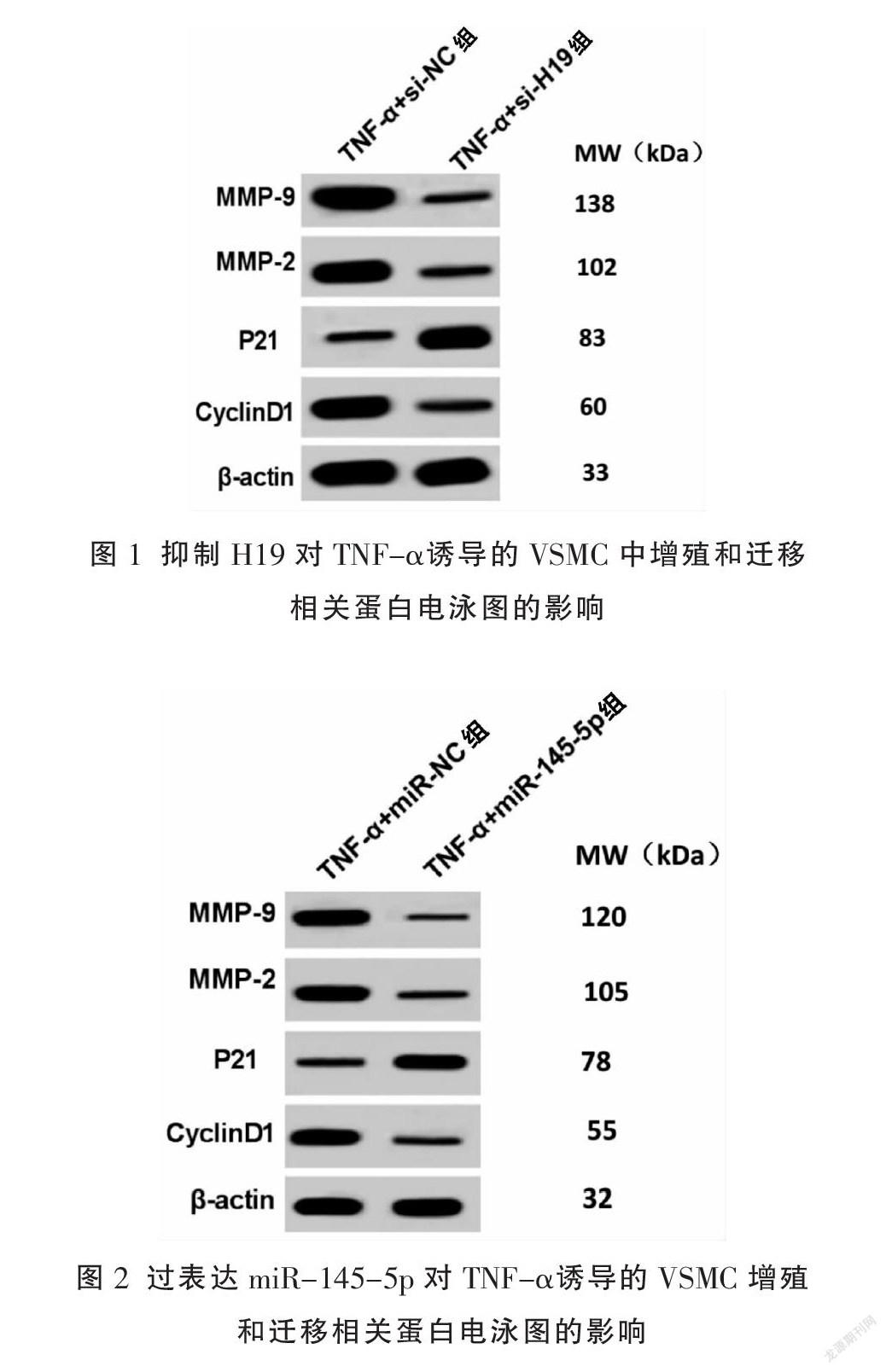
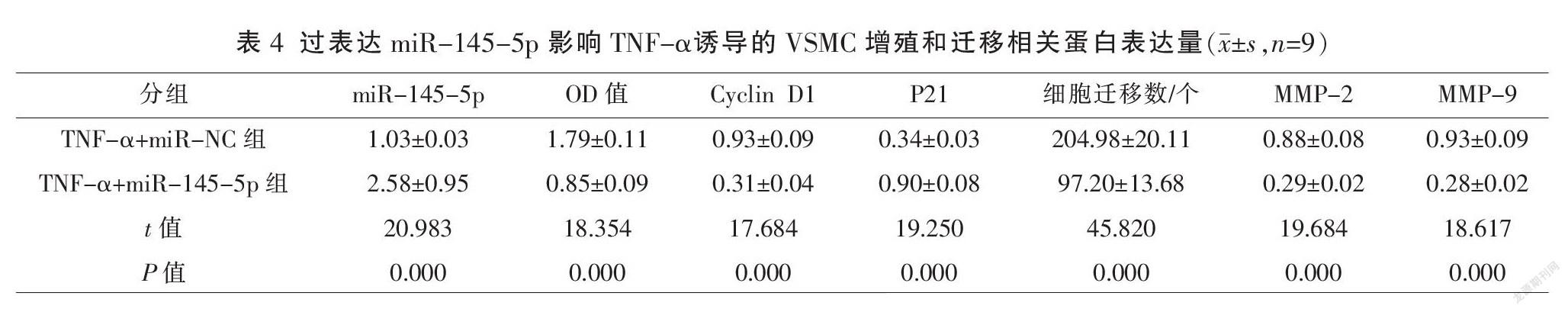
与TNF-α+si-NC组比较,TNF-α+si-H19组H19表达水平显著降低,OD值、Cyclin D1、细胞迁移数、MMP-2及MMP-9蛋白表达水平显著降低,P21蛋白表达水平显著升高(P<0.01)。见图1、表3。
2.3 过表达miR-145-5p对TNF-α诱导VSMC中的增殖和迁移的影响
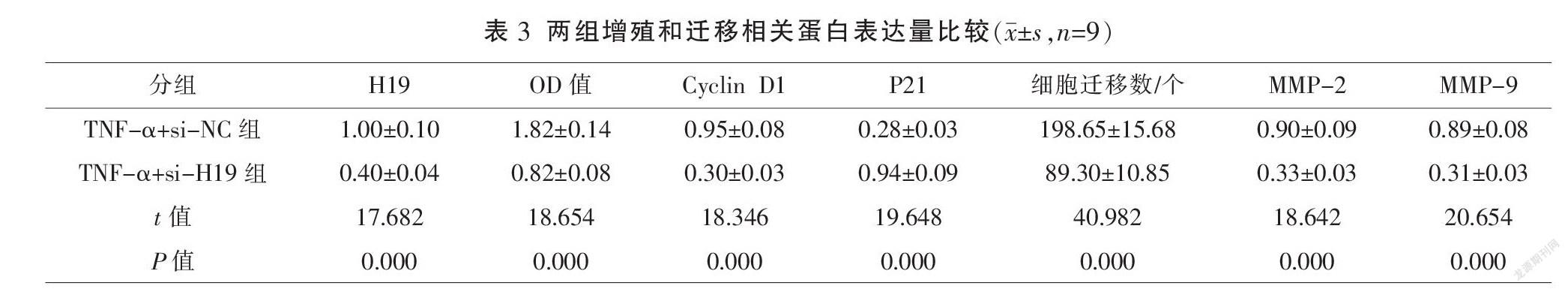
与TNF-α+miR-NC组比较,TNF-α+miR-145-5p组miR-145-5p表达水平显著降低,OD值、Cyclin D1、细胞迁移数、MMP-2及MMP-9蛋白表达水平显著降低,P21蛋白表达水平显著升高(P<0.01)。见图2、表4。
2.4 LncRNA-H19和miR-145-5p的靶向调控关系
通过生物信息学预测出LncRNA-H19和miR-145-5p的靶向关系,含有结合位点的WT或突变型MUT片段被克隆到pGL3荧光素酶载体中,分别称为WT-H19或MUT-H19,见图3。双荧光素酶报告实验结果显示,TNF-α+miR-145-5p组与TNF-α+miR-NC组比较,WT-H19荧光素酶活性显著性增高(P<0.01),MUT-H19荧光素酶活性差异无统计学意义(P>0.05)。見表5。
2.5 miR-145-5p表达对TNF-α诱导VSMC增殖和迁移相关蛋白的影响
与TNF-α+si-H19+anti-miR-NC组比较,TNF-α+si-H19+anti-miR-145-5p组OD值、Cyclin D1、细胞迁移数、MMP-2及MMP-9蛋白表达水平显著升高,P21蛋白表达水平显著降低(P<0.05)。见图4、表6。
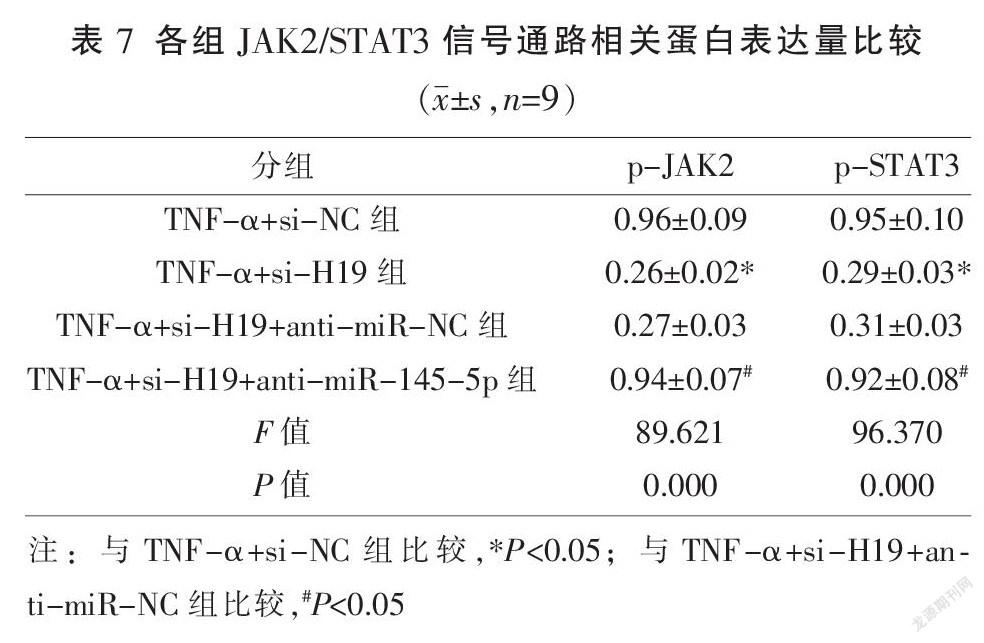
2.6 各组JAK2/STAT3信号通路相关蛋白表达
与TNF-α+si-NC组比较,TNF-α+si-H19组p-JAK2、p-STAT3蛋白表达显著降低(P<0.05);与TNF-α+si-H19+anti-miR-NC组比较,TNF-α+si-H19+anti-miR-145-5p组p-JAK2及p-STAT3蛋白表达显著升高(P<0.05)。见图5、表7。
3 讨论
平滑肌即无纹肌的通称,是被视为较横纹肌原始的一种肌肉。平滑肌除作为无脊椎动物的躯体肌而有广泛分布外,在脊椎动物除心肌之外,大部分内脏肌也是由平滑肌组成的。对于正常人,VSMC凋亡调控着动脉血管壁的细胞数量和血管稳态,在动脉粥样硬化发生发展过程中,VSMC迁移、增殖与细胞凋亡并存。在临床上,VSMC的结构一旦有所改变,就会引发高血压等较为严重的病症出现[11-12]。
LncRNA-H19位于细胞核内或胞质中,H19是最早被发现的有功能的LncRNA之一,它的序列高度保守,可通过多种模式参与调控生物学过程和疾病的发生发展,由于H19最早被证实在肺癌、卵巢癌、乳腺癌等多种癌症中表达上调,加速肿瘤细胞的增殖和侵袭,与肿瘤转移及预后密切相关,因此先前关于H19的研究大多集中在肿瘤领域。李峰等[13]报道:在MC3T3-E1细胞中LncRNA-H19被抑制后,H19表达量显著下降并激活miR-185-5p表达,验证了LncRNA-H19和 miR-185-5p有较强结合性,调控网络可能存在于成骨细胞的增殖分化过程中,H19通过ceRNA机制发挥作用,且LncRNA-H19可以有效降低miR-185-5p抑制MC3T3-E1细胞增殖和分化。
LncRNA-H19在血管重塑中发挥着重要作用[14]。近年来已有H19在心脑血管疾病中的研究报道:Viereck等[15]指出H19基因疗法可预防和逆转实验性压力超负荷引起的心力衰竭,H19充当抗心肌肥大的LncRNA代表,LncRNA-miRNA网络在调节细胞功能,包括代谢过程中起着重要作用,H19还可以通过竞争性结合let-7a促进VSMC增殖,导致血管负性重塑[16];miR-145是健康大鼠颈动脉平滑肌细胞中表达最丰富的miRNA,在VSMC的分化和增殖过程中扮演着重要角色,其上调会促进平滑肌细胞分化,而在细胞增殖时表达下降[17];miR-143/145团簇是通过协同调控一个包括kruppel样因子5(kruppel like factor 5, KLF5)、KLF4、心肌素的转录网络,建立的调节血管平滑肌可塑性的调节因子,驱动增殖性VSMC表型变化,从而导致巨噬细胞样特征的发展和VSMC摄取氧化低密度脂蛋白[18]。MiR-145进一步牵涉到促进血管平滑肌肌动蛋白和钙桥蛋白等血管平滑肌收缩标志物的变化[19],Lin等[20]发现LncRNA是通过直接靶向miR-145调控VEGF-A的表达促进卵巢癌的肿瘤生长与血管生成;研究[21]证实miRNA、hsa-mir-496、hsa-mir-151a、hsa-mir-296-3p、hsa-mir-148a、hsa-mir-365b-5p、hsamiR-3687、hsa-mir-454、hsa-mir-155-5p和hsa-mir-145-5p差异调节参与细胞黏附、血管生成、細胞周期、JAK-STAT信号传导的基因、MAPK信号传导、一氧化氮信号传导、VEGF信号传导和伤口愈合途径。李文婷等[22]研究指出miR-145靶向MMP-9表达抑制大鼠脑动脉VSMC增殖和迁移;另有研究[23]阐述IL-10通过JAK2/STAT3信号通路抑制VSMC凋亡;颜思阳等[24]研究发现活血荣络方可抑制miR-17 miRNA的表达,上调STAT3 mRNA的表达,提示活血荣络方可能通过调节STAT3-miR-17调控下游相关通路发挥作用。
基于以上,笔者推测LncRNA-H19靶向miR-145-
5p可能通过JAK2/STAT3信号通路调节TNF-α诱导的大鼠脑VSMC增殖和迁移,故以研究报道较少的LncRNA-H19和miR-145-5p两个指标作为切入点进行探讨,针对它们之间可能存在的靶向关系进行科学论证,本实验发现抑制LncRNA-H19和过表达miR-145-5p均可导致TNF-α组中增殖和迁移相关蛋白Cyclin D1、MMP-2、MMP-9表达显著降低,说明LncRNA-H19过表达可以促进平滑肌细胞周期的进程,它的上调可显著促进Cyclin D1的表达;荧光素酶报告检测系统经常用于RNA结合靶点的验证,本实验中,与TNF-α+miR-NC组比较,TNF-α+miR-145-5p组WT-H19荧光素酶活性增高,证实miR-145-5p已被H19靶向和调节,上调LncRNA-H19可以显著抑制miR-145-5p的表达,在VSMC中LncRNA-H19与miR-145-5p之间彼此抑制对方的表达,存在潜在的相互调控关系,故表明LncRNA-H19促进VSMC增殖、迁移及细胞活力的作用受miR-145-5p影响;在抑制miR-145-5p的同时过表达LncRNA-H19可见TNF-α组中p-JAK2、p-STAT3蛋白表达显著升高,反向验证了LncRNA-H19靶向miR-145-5p调节TNF-α诱导的大鼠脑VSMC增殖和迁移是通过JAK2/STAT3信号通路发挥作用的,且该过程可能受细胞外拮抗剂、膜受体、细胞质微环境和转录水平等多个层次的调控,但具体机制尚不明确且缺乏研究报道。
综上所述,干扰LncRNA-H19表达、上调miR-145-5p表达可抑制TNF-α诱导大鼠脑VSMC增殖和迁移,其作用机制可能与阻断JAK2/STAT3信号通路的磷酸化有关,具体作用靶点和调控机制有待更深入的探讨,或可为相关疾病的诊治与研究提供新指标和新思路。
参考文献
[1] ISLAM T. Impact of statins on vascular smooth muscle cells and relevance to atherosclerosis[J]. The Journal of Physiology, 2020, 598(12): 2295-2296.
[2] MOKHASHI N, CHOI R Y, CICALESE S, et al. Transduction efficiency of adenovirus vectors in endothelial cells and vascular smooth muscle cells[J]. Journal of Cardiovascular Pharmacology, 2020, 75(6): 603-607.
[3] OSMAN I, WANG L, HU G Q, et al. GFAP (glial fibrillary acidic protein)-positive progenitor cells contribute to the development of vascular smooth muscle cells and endothelial cells-brief report[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2020, 40(5): 1231-1238.
[4] LI J, CAO L T, LIU H H, et al. Long non coding RNA H19: An emerging therapeutic target in fibrosing diseases[J]. Autoimmunity, 2020, 53(1): 1-7.
[5] WANG Y F, DU L T, YANG X M, et al. A nomogram combining long non-coding RNA expression profiles and clinical factors predicts survival in patients with bladder cancer[J]. Aging, 2020, 12(3): 2857-2879.
[6] LIU H, YAN F. Gene regulation network modeling and mechanism analysis based on microRNA-disease related data[J]. Systems Medicine, 2021, 1:52-62.
[7] 张 华,李晓波.microRNAs与脑血管疾病研究进展[J].实用老年医学,2020,34(6):526-529.
[8] CHENG Y H, LIU X J, YANG J, et al. microRNA-145, a novel smooth muscle cell phenotypic marker and modulator, controls vascular neointimal lesion formation[J]. Circulation Research, 2009, 105(2): 158-166.
[9] KABIRI M, HEMMATPOUR A, ZARE F, et al. Paroxetine modulates immune responses by activating a JAK2/STAT3 signaling pathway[J]. Journal of Biochemical and Molecular Toxicology, 2020, 34(5): e22464.
[10] CHEN K, ZHAO Z W, WANG G, et al. Interleukin-5 promotes ATP-binding cassette transporter A1 expression through miR-211/JAK2/STAT3 pathways in THP-1-dervied macrophages[J]. Acta Biochimica et Biophysica Sinica, 2020, 52(8): 832-841.
[11] WANG X, BHULLAR K S, FAN H B, et al. Regulatory effects of a pea-derived peptide leu-arg-trp (LRW) on dysfunction of rat aortic vascular smooth muscle cells against angiotensin II stimulation[J]. Journal of Agricultural and Food Chemistry, 2020, 68(13): 3947-3953.
[12] CHOU E L, CARDENAS C L, CONRAD M F, et al. Vascular smooth muscle cells release protease nexin-1 in cell models of atherosclerosis and human carotid tissue[J]. Journal of Vascular Surgery, 2020, 72(1): e262-e263.
[13] 李 峰,劉翠中,伍 媛.LncRNA-H19通过抑制miR-185-5p的表达促进成骨细胞的增殖[J].湖南师范大学学报(医学版),2021, 18(4):13-17.
[15] VIERECK J, BüHRKE A, FOINQUINOS A, et al. Targeting
muscle-enriched long non-coding RNA H19 reverses pathological cardiac hypertrophy[J]. European Heart Journal, 2020, 41(36): 3462-3474.
[16] 孙伟峰. LncRNA H19通过靶向调控CyclinD1促进血管重塑的机制研究[D].沈阳:中国医科大学,2019.
[17] NAZARI-JAHANTIGH M, WEI Y Y, NOELS H, et al. microRNA-155 promotes atherosclerosis by repressing Bcl6 in macrophages[J]. The Journal of Clinical Investigation, 2012, 122(11): 4190-4202.
[18] 向 龙. miRNA-145促进胚胎干细胞向血管平滑肌细胞诱导分化的实验研究[D].遵义:遵义医科大学,2020.
[19] HUANG R S, HU G Q, LIN B, et al. microRNA-155 silencing enhances inflammatory response and lipid uptake in oxidized low-density lipoprotein-stimulated human THP-1 macrophages[J]. Journal of Investigative Medicine: the Official Publication of the American Federation for Clinical Research, 2010, 58(8): 961-967.
[20] LIN X J, YANG F, QI X R, et al. LncRNA DANCR promotes tumor growth and angiogenesis in ovarian cancer through direct targeting of miR-145[J]. Molecular Carcinogenesis, 2019, 58(12): 2286-2296.
[21] KASIVISWANATHAN D, CHINNASAMY PERUMAL R, BHUVANESWARI S, et al. Interactome of miRNAs and transcriptome of human umbilical cord endothelial cells exposed to short-term simulated microgravity[J]. Nature Partner Journals Microgravity, 2020, 6:18.
[22] 李文婷,邹 伟,曹 琳,等. miR-145靶向抑制MMP-9表达对大鼠脑动脉血管平滑肌细胞增殖和迁移的影响[J].山东医药,2017,
57(26): 25-28.
[23] MA L, ZHENG H B, ZHANG T. IL-10 suppress vascular smooth
muscle cell apoptosis via JAK2/STAT3 signaling pathway and its mechanism of action in atherosclerosis[J]. Minerva Endocrinologica, 2019, 44(4): 402-405.
[24] 颜思阳,杨仁义,刘利娟,等.基于“STAT3/miR-17”反馈环探讨活血荣络方对脑缺血再灌注损伤模型大鼠的保护作用机制[J].湖南中医药大学学报,2021,41(4):489-497.
