聚己内酯多通道神经导管的制备及表征
2022-03-23王菊粉曾嘉梅徐康丽李金瑞柯勤飞
王菊粉, 曾嘉梅, 徐康丽, 李金瑞, 黄 晨, 柯勤飞
(东华大学 纺织学院, 上海 201620)
交通和建筑事故、自然灾害等都会造成人体周围神经损伤(peripheral nerve injury, PNI)[1-2],导致患者的运动功能完全丧失,降低其生活质量,同时增加社会经济负担[3]。因此,PNI的修复与再生成为神经科学领域的研究热点,常用的治疗方法主要包括缝合手术、自体或异体移植以及人工神经导管桥接[4]。
对于小间隙(<5 mm)[5]PNI,缝合手术是一种较好的治疗方法,但是这种方法存在神经束错对和神经断端卷曲,会造成组织增生的缺陷[6-7]。而对于大间隙(>5 mm)PNI,则需要移植物来桥接断开的神经残端。自体神经移植依然是目前临床治疗大间隙PNI的“金标准”[8-11],该过程通常包括从患者腓肠神经获取供体移植物,然后进行移植以桥接损伤部位。自体移植的局限性包括永久性供体部位并发症、供体“牺牲”神经功能丧失、需要多次侵入性手术、感染风险增加[12]等。此外,在严重病例中,可用于自体移植的组织有限。而异体神经移植很容易产生异体间的排斥反应[13],需要使用系统免疫抑制剂,直到施万细胞和轴突萌芽再生,但是患者在这期间有发生感染或形成肿瘤的风险。
由于缝合手术、自体移植和异体移植存在许多局限性,组织工程技术成为了克服自体移植局限性的潜在解决方案[14-15]。典型的组织工程方法专注于通过植入天然、合成或半合成的基于生物材料的NGC(nerve guidance conduit)[16-18]来治疗损伤。最初生物材料被设计成简单的圆柱形管状中空结构[19],但是这种NGC的管壁比表面积小,不利于施万细胞的黏附和增殖。此外,在大间隙PNI的修复中,中空型NGC的力学性能不足,降解期间往往会出现块状崩塌现象,对再生神经产生压迫。Zhao等[20]引入多个管腔内通道来构建多通道神经导管,其设计是模仿神经束的结构。文献[21-22]研究表明:导管内纵向排列的通道可以作为合成基底层所需的大比表面积微管发挥作用,对神经细胞的延伸、附着、增殖和施万细胞的迁移有显著的积极效应;在导管内,纵向多通道可以减少轴突分支的分散,有利促进轴突的延长。此外,纵向多通道可以减少再生轴突的错向率。因此,多通道NGC被认为是比单通道NGC更合适的候选方案。
在现有研究基础上设计一种制备多通道神经导管的牺牲模板,并结合冷冻干燥技术,制备了具有约20个通道的聚己内酯(polycaprolactone, PCL)多通道神经导管用以修复间隙大于2 cm的PNI,并通过加入水溶性致孔剂聚乙烯吡咯烷酮(polyvinylpyrrolidone, PVP)提高PCL多通道神经导管的比表面积和孔体积,得到PCL/PVP多通道神经导管。
1 试验部分
1.1 试验材料
PCL,Mn=80 000,美国Sigma-Aldrich公司;PVP,美国Sigma-Aldrich公司;丙酮,分析纯,国药集团化学试剂有限公司;水溶性维纶纱线,直径约为0.15 mm,俊辉纺织;铁架,边长10 cm,封腾工艺品;塑料空心管,直径3 mm,四季鲜奶吧用品;小鼠胚胎成纤维细胞(NIH-3T3),美国Sigma-Aldrich公司;DMEM(dulbecco′s modified eagle medium)高糖培养基、双抗(青霉素+链霉素),美国Hyclone公司;胎牛血清,美国Gibco公司;活/死细胞活力检测试剂盒,赛默飞世尔科技公司。
1.2 试验方法
1.2.1 溶液的制备
将1.8 g PCL加入到8.2 g丙酮中,并在50 ℃水浴锅中搅拌12 h,使得PCL完全溶解于丙酮中,形成混合均匀的PCL溶液。
向PCL溶液中加入0.5 g的 PVP,继续在50 ℃水浴锅中搅拌,直至溶液混合均匀形成PCL/PVP溶液。
1.2.2 牺牲模板的制备
牺牲模板的制备流程共分为6个步骤,如图1所示。由图1可知:先准备一个边长10 cm的立方体铁架,选铁架平行的4条边套6根彼此相互平行的橡皮筋;再沿上述铁架4条平行边的垂直方向的4条边套6根彼此相互平行的橡皮筋;然后将维纶纱线穿过两个方向上橡皮筋交叉形成的两两相对的孔,使得铁架上下两面之间具有20根互不相交的维纶纱线;然后将两个方向上的橡皮筋分别收紧聚拢,使铁架上下两面之间形成具有20根相互平行的维纶纱线束;最后将直径3 mm的塑料空心管沿侧面切开后包裹在水溶性维纶纱线束的外侧,并用透明胶带在空心管切口处进行封口处理,避免向塑料空心管中注入溶液时发生溶液侧溢。本文所用维纶纱线直径约为0.15 mm,其常温即溶、无毒且能被生物降解。由步骤5图片特写部分可以看出,维纶纱线绕在外层的橡皮筋上,而内层橡皮筋的作用是将每根维纶纱线分离开。试验中溶液从步骤6图片特写部分用红色线标注的位置注入。

图1 牺牲模板的制备步骤
1.2.3 多通道神经导管的制备
用5 mL的医用注射器将PCL溶液和PCL/PVP溶液注入牺牲模板的空心管中制备样品,然后将牺牲模板放入冰箱中冷冻24 h,再将其置入冷冻干燥机中进行冷冻干燥处理。冷冻干燥处理8 h后,将带有样品的空心管从牺牲模板上剪下,并将样品从空心管中抽出放入去离子水中浸泡12 h,使其内部的水溶性维纶纱线完全溶解,形成多通道导管,同时也使含有PVP样品中的PVP得到充分溶解,在通道间形成可供物质交换的孔结构。最后将经水处理形成的样品放入40 ℃烘箱中烘干,得到通道数等于或略少于20的多通道神经导管,原因是在向牺牲模板的空心管中注入溶液时,相邻的维纶纱线可能会合并在一起,导致两根或多根纱线形成一个通道,致使得到的多通道神经导管的通道数少于试验预设的通道数。
1.3 测试与表征
1.3.1 多通道神经导管的形貌表征
将制备的PCL、PCL/PVP两种多通道神经导管放入液氮中冷冻充分后取出,用美工刀快速切取多通道神经导管的横截面和纵截面样品,然后将样品黏附在表面贴有导电胶的电镜台上。制样完成后,对样品进行一定时间的低温喷银处理,再把电镜台放入观察室抽真空,然后进行测试。采用试验仪器为TM 3000型扫描电子显微镜。
1.3.2 比表面积及孔结构表征
PCL、PCL/PVP两种多通道神经导管在30 ℃真空脱气24 h,以保证数据的准确性。然后采用ASAP 2460 型多站扩展式全自动快速比表面积与孔隙度分析仪测试PCL和PCL/PVP两种多通道神经导管样品的比表面积和孔径分布,基于低温氮物理吸附静态容量法原理得到多通道神经导管的氮气(N2)吸附-脱附等温曲线及孔径分布情况。
1.3.3 热失重分析(TGA)
采用国产TGA 8000型热失重分析仪对PCL颗粒、PVP颗粒以及PCL多通道神经导管和PCL/PVP多通道神经导管的热分解曲线进行测绘,设定升温范围为50~600 ℃,升温速率为50 ℃/min。
1.3.4 傅里叶红外光谱(FT-IR)表征
采用美国的NicoletIn10 MX/Nicolet6700 型傅里叶红外光谱仪对PCL颗粒、PVP颗粒以及PCL多通道神经导管和PCL/PVP多通道神经导管进行红外分析。
1.3.5 X射线衍射(XRD)表征
采用日本的D/max-2550VB+/PC型18 kW转靶X射线衍射仪对PCL颗粒、PVP颗粒以及PCL多通道神经导管和PCL/PVP多通道神经导管进行XRD分析。
1.3.6 拉伸断裂性能测试
由于神经导管必须承受缝合过程中的机械张力,同时还要承受神经再生过程中生理活动所施加的负荷,本试验采用YG026 MB 型多功能电子织物强力机测定多通道神经导管的拉伸断裂性能。
1.3.7 细胞相容性测试
将制备的PCL多通道神经导管和PCL/PVP多通道神经导管分别切割成24孔板大小、厚度约1 mm的薄片,每种多通道神经导管各制备24个薄片分别平铺于24孔板内,将样品用紫外灯照射12 h,然后向每孔添加500 μL含有体积分数分别为10%的胎牛血清和1%的双抗DMEM高糖培养液,浸润12 h,再分别向每个孔内种植105个NIH 3T3细胞,之后置于37 ℃的二氧化碳培养箱内培育。在培育的第2和5 d,用活/死细胞染色试剂盒对细胞进行染色,于荧光显微镜下观察细胞的存活状态,并用扫描电子显微镜观察细胞的生长状态。
2 结果与讨论
2.1 形态与结构
制备的PCL多通道神经导管和PCL/PVP多通道神经导管的外观图像如图2所示。

图2 多通道神经导管的外观图像
由图2可知,这两种多通道神经导管的直径均为(2.7±0.3) mm,长度均大于2 cm。
制备的PCL多通道神经导管和PCL/PVP多通道神经导管的横截面SEM图如图3所示。
由图3可知,设计的约20个通道的神经导管,由于水溶性维纶纱线之间合并,导致通道数可能少于20。


图3 多通道神经导管的横截面SEM图
PCL多通道神经导管和PCL/PVP多通道神经导管的纵截面SEM图如图4所示。由图4可知,制备的多通道神经导管通道内形成了直径为(2.7±0.3) mm的内通道结构。对比这两种多通道神经导管的截面SEM图,可以明显观察到PCL多通道神经导管的结构比较致密,而PCL/PVP多通道神经导管具有更高的孔隙率,而且内通道间存在孔结构,这种孔结构有利于通道间进行物质交换,更符合仿生结构。

图4 多通道神经导管的纵截面SEM图
2.2 比表面积和孔结构分析
对制备的PCL多通道神经导管和PCL/PVP多通道神经导管进行N2吸附-脱附分析,得到PCL多通道神经导管和PCL/PVP多通道神经导管的比表面积分别约为0.67、1.35 m2/g,后者比表面积约为前者的2倍。这表明在制备多通道神经导管的溶液中加入PVP,可以有效地增加多通道神经导管的比表面积,更有利于施万细胞的黏附和生长。
PCL多通道神经导管和PCL/PVP多通道神经导管的N2吸附-脱附等温曲线图和孔径分布图如图5所示。由图5可知,这两种多通道神经导管的N2吸附-脱附等温曲线形状相同,根据国际纯粹与应用化学联合会(IUPAC)提供的物理吸附等温线分类,这种曲线属于IV型[23],由于吸附、脱附等温曲线不重合,可以观察到有明显的H3型等温回滞环。在相对低压区域,N2的吸收量缓慢上升,表明制备的多通道神经导管中存在微孔(孔径<2.0 nm)结构;在相对高压的区域,N2的吸收量有一个陡峭的上升,表明制备的多通道神经导管中存在介孔(孔径为2.0~50.0 nm)结构[24]。在相对压力为1时,PCL/PVP多通道神经导管明显比PCL 多通道神经导管有更高的N2吸附量,说明在制备溶液中加入PVP可以增加神经导管的孔体积,使多通道神经导管的孔隙率更大。试验测得PCL多通道神经导管的主要孔径为2.0~60.0 nm,PCL/PVP多通道神经导管的主要孔径为1.4~40.0 nm,这两种多通道神经导管的孔结构均以介孔为主。对比两种多通道神经导管的孔径分布曲线可以发现,PCL/PVP多通道神经导管的孔径分布曲线拥有更大的面积,说明在制备多通道神经导管的溶液中加入适量PVP可以使其具有更多的介孔体积,而孔径小于30.0 nm的介孔[24]有利于多通道神经导管的通道间进行物质交换。
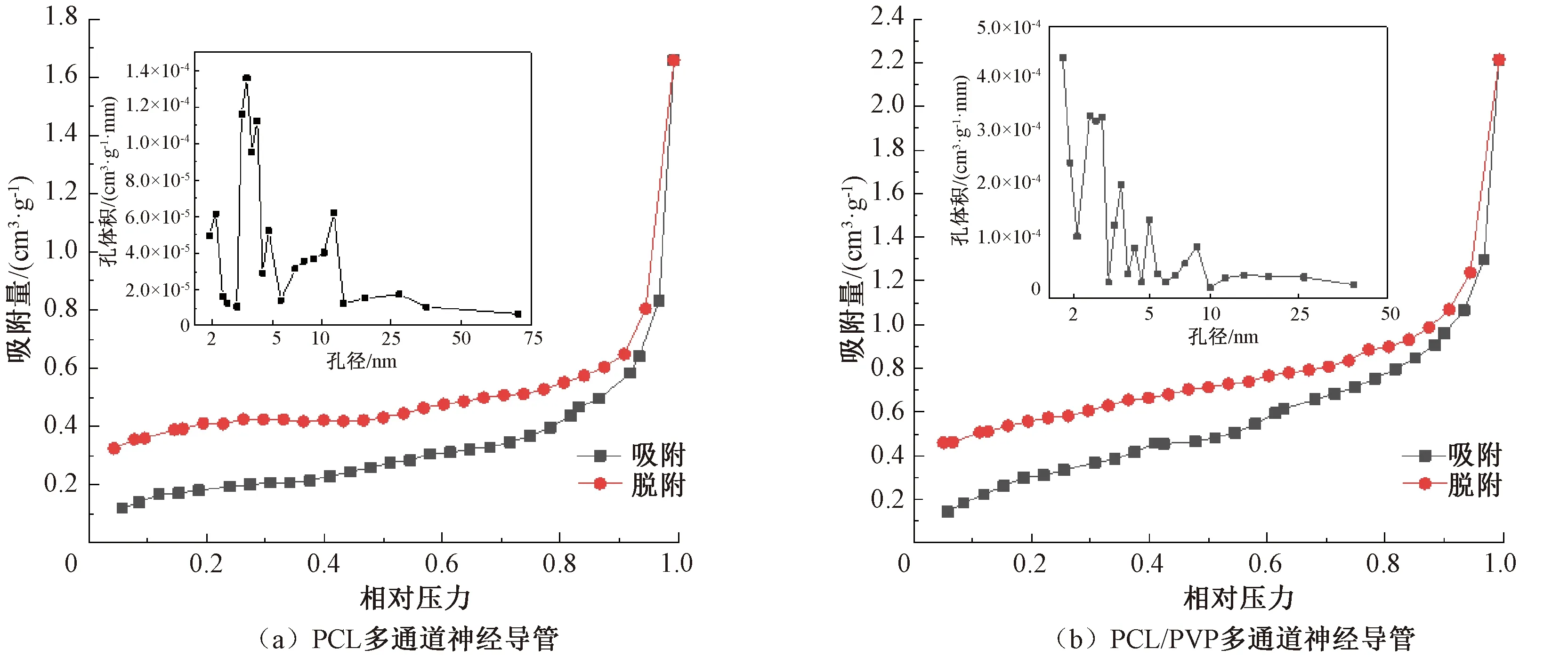
图5 多通道神经导管的N2吸附-脱附等温曲线图和孔径分布图
2.3 TGA分析
制备的PCL多通道神经导管和PCL/PVP多通道神经导管的TGA曲线如图6所示。
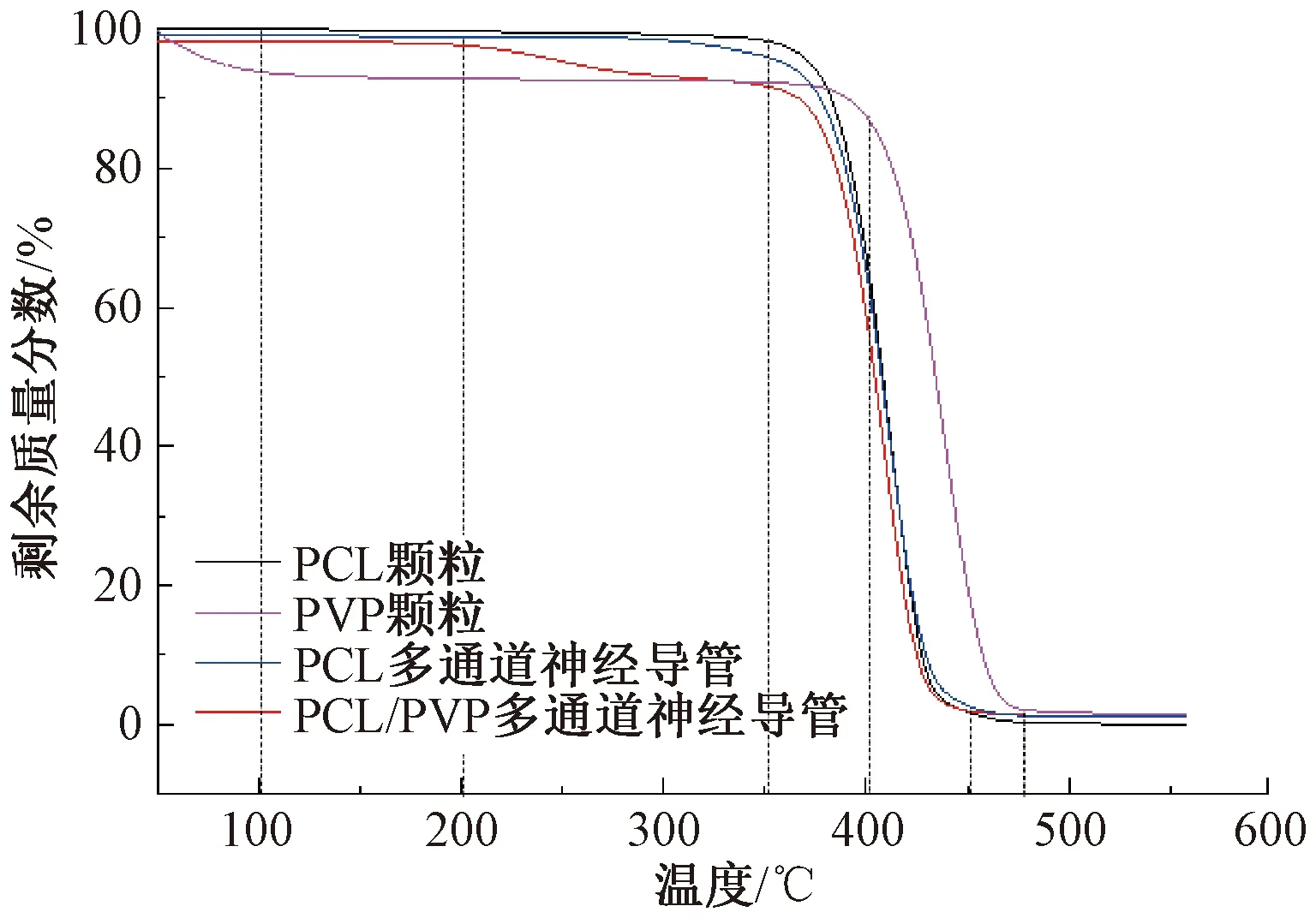
图6 PCL颗粒、PVP颗粒、PCL多通道神经导管和PCL/PVP多通道神经导管的TGA曲线
由图6可知,PCL多通道神经导管和PCL/PVP多通道神经导管的TGA曲线与PCL颗粒的TGA曲线形态相似,在350 ℃后质量开始急剧下降,说明PCL在此温度开始大量分解,到450 ℃时质量逐渐趋于0,PCL完全分解,表明制备的多通道神经导管具有良好的热稳定性。而PVP颗粒的TGA曲线在50~100 ℃ 有一段质量损失,是PVP颗粒具有吸水性所导致的。在400~480 ℃,PVP质量急剧下降,说明PVP在此温度范围内分解。PCL/PVP多通道神经导管在200~350 ℃有一段质量损失,可能是多通道神经导管中未烘干水份的蒸发以及PCL/PVP多通道神经导管的孔体积中含有的空气被释放所导致,说明制备多通道神经导管的过程中引入PVP并不会对神经导管的热稳定性造成明显影响。
2.4 FTIR分析
PCL颗粒、PVP颗粒以及PCL和PCL/PVP两种多通道神经导管的红外光谱图如图7所示。
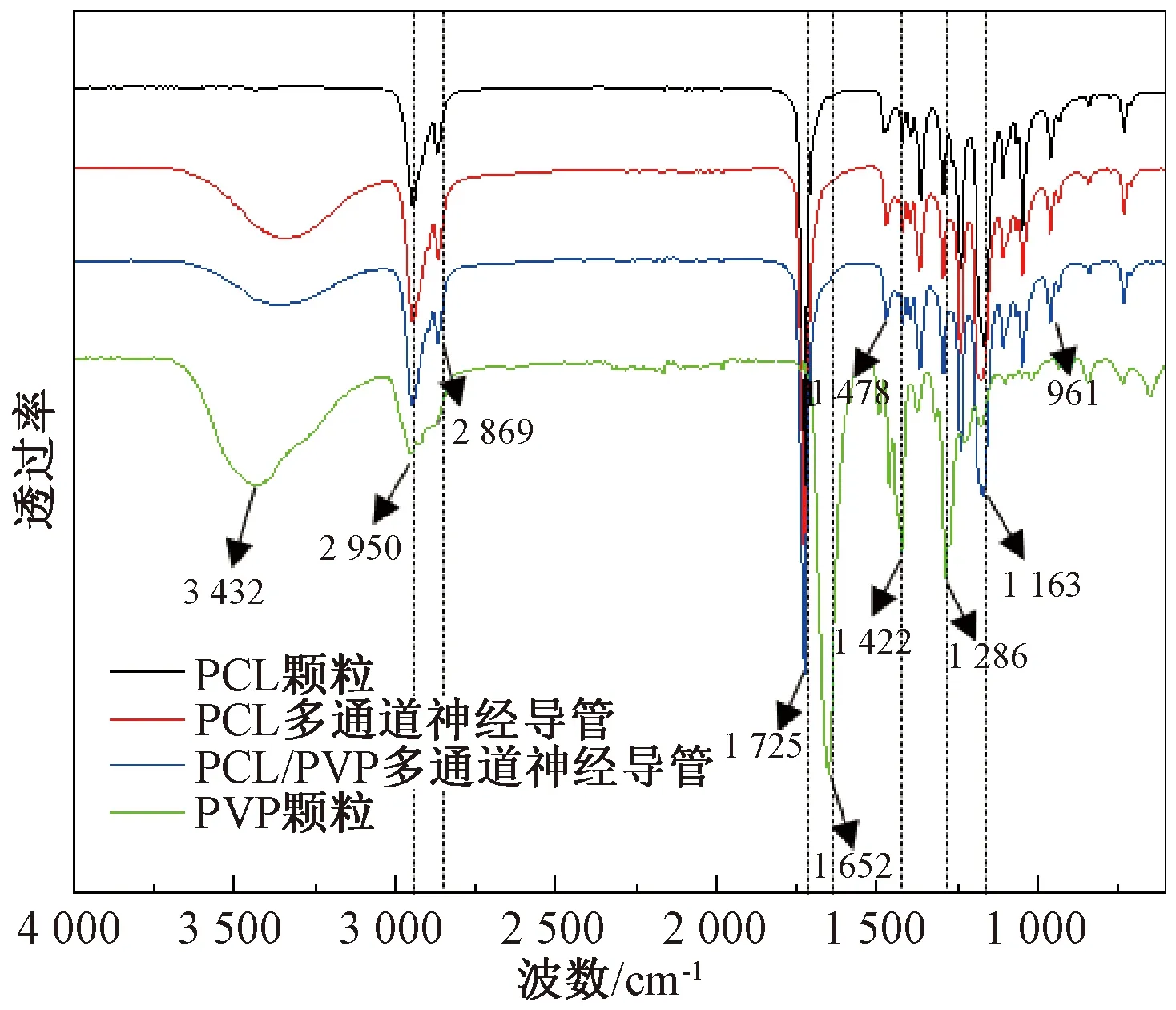
图7 PCL颗粒、PVP颗粒、PCL多通道神经导管和PCL/PVP多通道神经导管的红外光谱图

2.5 XRD分析
PCL颗粒、PVP颗粒、PCL和PCL/PVP两种多通道神经导管的XRD曲线如图8所示。由图8可知,制备的PCL多通道神经导管的衍射峰与PCL颗粒的衍射峰一致,2θ在 21.57°和23.85°处分别出现了一个很强的衍射吸收峰和一个较弱的衍射吸收峰,与文献[27]中PCL的特征衍射吸收峰一致,因此可以说明在多通道神经导管的制备过程中没有破坏PCL的晶型。而制备的PCL/PVP多通道神经导管在2θ=10.54°处有一个较弱的衍射峰,属于PVP的特征峰,说明制备的PCL/PVP多通道神经导管中可能含有少量未被水解完全的致孔剂PVP。PVP属于可生物降解材料,具有生物相容性,因此制备的PCL/PVP多通道神经导管中含有少量PVP并不会影响其在组织工程上的使用。
2.6 拉伸断裂性能
对制备的导管直径为2.5 mm、长度为2 cm的PCL和PCL/PVP两种多通道神经导管进行轴向拉伸断裂性能测试,得到应力-应变曲线如图9所示。由图9可知,PCL多通道神经导管在应变为20%时应力达到最大值2.5 MPa,而PCL/PVP多通道神经导管在应变为12.5%时应力达到最大值1.75 MPa,这是由于PVP使得多通道神经导管拥有更多孔体积,从而降低了多通道神经导管的力学性能。本文制备的多通道神经导管的力学性能与文献[28]中报道的PCL 神经导管的力学性能基本一致,表明这种多通道神经导管可用于修复间隙大于2 cm的PNI。
2.7 细胞相容性
NIH 3T3细胞分别在PCL和PCL/PVP两种多通道神经导管的样品上生长2和5 d后,活细胞(绿色)和死细胞(红色)的荧光现象如图10所示。由图10可知,两种多通道神经导管材料均支持NIH3T3细胞的生长,在培养的第2 d,细胞数量较少,培养的第5 d,细胞数量明显增加。在细胞培养的2和5 d,PCL/PVP多通道神经导管比PCL多通道神经导管表面有更多的活细胞,而死细胞的数量差距不大,说明PCL/PVP多通道神经导管更有助于细胞生长,这表明水溶性致孔剂PVP增加了多通道神经导管的孔隙率和比表面积,更有利于细胞的黏附和增殖。
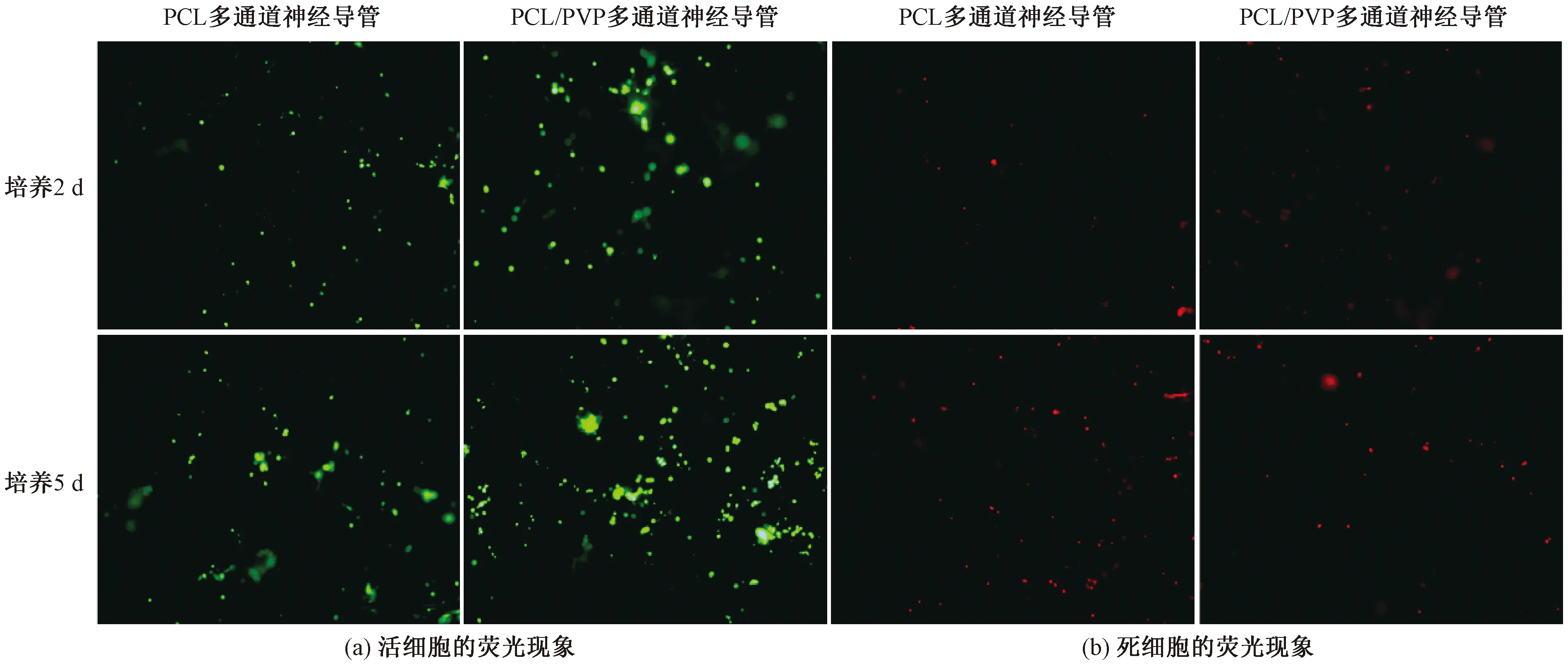
图10 活死细胞荧光染色图片
NIH 3T3细胞在PCL/PVP多通道神经导管样品材料上的生长情况如图11所示,其中绿色部分为细胞。由图11可知,NIH 3T3细胞在PCL/PVP多通道神经导管样品上生长2 d时,细胞数量较少,当细胞生长5 d时,细胞铺展在PCL/PVP多通道神经导管表面形成细胞聚集区。由此说明,制备的PCL/PVP多通道神经导管可以使细胞增殖和生长,具有细胞相容性。

图11 NIH 3T3细胞生长2和5 d的SEM图
3 结 语
本研究结合冷冻干燥技术和牺牲模板法制备出长度大于2 cm,且具有约20个通道的PCL多通道神经导管和PCL/PVP多通道神经导管。将这两种多通道神经导管制备的薄片通过活/死细胞染色试剂盒对细胞染色后,利用荧光显微镜观察细胞存活状态,用扫描电子显微镜观察其生长状态。试验结果表明,在制备PCL/PVP多通道神经导管时引入的PVP可以使神经导管具有更好的细胞相容性。相较于其他多通道神经导管的制备方法,冷冻干燥技术和牺牲模板法结合的制备方法工艺简单且成本低廉。但由于目前条件的限制,无法进一步进行动物体内试验,在未来的研究中,将进行更加全面系统的生物相容性评价和动物试验。
