ZOOMit IVIM成像评估子宫内膜癌病理分级及Ki-67表达的价值
2022-03-21王芳刘颖张宇威马娟微叶兆祥
王芳,刘颖,张宇威,马娟微,叶兆祥
子宫内膜癌(endometrial cancer,EC)是女性生殖系统常见恶性肿瘤,在我国发病率仅次于宫颈癌,在西方部分发达国家已占据首位[1-2]。病理分级是评价EC恶性程度的重要指标之一[3-4];核抗原蛋白Ki-67可反应细胞分裂及增殖活性,其表达指数与肿瘤进展密切相关[5]。术前准确评估EC病理分级及Ki-67表达有助于判断患者预后及制定个性化的治疗方案。
磁共振成像是EC患者术前首选的影像学检查方法,其功能成像序列体素内不相干运动(intravoxel incoherent motion,IVIM)是DWI的进阶模型,无需对比剂,一次成像即可同时获得组织内水分子扩散及微循环灌注信息[6],多项研究显示相对传统DWI单指数计算模型,IVIM更有助于精准表征组织微观结构特征[7-8]。由于需要多b值采集图像,定量参数对图像信噪比敏感,IVIM对成像设备及技术要求较高[9]。既往IVIM研究多采用常规单次激发平面回波成像(single-shot echo-planar imaging,SS-EPI)技术,研究显示SS-EPI成像存在图像空间分辨率低、伪影出现几率高等不足,在高场强下表现更为显著。有学者在头颈部肿瘤的研究中发现,采用ZOOMit成像可显著提高DWI图像质量[10-11]。本次研究拟前瞻性搜集子宫内膜癌患者,探讨ZOOMit技术在IVIM成像中的可行性以及ZOOMit IVIM成像在术前评估子宫内膜癌病理分级及Ki-67表达中的价值。
材料与方法
1.临床资料
前瞻性收集2020年6月-2021年3月在天津医科大学肿瘤医院就诊的65例子宫内膜样癌患者。病例纳入标准为:①活检病理示子宫内膜癌并于活检术后5~7天接受MRI检查;②MRI检查前未接受内分泌、放化疗等内膜癌相关治疗;③无MRI检查禁忌症。排除标准为:①图像质量欠佳或肿瘤体积小,无法有效勾画ROI;②未在本院行手术治疗或MRI检查与手术时间间隔超过14天;③术后病理示非子宫内膜样癌。本次入组患者年龄37~77岁,中位年龄52岁,绝经前32人,绝经后33人。本研究经天津医科大学肿瘤医院伦理委员会批准,所有入组患者均签署知情同意书。
2.MRI扫描方法
采用Siemens Magnetom Skyra 3.0T超导MR扫描仪和16通道相控阵体部线圈。检查前嘱患者适度憋尿。扫描序列包括常规横轴面T1WI,冠状面、矢状面T2WI,横轴面抑脂T2WI(FOV 360 mm×280 mm,层厚6 mm,层间距2 mm),小视野斜轴位T2WI(FOV 280 mm×280 mm,层厚6 mm,层间距2 mm),常规横轴面及矢状面DWI(FOV 360 mm×280 mm,层厚4 mm,层间距2 mm),斜轴位ZOOMit IVIM(FOV 190 mm×106 mm,TR 4100 ms,TE 75 ms,矩阵56×100)及矢状面T1WI多期动态增强扫描。其中入组的25例患者另加扫斜轴位SS-EPI IVIM序列(FOV 190 mm×105 mm,TR 4700 ms,TE 75 ms,矩阵44×80)。斜轴位ZOOMit IVIM及SS-EPI IVIM均垂直于子宫长轴位扫描,扫面范围参考小视野斜轴位T2WI,层厚3 mm,层间距0 mm,b=0、20、40、80、120、200、400、800 s/mm2,激励次数选择2(b=0~400 s/mm2)、4(b=800 s/mm2)。
3.图像质量评价
主观评估:由两名具有10年以上腹盆部影像诊断经验的副主任医师独立在工作站(Syngo via)上从几何失真、解剖细节及伪影三个方面对斜轴位ZOOMit IVIM、SS-EPI IVIM图像进行评分。评分标准如下[12-13]:几何失真:1为极度失真;2为存在失真;3为图像局部失真;4为轻微失真;5为可能无失真;6为无失真。解剖细节:1为极度模糊,解剖细节无法显示;2为模糊,病灶边界显示不清;3为图像局部模糊,影响病灶边界显示;4为轻度模糊,病灶边界显示欠清;5为解剖细节显示良好;6为解剖细节显示佳。伪影:1为极度严重伪影,图像显示不清;2为严重伪影,影响图像显示;3为图像局部存在伪影;4为轻微伪影;5为可能无伪影;6为图像清晰,无伪影。
客观评价:测量两种技术成像的信噪比(signal to noise radio,SNR)及对比信噪比(contrast to noise radio,CNR),计算公式如下:SNR=SI癌灶/SD背景,其中SI癌灶代表癌灶的信号强度,SD背景代表背景噪声信号的标准差(此次研究选择宫腔周围信号均匀区的脂肪组织作为背景噪声被试对象);CNR=SI癌灶/SD背景-SI肌层/SD背景,其中SI肌层代表子宫正常肌层的信号强度[13]。测量过程:由一名具有五年工作经验的放射技术人员参考斜轴位T2WI图像,分别在b=800 s/mm2斜轴位ZOOMit IVIM及SS-EPI IVIM图像上(相较其余b值图像,b=800 s/mm2图像病灶及周围肌层显示皆较为清晰)手动勾画兴趣区(region of interest,ROI),ROI面积取值不低于30 mm2,重复测量三次取均值作为结果并记录。每例图像ROI勾选的层面、位置及面积在两组IVIM图像上保持一致。
4.定量参数测量
将65例患者斜轴位ZOOMit多b值DWI图像导入后处理工作站(Body Diffusion Toolbox),通过软件分析自动生成标准扩散系数ADC图、真扩散系数D图、伪扩散系数D*图及灌注分数f图。由进行图像主观评分的两名副主任医师在生成的ADC图上独立进行ROI勾画:过程中参考小视野斜轴位T2WI、DWI及多期动态增强图像,选取肿瘤显示最大层面,沿病变内侧缘不规则形勾画[14],避开层面内非实性区如出血、坏死等。勾画完成后复制ROI至D图、D*图及f图(勾画示例见图1a~d、2a~d)。
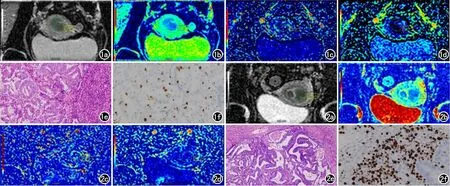
图1 患者,65岁,子宫内膜样癌,G2级,局灶浅肌层浸润。a)ADC图呈低信号,ADC值为0.849×10-3mm2/s; b)D图示D值为0.802×10-3mm2/s;c)D*图示D*值为17.041×10-3mm2/s;d)f图示f值为0.837;e)病理诊断为G2级(×400,HE);f)Ki-67指数约40%。 图2 患者,56岁,子宫内膜样癌,G3级,浅肌层浸润。a)ADC图呈低信号,ADC值为0.785×10-3mm2/s;b)D图示D值为0.742×10-3mm2/s;c)D*图示D*值为18.670×10-3mm2/s;d)f图示f值为0.672;e)病理诊断为G3级(×400,HE);f)Ki-67指数约80%。
两位医师另测量其中25位患者基于SS-EPI成像的IVIM定量参数D值,ROI勾画的层面、位置及面积与ZOOMit IVIM图像保持一致。
5.病理判定标准
患者手术标本均由病理科医师依据标准病理程序处理。病理分级:依据腺体结构和实性区的比例以及腺上皮细胞核的异型性分为三级:低级别(实性结构比例≤5%,G1)、中级别(实性结构比例6%~50%,G2)、高级别(实性结构比例>50%,G3)。Ki-67指数:肿瘤组织切片染色使用中杉金桥公司的鼠Ki-67单克隆抗体,肿瘤细胞浆内出现深褐色染色颗粒视为阳性,取10个视野放大400倍进行计算,指数定义为视野内阳性表达的肿瘤细胞数/总肿瘤细胞数×100%,Ki-67<50%视为低表达组,Ki-67≥50%视为高表达组[15](病理示例见图1e~f、2e~f)。
6.统计学分析
采用SPSS 26.0及Medcalc 15统计软件完成数据分析。采用Kappa检验分析两名医师主观评分结果的一致性(Kappa<0.4一致性差、0.45≤Kappa<0.6一致性中等、0.6≤Kappa<0.8一致性较好、Kappa≥0.8一致性好);采用Wilcoxon检验比较ZOOMit IVIM及SS-EPI IVIM图像主观评分、SNR、CNR及定量参数测量结果的组间差异;使用组内相关系数(intraclass correlation coefficient,ICC)评价两位医师定量参数测量结果的一致性:ICC>0.75表示一致性好。所有计量资料行S-W正态性检验及方差齐性分析。以术后病理作为检验标准,采用Spearman相关分析评估ZOOMit IVIM定量参数与子宫内膜癌病理分级、Ki-67表达之间的相关性。采用独立样本t检验或Mann-WhitneyU检验比较子宫内膜癌病理分级低级别组与高级别组、Ki-67低表达组与高表达组间各参数的差异。以P<0.05为差异具有统计学意义。绘制组间差异有统计学意义参数的受试者操作特征(receiver operating characteristic,ROC)曲线,通过曲线下面积(area under curve,AUC)评价IVIM模型参数对子宫内膜癌病理高级别组、Ki-67高表达组的鉴别诊断效能。
结 果
1.术后病理资料
65例患者中高分化15例(grade1,G1)、中分化36例(grade2,G2)、低分化14例(grade3,G3)。依据国际妇科病理学会[16]建议,将G1与G2合并为低级别组共51例,G3归为高级别组共14例。65例患者中Ki-67低表达组(<50%)33例,Ki-67高表达组(≥50%)32例。Ki-67高表达组患者平均年龄(54.3±7.1)岁,Ki-67低表达组平均年龄(50.6±6.6)岁,组间差异有统计学意义(t=-2.133,P=0.037)。患者年龄在病理高、低级别组间差异无统计学意义(t=-0.568;P=0.578)。
2.图像质量评价
两名医师对ZOOMit IVIM及SS-EPI IVIM两组图像质量主观评分一致性较好(Kappa值均>0.6)。ZOOMit IVIM及SS-EPI IVIM图像在几何失真(P<0.001)、解剖细节(P<0.001)、伪影(P<0.001)、SNR值(P<0.05)、CNR(P<0.05)值组间差异均具有统计学意义(表1)。D值测量结果在ZOOMit IVIM和SS-EPI IVIM两组图像间差异无统计学意义(Z=-0.700、-0.091;P=0.484、0.927),但基于ZOOMit IVIM成像测量的D值两名医师的组间一致性更高(ICCZOOMit=0.957,95%CI 0.899~0.981;ICCSS-EPI=0.890,95%CI 0.750~0.952),见图3a~b。
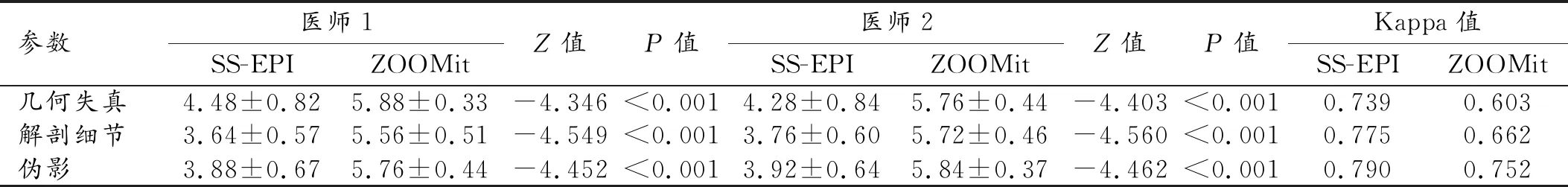
表1 SS-EPI IVIM与ZOOMit IVIM图像主观评分比较
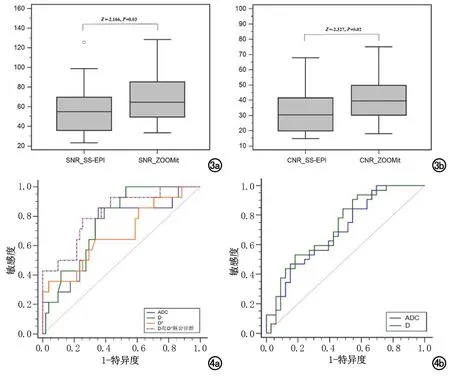
图3 a)两组IVIM图像SNR箱型图;b)两组IVIM图像CNR箱型图。图4 a) ADC值、D值、D*值及D与D*值联合鉴别诊断G3级子宫内膜癌的ROC曲线,AUC值分别为0.711、0.763、0.678、0.817;b)ADC值、D值鉴别诊断子宫内膜癌Ki-67高表达组的ROC曲线,AUC值分别为0.698、0.720。
3.不同病理分级及Ki-67表达水平组间定量参数分布特征
两名医师对各定量参数值测量结果一致性良好:ADC值ICC 0.953(95%CI 0.922~0.971),D值ICC 0.971(95%CI 0.949~0.983),D*值ICC 0.785(95%CI 0.648~0.869),f值ICC 0.889(95%CI 0.817~0.932)。本次研究取两名医师测量结果的均值进一步分析,见表2~4。
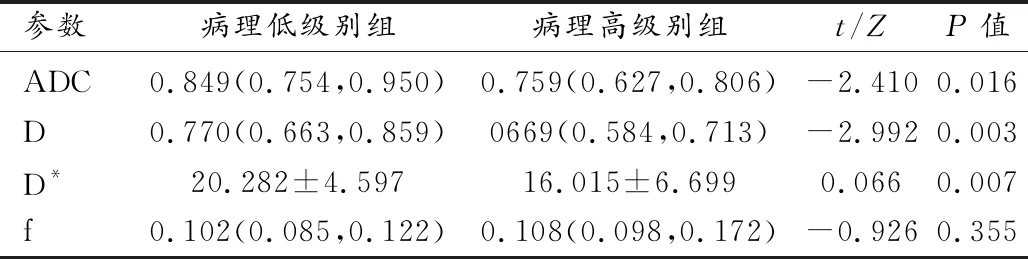
表2 病理低级别组与高级别组各定量参数值比较
①定量参数在病理高、低级别组间分布特征:ADC值、D值及D*值在病理高、低级别组间差异有统计学意义,与病理分级呈负相关(rs=-0.301、-0.374、-0.253,P=0.015、0.002、0.042);ADC值、D值及D*值鉴别病理高级别组子宫内膜癌的AUC值分别为0.711、0.763、0.679,各参数值AUC组间差异无统计学意义(ADC值和D值:Z=1.071、P=0.284;ADC值和D*值:Z=0.328、P=0.743;D值和D*值:Z=0.828、P=0.407)。以D值≤0.782×10-3mm2/s作为最佳阈值时,敏感度、特异度、阳性预测值、阴性预测值分别为100%、47.06%、34.1%、100.0%。D与D*值联合鉴别诊断病理高级别组子宫内膜癌的AUC为0.817(95%CI 0.701~0.902),敏感度、特异度、阳性预测值(PPV)、阴性预测值(NPV)分别为78.57%、74.51%、45.8%、92.7%。D与D*值联合鉴别病理高级别组AUC大于D*值(Z=2.537、P=0.011)、与ADC值及D值组间差异无统计学意义(Z=1.531、P=0126;Z=0.828、P=0.407)。参数f值与病理分级无相关性(rs=0.116,P=0.359)。
②定量参数在Ki-67高、低表达组间分布特征:ADC值、D值在子宫内膜癌Ki-67高、低表达组间差异有统计学意义(P<0.005),与Ki-67表达水平呈负相关(rs=-0.343、-0.381,P=0.005、0.002);ADC、D值鉴别诊断子宫内膜癌Ki-67高表达组AUC分别为0.698、0.720,ADC值及D值的AUC差异无统计学意义(Z=0.824,P=0.410)。以ADC值≤0.746×10-3mm2/s作为最佳阈值时,敏感度、特异度、阳性预测值、阴性预测值分别为46.88%、84.85%、75.0%、62.2%;以D值≤0.843×10-3mm2/s作为最佳阈值时,敏感度、特异度、阳性预测值、阴性预测值分别为93.75%、42.42%、61.2%、87.5%。D*值、f值与Ki-67表达无相关性(rs=-0.082、-0.007,P=0.516、0.959)。
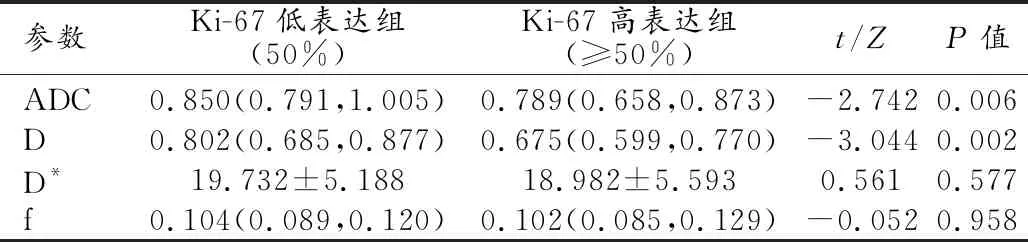
表3 Ki-67低表达组与高表达组各定量参数值比较
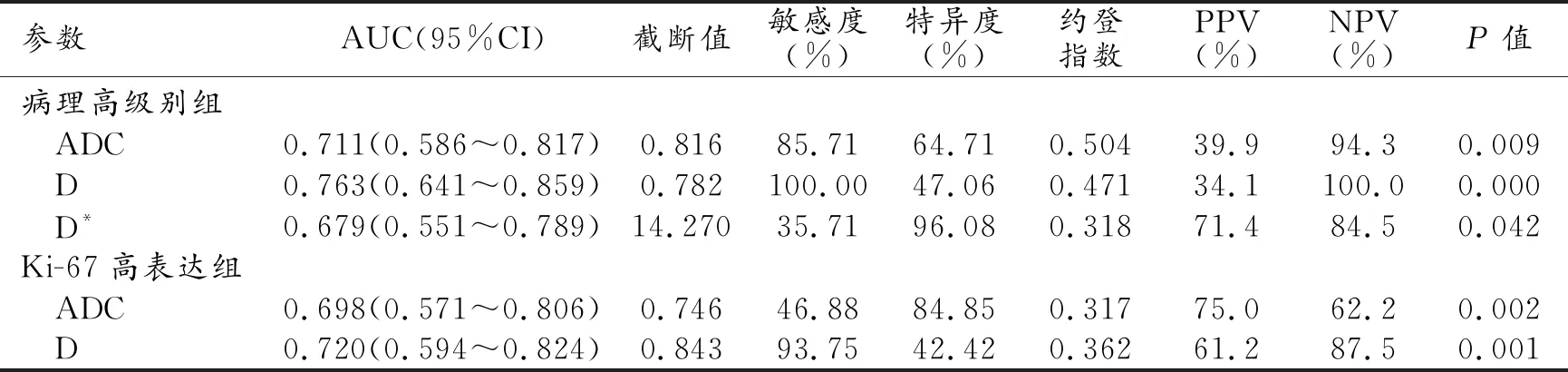
表4 参数诊断病理高级别、Ki-67高表达组子宫内膜癌ROC曲线分析
讨 论
本次研究显示采用ZOOMit技术较常规SS-EPI可获得更优质的IVIM图像,ZOOMit IVIM成像有助于术前评估子宫内膜癌病理分级及Ki-67表达。
IVIM成像可同时获取组织内环境水分子扩散及微血管灌注信息,且成像过程无需使用对比剂,有望解决磁共振检查在临床实践中一直颇受争议的对比剂过敏及钆沉积难题,是近年来肿瘤影像研究的热点[9,17-18]。目前IVIM成像研究多采用SS-EPI技术,SS-EPI由于成像回波链长、迂回的K空间填充方式及相位方向带宽小等,易导致图像存在失真变形、空间分辨率低、解剖细节显示欠佳等不足[10,19];另一方面子宫为一空腔脏器,且解剖位置临近膀胱、直肠,易产生磁化率差异伪影,而IVIM相对较长的成像时间又增加了膀胱尿液充盈、肠腔蠕动等运动相关伪影的生成几率,上述因素都将影响子宫成像质量,而良好的图像质量是进行有效影像观察及医学研究的前提。本次研究尝试采用ZOOMit技术行子宫内膜癌IVIM序列检查,结果显示ZOOMit IVIM图像在几何失真、解剖细节、伪影、信噪比、对比信噪比等方面均优于SS-EPI IVIM,与既往ZOOMit在DWI研究中结果一致[10-11]。本次研究另测量了病灶分别基于ZOOMit及SS-EPI成像条件下的定量参数D值,选择参数D是综合考虑其受干扰因素较小,较为稳健、客观[20],结果显示D值在两组图像间差异无统计学意义,但基于ZOOMit成像医师测量结果的组间一致性更高,有学者[21]在前列腺癌的研究中分别基于ZOOMit DWI与SS-EPI DWI提取影像组学特征,发现基于ZOOMit DWI提取的特征值具有更好的预测效能,结合本次研究提示ZOOMit成像更有助于医学观察及研究。
65例患者基于ZOOMit IVIM图像获取的定量参数值显示,病理高级别组、Ki-67高表达组的ADC值、D值低于对应的病理低级别组及Ki-67低表达组,且在同一组织类别中,D值低于ADC值,与既往研究结果一致[22-24]。ADC值、D值与水分子扩散自由度正相关,在b值<1000 s/mm2时,基于水分子运动高斯分布模型的ADC值、D值主要与细胞密度、细胞形态等细胞外空间结构有关[25]。随着肿瘤病理分级及Ki-67表达水平增高,组织内实性成分比例增加,细胞密度增大,间质血管生成增加,细胞外空间减少,水分子扩散自由度受限加剧,ADC值、D值减低,由于D值剔除了微循环灌注效应,故D值低于ADC值。在鉴别诊断子宫内膜癌病理高级别组、Ki-67高表达组中,D值AUC、敏感度、阴性预测值均高于ADC值,显示存在趋势上的差异,且D与D*值联合诊断的AUC值进一步提高,更利于提示患者存在高风险。虽然统计结果显示其特异度与阳性预测值较低,考虑与样本量的大小及分布有关,下一步工作中将继续收集样本进一步分析。
参数D*值主要与体素内微循环血流速度有关,f值表示灌注成分占整体扩散的比例,与血流量有关[6]。既往申洋等[26]对卵巢良、恶性研究显示卵巢良性组D*值高于恶性组,本次结果显示病理低级别组D*值高于高级别组。分析随着肿瘤恶性程度升高,单位体积内细胞密度增加,实性成分构成比增加,导致组织内微血管腔受压,体素内微循环血流平均通过时间延长,D*值减低。本次研究结果显示参数f值在病理高、低级别组与Ki-67高、低表达组间差异均无统计学意义,与邢金丽等[22]、孟楠等[27]在子宫内膜癌研究中的结果一致。f值与血流量相关,推测由于子宫内膜血供存在月经周期及内分泌水平的个体差异,且本次入组的病例皆为子宫内膜样癌,大部分子宫内膜样癌肿瘤血供并非异常丰富,上述原因导致不同病理分级、Ki-67表达组间血流量的差异不显著。目前也有部分学者认为D*值、f值由于影响因素较多,可重复性欠佳,稳定性较差,导致诊断效率较低[17,28]。D*值、f值在子宫内膜癌病变中的鉴别诊断价值仍需要扩大样本量,统一扫描参数及后处理方式,联合多中心及病理相关指标进一步研究。
本次研究存在一定局限性。首先综合低b值区T2WI的透射效应及高b值区背景的抑制因素,图像SNR、CNR只分析了b值=800 s/mm2的图像,其余b值未纳入分析,考虑在b值=800 s/mm2图像病灶及周围肌层显示较为清晰,更有助于ROI准确勾画;其次由于本次SS-EPI IVIM入组样本量较少,未对比ZOOMit IVIM与SS-EPI IVIM成像定量参数的诊断效能,下一步工作将继续扩大SS-EPI成像样本量作进一步分析;另外,本次研究为单中心单机型研究,得出的结论需要联合多中心、多机型进一步分析验证。
综上所述,ZOOMit技术在子宫内膜癌IVIM成像中具有较好可行性,ZOOMit IVIM成像对术前评估病理分级、Ki-67表达具有一定价值,有助于无创评估内膜癌肿瘤侵袭性及增殖性特征,为临床判断预后及制定个性化的治疗方案提供参考。
