循环肿瘤细胞、中性粒细胞淋巴细胞比值及体重指数对局部晚期食管鳞癌患者预后评估中的临床价值
2022-03-20刘阳阳
刘阳阳
(新泰市人民医院,山东 新泰 271200)
食管癌是世界上发病较高的恶性肿瘤,高致死率。我国食管癌以鳞癌为主,约占90%以上,发病率列恶性肿瘤第5位,死亡率第4位。因其发病隐匿、症状出现较晚,一旦发现多数属于中晚期,恶性程度高,预后较差[1-3]。对于中晚期患者,不具备手术指征,同步放化疗为美国国立综合癌症网络(NCCN)指南中治疗的金标准[4],但是近5年来,患者5年生存率没有明显提高。肿瘤TNM分期是判断食管癌患者预后重要标准,然而对于已经失去手术机会的晚期患者,TNM分期对于评估生存率和预后显然存在一定的缺陷,尽早准确判断局部晚期食管癌预后对降低其病死率有一定积极作用。循环肿瘤细胞(CTC)是指从实体瘤原发病灶或转移灶扩散进入外周血液循环中的肿瘤细胞,目前被认为是形成远处转移的关键步骤,被作为乳腺、肺癌等肿瘤的一种预后因素[5]。食管癌的潜在预后指标包括组织学变异、淋巴结转移的深度和基于营养或炎性反应的预后因素[总淋巴细胞计数、中性粒细胞与淋巴细胞比率(NLR)、血清白蛋白等]。体重指数(BMI)和NLR被广泛用于评估术前营养和代谢状况,也被认为是一些肿瘤的预后预测指标[6],但针对局部晚期食管鳞癌(ESCC)患者生存率的影响仍存在争议。本研究通过分析我院接受同步放化疗的局部晚期食管癌患者的基本资料、循环肿瘤细胞计数(CTCs)和实验室检测结果,旨在探讨CTCs、NLR和BMI联合检测对局部ESCC患者预后的价值判断,以便临床医师为患者及时、更好地选择一个最佳的治疗方法和个体化治疗方案提供理论依据。
1 资料与方法
1.1一般资料:收集2017年7月~2019年7月在我院肿瘤科就诊的93例患者,进行回顾性分析,其中男76例,女17例,年龄50~93岁,平均65岁;TNM分期为Ⅲ期48例,Ⅳ期45例;肿瘤直径为(4.36±1.58)cm;位于食管上端25例,中段39例,下段29例;高分化食管癌37例,中、低分化食管癌56例。患者临床病理分期,按照美国肿瘤联合委员会AJCC第8版食管癌分期系统标准对患者进行分期。纳入标准:年龄≥18岁的患者,无精神病史;经病理证实为鳞状细胞癌,患者自身情况不宜手术,无法手术切除的Ⅲ期患者,远处寡转移的Ⅳ期患者。排除标准:合并其他恶性肿瘤的患者;放化疗不耐受的患者;有严重的心、肺、肝、肾功能障碍者。本研究经医院医学伦理委员会批准,患者自愿参加并签署知情同意书。
1.2治疗方案:本研究中入组患者均予以三维适行放疗联合FP方案化疗:5-FU 1 000 mg/(m2·24 h),持续泵入4 d; DDP 75 mg/m2第1天静脉滴注,予以54~60 Gy/30~33f,1.8 Gy/次的三维适行放疗, 28 d为1周期,放疗第1天予以第1个周期化疗,放疗20次左右行第2个周期,放疗结束后继续行2个周期巩固化疗。
1.3外周血CTCs、NLR等指标检测:在放疗前7 d内和同步放化疗疗程结束后7 d内,空腹抽取静脉血,留取7.5 ml血标本进行CTCs,留取3 ml血标本检测中性粒细胞数、淋巴细胞数,并计算NLR,根据患者身高和体重计算BMI。通过红细胞裂解液将红细胞去除,采用免疫磁珠将白细胞去除,采用阴性富集法,用细胞免疫荧光技术对CTCs 判读及分析;采用全自动血细胞分析仪检测中性粒细胞、淋巴细胞数量,然后计算NLR(NLR=中性粒细胞数/淋巴细胞数)。所有操作严格按照操作程序操作,检测环境符合相关操作标准。CTCs阳性判断:CTCs>3个符合免疫荧光染色为CD45(-)、CK18/8/19(+)。根据中位值分组,NLR≥2.02定义为高NLR组,NLR<2.02为低NLR组。按初诊时的BMI将患者分为高BMI组(BMI≥25 kg/m2),低BM组(BMI<25 kg/m2)。
1.4患者随访:对93例患者进行放化疗后追踪随访。随访内容包括:体格检查、血常规检查、CTCs,观察和记录患者生存状况,根据检查结果,评估患者是否复发。以门诊随访和电话随访相结合的方式,以随访结束为终点事件,定义末次随访时间为死亡的当天或者末次随访仍存活时间,失访病例随访时间按末次随访仍存活的时间为截尾数据处理。随访时间6~42个月,中位随访(30.65±7.39)个月,随访时间截止到2021年1月,失访3例,随访率96.8%。
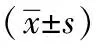
2 结果
2.1患者一般情况:93例患者中,40例外周血中检测CTCs>3,53例患者未检测到CTCs,阳性率43%。其中3例失访,随访率96.8%。中位生存时间15个月。放化疗后患者1年、2年、3年累积生存率分别为62%、28.1%、16.9%。
2.2患者单因素生存分析结果:由表1可见,在性别、年龄、BMI、肿瘤大小、肿瘤位置、分化程度、TNM分期、NLR、CTCs等众多因素中,单因素分析结果:肿瘤大小、分化程度、BMI、NLR、CTCs是影响局部晚期食管癌预后的因素(P<0.05)。采用Kaplan-Meier法构建不同CTCs、BMI、NLR水平生存曲线,经Log-rank检验,高BMI组累积生存率高于低BMI组,低NLR组累积生存率高于高NLR组,CTCs阴性组累积生存率显著优于CTCs阳性组。见图1~3。

表1 局部晚期食管癌患者生存时间的单因素分析

图1 不同CTCs组生存曲线图

图2 NLR高低组生存曲线图

图3 BMI高低组生存曲线图
2.3Cox回归模型分析结果:由表2可见,将单因素分析中P<0.05的变量纳入多因素分析模型,通过Cox模型回归显示CTCs、BMI、NLR是影响局部晚期食管癌预后的独立因素(P<0.05)。
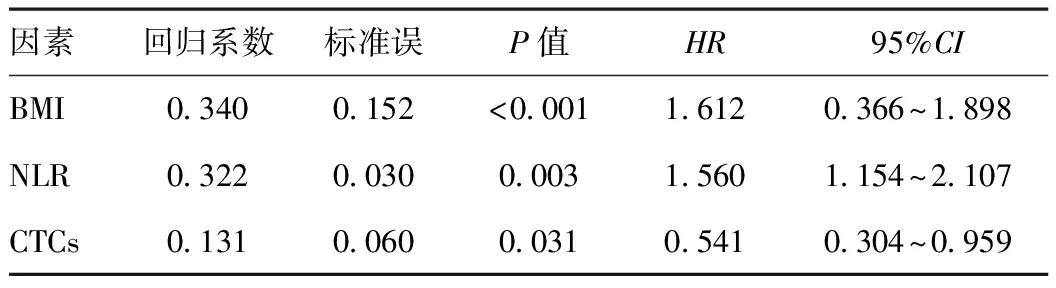
表2 局部晚期食管癌患者Cox回归模型分析
3 讨论
食管癌是常见恶性肿瘤之一,具有较高的发病率和死亡率。其中,TNM分期是目前临床上公认的判断预后的黄金标准,而对于一些无法手术的患者,TNM分期难以准确定性,对预后评估存在一定的局限性。营养、免疫及炎性反应状况影响预后的方式尚不为人知,但许多基于表现机体营养、免疫、炎性反应状况的标志物以及一些分子生物学指标已被报道为各种类型癌症的预后生物指标,但联合检测BMI、NLR和CTCs与局部ESCC患者预后的关系我国尚不多见,本研究针对局部晚期食管癌患者预后生物指标的研究,有利于及时检测治疗耐药性和选择后续治疗。
CTC从肿瘤释放到外周血中,携带原发肿瘤的分子和遗传学特征,被认为是潜在的肿瘤标志物,在一定程度上反映肿瘤进展情况,目前已经成为临床上关注的焦点。有研究表明,CTC 在预测乳腺癌、非小细胞肺癌、结直肠癌、胃癌患者的复发、转移及预后中具有重要的临床价值[7-10]。对于食管鳞癌,也有许多研究表明CTCs与鳞癌患者的早期诊断相关,与临床分期、预后相关[11-12],但是与放化疗相关的研究内容尚欠缺,针对局部ESCC患者外周血CTCs预测尚不清楚。本研究表明CTCs是局部晚期食管癌患者预后的独立影响因素,CTCs阳性组中位生存期、累积生存时间显著低于CTCs阴性组(P<0.01),证实了放化疗前后的CTCs动态变化与局部晚期食管癌患者的预后相关。Matsushita等[13]对食管癌放化疗患者进行CTC随访,发现在肿瘤临床进展阶段CTC阳性率显著高于疾病稳定阶段(P<0.01),Wang等[14-15]研究发现,CTCs阳性患者的无进展生存期与无病生存期、总体生存均明显低于CTCs阴性患者,表明CTCs可作为检测食管癌患者预后不良的独立指标,与本研究结果一致。因此CTC可以动态监测患者的局部ESCC的病程进展,制定个性化治疗方案,改善其预后。
NLR作为系统性炎性反应指标之一,虽然已被表明与多种恶性肿瘤预后有关,但在局部ESCC中作用尚不明确。英国学者Rashid等[16]发现术前NLR(≥3.5)升高与食管癌患者总生存期并无明显相关性。Sharaiha等[17]在分析了295例食管癌患者中发现,NLR增高患者的术后总生存期及无病生存期较差。本研究结果显示低NLR组生存期较长(P<0.01),NLR是影响局部中晚期食管鳞癌患者预后的独立预测因素。Queen等[18]研究表明,中性粒细胞常分布在肿瘤周围组织,其分泌了大量血管内皮生长因子,可提供适宜的微环境促进了肿瘤局部浸润及转移。同时中性粒细胞可能参与诱导抑癌基因的突变和受体、补体及免疫球蛋白的降解,对肿瘤细胞的增殖和分化具有促进作用。此外由于进展期的食管癌,机体中性粒细胞功能体现在促瘤阶段,有利于肿瘤细胞的增殖和微转移灶的形成[19]。
淋巴细胞则通过参与细胞毒性引起的细胞死亡和诱导抗肿瘤形成细胞因子的分泌,抑制肿瘤细胞的增殖和转移。在恶性肿瘤患者中,淋巴细胞计数下降,机体更容易出现不可控制的炎性反应,免疫调节水平下降,肿瘤细胞不受控制的增长,因此,在肿瘤组织的周围缺少淋巴细胞浸润的患者要比有淋巴细胞浸润的患者预后较差[20]。据报道,血液中淋巴细胞总数的减少是胰腺癌患者不良结局的指标。因此,NLR因其易于检测、价格低廉并直接反映系统性宿主炎性反应,可反映机体肿瘤与抗肿瘤的动态平衡状态,可作为局部ESCC预后的独立预测因素,影响患者预后。
BMI作为判断人体生理状态的常用指标,其与食管癌之间的关系目前尚无一个确定的结论。有研究显示,超重或肥胖是许多疾病的危险因素并与生存率呈负相关,但近年来越来越多的研究显示出不同的研究结果[21]。Ji等[22]研究发现,高BMI组的总生存率明显高于低BMI和正常BMI组,进一步多因素分析发现BMI≥25 kg/m2是生存率的独立预测因素。另有研究表明,高BMI的食管鳞癌患者生存期较短,分析原因可能为该研究中高BMI组的研究对象糖尿病患者居多,而流行病学调查显示,糖尿病会增加癌症患者的死亡率[23]。本研究发现,不同BMI局部ESCC患者中位生存差异有统计学意义(P<0.05),较高的BMI患者具有较高的中位生存期。分析原因为营养状况在食管癌中起到至关重要的作用,吞咽困难、体重减轻是食管癌最常见的症状,直接导致食物摄入量减少,患者体重下降。研究表明,83%的食管癌患者在诊断时体重下降,术前体重下降、食管癌术后5 年生存率降低[24],是重要的预后因素。此外,肿瘤导致的全身炎性反应可以导致患者本身能量消耗的增加,营养代谢改变也会导致体质量减轻和营养不良,而营养不良与癌症患者存活率低有关[25],营养状况差会削弱免疫细胞在肿瘤微环境中的免疫调节,从而影响免疫监视导致肿瘤复发。高BMI患者能量储备足以维持其免疫调节反应,就会获得较长的生存期。因此适当含量的脂肪可储存能量、调节免疫反应,有助于提高局部ESCC患者的生存期。其次,高BMI组患者经济状况可能更好,在复发、转移、并发症的处理过程中,接受辅助治疗的机会更多[26]。
在本研究中,分析了影响局部晚期食管癌预后的多种因素,证实CTCs、NLR、BMI是影响局部晚期食管癌预后的独立预测因素。NLR是衡量机体炎性反应的指标,BMI是反映机体营养状况的指标,CTCs作为从肿瘤原发灶或转移灶经过主动或被动方式进入血液并逃过了免疫杀伤而存活下来的肿瘤细胞,在一定程度上反映肿瘤的情况和变化。在局部晚期食管癌患者中,炎性反应、营养与CTCs是相互关联的,全身炎性反应越重,机体营养状况也越差,营养不足又可以导致机体免疫力下降,加重炎性反应,而全身免疫炎性反应指标被认为与循环肿瘤细胞的数量有着显著相关性,循环肿瘤细胞的数量大大促进了肿瘤的转移,这种恶性循环,最终导致患者预后较差。因此,NLR高、BMI低、CTCs高提示患者预后不理想。
综上所述,本研究证实CTCs、NLR、BMI是局部晚期食管癌患者预后的独立影响因素,三者联合检测在患者预后评估中具有重要价值,三者在各级医院均可检测,简便、快捷、可重复性高,三者联合检测有利于更及时、准确调整治疗方案及评估预后情况,可在临床工作中加大推广。然而,本研究仍存在一些局限性,关于CTCs、NLR、BMI三者最具临床价值的最佳临界值,还需要进一步的研究;此外,由于本研究样本量有限,样本选择上可能存在偏倚,还需要进一步进行多中心、大样本的前瞻性研究,为临床实践提供更加有力的理论依据。
