中华绒螯蟹微孢子虫全基因组分泌蛋白的预测分析
2022-03-20宁梓健寇诗瑀姜宏波
宁梓健,寇诗瑀,包 杰,姜宏波
( 沈阳农业大学 畜牧兽医学院,辽宁 沈阳 110866 )
中华绒螯蟹(Eriocheirsinensis)俗称河蟹,是我国重要的经济甲壳动物之一,广泛养殖于稻田、池塘、湖泊等水体中[1]。近年来,随着养殖产量的不断提高,很多中华绒螯蟹养殖地区相继出现了高死亡率的“肝胰腺坏死症”[2],部分个体组织学研究显示,肝胰脏上皮细胞细胞质内感染了微孢子虫(Hepatosporaeriocheir)[3]。中华绒螯蟹感染微孢子虫后,肝胰腺由健康的金黄色渐渐转变成灰白色,活动能力减弱,难以抵抗较大应激[4]。2002年,Wang等[5]通过电镜观察到中华绒螯蟹微孢子虫的虫体,开始对其形态结构、病理特征及流行病学进行研究。中华绒螯蟹微孢子虫是一种营专性细胞内寄生生活的单细胞真核生物,个体极小,呈卵圆形,长径(1.7±0.2) μm,短径(1.0±0.2) μm,有1个细胞核,占据虫体的中心位置,位于极膜层和后液泡之间,周围有2层或3层内质网和7~8圈极管[6-7]。由于微孢子虫是一种引起中华绒螯蟹肝胰腺坏死的新型水产病原,寄主感染该微孢子虫后抗病能力变弱、生长发育缓慢,给中华绒螯蟹养殖产业带来很大损失,因此深入研究此微孢子虫在中华绒螯蟹细胞内的侵染机制对于该病的防治具有重要意义。
在病原微生物侵染宿主的过程中,病原微生物会产生许多激发入侵和致病的信号分子,这些信号分子可能与宿主细胞表面受体蛋白产生识别作用。研究表明,病原微生物将信号分子分泌到体外,才可与宿主受体蛋白识别,产生作用[8]。如在植物中,有研究表明,马铃薯晚疫病菌(Phytophthorainfestans)Inf1[9]和豌豆锈病病菌(Uromycesvignae)小种1号产生的特异性信号分子为分泌蛋白[10]。在动物中,已报道家蚕微孢子虫的重要分泌蛋白——孢壁蛋白和丝氨酸蛋白酶抑制剂是微孢子虫入侵宿主细胞的关键蛋白[11],但关于中华绒螯蟹微孢子虫的分泌蛋白研究尚未见报道。笔者从全基因组水平预测和筛选中华绒螯蟹微孢子虫的分泌蛋白,分析可能与宿主受体蛋白起作用的信号分子,以期为探究中华绒螯蟹微孢子虫侵染机制奠定基础,同时为中华绒螯蟹养殖过程中微孢子虫的防治提供理论依据。
1 材料与方法
1.1 基因组数据来源
中华绒螯蟹微孢子虫基因组数据从GenBank数据库(http:∥www.ncbi.nlm.nih.gov)下载获得,其登录号为LVKB00000000.1。
1.2 分泌蛋白的预测
针对中华绒螯蟹微孢子虫全基因组的蛋白质编码序列,运行EuSecPred 2.0在线流程(http:∥microbe.Swu.Edu.cn/silkpathdb/eusecpred)筛选分泌蛋白,方法步骤参照文献[11-12]:利用TMHMM程序过滤掉跨膜蛋白[13];NLStradamus.Pl程序[14]和PredictNLS程序(https:∥rostlab.org/owiki/index.php/PredictNLS)筛去细胞核蛋白;SignalP 4.0程序对蛋白序列进行信号肽预测,筛去其中N端无信号肽的蛋白质[11-12];MitoProt程序预测线粒体蛋白[15];TargetP程序对非线粒体蛋白进行亚细胞定位预测,筛选定位于胞外的分泌型蛋白[16];Kohgpi程序去除可能具有GPI锚定修饰的蛋白质[17],得到中华绒螯蟹微孢子虫的分泌蛋白集合。
1.3 分泌蛋白序列特征的分析
根据分泌蛋白的信号肽预测结果,统计信号肽以及完整分泌蛋白序列的长度及氨基酸组成,提取信号肽剪切位点前后各3个氨基酸残基,通过WebLogo程序(http:∥weblogo.threeplusone.com/)统计分析其氨基酸组成[18],利用MEME程序(http:∥meme.nbcr.net/meme/)预测分泌蛋白信号肽区和非信号肽区中可能存在的基序[19]。
1.4 分泌蛋白功能的分析
利用BLASTP程序,将预测获得的中华绒螯蟹微孢子虫分泌蛋白序列在Nr(ftp:∥ftp.ncbi.nlm.nih.gov/blast/db/FASTA/nr.gz)和Swiss-Prot(ftp:∥ftp.uniprot.org/pub/databases/uniprot/current-release/knowledgebase/complete/uniprot-sprot.fasta.gz)数据库中进行比对,将比对结果中得分最高的同源序列的功能作为对应分泌蛋白的参考功能,并对功能进行分类。
2 结 果
2.1 预测所得的中华绒螯蟹微孢子虫的分泌蛋白
运行EuSecPred 2.0在线流程筛选分泌蛋白,对从GenBank数据库下载得到的全部2700个中华绒螯蟹微孢子虫蛋白质序列进行预测,得到的结果为:484个蛋白质具有跨膜域结构;200个核蛋白;128个蛋白质具有信号肽序列;18个定位于线粒体的蛋白质;87个蛋白质具有亚细胞定位信号;剔除了8个具有GPI锚定位点的蛋白质以后,最终筛选得到了99个分泌蛋白。对这99个分泌蛋白所对应的基因编号、基因长度、基因GC含量及分泌蛋白的氨基酸序列长度和信号肽序列长度进行了数据的统计整合,结果见表1。
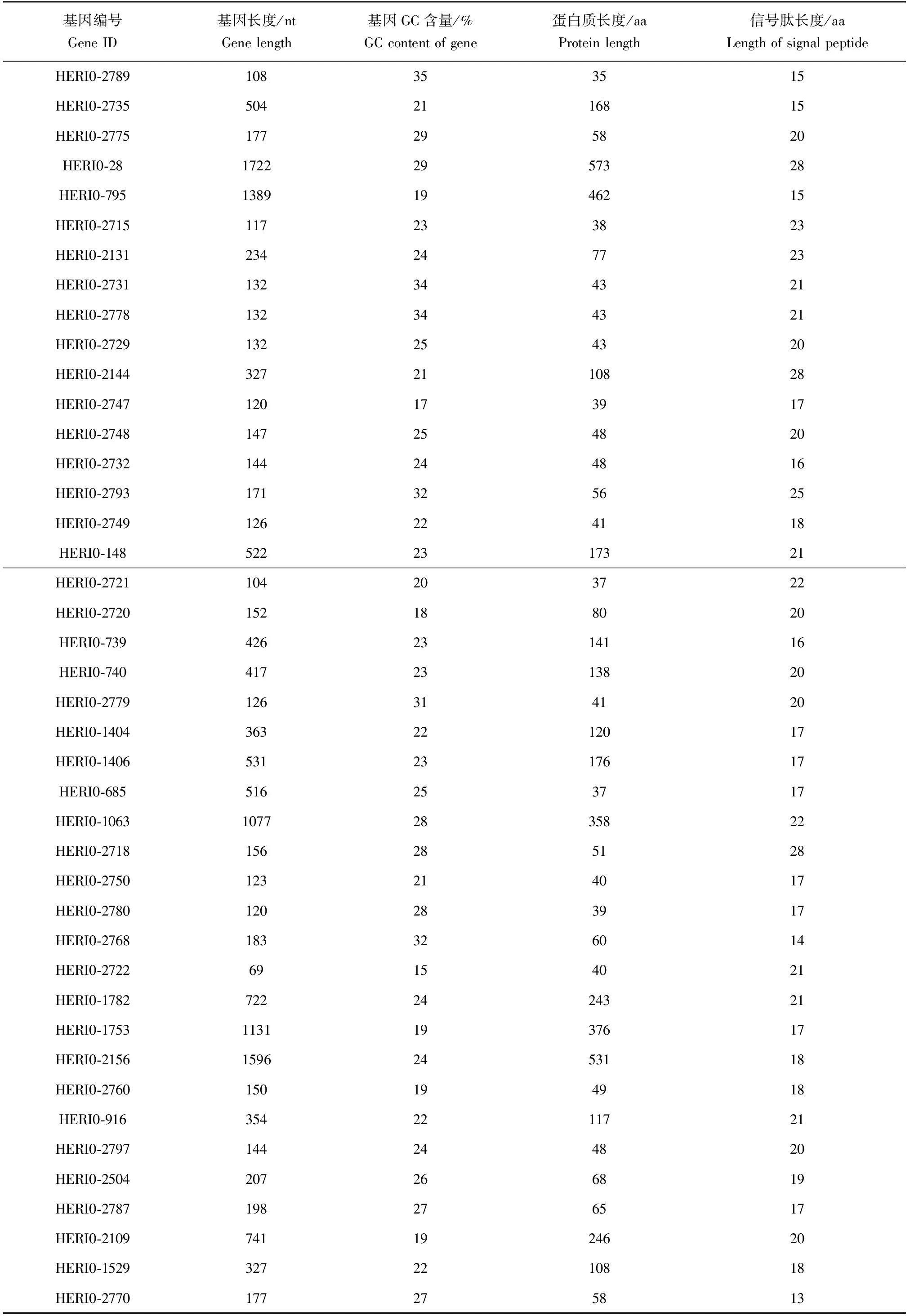
表1 预测到的中华绒螯蟹分泌蛋白基因及序列分析Tab.1 Coding genes and sequence information on the predicted secreted protein gene in microsporidium parasited in Chinese mitten crab E. sinensis
2.2 分析预测所得的中华绒螯蟹微孢子虫分泌蛋白的序列特征
2.2.1 分泌蛋白与其信号肽的长度与氨基酸组成
对预测所得的99个中华绒螯蟹微孢子虫的分泌蛋白及其信号肽的长度进行数据统计和整理,得到蛋白质序列长度为30~700 aa,主要集中在30~300 aa,平均值为142.84 aa,中值为79.00 aa(图1);信号肽序列长度为11~28 aa,主要分布在11~23 aa,长度平均值为18.63 aa,中值为19.00 aa(图2)。
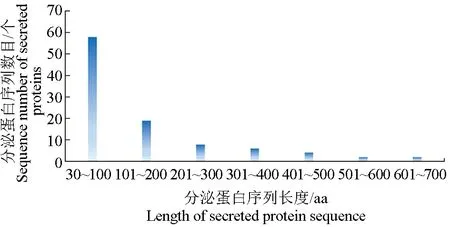
图1 中华绒螯蟹微孢子虫分泌蛋白序列长度分析Fig.1 Analysis of the lengths of secretory protein sequence in microsporidium H. eriocheir parasited in Chinese mitten crab E. sinensis
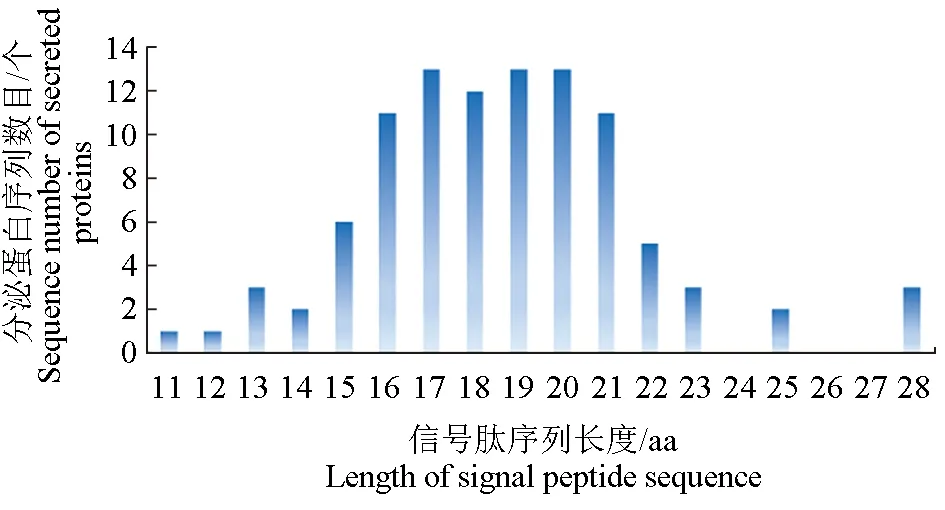
图2 中华绒螯蟹微孢子虫分泌蛋白信号肽长度分析Fig.2 Analysis of the lengths of signal peptides of secretory protein in microsporidium H. eriocheir parasited in Chinese mitten crab E. sinensis
对预测所得的99个中华绒螯蟹微孢子虫的分泌蛋白及其信号肽的氨基酸组成进行数据统计和整理,结果显示,在分泌蛋白的组成中,以疏水性氨基酸为主,占分泌蛋白中所有氨基酸的43.70%,其次为亲水性氨基酸,占分泌蛋白中所有氨基酸的17.21%;在信号肽中,氨基酸的组成同样主要为疏水性氨基酸,占信号肽中所有氨基酸的64.80%,其次为亲水性氨基酸,占信号肽中所有氨基酸的18.34%(表2、图3)。

图3 中华绒螯蟹微孢子虫分泌蛋白及信号肽的氨基酸组成Fig.3 Amino acid composition of signal peptide and secretory protein in microsporidium H. eriocheir parasited in Chinese mitten crab E. sinensis每种氨基酸对应柱体中,左侧柱体为分泌蛋白中各氨基酸所占的比例,右侧柱体为分泌蛋白信号肽中各氨基酸所占的比例. 黑色.疏水性氨基酸;绿色.亲水性氨基酸;红色.酸性氨基酸;蓝色.碱性氨基酸;紫色.中性氨基酸;下同.In the column corresponding to each amino acid, the left column is the proportion of each amino acid in the secretory protein, and the right column is the proportion of each amino acid in the signal peptide. Black.hydrophobic amino acid; green.hydrophilic amino acid; red.acidic amino acid; blue.basic amino acid; purple. neutral amino acid; et sequntia.
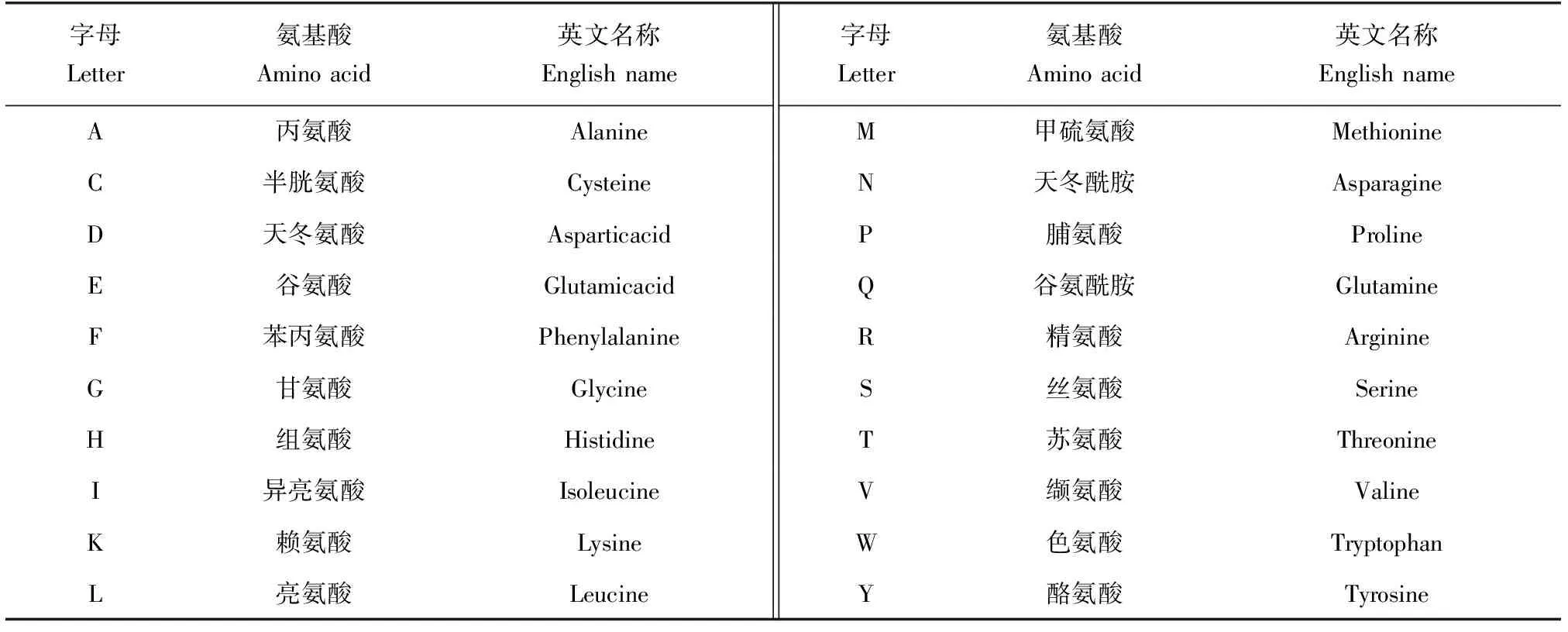
表2 各字母所代表氨基酸种类及英文对照Tab.2 Comparison table of amino acid types and their abbreviations represented by each letter
2.2.2 信号肽剪切位点的氨基酸组成
对各分泌蛋白信号肽的剪切位点的氨基酸组成进行了数据统计和整理,发现其结果与信号肽的氨基酸组成十分相近。分泌蛋白信号肽剪切位点处疏水性氨基酸所占比例最高,为42.24%,其中最多的为亮氨酸(L),占比为11.87%;其次为亲水性氨基酸,占信号肽剪切位点中所有氨基酸的26.35%,其中最多的是丝氨酸(S),占比为10.65%(图4)。对信号肽剪切位点前后氨基酸组成进行分析,剪切位点上游的-3位主要为缬氨酸(V),-2位主要为亮氨酸,剪切位点两侧的-1位和1位所占比例最高的分别为丙氨酸(A)和谷氨酸(E),下游的2位主要为天冬氨酸(D),3位主要为异亮氨酸(I)。综合来看,疏水性氨基酸的比例较大(图5)。

图5 中华绒螯蟹微孢子虫分泌蛋白信号肽剪切位点处氨基酸的组成Fig.5 The composition of amino acids flanking the signal peptide splice site in the secreted proteins in microsporidium H. eriocheir parasited in Chinese mitten crab E. sinensis
2.2.3 分泌蛋白和其信号肽的基序
对中华绒螯蟹微孢子虫分泌蛋白信号肽区域进行基序分析,发现了一种基序为S[NS]N[TI][FI]V[IV][IGD][RG]VRC(图6)。

图6 中华绒螯蟹微孢子虫分泌蛋白信号肽基序Fig.6 Motif in signal peptide of HERI secreted proteins in microsporidium H. eriocheir parasited in Chinese mitten crab E. sinensis
而在分泌蛋白非信号肽区域发现了3种基序,分别为:RIERP[SG]GEWGQVLTGNPVHKKLR LVKTNEDNVRIEPHYNMANPQM、VKGQLSK GLDMLAGSENLKNFMNIKTLCSWIKFVLQFQ QEQKEDVR和TALYTDADTRSICSINLSDPSIR EAMVY(图7)。
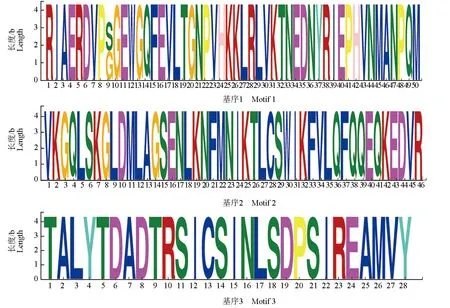
图7 中华绒螯蟹微孢子虫分泌蛋白非信号肽区基序Fig.7 Motif in non-signal peptide of secretory protein in microsporidium H. eriocheir parasited in Chinese mitten crab E. sinensis
2.3 预测分泌蛋白功能
对筛选预测所获得的99个中华绒螯蟹微孢子虫分泌蛋白通过BLASTP程序,与Nr和Swiss-Prot数据库比对进行功能注释,其中有68个分泌蛋白未在数据库内检索到明确的功能,可能为中华绒螯蟹微孢子虫分泌的独特蛋白质,占全部预测所得分泌蛋白的68.69%。另外31个分泌蛋白在数据库内检索到了同源蛋白,其中酶类占比最大,共有19个,通常为一些具有能够调控宿主细胞的增殖、代谢及免疫反应能力的酶类,如ATP磷酸核糖转移酶调节亚基、1,4-葡聚糖分支酶、磷酸核糖焦磷酸合成酶Ⅰ和丝氨酸/苏氨酸蛋白激酶,推测其能够为中华绒螯蟹微孢子虫侵入宿主细胞后的增殖发育提供帮助。另外,还预测到了1个糖蛋白、1个交换因子和10个具有其他功能的分泌蛋白(图8)。其中,糖蛋白可能与中华绒螯蟹微孢子虫黏附并入侵宿主细胞有关,交换因子对细胞凋亡和细胞周期产生了一定的影响。
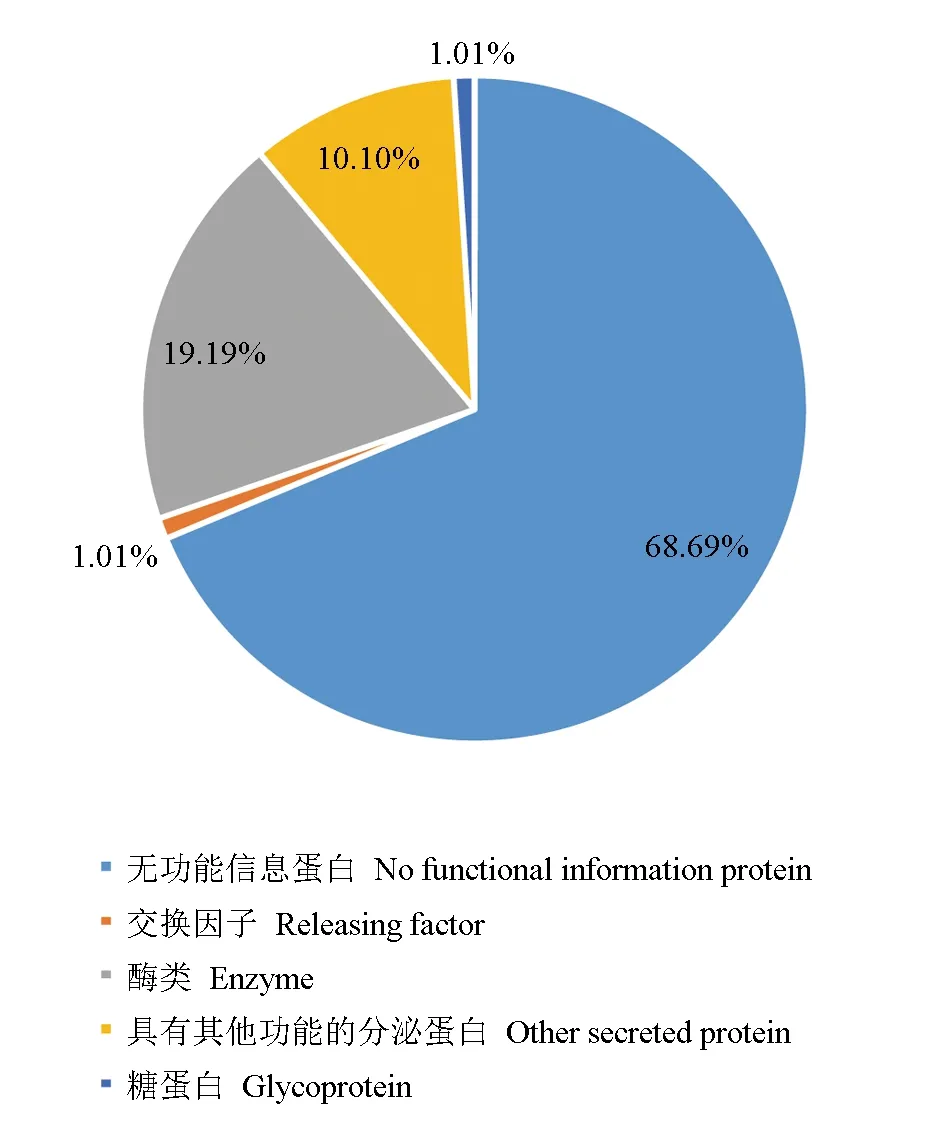
图8 中华绒螯蟹微孢子虫分泌蛋白的功能分类Fig.8 Functional classification of secretory protein in microsporidium H. eriocheir parasited in Chinese mitten crab E. sinensis
3 讨 论
3.1 中华绒螯蟹微孢子虫序列特征
本试验中所使用的EuSecPred 2.0在线流程是十分严谨可靠的,但由于生物信息学方法对分泌蛋白在全基因组范围进行的检测具有一定的局限性,一些特殊的分泌蛋白无法被该流程所预测出,如以非经典途径分泌的蛋白质。
整理分析分泌蛋白、分泌蛋白的信号肽和信号肽剪切位点两侧各3个氨基酸的组成发现,含量最多的氨基酸种类为疏水性氨基酸,其中亮氨酸的含量最为突出。在家蚕微孢子虫、兔脑炎微孢子虫、中蜂微孢子虫和毕氏肠道微孢子虫的分泌蛋白比较分析中[11],也得到了相同的结论,说明疏水性氨基酸的含量高可能是分泌蛋白所具有的共同特性。
3.2 中华绒螯蟹微孢子虫分泌蛋白功能分析
对分泌蛋白进行功能注释中,比对得到一些表面糖蛋白,如血凝素酯酶,它是病毒的一种膜囊糖蛋白,有研究认为它与病毒早期吸附有关[20-21],另外有报道称它类似于流感病毒分泌的神经氨酸苷酶,可促进新生病毒顺利从感染细胞中退出[22],推测该分泌蛋白可能在中华绒螯蟹微孢子虫黏附入侵宿主细胞和胞内增殖后扩散中发挥了重要作用。
此外,中华绒螯蟹微孢子虫侵染宿主细胞时,还需要考虑宿主免疫系统的排斥,预测所得的分泌蛋白中,有一些具有抑制宿主免疫反应的能力,例如,甲基转移酶EZH1。Jia等[23]研究表明,该分泌蛋白可以通过修饰巨噬细胞极化来调控免疫反应,从而避免在侵染过程被宿主的免疫系统发现并清除,为微孢子虫入侵宿主细胞提供条件,但其对巨噬细胞具体产生的影响和调控宿主免疫反应的功能,还需进一步研究才能明确。
除了黏附和侵染宿主细胞及抑制宿主细胞免疫反应以外,一些分泌蛋白还可以参与调控宿主细胞的增殖和代谢,为微孢子虫侵染宿主细胞后的生命活动和繁衍后代提供营养物质,如在预测中比对到了1,4-葡聚酶分支糖。糖原为生物体存储了大量能量,D-葡萄糖通过α-(1,4)糖苷键和α-(1,6)糖苷键能链接聚合成高分子聚糖,而1,4-葡聚酶分支糖广泛存在于原核动物和真核动物体内,是催化合成糖苷键分支的关键酶,糖原分支越多,糖原的水溶性越大,非还原端的数目越多,有利于糖原储存和分解产生作用[24],在李晓旭等[25]的研究中发现,1,4-葡聚酶分支糖含量增加可使糖原合成酶的活性及糖原含量均先增加再减少。另外,还比对到了丝氨酸/苏氨酸蛋白激酶,它不仅可以使一些与细胞分裂、机体中心代谢和转录调节有关的蛋白质磷酸化而激发其功能,还具有合成嘌呤及嘧啶、修复DNA、合成谷氨酰胺、氧化应激反应等作用[26-27]。丝氨酸/苏氨酸蛋白激酶在中华绒螯蟹微孢子虫的增殖和代谢中具体扮演何种角色有必要开展深入研究进行解答。除了上述几种分泌蛋白之外,同时预测到了鸟嘌呤核苷酸交换因子,有研究表明,鸟嘌呤核苷酸交换子可能作为一种促癌因子参与癌症的发生、发展过程[28],在一定程度上影响细胞增殖和细胞凋亡。
4 结 论
从2700个中华绒螯蟹微孢子虫蛋白质序列中,筛选出99个分泌蛋白,这些分泌蛋白平均长度为142.84 aa,信号肽平均长度为18.63 aa。分泌蛋白与其信号肽的氨基酸组成中,均以疏水性氨基酸为主,截取的信号肽剪切位点前后各3个氨基酸残基中,含量最多的种类也为疏水性氨基酸。
对99个预测所得的分泌蛋白进行比对分析和功能注释发现,其中有68个未检测出同源蛋白的分泌蛋白、19个酶类物质、1个糖蛋白、1个交换因子和10个具有其他功能的分泌蛋白。预测获得的这些重要分泌蛋白可能与中华绒螯蟹微孢子虫侵染宿主、调控宿主细胞周期及免疫反应等生理活动相关,研究结果可为进一步研究微孢子虫侵染宿主细胞的过程及宿主—寄生虫相互作用提供参考。
