AuNCs@BSA/抗生素的制备及性能研究
2022-03-15马德彪张小舟韩常雨刘洋刘欣
马德彪,张小舟,韩常雨,刘洋,刘欣
AuNCs@BSA/抗生素的制备及性能研究
马德彪,张小舟,韩常雨,刘洋,刘欣
(齐齐哈尔大学 材料科学与工程学院,黑龙江 齐齐哈尔 161006)
研究制备了一种微波辅助制备牛血清白蛋白包封荧光金纳米团簇(AuNCs@BSA)。通过荧光光谱,透射电子显微镜等对其最佳实验条件进行了探究。分别改变其反应温度及反应时间,测试其粒径及荧光强度的变化,以此来探究出最佳反应条件。蛋白质可以作为保护剂用于金纳米簇合成。这些生物大分子本身具有优良的生物相容性,与抗生素相结合,对部分抗生素具有药效增强的作用,并且对AuNCs@BSA的荧光性能没有大的影响,又提供了药物荧光示踪的可能。
AuNCs@BSA; 青霉素; 阿莫西林; 大肠杆菌; 金黄色葡萄球菌
金纳米材料是最早出现的纳米材料,具有制备方便、生物相容性好、易于进行表面修饰和性质稳定等优点,在生物医学分析和成像中有广泛应用。金纳米簇(AuNCs)是近年来出现的一种新型发光材料,其性质类似于分子,生物相容性好且具有较强荧光,将具有广阔的应用前景。荧光金纳米团簇(AuNCs)由几个到几十个金原子组成。由于它们具有类似分子的特性,因此被认为是具有多种生物应用价值的材料[1]。金纳米簇的合成主要有两种策略:自下到上和自上到下。第一种自下到上的策略是把金离子还原成金原子再通过成核作用形成金纳米簇,化学还原法、生物还原法、光致还原法、电化学还原法和光致还原法属于这一类。另一种自上到下的策略是把较大的金纳米粒子或金纳米簇蚀刻以产生超小型的金纳米簇,例如化学蚀刻法。这些合成方法中最常用的还是化学还原法、光致还原法和化学蚀刻法三种。除此以外,金属纳米簇的合成方法还有微波合成法、电致合成法、电化学法、微乳法、相转移法和低温气相沉淀法等[2-5]。
2009年,Xie等首次展示了一种制备荧光牛血清白蛋白(BSA)保护AuNCs (BSA-AuNCs)的简单方法[6-7]。这些AuNCs含有25个金原子,它们呈现出红色发射。但它们需要较长的制备时间,且pH值为8.0。最近,又有一种通过蚀刻和钝化合成烷硫醇保护的AuNCs@BSA的方法被开发出来。所使用的烷硫醇的性质以及金属-硫醇相互作用是决定这些AuNCs@BSA结构和电子性质的关键因素,因为它们导致AuNCs@BSA中不同程度的荧光增强。上述方法可用于制备从蓝色到红外的离散高质量荧光发射的AuNCs@BSA,但AuNCs@BSA仍需要较长的蚀刻时间[8-10]。2017年首次报导出一种利用微波加热技术开发了一种更高效的微波加热系统AuNCs@BSA的制备方法。微波加热不仅将反应时间从几十小时减少到几分钟,而且还抑制了副反应,从而提高了特定合成方案的收率和重现性[11-14]。此外,由于小型AuNCs@BSA的合成对反应条件高度敏感,所以钨辅助的方法可以对AuNCs@BSA的生长提供更大的控制,从而提高其光学性能。并且,用这种方法得到的AuNCs@BSA仍然呈现红色发射。感染性疾病一直严重威胁着人类健康的,对细菌性传染病的早期诊断来说,细菌病原体准确鉴别是关键,然而,传统的检测方法如细胞培养、生化检测、免疫学检测和遗传学分析都是耗时耗力的,对于危重病人来说可能会错过最佳治疗机会。荧光金纳米簇已经开始被应用于细菌感染诊断和生物成像。具有良好水溶性和高荧光量子产率的以甘露糖为保护剂的金纳米簇可以被用于检测大肠杆菌,其利用表面上的甘露糖残基与大肠杆菌细胞上的甘露糖受体相互作用而结合在大肠杆菌细胞上。Chan和Chen报道了一种基于人血清白蛋白为保护剂的荧光金纳米簇HSA- AuNCs的检测细菌的方法,HSA-AuNCs可以特异性地与金黄色葡萄球菌结合[15]。
本研究探索了制备AuNCs@BSA最佳反应条件。结合AuNCs@BSA抑菌的特性,并与抗生素相结合,以此来测试是否可以提高部分抗生素药效,有效地抑制病菌的生长,并且测试了AuNCs@BSA的荧光特性,结果表明在与抗生素结合后对其荧光性能没有大的影响,又提供了药物荧光示踪的可能。
1 实验部分
1.1 材料
四氯金酸(北京伊诺凯科技有限公司),牛血清白蛋白(北京伊诺凯科技有限公司),硫酸奎宁(北京伊诺凯科技有限公司)、核黄素-5ʹ-磷酸盐(宁波贝伽尔新材料有限公司)、氢氧化钠(天津市科密欧化学试剂有限公司),去离子水。
1.2 AuNCs@BSA的制备
2.5 mL的50 mg·mL-1BSA溶液加入2.5 mL 10 mM的HAuCl4溶液,在室温下搅拌。然后滴加0.25 mL 1.0 M NaOH溶液。溶液混合物在300 W下加热至80 ℃ 4 min。自然冷却至室温,离心除去大颗粒,放入透析袋,每隔6 h换1次水,提纯48 h后冻干,4 ℃保存。
1.3 大肠杆菌/金黄色葡萄球菌的制备
将大肠杆菌标准菌株接种于营养肉汤培养基,37 ℃、200 r·min-1培养 12 h。随后10 000 g 离心5 min,弃去上清液,菌泥用PBS重悬并稀释,得到适宜浓度的大肠杆菌菌液。将保护剂,加入大肠杆菌菌液后,将保护剂分装至棕色西林瓶中。液体LB培养基,称取10 g胰蛋白胨,5 g酵母粉,10 g氯化钠,121℃,灭菌30 min。将大肠杆菌接种到冷却后的LB后放置摇床中,37 ℃,220 r·min-1, 培养12 h。
将金黄色葡萄球菌接种到TSA+YE(0.6%酵母浸粉的胰蛋白胨大豆琼脂)上,在37 ℃恒温恒湿培养箱中培养24 h,用接种环挑取单菌落至TSB+ YE (0.6%酵母浸粉的胰蛋白胨大豆肉汤)中,在37 ℃,150 r·min-1条件下振荡培养12 h至稳定前期,放置4 ℃冰箱中备用。
0.2 g的抗生素溶于5 mL去离子水,加入0.1 mL AuNCs@BSA, 混合完全后滴加到大肠杆菌和金黄色葡萄球菌中,24 h后观察结果。
2 结果与讨论
2.1 不同比例下的AuNCs@BSA荧光对比图
由表1可知,本研究设计了四种物料比,分别改变HAuCl4,BSA,NaOH的量,比例分别为1∶1∶0.25,1∶1∶0.5,2∶1∶0.25,1∶2∶0.25四种物料比。并直观的在365 nm紫外灯下观察荧光的强弱。

表1 制备AuNCs@BSA的原料配比

图1 不同配比下AuNCs@BSA的高清图及在紫外灯下的荧光对比图
图1可明显看出,改变物料比,产物的颜色有明显不同,在365 nm:紫外光下可明显看出,深棕色的溶液荧光明显。

图2 AuNCs@BSA荧光光谱图
图2是使用荧光光谱仪测试的强度,分别将不同物料比的AuNCs@BSA取10 μL AuNCs@BSA溶于10 mL去离子水中,进行荧光测试,在375 nm激发下,在550~650红外光区达到最高值,在物料比为1∶1∶0.25时,AuNCs@BSA荧光强度最强。

图3 AuNCs@BSA与消炎药结合原理图
采取一种简单的办法,将AuNCs@BSA与消炎药结合,充分混合后,滴到含有致病菌的培养基上,24 h后,观察抑菌圈的大小,可以直观地观察到AuNCs@BSA是否对抗生素有无增强作用,本研究选用了两种常见的致病菌,大肠杆菌和金黄色葡萄球菌用来做对照试验。
图4(a)选用的菌种为大肠杆菌,由图可明显看出,AuNCs@BSA与青霉素结合虽并未增强对大肠杆菌的抑制作用,但是阿莫西林与AuNCs@BSA的结合对大肠杆菌的抑制作用有明显增强。图4(b)选用的菌种为金黄色葡萄球菌,由图可明显看出,AuNCs@BSA与两种消炎药的结合均大幅提高了对金黄色葡萄球菌的抑制作用。
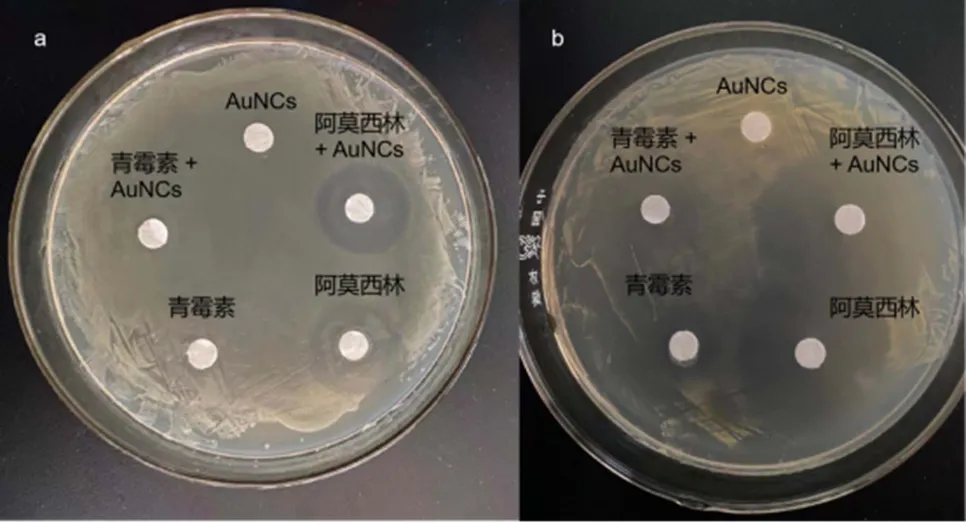
图4 AuNCs@BSA/青霉素和AuNCs@BSA/阿莫西林抑菌实验效果图
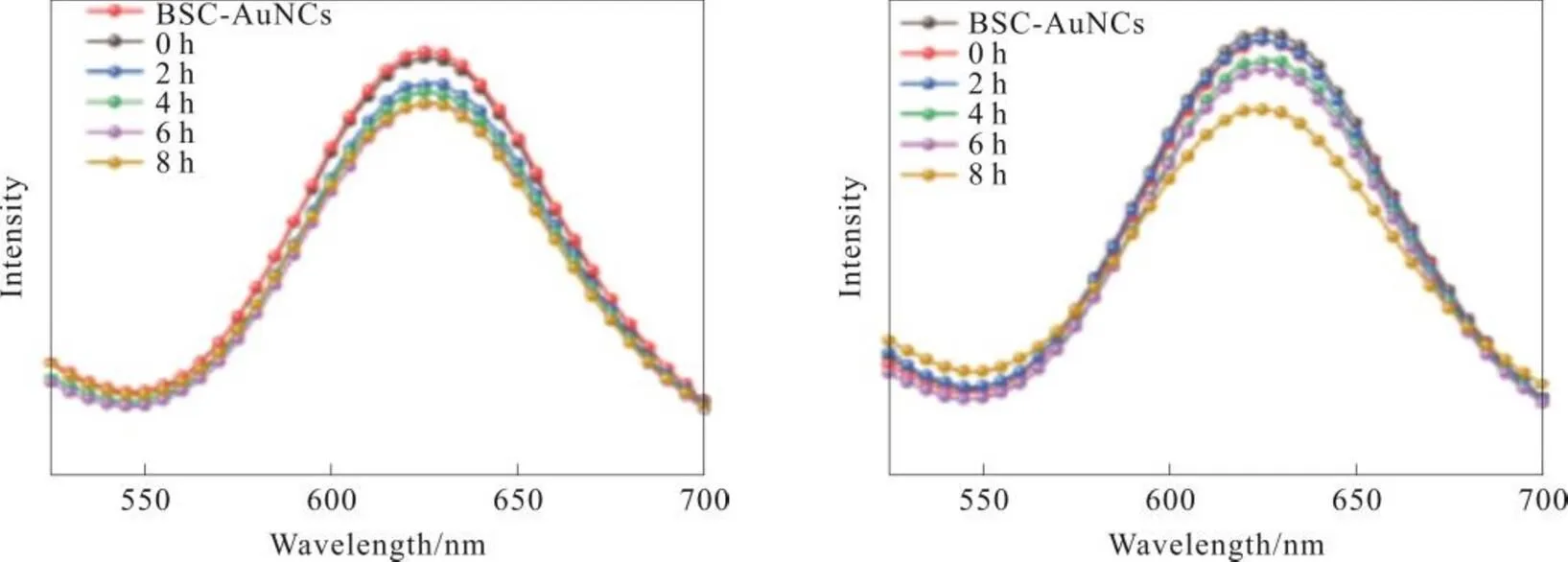
图5 (a)AuNCs@BSA/青霉素结合后8 h内的荧光强度变化图;(b)AuNCs@BSA/阿莫西林结合后8 h内的荧光强度变化图
图5为AuNCs@BSA/青霉素/阿莫西林结合后8 h内的荧光光谱图,分别混合后,2 h,4 h,6 h,8 h测试其荧光强度,AuNCs与青霉素相结合后8 h内荧光强度没有太大变化,可以依旧保持AuNCs@BSA的荧光特性,虽然在与阿莫西林的几个小时后荧光强度发生了微量减弱,但是依旧保持着很高的荧光强度,所以为药物示踪提供了可能。
3 结 论
本研究探索了制备AuNCs@BSA最佳反应条件。并与抗生素相结合,以此来提高部分抗生素药效,可以有效地抑制病菌的生长,发展快速简便的方法,对解决基层临床和野外等特殊场合的细菌问题有重要意义。选择合适的指示物用于标记细菌细胞是大多数细菌检测技术的基础,很多具有鲜艳的颜色的染料和能发出特定荧光的荧光物质陆续被选作细菌细胞标记物。金纳米材料具有廉价易制备易保存的优点,其中金纳米粒子溶液具有鲜艳的颜色,金纳米簇能在被激发后发出强烈的荧光,分别可以用于荧光标记。并且测试了AuNCs@BSA的荧光特性,结果表明在与抗生素结合后对其荧光性能没有大的影响,又提供了药物荧光示踪的可能。
[1]CAO X L, LI H W, YUE Y, et al. pH-Induced conformational changes of BSA in fluorescent AuNCs@BSA and its effects on NCs emission[J]., 2013, 65:186-192.
[2]ZHANG H, HUANG X, LI L, et al. Photoreductive synthesis of water-soluble fluorescent metal nanoclusters[J].., 2012, 48 (4): 567-569.
[3]SANTIAGO GONZALEZ B, RODIGUEZ M J, BLANCO C, et al. One step synthesis of the smallest photoluminescent and paramagnetic PVP- protected gold atomic clusters[J].., 2010, 10 (10): 4217-21.
[4]WANG J L, ZHANG G, LI Q, et al. In vivo self-bio-imaging of tumors through in situ biosynthesized fluorescent gold nanoclusters[J].., 2013, 3.
[5]XIE J P, ZHENG Y G, YING J Y. Protein-directed synthesis of highly fluorescent gold nanoclusters[J].., 2009, 131 (3): 888-889.
[6]CAO X , LI H , LIAN L , et al. A dual-responsive fluorescence method for the detection of clenbuterol based on BSA-protected gold nanoclusters[J]., 2016, 871.
[7]ZHANG M , DANG Y Q , LIU T Y , et al. Pressure-Induced Fluorescence Enhancement of the BSA-Protected Gold Nanoclusters and the Corresponding Conformational Changes of Protein[J]., 2013, 117 (1): 639-647.
[8]DING C, XU Y, ZHAO Y, et al. Fabrication of BSA@AuNCs Based Nanostructures for Cell Fluoresce Imaging and Target Drug Delivery. 2017.
[9]ESCUDERO-FRANCOS M A, CEPAS V, P GONZÁLEZ-MENÉDEZ, et al. Cellular Uptake and Tissue Biodistribution of Functionalized Gold Nanoparticles and Nanoclusters[J]., 2017, 13 (2): 167-179.
[10]付娆, 程欣. Ni2+离子修饰的金纳米粒子对牛血红蛋白的选择性吸附[J]. 东北电力大学学报, 2016 (2): 57-60.
[11]WANG T, XIAO D. Rapid synthesis of fluorescent bovine serum albumin-gold nanoclusters complex for glutathione determination[J]., 2021, 188 (6).
[12]ZHANG Z, ZHU N, ZOU Y, et al. A novel, enzyme-linked immunosorbent assay based on the catalysis of AuNCs@BSA-induced signal amplification for the detection of dibutyl phthalate[J]., 2018, 179: 64.
[13]YANG Y, LIU T L, ZHANG Y Y, et al. Acute Toxicity of BSA-AuNCs after Single Intranasal Exposure in Mice[D]. Chinese Journal of Veterinary Medicine, 2018.
[14]YOO D, LEE D. Oligochitosan-stabilized photoluminescent gold nanoconstructs for optical bioimaging[J]., 2017, 21 (1): 20.
[15]尤其. 金纳米簇/粒子的制备新方法及其在细菌检测中的应用[D]. 东南大学, 2019.
Study on the Preparation and Properties of AuNCs@BSA/Antibiotics
,,,,
(College of Materials Science and Engineering, Qiqihar University, Qiqihar Heilongjiang 161006, China)
Bovine serum albumin encapsulated fluorescent gold nanoclusters (AuNCs@BSA) wwere prepared by microwave-assisted process. The optimum experimental conditions were investigated by fluorescence spectrum and transmission electron microscope. Through changing reaction temperature and reaction time,the changes of particle size and fluorescence intensity were tested to explore the best reaction conditions. Proteins can be used as protective agents for the synthesis of gold nanoclusters. These biomacromolecules themselves have excellent biocompatibility and can be combined with antibiotics to enhance the efficacy of some antibiotics, and have no significant impact on the fluorescence properties of AuNCs@BSA, and provide the possibility of drug fluorescence tracing.
AuNCs@BSA; Penicillin; Amoxicillin; Escherichia coli; Staphylococcus aureus
TQ050.4+1
A
1004-0935(2022)02-0190-04
2021-10-28
马德彪(1997-),男,黑龙江省大庆市人,齐齐哈尔大学硕士研究生在读,研究方向:荧光纳米粒子的制备及性能研究。
张小舟(1974-),女,教授,研究方向:生物基聚碳酸酯及其复合材料的研究。
