山羊传染性胸膜肺炎荧光定量PCR 检测方法的初步建立
2022-03-10赵文华李富祥杨仕标
赵文华,李富祥,杨仕标
(云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
山羊传染性胸膜肺炎(CCPP)是一种由山羊支原体山羊肺炎亚种(Mccp)引起的高度接触性传染病,流行于亚非各国。在易感羊群中,CCPP 的发病率和病死率分别达100%、80%,可对山羊养殖业造成的巨大经济损失,被世界动物卫生组织(OIE)列为必须报告的疫病之一[1-3]。CCPP的典型病症为高热(41~43 ℃),感染羊群无年龄和性别差异,妊娠母羊易流产[4-5];病理特征为肺间质及间叶水肿。流行地区的CCPP 诊断比较复杂,在临床病理上必须与其他相似的综合症状加以区分,如小反刍兽疫、巴氏杆菌病等[6-8]。临床准确诊断该病通常结合临床症状与实验室方法。常用的实验室方法包括分子生物学检测、病原学诊断和血清学诊断等[9-10]。其中,进行病原分离是确诊CCPP最为特异准确的方法,但Mccp对营养条件要求苛刻,难以体外进行分离培养,非专业实验室一般无法完成分离鉴定;免疫血清学检测方法存在非特异性、实验室仪器设备要求成本高和不易操作等缺点;病原核酸检测则可快速确诊该病。本研究为建立快速进行CCPP临床检测的分子生物学核酸检测方法,以期为后续相关研究提供参考。
1 材料与方法
1.1 试验材料
CCPP 疫苗菌株由哈尔滨兽医研究所辛九庆老师馈赠,巴氏杆菌细菌为本实验室自临床送检病料分离获得。
1.2 试剂与仪器
主要仪器:TaKaRa MiniBest Universal Genomic DNA Extraction kit、TaKaRa Ex Taq RR001A(大连宝生物工程有限公司);GeneAmp PCR SYSTEM 9700 普通PCR 仪、ABI 7500 Fast 荧光定量PCR 仪、荧光定量PCR 反应管(ABI 公司);Nanovue Plus微量分光光度仪(GE公司)。
主要试剂:Premix Ex TaqTM(Probe qPCR,RR390A)试剂盒、Goldview 核酸染色剂(大连宝生物工程有限公司);琼脂糖、氯仿、异丙醇、无水乙醇等(分析纯,上海生工生物工程技术服务有限公司)。
1.3 引物及探针
根据参考文献[11]及相关GenBank 序列设计两对CCPP 普通PCR检测引物,荧光定量PCR检测所用引物及探针根据自测序列及相关GenBank序列设计合成,级别为HPLC级的Taqman探针及引物均由大连宝生物公司合成。采用无RNAase酶的PCR级水溶解合成的引物/探针干粉,制备100 mmol/L的引物/探针贮存浓度、20 mmol/L的引物工作浓度、10 mmol/L的探针工作浓度,-80 ℃贮存。普通PCR引物情况见表1,荧光定量PCR引物情况见表2。

表1 CCPP普通PCR检测引物Tab.1 Primers of routine PCR for detection of CCPP
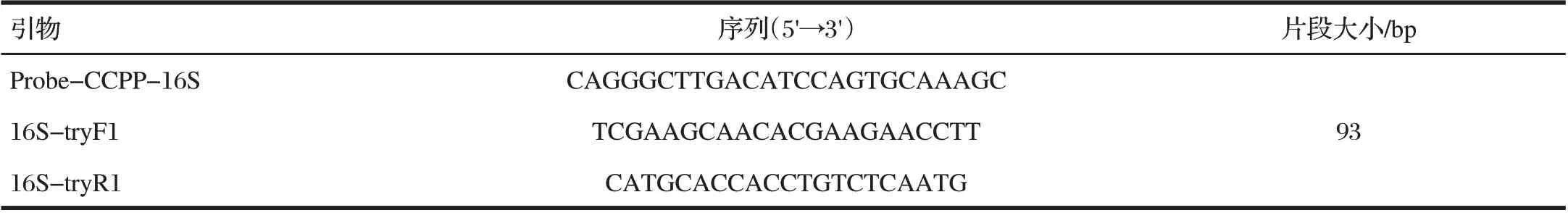
表2 CCPP荧光定量PCR引物探针Tab.2 Probe and Primers of real-time PCR for detection of CCPP
1.4 试验方法
1.4.1 菌体基因组DNA提取
按照提取试剂盒说明书操作。收集1.0~5.0×109菌体细胞,12 000 r/min 离心2 min,弃上清;将180 µL Buffer GL、20 µL Proteinase K 和10 µL RNase A(10 g/L)加入沉淀,混匀,56 ℃温浴10 min;将上述样本移入吸附柱,12 000 r/min离心2 min,弃滤液后加入500µL Buffer WA,12 000 r/min 离心1 min,弃滤液;再加入700 µL Buffer WB,室温静置1 min,12 000 r/m 离心1 min,弃滤液,循环2 次。最后将吸附柱安置于一新离心管,将50µL Elution Buffer 加入吸附柱膜中央,室温静置3~5 min,12 000 r/min离心2 min 洗脱DNA,弃去吸附柱,收集有DNA 液体的离心管,-80 ℃贮存。
1.4.2 反应体系及反应程序
CCPP 普通PCR 反应液:10×ExTaq buffer 5.0 µL、TaKaRa Ex Taq 0.5 µL、dNTP Mixture 4.0 µL、Primer F 1.0µL、Primer R 1.0µL、DNA 1.0µL、H2O 37.5µL。
反应程序为:95℃4 min;94 ℃1 min,55 ℃1 min,72 ℃1 min,循环34 次;72 ℃10 min。采用2%琼脂糖凝胶跑电泳,紫外成像仪检测扩增结果,拍照记录。
荧光定量PCR 反应液:Premix Ex Taq(Probe qPCR)10.0 µL、Primer 16S-tryF1 0.2 µL、Primer 16S-tryR1 0.2 µL、Probe CCPP 16S 0.4 µL、Rox II 0.2 µL、DNA 1.0µL、H2O 8.0µL。
实时荧光定量PCR反应程序为:95 ℃20 s;95 ℃5 s,60 ℃30 s,40个循环。
1.4.3 CCPP 普通PCR 扩增片段的纯化回收、克隆及序列测定
胶回收扩增得到的CCPP16S 及arcD基因片段,克隆连接至pMD-18T Vector,挑取阳性克隆,对获得的阳性克隆进行序列测定和BLAST 分析,具体详细操作步骤参见相关的参考文献[12]和[13]。根据获得的基因序列合成荧光定量PCR引物及探针。
1.4.4 构建标准曲线及敏感性、重复性试验
以已构建的CCPP-16S 基因pMD-18T 载体质粒为标准品,采用Nanovue Plus 核酸快速检测仪测定并计算原始质粒的浓度,制备108~100copies/µL 共9 个稀释度的标准品,构建CCPP-16S标准曲线并检测敏感性、重复性。
1.4.5 特异性试验及临床样本检测
除对CCPP疫苗株、临床样本进行荧光定量检测外,还对临床上极易混淆的巴氏杆菌等进行鉴别检测,以验证探针及配套引物对的特异性。
2 结果与分析
2.1 CCPP普通PCR扩增片段的纯化回收、克隆及序列测定(见图1)
由图1可知,根据表1所设计的两对引物对CCPP疫苗株DNA 进行常规PCR 扩增,均有预期大小片段扩增出。将各预期片段胶回收、纯化,克隆连接至pMD-18T Vector获得阳性克隆,提取质粒进行序列测定和分析;所测序列经网上BLAST 比对,均为CCPP 相应基因片段的正确序列。根据所测序列设计合成位于16S 基因片段的一对引物和配套探针见表2。
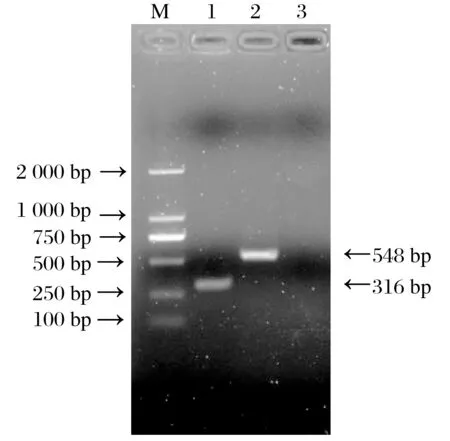
图1 CCPP疫苗株两对引物普通PCR扩增结果Fig.1 Result of routine PCR of CCPP vaccine strain amplified with the two primer sets
2.2 CCPP-16S 荧光探针标准曲线的构建(见图2~图4、表3)
由图2 可知,在103~108copies/µL 浓度之间标准品质粒浓度的对数与Ct 值之间存在良好的线性关系,CCPP-16S 探针标准曲线的方程式表达为:Y=-3.323 058X+41.844 292,R2=0.998 517,扩增效率为99.95%。上述方程式中Y为Ct值,X为拷贝数的对数,R2为相关系数。
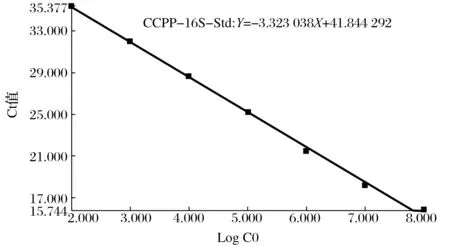
图2 CCPP-16S质粒标准品荧光定量PCR标准曲线Fig.2 Standard curve of CCPP-16S standard plasmids real-time PCR
由图3可知,以Ct值35为阳性样品临界值,则CCPP-16S 探针对样本的检测敏感性可低至102.06copies/µL。由图4可知,利用配套引物对进行普通PCR检测时检测敏感度仅为104copies/µL,较实时荧光定量法的敏感度低近100 倍。以 优 化 的 反 应 条 件 选 取103、104、105、106、107copies/µL的标准模板分别连续扩增3次,结果显示,每个梯度的样本重复性均较好。

图3 CCPP-16S质粒标准品动力学扩增曲线Fig.3 Dynamic curve of CCPP-16S standard plasmids

图4 CCPP-16S普通PCR敏感性试验结果Fig.4 Sensibility test results of CCPP-16S routine PCR
由表3 可知,组内重复性试验变异系数均小于2.5%,说明该方法具有较好的重复性与稳定性。
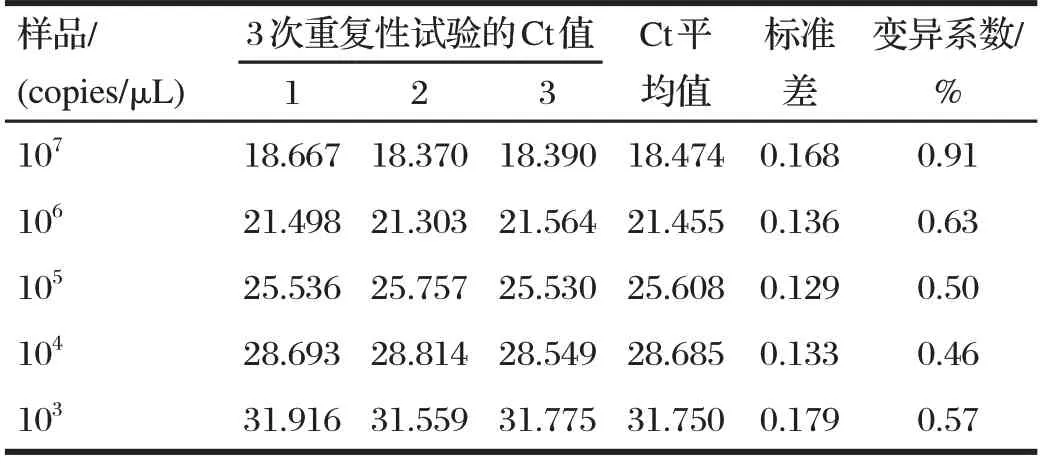
表3 荧光定量PCR CCPP-16S质粒标准品的重复性试验结果Tab.3 Repeatability test results of real-time PCR for CCPP-16S standard plasmids
2.3 特异性检测及初步临床应用(见图5)
由图5 可知,本研究建立的CCPP-16S 荧光定量PCR方法仅对CCPP有特异性荧光信号检出,而阴性对照、巴氏杆菌均无荧光信号测出。
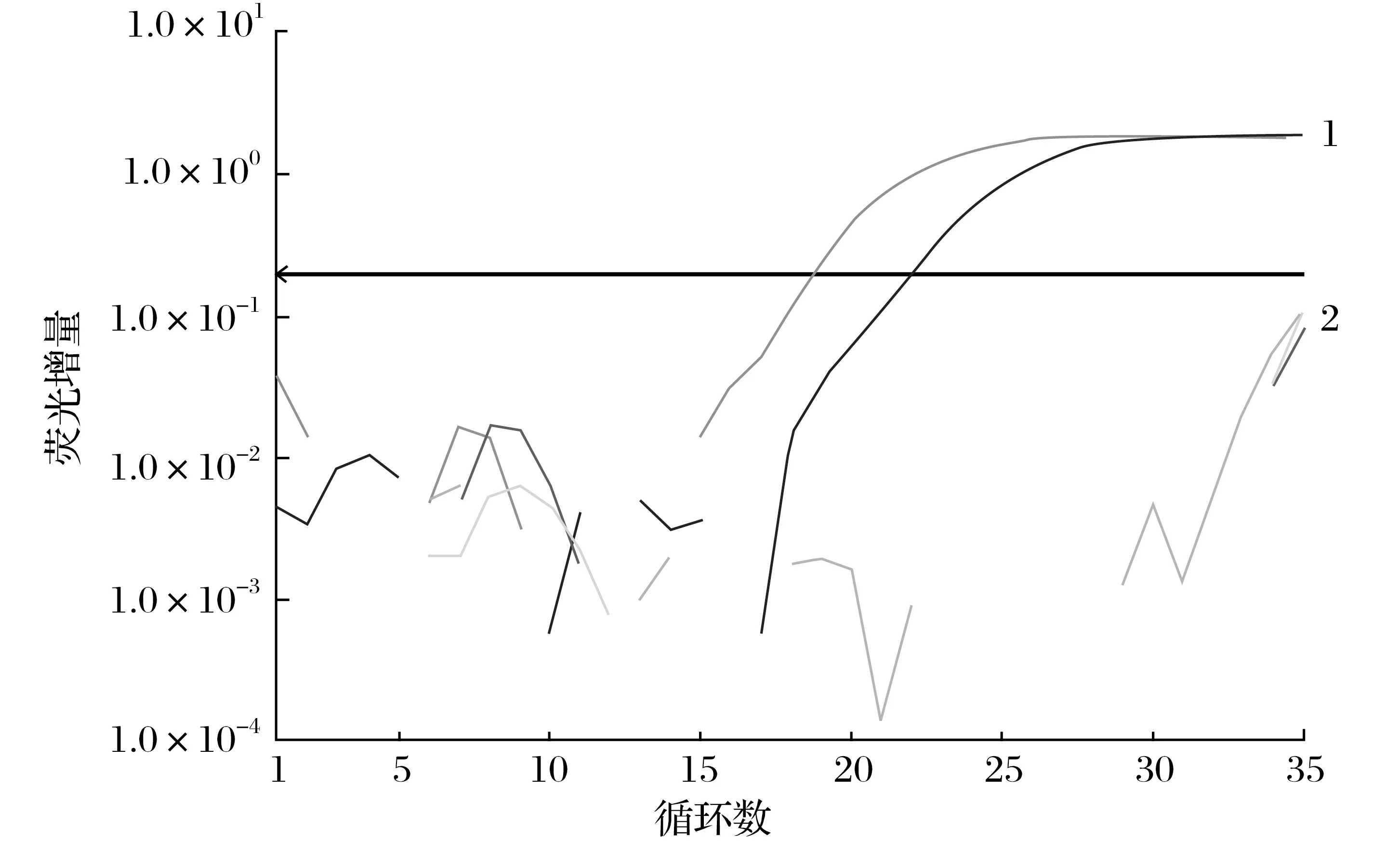
图5 CCPP-16S Taqman探针荧光定量PCR检测结果Fig.5 Results of CCPP-16S Taqman probe real-time PCR
3 讨论
随着技术进步,各种疫病的检测均需实现快速、高效,以便及时应对疫情、准确处置,将损失降至最低。CCPP的病死率极高,危害极其严重,临床诊断中易混淆的疫病也很多;目前,国内外对CCPP 的诊断主要依靠病原分离鉴定、血清学试验以及分子生物学技术[14-16]。对比3 类诊断方法可知,传统的分离鉴定方法因支原体生长速度慢且生长条件苛刻等特点,无法立即解决快速诊断的问题;而间接血凝试验、补体结合试验与竞争ELISA 等血清学试验,因敏感性或特异性较差等缺陷问题,亦无法作为诊断该病原的快检方法。分子生物学技术具有快速、准确、灵敏、特异等优点,尤其是新近发展起来的荧光定量PCR 诊断技术。实时荧光定量PCR 是一种飞速发展且广泛应用于各行各业的快速定性、定量的检测技术。相对传统的基于抗体而建立的血清学检测方法及普通PCR技术,实时荧光定量PCR技术具有更快速更灵敏的优势,可通过检测病原遗传物质“核酸”对疫病进行快速确诊,进而及时制定疫情处置措施制定相应的治疗方案。
4 结论
本研究基于Mccp 16S rRNA基因初步建立可对CCPP进行快速特异性检测的Taqman探针实时荧光定量PCR检测方法,可快速特异性确诊CCPP,但仍需大量临床样本进行方法的验证和进一步的条件优化。本方法的初步建立为CCPP的快速高通量临床检测提供了一定的技术参考。
