CeO2/Ti3C2/CdS Z型异质结复合物的制备及其光催化降解甲基橙
2022-03-08张冉冉刘传鹏陈汝芬
张冉冉, 刘传鹏, 陈汝芬
(1.河北师范大学 化学与材料科学学院,河北 石家庄 050024; 2.石家庄市冶河灌区引岗服务中心,河北 石家庄 050200)
染料的大规模使用引起环境污染[1].甲基橙(MO)是一种常见的阴离子染料,存在于工业废水中[2].从废水中去除MO的方法较多[3-5],其中光催化降解具有操作简单、实施成本低、不产生有毒物质等优点而被广泛应用[6].Ti3C2层状材料具有较高的表面活性、窄的带隙能(Eg≈0.5 eV)、优良的导电性,是一种常见的n型半导体,常作为光助催化剂应用于可见光催化领域[7].Ti3C2的光催化活性不高,但其表面丰富的亲水官能团可与一些半导体材料形成紧密接触的异质结复合物,可促进光生载流子的分离,有助于提高可见光催化降解活性[8-11].其中CeO2(Eg≈2.2 eV)[12]和CdS(Eg≈2.4 eV) 是常见的n型半导体光催化剂,但可见光利用效率较低、光生电子-空穴对易复合、光腐蚀等缺点限制了其进一步的应用[13-14].研究发现,将CeO2和CdS与其他半导体材料构成异质结复合材料,可提高光催化降解性能[15-17].
在异质结复合物光催化剂中,Z型异质结的形成可增强催化剂的氧化还原降解能力,有效提高光催化降解性能.近年来,以Ti3C2为传输介质,构筑三元Z型异质结复合物的研究引起了科研人员的广泛关注.如TiO2/Ti3C2/MoS2[18],g-C3N4/Ti3C2/TiO2[19],Bi2WO6/Ti3C2/g-C3N4[20]等三元Z型异质结的形成加速了载流子的分离和传输,可显著提高对污染物的降解性能[21].但是,采用简单的方法制备以Ti3C2为介质的可见光响应高效稳定的三元Z型异质结光催化剂仍需深入研究.
本文中,笔者采用氢氟酸蚀刻法制备了Ti3C2,采用水热法制备了Ti3C2/CeO2复合物,通过水热过程合成了Ti3C2/CeO2/CdS三元Z型异质结复合物,并研究了复合物对MO的可见光催化降解性能.
1 实验部分
1.1 试剂及仪器
Ti3AlC2,HF,六水合硝酸铈,氢氧化钠,氯化铬,九水合硫化钠,橙黄Ⅱ,氯化钾,对苯醌,异丙醇,乙二胺四乙酸二钠等均为分析纯.
S-4800扫描电镜(SEM,日本Hitachis),JEOLJEM-F200透射电镜(TEM,日本电子株式会社),AXS-D8-Advance X射线衍射仪(XRD,德国布鲁克),Fisher K-Alpha X射线光电子能谱(XPS,美国赛默飞世尔),Kubo-X1000比表面测定仪(BET,北京彼奥德电子技术有限公司),Carry60紫外可见漫反射(UV-vis,美国安捷伦科技公司),FS5荧光分光光度计(PL,Edinburg Hinstruments),PGSTAT302N(电化学工作站,瑞士万通中国有限公司).
1.2 实验内容
1.2.1 Ti3C2和CeO2/Ti3C2的制备
以Ti3AlC2和HF为原料,向适量Ti3AlC2中缓慢加入HF,并放入磁子搅拌30 min后放入水浴锅中,30 ℃水浴加热25 h,然后取出样品进行离心、洗涤,直至样品pH=7,将其放入真空干燥箱,80 ℃,干燥12 h,制得Ti3C2.将Ti3C2分散于0.03 mol/L的Ce(NO3)3溶液中,超声15 min,然后滴入4 mol/L NaOH溶液中,搅拌15 min,混合完成,得到前体;将此前体转入内衬聚四氟乙烯的高压釜,在120 ℃时下水热处理12 h;降温,取出试样用蒸馏水洗涤,在80 ℃真空条件下干燥12 h,即制得CeO2/Ti3C2复合物[22].
1.2.2 CeO2/Ti3C2/CdS的制备
将制备的CeO2/Ti3C2复合材料分散在一定浓度的CdCl2溶液中,超声振荡15 min,在搅拌下逐滴加入与Cd2+等物质的量的Na2S水溶液,形成黄色胶状沉淀,即前体;将此前体转入高压反应釜中,在200 ℃时水热处理6 h,待高压反应釜冷却至室温后,离心洗涤,在85 ℃真空条件下干燥12 h,即制得CeO2/Ti3C2/CdS复合光催化剂.复合物中CeO2/Ti3C2与CdS的质量比为1∶0.5,1∶1,1∶3,1∶5,分别记为CTC-1∶0.5,CTC-1∶1,CTC-1∶3,CTC-1∶5.
同时,在上述条件下,加入CeO2,CeO2与CdS的质量比为1∶1,制备得到CeO2/CdS.
1.3 复合物对甲基橙的光催化降解
将0.05 g的光催化剂加入到200 mL 22 mg/L的MO溶液中,用0.5 mol/L的H2SO4溶液调节pH为3,在暗室(自制铁皮箱)中静置12 h;达到吸附平衡后,在氙灯照射下,利用冷却恒温槽控制温度为25 ℃,向其中通入空气,MO发生降解.在降解过程中,每隔5 min取样6 mL左右,利用UV-5100紫外-可见分光光度计在最大吸收波长(λmax=504 nm)处测量溶液的吸光度A,计算降解率.
2 结果与讨论
2.1 SEM和HRTEM分析
图1是CeO2/Ti3C2和不同复合比CeO2/Ti3C2/CdS复合物的SEM及HR-TEM图.由图1a可以看出,在Ti3C2的片层上负载着不规则的棒状样品,基于EDS分析,棒状纳米颗粒为CeO2.从图1 b~e中可看出,三元复合物中,随CdS的增加,复合物表面球状颗粒样品增多,层状结构越来越不明显.由图1f可见,CTC-1∶3的晶格条纹间距分别为0.31,0.33,0.189 nm,分别对应立方相CeO2的(111)晶面[23]、Ti3C2的(110)晶面[24]以及六方相CdS(103)晶面[25],说明复合物中存在 CeO2,Ti3C2,CdS,且彼此间紧密而连续地接触.

a.Ti3C2/CeO2; b.CTC-1∶0.5; c.CTC-1∶1; d.CTC-1∶3; e.CTC-1∶5; f.CTC-1∶3.
2.2 XRD 分析
图2是CeO2/Ti3C2和Ti3C2(A)及不同复合比CeO2/Ti3C2/CdS复合物(B)的XRD谱,在图2A中,存在着Ti3C2[9.5 °(002),19.2 °(004),61.0 °(110)]和立方相CeO2(JCPDS43-1002)[28.54 °(111),33.39 °(200),47.50 °(220)]的特征峰[26].在图2B中24.8 °(100),28.3 °(101),43.7 °(110),47.8 °(103),51.9 °(112)处出现了六方相CdS(JCPDF 41-1049)的特征峰.随着CeO2/Ti3C2/CdS复合物中CdS含量的增加,CdS的特征峰明显增强.

a.CTC-1∶5; b.CTC-1∶3; c.CTC-1∶1; d.CTC-1∶0.5.
2.3 XPS及BET分析
对样品进行了XPS分析,结果如图3所示.图3a,b为CTC-1∶3的Ti 2p和C 1s谱.在Ti 2p的XPS谱(图3a)中,结合能为458.28,464.03 eV处的2个峰分别对应Ti3C2中的Ti 2p3/2和Ti 2p1/2自旋轨道[27-28];在C 1s的XPS谱(图3b)中,结合能为284.56,286.15,288.52 eV处的3个峰分别对应C—Ti,C—O,C—F键,说明CTC—1∶3中存在Ti3C2[19].
图3c,d为CTC-1∶3与CdS的Cd 3d和S 2p谱.在CdS的Cd 3d谱(图3c)中,404.74,411.48 eV处的2个峰分别对应Cd2+的Cd 3d5/2和3d3/2自旋轨道,表明Cd2+的存在[29].在CdS的S 2p谱(图3d)中,160.95,162.47 eV处的峰分别对应S 2p3/2和S 2p1/2自旋轨道,表明S2-的存在[30].对比发现,CTC-1∶3的Cd 3d和S 2p谱峰的结合能均比CdS的偏高,其结合能的正位移归因于CdS的电子密度增加,说明CdS与CeO2/Ti3C2之间存在一定的化学相互作用[31].

图3 不同样品的XPS谱
图3e,f给出了CTC-1∶3与CeO2的Ce 3d和O 1s谱.在图3e中,纯CeO2的Ce 3d谱有2个多重峰ν峰和u峰,分别归属于Ce离子3d5/2和3d3/2自旋分裂轨道.Ce3+的峰标记为{u3(907.29),ν3(888.27),u1(899.39),ν1(883.66)} ,Ce4+峰标记为{u5(917.30),ν5(899.27),u4(910.73),ν4(889.69),u2(902.41),ν2(883.78)}[32],可以看出CeO2和CTC-1∶3中的Ce主要处于Ce4+化学态;与CeO2相比,CTC-1∶3 Ce 3d谱的Ce4+和Ce3+峰向低的结合能方向偏移.在O 1s谱(图3f)中,CeO2的O 1s谱在529.3,531.5 eV和533.1 eV的峰为晶格氧(Olat)、氧空位(Ovac)和化学吸附氧(Oads);相应地CTC-1∶3 O 1s谱的Olat,Ovac和Oads峰值有一定的偏移;同时对O 1s XPS 峰面积进行了拟合,CTC-1∶3,CeO2拟合的Ovac含量分别为64.54 %,49.18%,显然CTC-1∶3具有较高的表面氧空位.样品表面产生的氧空位可能由于在水热形成CeO2的过程中产生一定的Ce3+[26,32],Ce4+和Ce3+之间的氧化还原反应会促进激活氧空位的产生.CTC-1∶3复合物的形成中,CeO2与Ti3C2,CdS之间的相互作用,进一步促进了氧空位的形成[27-33].
同时,对不同样品进行了比表面积分析.由表1可知,与Ti3C2/CeO2和CdS相比,CeO2/Ti3C2/CdS的比表面积和孔容均有提高.其中,CTC-1∶3具有最高的比表面积,高比表面积的样品具有较多的活性位点,有利于光催化反应的进行.

表1 不同样品的比表面积、孔容及带隙能
2.4 光催化降解
2.4.1 不同样品光催化降解MO的分析
以制备的样品作为光催化剂,对MO进行光催化降解,得到的降解曲线如图4所示.CeO2/Ti3C2/CdS三元复合物对MO的降解率均高于Ti3C2/CeO2及CdS.三元复合物中,CeO2/Ti3C2/CdS-1∶3具有最高的光催化降解活性,光催化30 min,对MO的降解率达到98.26 %.另外,CeO2/CdS对MO的降解率为33.87 %,加入Ti3C2制备的CeO2/Ti3C2/CdS三元复合物后,对MO的降解率明显高于CdS/CeO2,说明在CeO2/Ti3C2/CdS三元复合物中,Ti3C2起了关键作用,使其光催化降解性能得到提高.

a.CTC-1∶0.5; b.CTC -1∶1; c.CTC-1∶3; d.CTC-1∶5;e.Ti3C2/CeO2; f.CeO2/CdS; g.CdS.
2.4.2 光催化机理分析
对不同样品进行了UV-vis DRS测试(见图5A),同时,依据吸收光谱的数据,以(αhν)2~hν作图,得到了样品的带隙能(见图5B).不同样品的带隙能列于表1.与CdS相比,CeO2/Ti3C2/CdS复合物的带隙能有所降低,在可见光范围内有一定的吸收.在三元复合物中,CTC-1∶3的带隙能最小,对可见光的利用率最高.
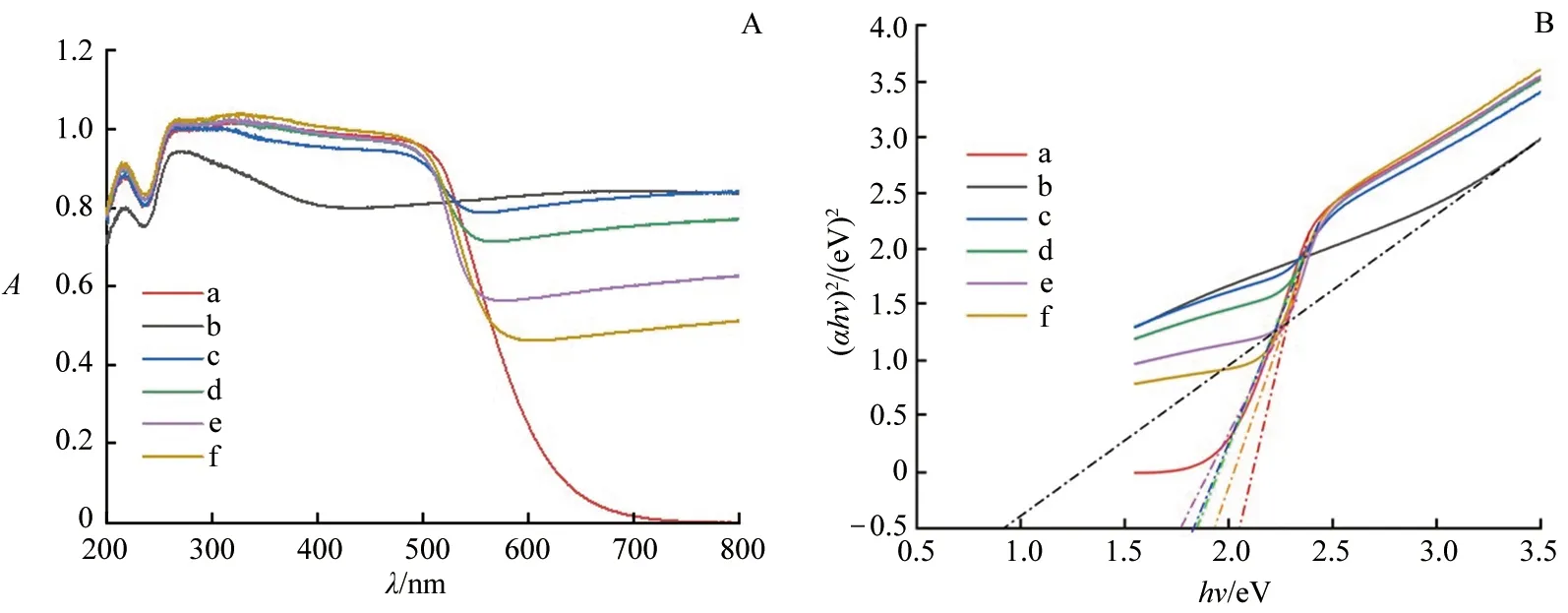
a.CdS; b.Ti3C2/CeO2; c.CTC-1∶0.5; d.CTC-1∶1; e.CTC-1∶3; f.CTC-1∶5.
对样品进行PL和光电流测试的结果如图6所示.可以看出,与Ti3C2/CeO2和CdS相比,CeO2/Ti3C2/CdS复合物的PL谱强度降低、光电流增大,说明CeO2/Ti3C2/CdS复合物的形成,有效地抑制了表面光生电子-空穴对的复合,其中CTC-1∶3的PL谱峰强度最低,光电流强度最大,说明其具有最强的抑制光生载流子复合的能力,显示出最佳的光催化降解活性.

a.CdS; b.CeO2/Ti3C2; c.CTC-1∶0.5; d.CTC-1∶1; e.CTC-1∶3; f.CTC-1∶5.
2.4.3 光催化活性物种分析
在CTC-1∶3降解MO体系中,分别加入一定量的异丙醇(·OH的淬灭剂)、对苯醌(·O2-的淬灭剂)、乙二胺四乙酸二钠 (EDTA-2Na,h+的淬灭剂),分析体系的活性物种.由图7可见,加入3种猝灭剂,体系对MO的降解活性均有所降低,说明降解体系中存在·O2-,·OH和h+活性物种,其中,·O2-是降解的主要活性物种.

a.加对苯醌; b.加EDTA-2Na; c.加异丙醇; d.未加.
另外,通过Mott-Schottky测试得到样品的半导体类型和平带电位,如图8所示.CdS,Ti3C2和CeO2的M-S斜率为正,均为n型半导体,同时得到CdS,Ti3C2和CeO2的平带电位(Efb),分别为-0.85,-0.28,-0.51 V(vs·Ag/AgCl),以Ag/AgCl(0.22 V vs·NHE)作为参比电极时,3种样品的Efb相当于-0.63,-0.06,-0.29 V(vs·NHE).一般认为,n型半导体的导带电位(ECB)比平带电位低约0.1 V[34],所以CdS,Ti3C2和CeO2的ECB分别为-0.73,-0.16,-0.39 V(vs·NHE).再根据EVB=ECB+Eg[35],计算出CdS,Ti3C2和CeO2的价带电位(EVB)分别为1.31,0.34,1.37 V(vs·NHE).

图8 不同样品的Mott-Schottky图
综上分析可知,CeO2/Ti3C2/CdS中形成了以Ti3C2为传输介质的Z型异质结,其光催化降解机理如图9所示.在可见光照射下,CeO2和CdS中的电子发生跃迁,由于CeO2的ECB(-0.39 V vs·NHE)比Ti3C2的ECB(-0.16 V vs·NHE)更负,电子可由CeO2的导带转移到Ti3C2上,CdS的EVB(1.31 V vs·NHE)比Ti3C2的EVB值(0.34 Vvs NHE )更正,CdS价带上的空穴可以迁移到Ti3C2上,使催化剂表面的电子-空穴对有效分离.同时,CdS的ECB(-0.73 V)比O2/·O2-的电位(-0.046 V vs·NHE)更负[22,35],电子可以与溶解在水中的氧(O2)反应生成 ·O2-,在酸性体系中,体系产生的·O2-与溶液中的H+结合生成·OH[15].同时,在CeO2价带上积累一些h+.在CeO2/Ti3C2/CdS三元Z型异质结复合物中,Ti3C2作为电荷传输的介质,促进了电荷的转移和传输,有效抑制了光生载流子的复合,提高了体系的氧化还原降解能力,产生较多的活性物种(·O2-,·OH,h+),增强了体系对MO的光催化降解性能.

图9 CeO2/Ti3C2/CdS光催化降解机理示意图
3 结 论
通过水热法制备了CeO2/Ti3C2/CdS Z型异质结复合物,并对样品结构、形貌及光催化性质进行了表征.与CeO2/Ti3C2和CdS相比,该三元复合物具有较高的光催化降解MO的性能.与CeO2/CdS相比,该复合物对MO的光催化活性有明显提高.分析发现,以Ti3C2为传输介质,CeO2/Ti3C2/CdS Z型异质结的形成,有效抑制了催化剂中光生电子-空穴对的复合,促进了活性物种(·O2-,·OH,h+)的产生,提高了催化剂的光催化降解能力,其中,CeO2/Ti3C2/CdS-1∶3具有最高的可见光催化降解活性.该研究有助于三元复合物在废水净化领域中的进一步应用.
