丹参酮调控LncRNA DLX6-AS1对LPS诱导的肺泡Ⅱ型上皮细胞损伤的作用*
2022-03-06余淑菁余莉萍李旭成崔金涛
余淑菁 余莉萍 李旭成 崔金涛
(1.湖北省武汉市优抚医院,湖北 武汉 430021;2.湖北省武汉市中医医院,湖北 武汉 430014)
急性肺损伤发病机制较为复杂,目前尚无有效的治疗手段[1-2]。肺泡Ⅱ型上皮细胞位于肺泡表面并可抵御外界病原体,肺泡Ⅱ型上皮细胞凋亡及炎症反应等可造成细胞损伤从而促进急性肺损伤的发生[3]。研究表明中医药成分具有减轻急性肺损伤作用,但关于其具体作用机制尚未阐明[4]。丹参酮(又称丹参酮ⅡA)是从唇形科植物丹参中提取的一种脂溶性非醌色素类化合物,研究表明丹参酮可抑制心肌细胞氧化应激从而减轻心肌细胞损伤[5]。但丹参酮与急性肺损伤相关研究报道相对较少。研究表明,LncRNA DLX6-AS1在脂多糖(LPS)诱导的人肾小管上皮细胞中表达上调,降低其表达可抑制细胞凋亡从而减轻急性肾损伤[6]。但DLX6-AS1在急性肺损伤中的作用机制尚未阐明。因此,本研究采用LPS诱导的肺泡Ⅱ型上皮细胞建立急性肺损伤模型,探讨丹参酮是否可通过调控DLX6-AS1表达而影响LPS诱导的肺泡Ⅱ型上皮细胞损伤。
1 材料与方法
1.1 药物与试剂 丹参酮(纯度≥98%)购自上海源叶生物科技有限公司;LPS购自美国Sigma;Trizol试剂、LipofectamineTM3000 Transfection Reagent购自美国Invitrogen;MTT试剂、细胞凋亡检测试剂盒购自北京索莱宝;白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)检测试剂盒购自上海酶联生物;反转录与荧光定量PCR试剂购自美国Thermo Fisher;si-NC、si-DLX6-AS1、pcDNA、pcDNA-DLX6-AS1购自上海吉玛制药。
1.2 细胞株 肺泡Ⅱ型上皮细胞,购自无锡菩禾生物医药技术有限公司。
1.3 分组与干预 肺泡Ⅱ型上皮细胞常规培养,待细胞生长至80%融合度时进行传代培养。取对数生长期细胞按 1×104个/孔接种于 6孔板,加入含 5 μg/mL LPS的DMEM培养基处理24 h[7],记为LPS组。同时将正常培养细胞记为空白对照组。用不同质量浓度(5、10、20 μg/L)的丹参酮[8]与含5 μg/mL LPS的DMEM培养基处理24 h,分别记为LPS+丹参酮L组、LPS+丹参酮M组、LPS+丹参酮H组。采用脂质体转染法将si-NC、si-DLX6-AS1分别转染至肺泡Ⅱ型上皮细胞,转染成功后加入含有5 μg/mL LPS的DMEM培养基培养24 h,分别记为LPS+si-NC组、LPS+si-DLX6-AS1组。采用脂质体转染法将pcDNA-DLX6-AS1转染至肺泡Ⅱ型上皮细胞,转染成功后加入含有20 μg/L丹参酮与 5 μg/mL LPS的DMEM培养基培养24 h,记为LPS+丹参酮+pcDNA-DLX6-AS1组。
1.4 MTT检测细胞增殖 将各组肺泡Ⅱ型上皮细胞以2×103个/孔接种于96孔板,每孔添加20 μL的MTT溶液,孵育4 h后,每孔添加150 μL DMSO,避光振荡孵育5 min。酶标仪检测490 nm处各孔吸光度(A)值。
1.5 流式细胞术检测细胞凋亡率 胰蛋白酶消化各组肺泡Ⅱ型上皮细胞,按照凋亡检测试剂盒进行双染色,用流式细胞仪检测凋亡率。
1.6 ELISA法检测IL-6、IL-10、TNF-α的水平 肺泡Ⅱ型上皮细胞按照分组处理后,收集培养液上清,参照ELISA试剂盒步骤测定IL-6、IL-10、TNF-α的水平。
1.7 qRT-PCR检测DLX6-AS1的表达水平 取1 mL Trizol试剂q
1.8 统计学处理 应用SPSS21.0统计软件。计量资料以()表示,两组间计量资料的比较采用独立样本t检验,多组间计量资料的比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组肺泡Ⅱ型上皮细胞损伤及炎症因子的比较 见图1,表1。与空白对照组比较,LPS组细胞增殖抑制率和细胞凋亡率升高(P<0.05),IL-6、TNF-α、IL-10的水平升高(P<0.05);与LPS组相比,LPS+丹参酮L组、LPS+丹参酮M组、LPS+丹参酮H组细胞增殖抑制率和细胞凋亡率降低(P<0.05),IL-6、IL-10、TNF-α的水平降低(P<0.05),且呈剂量依赖性。
表1 各组肺泡Ⅱ型上皮细胞损伤及炎症因子的比较(±s)

表1 各组肺泡Ⅱ型上皮细胞损伤及炎症因子的比较(±s)
注:与空白对照组比较,*P<0.05;与LPS组比较,#P<0.05;与LPS+丹参酮L组比较,△P<0.05;与LPS+丹参酮M组比较,□P<0.05。下同。
组 别n 抑制率(%) 凋亡率(%)IL-6(pg/mL)IL-10(pg/mL)TNF-α(pg/mL)空白对照组LPS组LPS+丹参酮L组LPS+丹参酮M组LPS+丹参酮H组3 3 3 3 3 0.00±0.00 58.27±3.37*49.98±2.43#38.41±1.54#△21.98±1.21#△□7.72±0.61 23.67±1.81*20.24±1.09#16.46±0.96#△11.25±0.64#△□55.35±5.36 307.13±15.42*254.17±17.67#173.22±8.61#△119.88±13.31#△□101.92±12.13 350.89±18.91*304.42±13.11#237.74±10.84#△180.84±14.10#△□22.49±2.32 166.55±15.30*120.32±12.60#91.33±5.17#△58.90±6.78#△□
2.2 各组肺泡Ⅱ型上皮细胞中DLX6-AS1表达的比较 见表2。与空白对照组比较,LPS组DLX6-AS1的表达量升高(P<0.05);与LPS组相比,LPS+丹参酮H组、LPS+丹参酮L组、LPS+丹参酮M组DLX6-AS1的表达量降低(P<0.05),且呈剂量依赖性。
表2 各组肺泡Ⅱ型上皮细胞中DLX6-AS1表达的比较(±s)

表2 各组肺泡Ⅱ型上皮细胞中DLX6-AS1表达的比较(±s)
组别空白对照组LPS组LPS+丹参酮L组LPS+丹参酮M组LPS+丹参酮H组n33333 DLX6-AS1 1.00±0.00 4.00±0.11*3.35±0.07#2.53±0.07#△1.78±0.11#△□
2.3 各组DLX6-AS1转染后DLX6-AS1转染效率的检测 见表3。与si-NC组比较,si-DLX6-AS1组DLX6-AS1的表达量降低(P<0.05);与pcDNA组比较,pcDNA-DLX6-AS1组DLX6-AS1的表达量升高(P<0.05)。
表3 各组DLX6-AS1表达的检测(±s)

表3 各组DLX6-AS1表达的检测(±s)
注:与si-NC组相比,*P<0.05;与pcDNA组相比,#P<0.05。
组别si-NC组si-DLX6-AS1组pcDNA组pcDNA-DLX6-AS1组n 3333 DLX6-AS1 1.00±0.00 0.37±0.04*1.00±0.00 3.68±0.09#
2.4 各组肺泡Ⅱ型上皮细胞损伤及炎症因子的比较 见图2,表4。与LPS组、LPS+si-NC组比较,LPS+si-DLX6-AS1组细胞增殖抑制率和细胞凋亡率降低(P<0.05),IL-6、IL-10、TNF-α的水平降低(P<0.05)。
表4 沉默DLX6-AS1对肺泡Ⅱ型上皮细胞损伤及炎症因子的影响(±s)
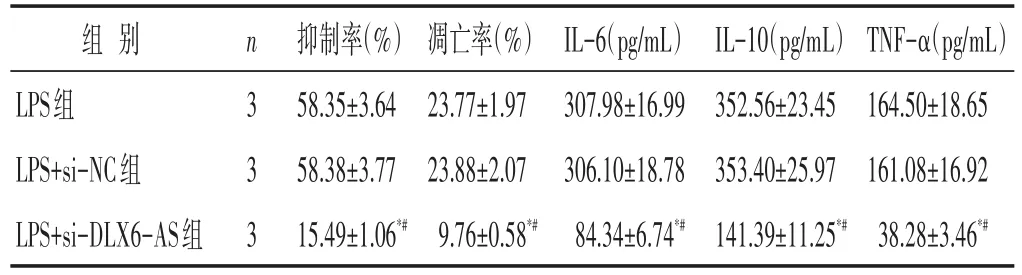
表4 沉默DLX6-AS1对肺泡Ⅱ型上皮细胞损伤及炎症因子的影响(±s)
注:与LPS组比较,*P<0.05;与LPS+si-NC组比较,#P<0.05。
组别LPS组LPS+si-NC组LPS+si-DLX6-AS组n 3 3 3抑制率(%)58.35±3.64 58.38±3.77 15.49±1.06*#凋亡率(%)23.77±1.97 23.88±2.07 9.76±0.58*#IL-6(pg/mL)307.98±16.99 306.10±18.78 84.34±6.74*#IL-10(pg/mL)352.56±23.45 353.40±25.97 141.39±11.25*#TNF-α(pg/mL)164.50±18.65 161.08±16.92 38.28±3.46*#
2.5 过表达DLX6-AS1对丹参酮处理的LPS诱导的肺泡Ⅱ型上皮细胞损伤及炎症因子的影响 见图3,表5。与LPS+丹参酮组比较,LPS+丹参酮+pcDNADLX6-AS1组细胞增殖抑制率和细胞凋亡率升高(P<0.05),IL-6、IL-10、TNF-α的水平升高(P<0.05)。
表5 过表达DLX6-AS1可逆转丹参酮对LPS诱导的肺泡Ⅱ型上皮细胞损伤及炎症因子的影响(±s)

表5 过表达DLX6-AS1可逆转丹参酮对LPS诱导的肺泡Ⅱ型上皮细胞损伤及炎症因子的影响(±s)
注:与LPS组比较,*P<0.05;与LPS+丹参酮组比较,#P<0.05。
组别LPS组LPS+丹参酮L组LPS+丹参酮+pcDNA-DLX6-AS1组TNF-α(pg/mL)161.11±20.19 58.14±7.94*138.41±9.00#n 3 3 3抑制率(%)58.49±3.91 22.10±1.21*51.52±4.44#凋亡率(%)23.75±1.97 11.15±0.87*21.05±1.27#IL-6(pg/mL)312.88±16.33 118.22±12.90*270.67±14.55#IL-10(pg/mL)349.21±33.38 178.67±18.22*311.01±24.80#
3 讨 论
据研究,丹参酮可促进心肌细胞增殖及抑制细胞凋亡从而减轻心肌细胞损伤[9],可抑制炎症反应从而减轻脑微血管内皮细胞炎性损伤[10],也可抑制β淀粉样蛋白诱导的脑微血管内皮细胞氧化应激从而减轻细胞损伤[11]。本研究结果显示,LPS诱导的肺泡Ⅱ型上皮细胞增殖抑制率和细胞凋亡率升高,TNF-α、IL-6、IL-10水平升高,与已有研究结果相似[12],提示成功建立急性肺损伤模型。本研究进一步分析发现,随着丹参酮浓度的升高,LPS诱导的肺泡Ⅱ型上皮细胞增殖抑制率和细胞凋亡率降低,并可降低IL-6、IL-10、TNF-α的水平。
沉默DLX6-AS1可减轻脑缺血/再灌注损伤[13]。DLX6-AS1在肝癌[14]、喉癌[15]中表达上调。本研究结果显示,LPS诱导的肺泡Ⅱ型上皮细胞中DLX6-AS1的表达量升高,丹参酮处理后LPS诱导的肺泡Ⅱ型上皮细胞中DLX6-AS1的表达量降低,提示丹参酮可能通过抑制DLX6-AS1表达而减轻急性肺损伤。同时本研究结果显示DLX6-AS1过表达可减弱丹参酮对LPS诱导的肺泡Ⅱ型上皮细胞凋亡及炎症反应,并降低LPS对肺泡Ⅱ型上皮细胞的增殖抑制作用。
综上所述,丹参酮可通过下调DLX6-AS1表达来抑制LPS诱导的肺泡Ⅱ型上皮细胞凋亡、炎症反应,促进细胞凋亡。DLX6-AS1可能作为丹参酮治疗急性肺损伤的潜在靶点。
