干燥方式对秋葵多糖结构特征和抗氧化性的影响
2022-03-04马璐瑶林海峰聂少平殷军艺
王 喆, 马璐瑶, 林海峰, 聂少平, 殷军艺
(南昌大学 食品科学与技术国家重点实验室 南昌330047)
秋葵【Abelmoschus esculentus (L.) Moench】是药食两用的一年生草本,有多个品种[1]。 最初生长于非洲,现广泛种植于亚热带与热带地区,在我国一些地区(江西、海南、广东等)也有种植。 这种营养成分丰富、 有一定保健作用的蔬菜深受人们的喜爱。
秋葵多糖是一种酸性多糖,主要由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖和半乳糖醛酸等组成[2]。 它具有抗疲劳[3],抗氧化[4],调节血糖、血脂[5-6],改善肠道状况[7],调节免疫[8]等多种功能活性。秋葵多糖在合成材料上有应用前景,可以提高絮凝剂的混凝活性[9],提高乙酰二胺的促生长活性[10],强化其它材料的凝胶性[11],甚至还可用于改变羟基磷灰石的孔隙率, 有望作为骨与软骨的修复材料[12]。 在医药领域,秋葵多糖也有一定价值,它可以合成纳米银离子[13],还可以制成运载药物的包材[14]。
新鲜秋葵水分含量高,容易腐败变质,干燥后可以延长秋葵的储存时间并保留其营养成分[15]。多糖是秋葵中主要的营养成分之一。 对于果蔬的干燥方法已有一些研究, 常用的干燥方法有真空干燥、冷冻干燥、热风干燥、红外干燥和微波干燥等[16-17]。不同干燥方式的干燥效率与能耗都有所不同, 干燥处理后多糖的结构特征和功能性质也会发生变化。 本文以秋葵为原料,去头、尾后采用不同干燥方式前处理,然后提取制备多糖,并用多种分析方法比较多糖的结构, 分析干燥方式对秋葵水溶性多糖结构特征以及抗氧化功能的影响,为秋葵加工提供理论基础。
1 材料与方法
1.1 材料与试剂
新鲜秋葵购于江西省萍乡市福田镇。
葡萄糖(Glucose, Glc)、半乳糖醛酸(Galacturonic acid, GalA)、鼠 李 糖(Rhamnose, Rha)、阿拉伯糖 (Arabinose, Ara)、 半乳糖(Galactose,Gal),美国Merck(Sigma-Aldrich)公司;葡萄糖醛酸 (Glucuronic acid, GlcA)、 葡聚糖标准品(MW2.0×106,5.0×105,7.0×104,4.0×104,1.0×104u)、考马斯亮蓝G-250、牛血清蛋白、没食子酸、福林酚,上海阿拉丁试剂有限公司;乙醇,西陇科学股份有限公司;浓硫酸等其它化学试剂为国产分析纯级,国药集团化学试剂有限公司。
1.2 仪器与设备
Aglient 1260 超高效液相色谱仪,美国安捷伦科技有限公司;Bruker AVANCE Ⅲ HD 400 MHz NMR 光谱仪, 瑞士Bruker 公司;Dionex ICS 5000 离子色谱仪、Nicolet 5700 红外光谱仪、Varioskan Flash 多功能酶标仪,美国Thermo Scientific 公司;JSM-7610F 场发射扫描电镜带能谱仪,日本电子公司;ARES-G2 流变仪,美国TA 公司;TU 1900 紫外分光光度计,北京普析通用仪器有限责任公司;12 L 立式冷冻干燥机, 美国Labconco 公司;DSH-50 A-1 水分测定仪,上海佑科仪器仪表有限公司;Milli-Q 超纯水仪,美国Millipore 公司;AL104 电子天平,上海梅特勒-托利多仪器公司。
1.3 秋葵干燥与秋葵多糖提取
1.3.1 秋葵预处理 取形态大小相似秋葵等分3份,将其洗净切成2.5 cm 小段,一份在50 ℃干燥48 h 后粉碎得到热风干燥的秋葵原料, 一份在自然状态下干燥72 h 后粉碎得到自然干燥的秋葵原料, 一份在-80 ℃干燥68 h 后粉碎得到冷冻干燥的秋葵原料。
1.3.2 秋葵多糖提取 称取一定量的秋葵干粉,按料液比1 ∶10 加入95%乙醇浸泡24 h 脱色,过滤收集样品,挥干乙醇后,按料液比1 ∶60 加入蒸馏水,于60 ℃下水浴条件下提取4 h,离心收集残渣,沉淀物重复提取一次,合并上清液,经过旋转蒸发仪浓缩后缓慢加入95%乙醇醇沉(终体积分数约为80%),静置过夜。离心收集沉淀,加入蒸馏水复溶浓缩后再次醇沉离心收集沉淀,复溶于水,浓缩冻干得到秋葵多糖。将从热风干燥、自然干燥和真空冷冻干燥后的秋葵中提取得到的多糖,分别记为OPH-60,OPN-60 和OPF-60。
1.4 基本理化性质测定
1) 总糖测定 以葡萄糖为标准品, 采用苯酚-硫酸法测定总糖含量[18]。
2) 蛋白质含量测定 以牛血清白蛋白为标准品,采用考马斯亮蓝法测定蛋白质含量[19]。
3) 糖醛酸含量测定 以半乳糖醛酸为标准品,采用硫酸-咔唑法测定糖醛酸含量[20]。
4) 总酚含量测定 以没食子酸为标准品,采用福林酚法测定总酚含量[21]。
1.5 单糖组成
称取5.0 mg 样品加入试管中, 在冰浴条件下加入12 mol/L 硫酸0.5 mL 水解,加入2.5 mL 超纯水混匀,于120 ℃油浴锅中水解2 h,然后将水解液加水定容、 稀释, 过孔径为0.22 μm 的水系滤膜,进样检测[22-23]。
色谱条件: 高效阴离子交换色谱配备CarboPacTMPA20 保护柱 (3 mm × 30 mm) 和CarboPacTMPA20 分析柱(3 mm×150 mm)串联;流动相:A 为250 mmol/L 氢氧化钠,B 为超纯水,C 为1 mol/L 醋酸钠,D 为超纯水;流速为0.5 mL/min,进样量为10 μL。
1.6 相对分子质量测定
使用流动相溶解样品配制成1 mg/mL 溶液,采用孔径为0.22 μm 的水系滤膜后进样检测。
色谱条件:安捷伦1260 型超高效液相色谱仪系统, 带有UltrahydrogelTM分析柱 (7.8 mm×300 mm); 流动相为0.1 mol/L NaNO3和0.02% NaN3的混合溶液;流速为0.6 mL/min;柱温为35.0 ℃。
1.7 红外光谱测定
取适量样品采用压片法, 用傅里叶红外光谱于波长4 000~500 cm-1区域内进行扫描, 扫描分辨率为4 cm-1。
1.8 核磁共振光谱测定
取多糖样品使其完全溶于D2O 中, 充分交换12 h 以上然后冻干, 重复3 次, 最后用99.9%的D2O 溶解取适量溶液加入核磁管中,静置过夜,采用400 MHz 核磁共振仪用5 mm 探头在50 ℃扫描64 次进行核磁共振分析。
1.9 扫描电镜测定
配置1 mg/mL 的多糖溶液,置于液氮中冷却10 min 后冻干, 取样品进行喷金处理, 用JSM-6701F 型场发射扫描电镜带能谱仪观察样品表观形态。
1.10 表观黏度测定
配置质量分数为1%的多糖溶液,完全溶解后于室温静置12 h 后用ARES-G2 流变仪测定,同时采用TA-Orchestrator-7 软件采集数据。
测试条件:温度25 ℃,40 mm 不锈钢平板,上下板间距0.4 mm,剪切速率0.01~1 000 s-1。
1.11 体外抗氧化活性测定
参照文献并略作修改进行试验。 分别测定3种多糖对DPPH 自由基清除能力[24]、羟自由基清除能力[25]以及对金属离子螯合能力[24],DPPH 自由基和羟自由基清除能力试验中以VC 作为阳性对照,金属离子螯合能力试验以EDTA 为阳性对照。根据以下公式得出多糖及阳性对照的清除率和螯合率。

式中,A0——蒸馏水的吸光度;A1——多糖溶液本身的吸光度;A2——加入多糖后的吸光度。
1.12 数据分析
文中表格数据采用SPSS 的单因素方差分析进行评价, 图是根据数据由Origin 2017 处理绘图。
2 结果与分析
2.1 秋葵多糖基本理化性质及单糖组成
秋葵经不同干燥方式处理后提取所得水溶性多糖, 其基本理化性质和单糖组成结果如表1 所示。 3 种多糖的总糖、糖醛酸、蛋白质、总酚含量分别处于67.0%~69.6%、34.3%~38.4%、2.6%~4.5%和0.6%~1.0%。 其中,冷冻干燥后的样品OPF-60中总糖和糖醛酸含量最高, 达到69.6%和38.4%,这可能是由于冷冻干燥过程中植物机制内会形成冰晶,导致了植物细胞结构更大程度的破裂,促进了样品中活性成分的提取[28],而在热风干燥和自然干燥过程中, 糖醛酸等会因为较高的环境温度而变性[29]。

表1 3 种干燥方式秋葵多糖的理化性质(n=3)Table 1 Physical and chemical properties of okra polysaccharides in three drying methods(n=3)
通过离子色谱仪测定3 种干燥方式多糖单糖组成,发现均主要由Rha(13.9%~14.9%)、Gal(21.4%~23.4%)和GalA(10.3%~14.7%)组成,而在含量上有所不同,具有结构差异。常用6 种单糖组成比来评价果胶多糖的结构特征[26-27],其中R1是果胶主链糖GalA 与侧链中所含中性糖的比例,常用作估算果胶线性度。3 种多糖R1值一致,表明线性程度接近;R2表示鼠李半乳糖醛酸(RG)对果胶的贡献,多糖的R2值依次为OPN-60>OPH-60>OPF-60, 表明冷冻干燥降低了果胶的支链程度;R3值反映了RG 的半乳糖侧链长度,OPN-60 在3种干燥方式中显示出最高的RG 分支。 在这3 种多糖中,I 型鼠李糖半乳糖醛酸聚糖(RG-I)的范围为97.7 至100.0。
2.2 分子质量分布
采用HPGPC 法测定干燥方式对多糖的分子质量分布的影响(图1),根据标准品洗脱的时间和分子质量建立标准曲线计算3 种多糖的分子质量,3 种多糖在7~16 min 范围内主要有5 个信号峰,信号峰的分布范围较宽且互相重叠,其中10 min 左右的峰分子质量最大(>2×106u),3 种干燥方式多糖分子质量分布基本相似, 然而在低分子质量区域还是存在一定的不同。

图1 3 种干燥方式秋葵多糖的HPGPC 图Fig.1 HPGPC diagram of okra polysaccharides in three drying methods
表2 列出了秋葵多糖每个信号峰对应的具体分子质量数值,3 种多糖的分子质量分布在1.76×104~2.04×107u, 出峰时间最早的组分P 1 的相对分子质量最大的为OPN-60 和OPF-60,最小的为OPH-60。

表2 3 种干燥方式秋葵多糖的分子质量分布(u)Table 2 Molecular weight distribution of okra polysaccharides in three drying methods (u)
2.3 干燥方式对秋葵多糖红外光谱的影响
由图2 可知,3 400 cm-1处的强吸收峰为多糖类物质的特征吸收峰,是O-H 的伸缩振动[30]。 在2 970 cm-1和2 925 cm-1处的吸收峰可能为CH2、CH3或GalA 单元的C-H 伸缩振动[31]。 而在1 600 cm-1处的吸收峰为COO-的伸缩振动[32]。 1 400 cm-1和1 260 cm-1附近的弱吸收峰为GalA 和GlcA 中羧酸的C-O 伸缩振动[33]。 此外,1 048 cm-1附近为果胶的特征吸收峰[34];在880 cm-1左右的吸收峰表明多糖可能存在β 构型, 而840 cm-1也出现了代表α 构型的弱吸收峰。 由以上结果可知,3 种多糖主要官能团相似, 且都具有果胶多糖的特征吸收峰。

图2 3 种干燥方式对秋葵多糖红外光谱特征的影响Fig.2 Effects of three drying methods on infrared spectra characteristics of okra polysaccharides
2.4 干燥方式对秋葵多糖1H NMR 的影响
图3 为不同干燥方式秋葵多糖于50 ℃条件下的1H NMR 谱图。 与文献报道相比本试验的NMR 谱图向低场方向略有偏移。 3 种多糖的谱图虽然相似,但也有一定的差异。 很明显,3 种多糖中都含有非支链的α-1,2-连接的鼠李糖(δ 1.41)和支链α-1,2,4-连接的鼠李糖(δ 1.49),在δ 2.07~2.27 范围的共振信号为-CH3的质子峰, 证明了O-乙酰基的存在[35]。在δ 4.45~4.65 范围内出现的异头信号表明存在末端半乳糖或1,4-连接的半乳糖[36]。在δ 3.98 处有一处较大的信号峰,可能是由于甲基与半乳糖醛酸上羧基的结合所致[37]。

图3 3 种干燥方式对秋葵多糖1H NMR 谱图的影响Fig.3 Effects of three drying methods on 1H NMR diagram of okra polysaccharides
2.5 干燥方式对秋葵多糖表面形貌的影响
由图4 可知,3 种多糖的微观结构相似,其主体均由线性结构和片状结构组成。 其中,OPH-60为线性结构,OPN-60 为线性结构和片状结构交联,OPF-60 主要为线性和片状结构, 除此之外还分布着多孔结构, 这是由于原料在冷冻干燥过程中, 水分直接由固态升华到气态而未受到外力的破坏所致[28]。

图4 3 种干燥方式对秋葵多糖微观结构的影响(5 000×)Fig.4 Effects of three drying methods on the microstructure of okra polysaccharies (5 000×)
2.6 干燥方式对秋葵多糖流变特性的影响
由图5 可知,剪切速率在0.1~1 000 s-1范围,3 种秋葵多糖的表观黏度随着剪切速率的增大而减小,表现出明显的剪切稀化现象,多糖黏度减小原因是随着剪切速率的加快, 分子间的相互作用力被破坏,使得多糖流动性增大[38]。 在0.1~1 000 s-1范围的剪切速率下,OPH-60 表观黏度最大,OPF-60 表观黏度其次,OPN-60 的表观黏度最小, 这可能与样品总蛋白质与单糖组成的类型和含量有关[39],例如有文献报道称,蛋白质含量降低,黏度增大[40]。 此外3 个组分间的黏度差异可能和分子质量也有关系,即通过测定过膜前、后多糖的糖含量,发现其含量差异较大,滤膜对于多糖的截留率从大到小依次为OPF-60(50.93%)>OPN-60(45.86%)>OPH-60(40.58%),这可能是由于较小孔径的水系滤膜将多糖中较大的分子质量的组分截留在膜外, 因此导致较大分子质量组分未通过仪器检测,使得测得的分子质量相似。

图5 3 种干燥方式对秋葵多糖表观黏度的影响Fig.5 Effects of three drying methods on apparent viscosity of okra polysaccharides
采用Power-law 模型计算3 种干燥方式秋葵多糖剪切稀化的流变参数, 模型拟合R2>0.99,表3 中可以发现它们的流动特性指数均小于1,表明3 种多糖均属于假塑性流体。 它们的K 值大小依次是OPH-60>OPF-60>OPN-60,与表观黏度的变化趋势一致,OPN-60 的n 值最大, 其假塑性相对最低。
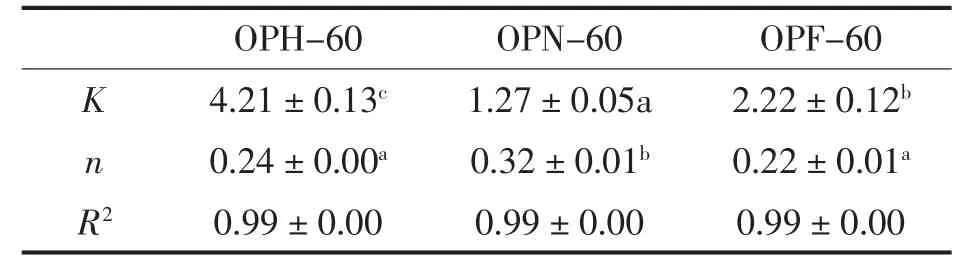
表3 3 种干燥方式秋葵多糖的剪切稀化流变参数(n=3)Table 3 Rheological parameters of shear thinning of okra polysaccharide in three drying modes (n=3)
2.7 干燥方式对秋葵多糖体外抗氧化活性的影响
图6 显示3 种秋葵多糖对DPPH 自由基、羟自由基清除能力和金属离子螯合能力。 从图中可以看出, 随着多糖质量浓度的增加,3 种多糖对DPPH 自由基、 羟自由基清除能力和金属离子螯合能力也都增强。 在相同的多糖质量浓度, 对于DPPH 自由基的清除能力依次为OPN-60>OPH-60>OPF-60; 对于羟自由基,OPN-60 的清除能力最强,OPH-60 和OPF-60 的清除能力相似;3 种多糖对金属离子的螯合能力依次为OPN-60>OPH-60>OPF-60。总体数据来看,3 种秋葵多糖都具有体外抗氧化活性,OPN-60 的体外抗氧化活性最强,这可能是与多糖中的总酚含量有一定关系,有研究表明多糖中其抗氧化作用的主要物质是多酚[41]。
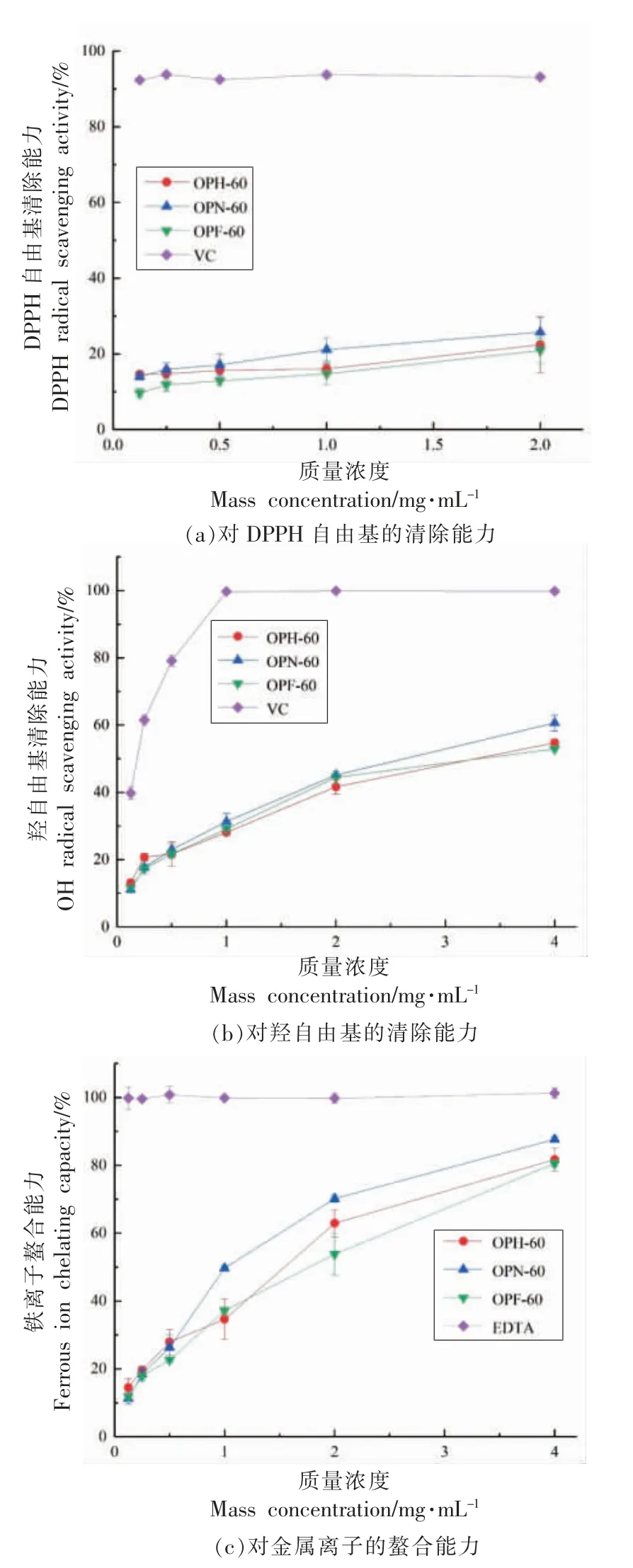
图6 3 种干燥方式秋葵多糖的抗氧化能力Fig.6 Antioxidant capacity of okra polysaccharide in three drying methods
3 结论
3 种干燥方式处理秋葵, 得到的秋葵多糖都是RG-I 型果胶多糖, 它们的得率和化学组成都有所不同,秋葵多糖的蛋白质含量、糖醛酸含量、总酚含量出现了显著变化。通过单糖组成、红外光谱和表面形貌分析, 发现干燥方式主要对多糖相关成分的含量(如单糖组成比例、官能团响应值之间的比例) 产生影响, 而对它们的种类影响不明显。 3 种干燥方式秋葵多糖都表现出弱凝胶行为,都属于假塑性流体, 热风干燥处理的秋葵所提取的多糖黏度相对较大, 在体外抗氧化活性中可以发现OPN-60 的抗氧化活性最好, 真空冷冻干燥得到的多糖中总糖、糖醛酸含量最高。 3 种方法在对样品的处理后得到的多糖都有其各自结构和功能特性。
