2017—2020年浙江省猪主要病毒性传染病的流行病学调查与分析
2022-03-04徐丽华李军星邓利荣毛慧敏吴一戈杨富文袁秀芳浙江省农业科学院畜牧兽医研究所浙江杭州300江山康农农业发展有限公司浙江江山3400
徐丽华,苏 菲,余 斌,李军星,邓利荣,毛慧敏,吴一戈,杨富文,袁秀芳* (.浙江省农业科学院 畜牧兽医研究所,浙江 杭州 300;.江山康农农业发展有限公司,浙江 江山 3400 )
养猪业是浙江省畜牧业发展的重中之重,近年来随着我国经济的快速发展,浙江省养猪行业的规模化、集约化和标准化程度也得到了进一步提升,但是制约养猪业发展的猪疫病,尤其危害严重的猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV2)和猪伪狂犬病病毒(PRV)这4种猪病毒性传染病的防控难度不断加大,给养猪业带来很大的经济损失[1-3]。目前这4种疫病的临床症状呈非典型性且多样化,病毒间的混合感染、细菌的继发感染、公猪精液带毒、母猪隐性感染和垂直传播、疫苗免疫后的免疫抑制干扰和母源抗体被中和等问题,造成猪场免疫猪群抗体水平参差不齐或免疫失败,出现传染性疫病多发的情况[3-5]。
为较全面客观地了解浙江省不同地区猪场的主要疫病的病原流行情况和疫苗免疫现状,本实验室于2017—2020年采集浙江省不同地区猪场的猪血清样品和临床疑似病料样品,分别进行PRRSV、CSFV、PCV2和PRV的血清学抗体监测和病原学检测,分析当前规模化猪场主要疫病种类、流行状况和猪群免疫状况的变化动态,为养猪企业制定合理的疫苗免疫程序和有针对性地疫病防控措施提供理论依据。
1 材料与方法
1.1 样品来源本实验室通过实地走访、现场检剖和收集送检样品等方式,2017—2020年采集浙江省不同地区(杭州、湖州、嘉兴、绍兴、金华、衢州、宁波和台州丽水)猪血清样品和临床疑似病料样品(肺脏、脾脏、肝脏、淋巴结和肾脏),分别用于抗体和病原检测。
1.2 主要试剂病毒核酸提取试剂盒购自济凡生物科技(常州)有限公司;一步法RT-PCR试剂盒购自宝生物(大连)有限公司;高成功率PCR 酶KOD FX购自日本TOYOBO公司;dNTPS等均购自上海生工生物工程技术服务有限公司;无水乙醇等化学试剂均为国产分析纯;PRRSV ELISA抗体检测试剂盒购自美国IDEXX公司,产品批号40959-L481、40959-M191等;CSFV ELISA抗体检测试剂盒购自美国IDEXX公司,产品批号43220-K411、43220-M051等;PRV gI抗体ELISA检测试剂盒购自美国IDEXX公司,产品批号09836-AP757、09836-FP435等;PRV gB抗体ELISA检测试剂盒购自美国IDEXX公司,产品批号09836-KN364、09836-CP068等;PCV2抗体ELISA检测试剂盒购自韩国金诺公司,产品批号PCVB18068等。
1.3 猪血清中PRRSV、CSFV、PCV2和PRV抗体检测从猪的前腔静脉采集血液2~3 mL,室温静置2 h,离心分离出血清,4℃冷藏备用(超过7 d,-20℃ 冻存)。利用商品化的ELISA抗体检测试剂盒对猪血清中相应的病毒进行抗体检测,具体操作严格按照试剂盒说明书进行。
1.4 临床疑似样品中PRRSV、CSFV、PCV2和PRV病原检测
1.4.1引物设计 PRRSV、CSFV、PCV2和PRV病原检测的引物序列参考文献[6]方法,委托上海生工生物工程有限公司合成。
1.4.2 核酸(DNA/RNA)提取取临床疑似病料0.1 g,置于Eppendorf管中,加入PBS缓冲液(pH7.4)0.5 mL,用全自动研磨仪(90 Hz,60 s)研磨成匀浆,-70℃冻融3次,高速离心,取上清0.15 mL,用病毒核酸提取试剂盒提取核酸,操作过程严格按照说明书进行,-70℃保存备用。
1.4.3PCR扩增及电泳 按照一步法RT-PCR检测试剂盒说明书操作扩增 PRRSV和CSFV病原。25 μL体系,混匀分装后置PCR 扩增仪中,扩增条件:50℃ 30 min;95℃ 2 min,94℃ 30 s,58℃ 30 s,72℃ 60 s,35个循环;最后72℃延伸10 min。
PCV2和PRV病原PCR扩增:25 μL反应体系分别:2×PCR Buffer 12.5 μL,2 mmol/L dNTPs 5.0 μL,引物各1.5 μL(浓度为5 μmol/L),KOD FX(1.0 U/μL)0.5 μL,模板DNA为2.0 μL,ddH2O 2 μL。混匀分装后置PCR 扩增仪中,扩增条件:94℃ 2 min;98℃ 10 s,68℃ 1 min,35个循环;最后68℃延伸7 min。
反应完成后,分别取PCR产物5 μL,经1.2%琼脂糖凝胶电泳检测,用凝胶成像系统观察拍照。
2 结果
2.1 样品采集情况2017—2020年共采集浙江省不同地区猪血清样品34 000余份,临床疑似病料样品2 000余份。各疾病的样本采集及检测情况参见表1,2。

表1 2017—2020年浙江地区用于检测4种疫病的猪血清样本数统计 份

表2 2017—2020年浙江地区用于检测4种疫病的临床疑似样本数统计 份
2.2 血清学检测结果对浙江省不同地区猪场进行PRRSV、CSFV、PRV-gE/gI、PRV-gB、PCV2的血清学抗体水平的检测。近4年来,PRRSV、CSFV、PCV2、PRV-gE/gI、PRV-gB的抗体平均阳性率分别为81.4%(26 578/32 654),83.6%(26 322/31 471),91.4%(8 382/9 172),36.1%(12 308/34 090),94.3%(17 336/18 392)。
2.2.12017—2020年4种疫病抗体检测结果 2017—2019年PRRSV抗体阳性率为82.0%~85.0%,而2020年抗体阳性率为70.8%,下降明显。CSFV抗体阳性率从2017年的83.3%上升到2020年的86.3%,呈现稳中有升的状态。PCV2抗体阳性率2017和2018年均在89.5%左右,2019年和2020年上升到95.0%左右,抗体水平稳定上升。PRV-gB抗体阳性率在4年来一直维持在92.0%~95.0%之间。PRV-gE/gI抗体阳性率在2017和2018年均为40.0%,然后逐年下降,到2020年为20.3%(图1)。
2.2.2浙江省不同地区抗体检测结果 将浙江省分为杭州地区、金华地区、湖州地区、嘉兴地区、宁波地区、绍兴地区、衢州地区和温州丽水台州地区,进行血清抗体阳性率比较。2017—2019年不同地区PRRSV抗体阳性率相对稳定,保持在75.0%~85.0%之间,2020年抗体水平差异大,其中衢州地区抗体阳性率下降明显(51.9%)。CSFV抗体阳性率不同地区差异较小,均在77.0%~90.0%之间。嘉兴地区PCV2抗体阳性率从2017年的65.0%上升到2020年的95.0%,其他地区一直稳定在90.0%~95.0%之间。不同地区PRV-gB抗体阳性率一直维持在较高水平,而PRV-gE/gI抗体阳性率随时间推移均有不同程度的下降,其中杭州、宁波、湖州、衢州地区下降明显,在10%以下(图2)。
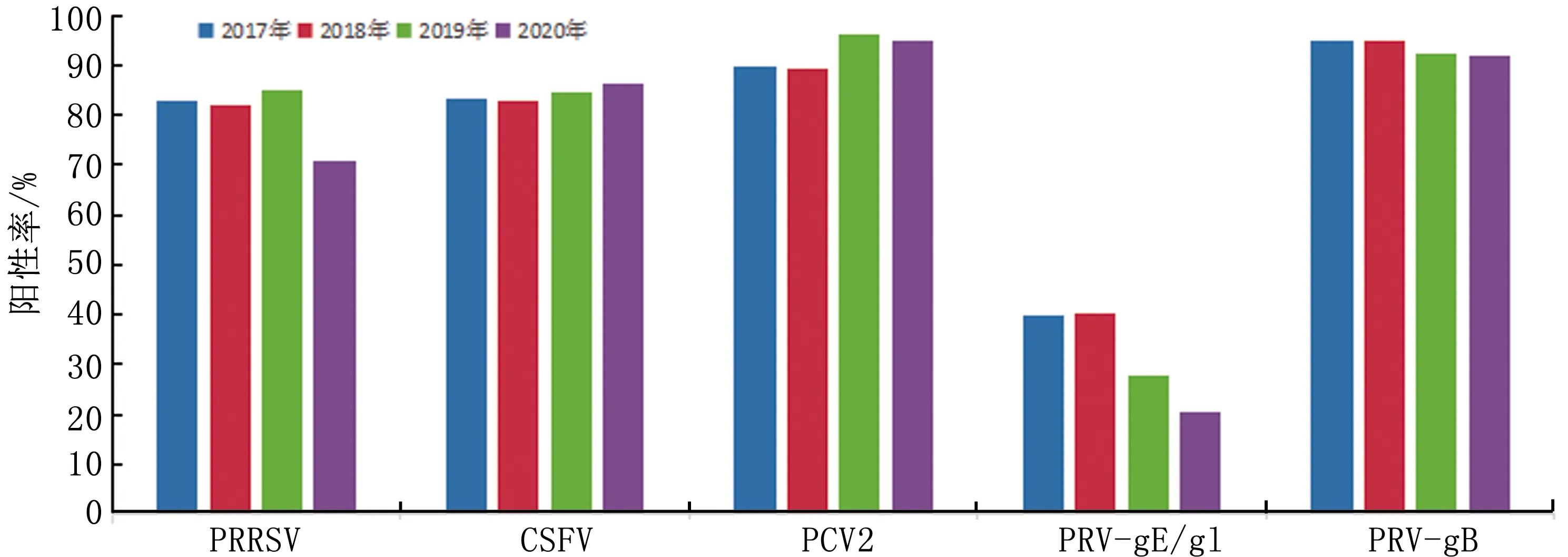
图1 2017—2020年PRRSV、CSFV、PRV-gE/gI、PRV-gB、PCV2抗体检测结果
2.2.3不同日龄猪群抗体检测结果 将猪群分为公猪、后备母猪、经产母猪、产房仔猪、保育猪和肥育猪,进行4种疫病抗体阳性率的比较。PRRSV抗体阳性率在产房仔猪和保育猪阶段呈下降趋势(60%~70%),肥育猪抗体水平上升。种猪群CSFV抗体阳性率较高,均在90%以上,产房仔猪抗体阳性率开始下降,保育猪最低,在60%~65%之间,肥育猪开始回升到70%以上。2017—2018年肥育猪的PCV2抗体阳性率在70%左右,2019—2020年上升到90%,但整体上肥育猪抗体水平略低于其他猪群。不同年龄段猪群PRV-gB抗体阳性率均维持在较高水平。与其他猪群相比,经产母猪和产房仔猪PRV-gE/gI抗体阳性率较高,另外公猪和肥育猪的抗体阳性率较低(图3)。

图2 2017—2020年浙江不同地区抗体检测结果

图3 2017—2020年不同日龄猪群抗体监测结果
2.3 病原检测结果对浙江省猪场临床疑似病料进行PRRSV、CSFV、PCV2、PRV的病原检测。近4年来,PRRSV病原平均阳性率22.9%(450/1963),CSFV病原平均阳性率2.5%(33/1334),PCV2病原平均阳性率17.3%(247/1431),PRV病原平均阳性率6.6%(108/1646)。
2.3.1PRRSV、CSFV、PCV2、PRV单一感染和混合感染情况 2017—2020年病毒单一感染和混合感染整体呈下降趋势,特别2020年阳性率明显下降。PRRSV单一感染在2019年最高,阳性率为35.5%,2020年最低,阳性率13.3%。CSFV的阳性率一直维持在较低水平,阳性率在5.5%~1.1%之间。PCV2和PRV的阳性率逐年降低。混合感染中PRRSV/PCV2双重感染最高,阳性率为9.7%,其次是PRRSV/CSFV的双重感染,此外,PRRSV/PRV和PCV2/PRV双重感染、PRRSV/PCV2/PRV 三重感染和PRRSV/CSFV/PCV2/PRV四重感染均在2017与2018年有较低阳性率,2019与2020年均没有检测到(表3)。
2.3.2不同日龄猪病原检测结果 对种猪、流产胎儿、产房仔猪、保育猪和肥育猪进行PRRSV、CSFV、PCV2、PRV病原检测。结果显示:PRRSV、PCV2和CSFV病原保育猪的阳性率最高,2019年保育猪的PRRSV阳性率高达65.3%,平均阳性率为43.0%,2018年保育猪PCV2阳性率为38.8%,育肥猪次之,流产胎儿中阳性率最低。PRV病原在产房仔猪中阳性率最高,2017年产房仔猪PRV阳性率为22.2%,流产胎儿次之,保育猪PRV阳性率最低(图4)。
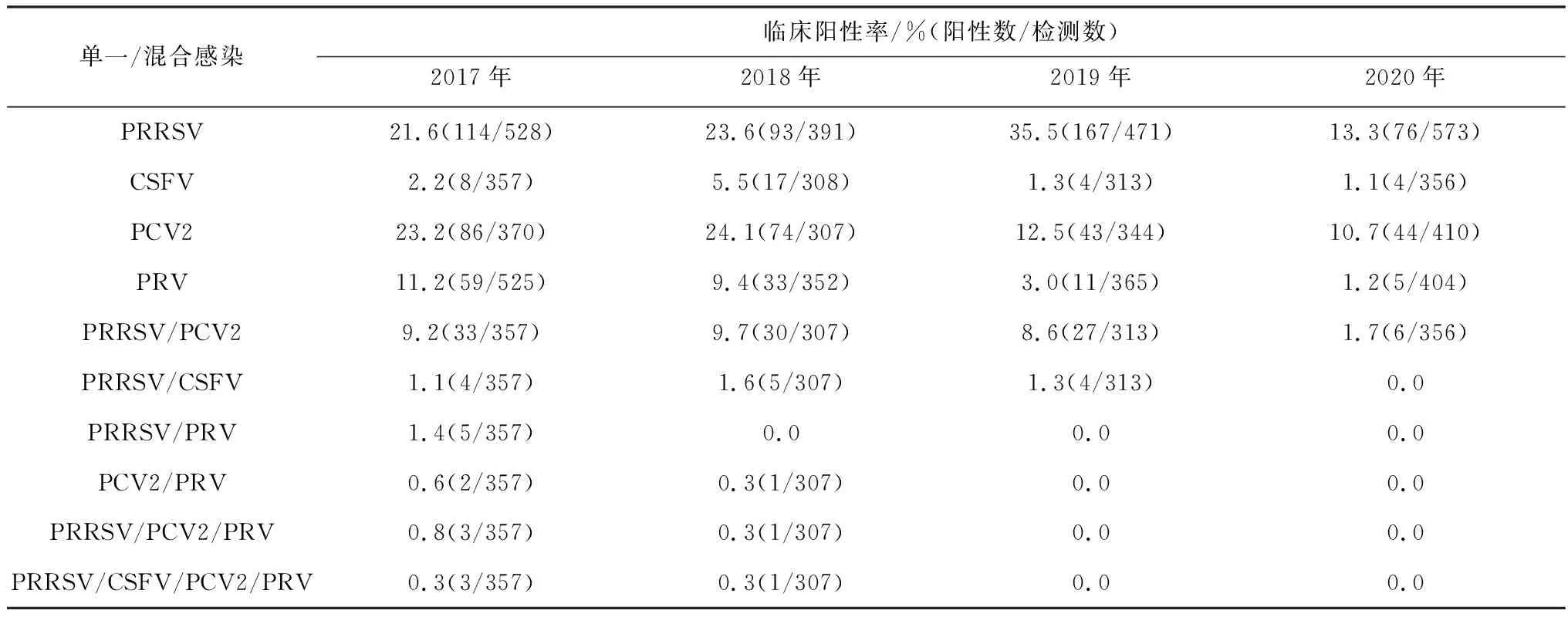
表3 2017—2020年PRRSV、CSFV、PCV2、PRV单一感染和混合感染情况

图4 2017—2020年不同日龄猪群病原检测结果
3 讨论
2017年开始,我国正式取消了PRRSV和CSFV的强制免疫计划,实施“先打后补”政策试点,表明我国PRRSV和CSFV的防控工作取得了阶段性胜利,也促使养殖企业更加注重免疫的合理性和科学性,提升猪场生物安全意识,建立综合性的疫病防控体系,降低疫病发生风险。
本研究对2017—2020年浙江地区不同猪场猪血清抗体进行检测,显示4年来PRRSV、CSFV、PCV2、PRV-gE/gI、PRV-gB的抗体平均阳性率分别为81.4%,83.6%,91.4%,36.1%,94.3%,其中PRRSV和CSFV均达到了国家免疫方案中群体免疫抗体合格率≥70%的要求。与张树金等[7]2015—2017年在山东地区CSFV、PRRSV和PRV的流行病学调查中结果相似。而本研究中病原检测PRRSV、CSFV、PCV2和PRV的阳性率分别为22.9%,2.5%,17.3%,6.6%。与贺会利等[8]对2015—2017年广西地区规模化猪场的病原检测结果较为一致。而汪志等[9]对2011—2015年华南地区规模化猪场的病原检测显示,CSFV病原阳性率为42%以上,PCV2病原阳性率达到50%以上。本次检测阳性率相比较低,原因可能是近几年养殖场规模化程度渐高,猪群疫苗免疫规范合理,猪场生物安全意识提高,整体发病率下降。
PRRS是规模化猪场最重要的烈性传染病之一。1987年美国首次分离到PRRSV以来,该病毒持续变异重组,流行毒株由高致病性毒株(HP-PRRSV)逐步演变为目前的类NADC30毒株,且类NADC34、PRRSV 1-4-4等毒株不断出现,导致母猪高流产率,仔猪高死亡率,均对养猪业带来巨大影响[10-12]。2017—2020年浙江省PRRSV的病原检测阳性率分别为21.6%,23.6%,35.5%,13.3%,波动比较大,其中2019年检测阳性率较高。同时,PRRSV抗体水平在2019年最高,为85%左右,2020年下降到最低(70.8%),其抗体水平维持较高水平,说明浙江省PRRSV疫苗免疫或者野毒感染十分普遍。PRRSV抗体水平的变化趋势和其病原检测阳性率的变化趋势相一致,这可能与2018年非洲猪瘟暴发,大部分猪场改变或取消PRRSV免疫计划有关。
CSFV在我国被列为5种优先防制的“一类动物疫病”之一,具有高度传染性。目前我国主要采取疫苗免疫接种措施预防猪瘟,常用的疫苗为猪瘟兔化弱毒疫苗株(C株或HCLV株),安全性和免疫原性较好,可以同时诱导体液免疫和细胞免疫反应,能够保护不同年龄猪抵抗猪瘟强毒的攻击[13]。2017—2020年浙江省猪瘟抗体水平逐年稳定上升,而病原检测阳性率一直维持在5%以下,呈零星散发状态,据回顾性调查暴发CSFV的猪场都存在免疫不到位或疫苗保存不当而导致免疫失败的问题。同时也说明CSFV的高水平抗体能有效阻止猪瘟野毒感染。
PCV2感染主要引起猪消瘦、生长缓慢、僵猪、饲料产出比下降、养殖成本增加、同时造成免疫抑制,导致PRRSV、PRV混合感染,副猪嗜血杆菌等继发感染的机会[14]。2017—2018年PCV2抗体阳性率为89%,病原检测阳性率在24%左右,而2019—2020年抗体阳性率提高到95%,病原检测阳性率下降到10%左右。其原因可能是目前浙江省规模化猪场普遍使用PCV2灭活疫苗,而PCV2抗体检测试剂盒(爱德士公司)检测的抗体无法区分是野毒感染后产生的抗体还是疫苗免疫抗体,导致本试验中PCV2抗体有可能有一部分是野毒感染抗体。
2011年,PRV变异株的出现及流行,浙江省很多规模化猪场暴发猪伪狂犬病(PR)造成母猪流产、死胎,而现有疫苗不能提供完全保护,只能通过增加免疫次数和免疫剂量,以阻止PRV的侵袭[15]。PRV-gE/gI检测野毒抗体,PRV-gB检测疫苗免疫抗体或野毒感染抗体,2017—2020年PRV-gB抗体阳性率一直维持在92.0%以上,PRV-gE/gI抗体阳性率从40.0%逐年下降到2020年的20.3%,不同地区PRV-gE/gI抗体阳性率相差较大,同时浙江省PRV病原平均阳性率6.6%,说明目前部分种猪场已达到了PR的净化,但也有很多猪场尚存在野毒感染,带毒生产,特别是商品猪场PRV-gE/gI抗体阳性率较高。因此,建立合理的PRV免疫程序和生物安全措施,加强疫苗免疫,淘汰野毒抗体阳性母猪,并最终实现PR净化。
对后备猪、经产母猪、产房仔猪、保育猪和肥育猪4种病毒的抗体检测结果显示保育猪抗体水平最低,而病原检测结果显示保育猪抗原阳性率最高。可能与保育猪阶段母源抗体消失,而疫苗免疫抗体尚没有上升,导致高发病率有关。将浙江省分为8个地区,区域间4种病毒的抗体水平变化较一致,说明抗体水平变化和区域关系不大。2017—2020年均检测到混合感染,其中PRRSV/PCV2双重感染最多,其次是PRRSV/CSFV、PRRSV/PRV、PCV2/PRV双重感染,同时检测到不同程度的PRRSV/PCV2/PRV三重感染、PRRSV/CSFV/PCV2/PRV四重感染,混合感染严重,情况复杂。这与鲍印等[16]在豫西南地区的检测结果相一致。建议临床工作者判断主要病原感染同时,还应考虑混合感染或继发感染,加强混合感染的综合措施,为我省规模化猪场猪病毒病的防控提供了一定方向。
本研究通过对2017—2020年浙江省不同地区猪场主要病毒性疫病的流行病学调查分析,可知浙江省PRRSV、CSFV、PCV2和PRV感染仍具有普遍性,但从2019年开始,病毒检测阳性率明显下降,这可能与非洲猪瘟发生后猪场人员交叉减少,生物安全意识提高,疫病防控力度加大有关,同时也说明猪场在完善疫苗免疫,加强疫病抗体病原检测以及持续做好生物安全措施的重要性。
