高频电刀手术电极表面润湿性对胰管闭合效果的影响
2022-03-03蒋烁杨丹刘文韬郑靖张浩李可洲
蒋烁,杨丹,刘文韬,郑靖,张浩,李可洲
表面功能化
高频电刀手术电极表面润湿性对胰管闭合效果的影响
蒋烁1,杨丹1,刘文韬1,郑靖1,张浩2,李可洲2
(1.西南交通大学 机械工程学院,成都 610031;2.四川大学 华西医院,成都 610041)
研究手术电极表面润湿性对胰管闭合效果的影响,旨在从电极表面改性角度探索提升高频电刀防胰瘘效果的措施。选用电外科临床常用的304不锈钢手术电极制备电极样品,利用化学刻蚀法在电极表面构建微结构,以改变电极表面润湿性,进而选用新鲜离体猪胰腺作为生物组织样品,使用高频电刀进行胰管闭合试验。对不同表面润湿性的电极样品进行胰管闭合试验后,观察表征电极表面的组织粘附、胰腺断面焦痂形貌、主胰管爆破压和胰腺残端组织损伤。原始304不锈钢手术电极表面接触角为86.1°,经FeCl3溶液一步刻蚀处理后,表面形成微米级凹坑结构,接触角降至65.3°,再经HCl溶液两步刻蚀处理后,微米凹坑上形成纳米孔洞,接触角增大至111.5°。在相同的电外科手术模拟试验工况下,随着手术电极表面接触角的增大,电极表面组织粘附减轻,胰腺断面焦痂组织的孔洞尺寸变小,主胰管的闭合厚度增大、爆破压提高,胰腺残端组织损伤减轻。在电外科手术过程中,高频电刀手术电极表面润湿性会影响胰管闭合效果。表面疏水化可以有效抵抗电极作用于胰腺组织时的表面组织粘附,抑制电极-胰腺组织界面的电弧放电,从而促进胰管的有效闭合,减轻胰腺残端组织损伤,降低术后胰瘘风险。
高频电刀;手术电极;表面润湿性;组织粘附;胰管闭合
目前,胰腺外科手术的术后并发症高达40%~ 50%[1-3],其中,胰瘘是最常见的术后并发症。胰瘘会造成大量胰液渗出,如果胰酶被激活,可腐蚀破坏手术创面和胰腺周围血管,导致腹腔脓肿或严重出血[4-5]。传统防胰瘘技术主要依赖医生的临床经验和手术方法改进。随着载能手术器械的问世和快速发展,Ligasure结扎速系统和谐波超声刀等载能手术器械,开始应用于胰腺外科手术临床。然而,这些器械成本昂贵、切割效率低,难以推广[6]。相比其他载能手术器械,高频电刀具备出色的止血效果和切割效率,形状多样的电极可以满足不同的临床需求,低成本、易操作的优点也使其容易在各中小型医院推广[7-8]。在胰腺电外科手术中,高频电刀利用高频交流电流经胰腺组织,使得胰腺组织细胞内的带电粒子剧烈震荡、相互摩擦,产生大量焦耳热,诱导细胞破裂汽化、蛋白质变性凝固,在胰腺断面形成焦痂组织,无需缝合就可以闭合血管和胰管,实现止血防胰瘘的手术效果[9-12]。但是,研究发现,相比其他载能手术器械,高频电刀手术电极作用胰腺时,电极-组织界面的电弧放电导致胰腺断面组织烧蚀损伤严重,防胰瘘效果并不理想[13-15],这个问题严重制约了高频电刀在胰腺外科领域的临床应用。
高频电刀的工作原理使其在作用于目标组织时,手术电极表面不可避免地发生组织粘附[16-17]。鉴于电极表面组织粘附会加剧电弧放电[7],从理论上讲,通过抑制手术电极表面的组织粘附,可以提升高频电刀的防胰瘘效果。近年来,有研究发现,高频电刀手术电极表面疏水化有助于抑制组织粘附[18-20]。遗憾的是,手术电极表面润湿性对高频电刀防胰瘘效果的影响研究,目前几乎未见报道。
本研究采用化学刻蚀技术在304不锈钢手术电极表面构建微结构,改变电极表面润湿性,在高频电刀上利用不同润湿性的电极进行胰管闭合试验,研究手术电极表面润湿性对胰管闭合效果的影响,旨在从电极表面改性角度探索提升高频电刀防胰瘘效果的措施。
1 试验材料与方法
1.1 样品制备
本研究使用扬州市华威医疗器械有限公司生产的标准刀形304不锈钢手术电极作为基体,分别采用一步湿法化学刻蚀和两步湿法化学刻蚀在电极表面构建微结构,改变表面润湿性。304不锈钢具有抗氧化性、耐腐蚀性和良好的生理相容性等优点,是目前电外科手术最常用的电极材料。所有304不锈钢电极,在刻蚀前,均须轻微打磨抛光至表面粗糙度约为0.1 μm,以避免电极表面加工纹理对试验结果产生影响。一步刻蚀工艺如下:将304不锈钢电极试样放入混合刻蚀液中,4 min后取出,清水冲洗后再用去离子水超声清洗5 min,在60 ℃烘箱中干燥12 h后备用。两步刻蚀工艺如下:将一步刻蚀完成后的304不锈钢电极试样放入1 mol/L盐酸溶液(HCl)中,反应20 min后取出,用相同的方法清洗表面,干燥备用。其中,一步刻蚀用的混合刻蚀液由1.35 mol/L三氯化铁溶液(FeCl3)、1 mol/L盐酸溶液、10 mol/L双氧水溶液(H2O2)和15 mol/L 磷酸溶液(H3PO4)按照体积比15∶1∶1∶1混合而成[21]。将未经刻蚀处理的304不锈钢手术电极定义为“普通型”(Ordinary),其余两种电极按照刻蚀处理方法分别定义为“一步刻蚀型”(One-step etching)和“两步刻蚀型”(two-step etching)。
猪胰腺左叶的形态、生理结构、解剖位置及MRI、CT影像学特征均与人胰腺体尾部相似,胰腺疾病研究的动物模型常选用猪胰腺[22]。因此,本研究选用新鲜离体猪胰腺制备生物组织样品。猪胰腺来自本地屠宰场的成年猪,尺寸参数如下:胰腺长度(22.8± 1.7) cm,胰腺左叶长度(14.0±1.6) cm,主胰管直径(1.0±0.3) mm。新鲜取出的胰腺组织放入4 ℃生理盐水中运送到实验室,胰管闭合试验在猪胰腺离体2 h内完成,以防止组织样品失活。
1.2 方法
本研究采用美国威力Force FX 8CS型高频电刀作为主机,在单极电凝干燥模式下,使用不同刻蚀处理的304不锈钢手术电极,在同一种实验参数下,对离体猪胰腺进行胰管闭合试验,具体实验参数如下:功率为60 W,作用时间为2 s,工作电流输出波形为240 kHz正弦波,重复频率为39 kHz,8%负载周期。高频电刀单极工况下有切割和电凝两个功能模块。其中,电凝具有良好的干燥和凝血效果,有利于胰管闭合。电凝分为干燥、电灼和喷凝3种工作模式,不同模式的输出电流波形、重复频率和峰值电压不同,对生物组织的作用效果也不同。前期研究结果表明[23],干燥模式60 W、作用时间2 s,高频电刀手术电极对猪胰管的闭合效果最佳,且胰腺残端组织热损伤较轻。为避免试验误差,所有电极样品均不重复使用。
血管吻合口所能承受的最大压力通常用爆破压评价[24],胰管的生物学性质类似于血管,焦痂封闭主胰管也与吻合口闭合血管的作用机制相似。因此,本研究将胰管爆破压作为闭合效果的评价指标。爆破压测试装置由蠕动泵、中心静脉导管、数字压力表和三通管组成,如图1所示。测量时,首先将三通管一端通过中心静脉导管连接主胰管,一端通过蠕动泵和软管连接生理盐水,一端通过软管连接数字压力表。其中,中心静脉导管从胰腺远端穿入主胰管,接口处用手术缝合线打结固定,整个穿刺过程要确保顺滑无阻碍,以避免胰管壁破坏而影响测试结果。随后,手术电极在给定的工况下作用于胰腺断面以形成焦痂,作用2 s后移开电极,开启蠕动泵,压力表峰值读数即为胰管爆破压。其中,蠕动泵的泵水速率设置为0.4 mL/min(模拟胰液流动速度),数字压力表的精度为0.001 kPa。每种手术电极对应的胰管爆破压测试10次,取平均值。
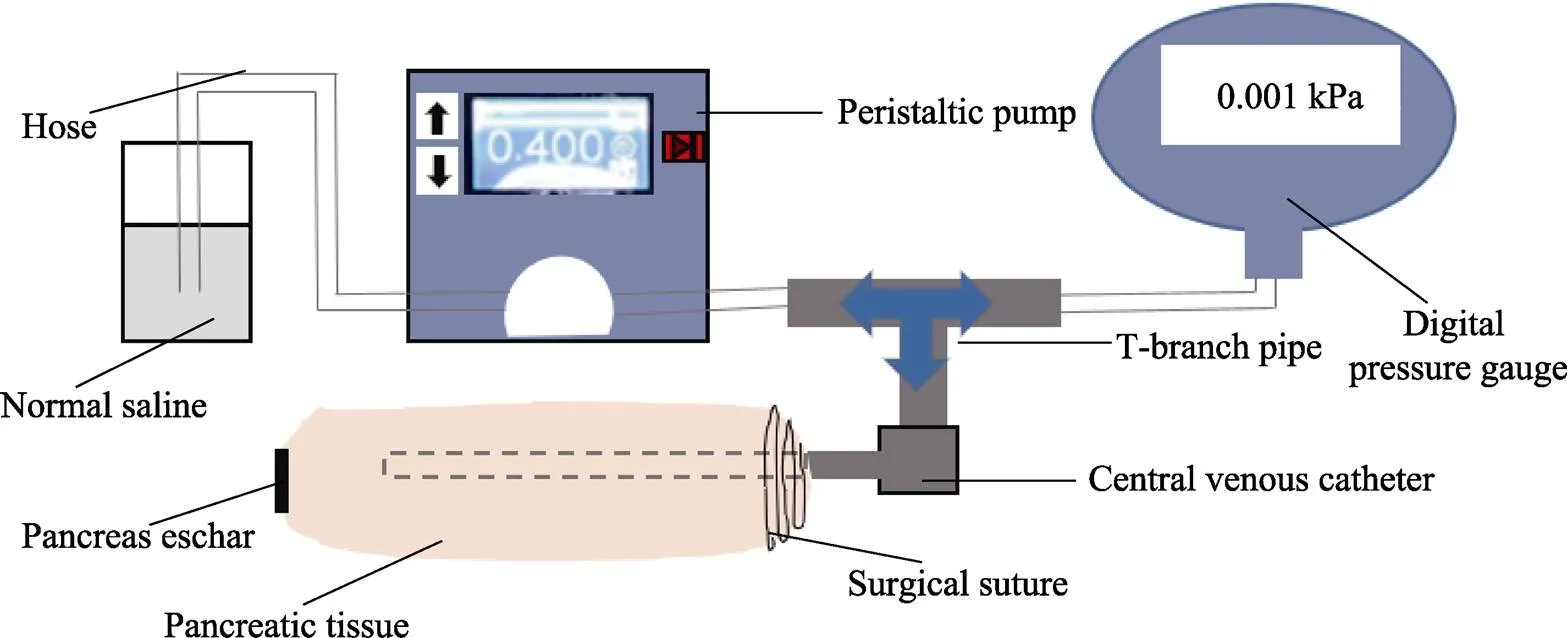
图1 爆破压测试装置示意图
304不锈钢电极试样的表面水接触角和微观形貌,分别采用东莞市晟鼎精密仪器有限公司生产的SDC-200光学接触角测量仪和荷兰FEI公司生产的QUANTA 200型扫描电子显微镜(SEM)进行表征。电极表面的组织粘附量采用称量法进行表征。采用日本KEYENCE公司生产的VK-X1000型激光共聚焦显微镜(LCSM),观察电极-粘附组织的界面形貌。采用日本KEYENCE公司生产的VHX-7000型超景深三维显微系统,分析表征胰腺断面焦痂组织形貌。胰腺残端组织损伤采用HE染色病理切片进行分析,每种手术电极的组织切片样本量为5个,组织损伤深度取平均值。
2 结果与讨论
2.1 电极表面润湿性与组织粘附
图2为3种304不锈钢手术电极表面SEM形貌和接触角。普通型电极表面光滑平整,接触角为86.1°,呈弱亲水性。使用FeCl3混合刻蚀液经过一步刻蚀处理4 min后,304不锈钢表面的内部位错部位被溶解[25],形成均匀分布的微米级凹坑结构,接触角降为65.3°,表面更加亲水。两步刻蚀型电极表面的微米级凹坑上形成了许多纳米级孔洞,平均直径约为200 nm,接触角增大到111.5°,呈现疏水性。本研究的两步刻蚀处理是在一步刻蚀的基础上,将电极再经1 mol/L HCl溶液刻蚀20 min,304不锈钢表面位错部位被进一步溶解,由于HCl溶液的浓度较低,刻蚀主要是在一步刻蚀生成的微米级凹坑上形成纳米级孔洞结构[21]。可见,在304不锈钢电极表面构建微纳米双级结构,电极由亲水转变为疏水。
图3为胰管闭合试验后3种手术电极的截面形貌 LCSM照片和表面组织粘附量。3种304不锈钢手术电极表面均出现组织粘附,其中,普通型电极表面的组织粘附层厚度约为(7.19±0.79) μm,一步刻蚀型电极表面的组织粘附加重,粘附层厚度为(9.28±0.55) μm;两步刻蚀型电极表面的组织粘附减轻,粘附层厚度为(5.58±0.61) μm。称量法得到的电极表面组织粘附量具有相同的变化趋势,如图3b所示。结合电极表面接触角测量结果可以发现,手术电极表面的组织粘附随接触角的增大而减弱,这表明手术电极表面的润湿性会影响电极作用于胰腺组织时的表面组织粘附,表面疏水化能抑制组织粘附。

图2 3种304不锈钢手术电极表面的SEM形貌与接触角
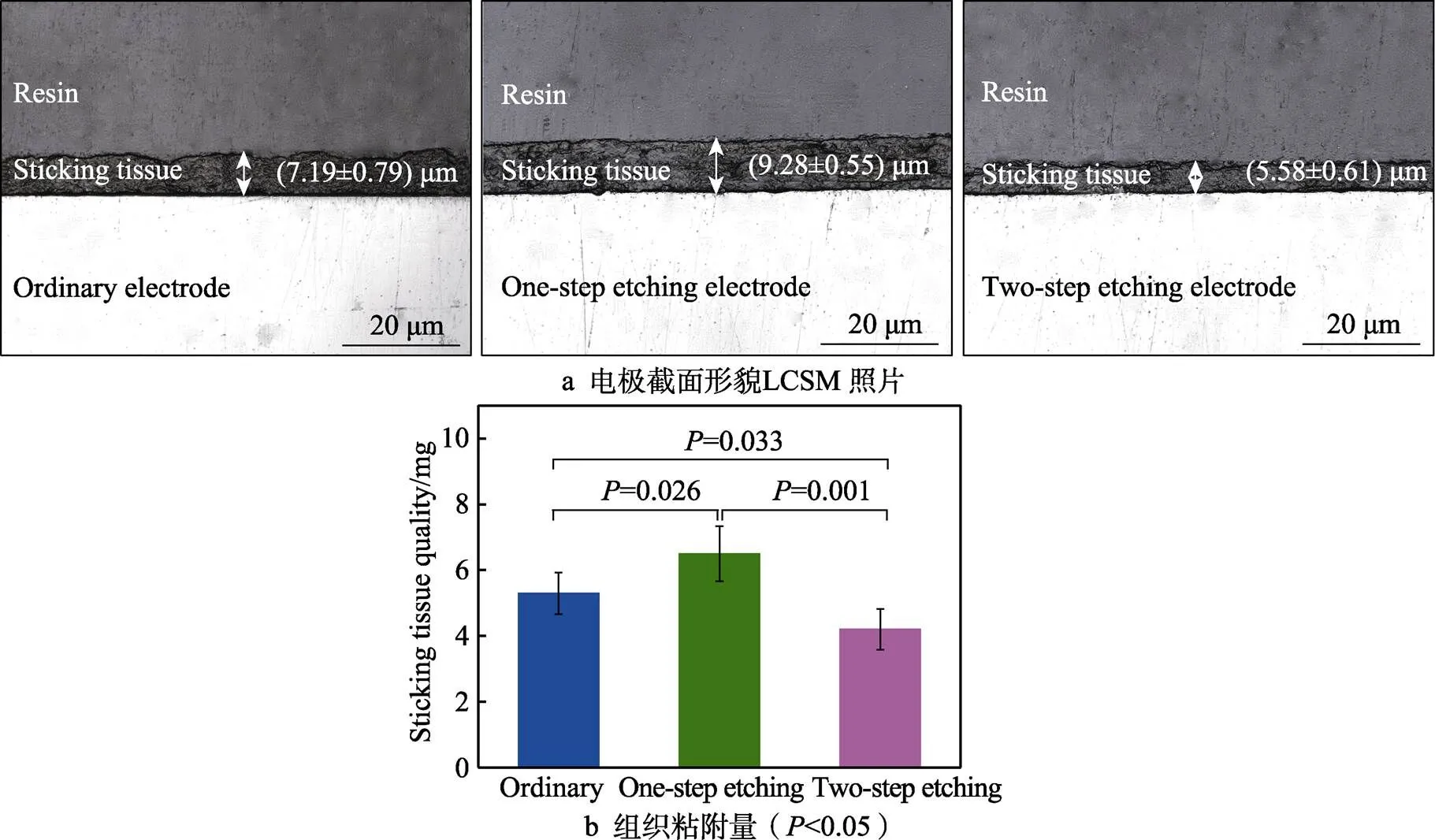
图3 胰管闭合试验后3种不锈钢手术电极表面的组织粘附
2.2 胰管闭合效果
图4为3种304不锈钢手术电极作用下胰腺断面焦痂组织形貌的OM图。焦痂表面最大孔洞直径、焦痂厚度和主胰管有效闭合厚度见表1。为了保证数据的可靠性,每种电极的重复试验不低于10次。在普通型电极作用下,胰腺断面生成的焦痂组织结构疏松,表面孔洞较大,孔洞周围有明显的黑色碳化物。相比普通型电极,一步刻蚀型电极作用下的胰腺断面焦痂组织的厚度和表面孔洞尺寸均增大,疏松程度加重,孔洞周围的黑色碳化物增多,主胰管闭合厚度则减小。而两步刻蚀型电极作用下的胰腺断面焦痂组织的疏松程度降低,焦痂厚度和表面孔洞尺寸减小,孔洞周围的黑色碳化物减少,主胰管闭合厚度增大。高频电刀的工作原理会导致手术电极表面电弧放电,电弧放电产生的瞬时大量热量,使得胰腺断面表层组织脱水碳化,进而生成疏松多孔的焦痂,电弧放电越严重,焦痂的厚度和表面孔洞尺寸越大。显然,在相同的电外科手术工况下,3种手术电极作用于猪胰腺组织时,电极表面的电弧放电程度为:一步刻蚀型>普通型>两步刻蚀型,胰管的闭合厚度则呈相反趋势。
图5为3种304不锈钢手术电极作用下的主胰管爆破压。3种电极对应的主胰管爆破压存在显著性差异(<0.05)。其中,普通型电极作用下的胰管爆破压为(6.72±0.64) kPa,一步刻蚀型电极对应的胰管爆破压降低至(5.89±0.49) kPa,而两步刻蚀型电极对应的胰管爆破压则增大为(7.33±0.59) kPa。可见,胰管爆破压与胰管闭合厚度呈正相关。

图4 胰管闭合试验后胰腺断面焦痂组织形貌的OM照片
表1 胰管闭合试验后胰腺断面焦痂组织的特征参数与主胰管闭合厚度
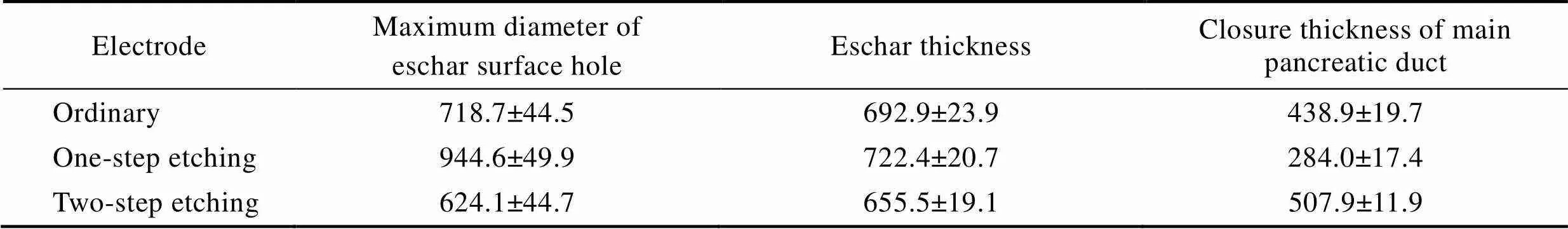
Tab.1 Characteristic parameters of eschar tissues on pancreas sections and closure thickness of main pancreatic duct after pancreatic duct closure test μm
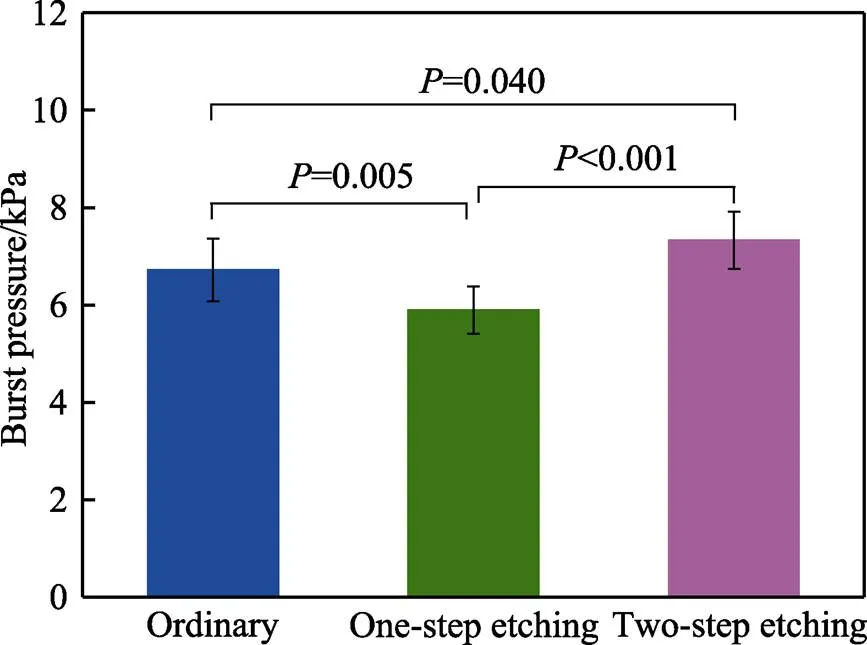
图5 胰管闭合试验后的主胰管爆破压(P<0.05)
2.3 组织损伤
高频电刀利用组织热效应来闭合胰管,在手术操作中,邻近组织不可避免地产生热损伤。图6为胰管闭合试验后的胰腺残端组织病理切片图,损伤区域及深度如图中虚线和箭头所示。热损伤会导致胰腺组织的细胞结构被破坏,不能和染料正常结合,表现为损伤组织的切片颜色浅于正常组织。可以发现,采用一步刻蚀型电极闭合胰管,胰腺残端组织损伤深度((839.6±24.5) μm)大于普通型电极((754.2±15.9) μm),而两步刻蚀型电极对应的胰腺残端组织损伤深度则减小到(698.5±19.9) μm,小于普通型电极。可见,3种手术电极对应的胰腺组织损伤程度不同,组织损伤程度与电极表面的接触角呈负相关。
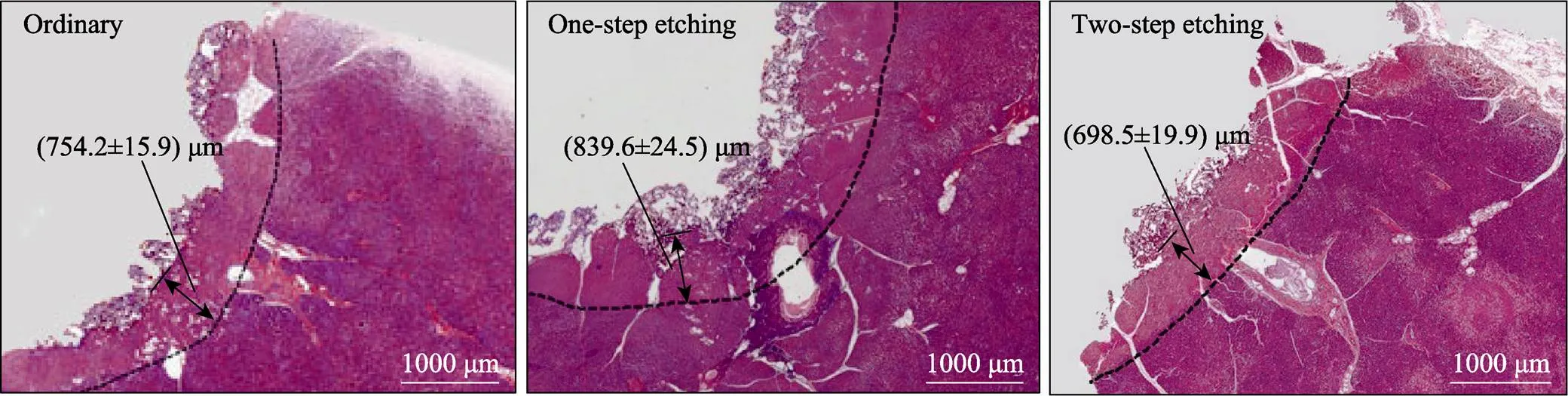
图6 胰管闭合试验后胰腺残端组织的病理切片
2.4 讨论
在电外科手术过程中,目标组织细胞由于热效应爆裂汽化,汽化后的组织颗粒粘附在手术电极表面,形成一层难以去除的粘附组织,这层粘附组织会加剧电极表面电弧放电[7,20]。如图3和图4所示,一步刻蚀型电极表面的组织粘附最显著,对应的胰腺断面焦痂组织的孔洞最大,组织碳化也最明显,这证实电极表面电弧放电与组织粘附密切相关。鉴于电弧放电会显著影响高频电刀的胰管闭合效果[13-15],因此有效抑制电极表面组织粘附,有助于减轻手术电极作用于胰腺时的电弧放电,从而促进胰管闭合。
如图2所示,一步刻蚀处理在光滑平整的304不锈钢手术电极表面构筑出均匀分布的微米级凹坑结构,接触角由86.1°降至65.3°,而进一步的两步刻蚀处理在微米级凹坑上形成均匀分布的纳米级孔洞结构,接触角增大至111.5°。这是因为在金属表面构建微结构可以改变表面润湿性,而且润湿性与表面微结构尺寸密切相关。通常,在亲水的金属表面构建微米级结构,水滴可以完全浸入粗糙结构,表面更加亲水[26-27],而在微米结构上进一步构筑纳米级孔洞,能促进空气在表面存储,并形成气体层[27-28],使水滴无法渗入,并可能吸附空气中的有机物,从而降低表面自由能[29-30]。因此,两步刻蚀型电极表面呈疏水性。
表面疏水化可以有效抵抗手术电极作用于胰腺组织时的表面组织粘附。如图3所示,3种304不锈钢手术电极表面的组织粘附量为:一步刻蚀型>普通型>两步刻蚀型,与表面接触角呈负相关。图4和表1给出的胰腺断面焦痂组织的厚度、表面孔洞尺寸和疏松程度均表明,3种手术电极作用于猪胰腺组织时,表面电弧放电程度为:一步刻蚀型>普通型>两步刻蚀型。在电外科手术过程中,高频电刀手术电极表面的组织粘附会导致电极表面阻抗增大,加剧表面电弧放电[7,31]。可见,手术电极表面疏水化可以通过抑制电外科手术过程中的组织粘附,降低电极表面阻抗的增幅,从而减轻电极作用于胰腺时的电弧放电。
手术电极作用于胰腺组织时,胰腺组织细胞内带电粒子剧烈震荡、相互摩擦,产生大量焦耳热,胰管壁皱缩、胰液凝固,引发胰管闭合。需要指出的是,手术电极表面电弧放电导致极短的时间内产生大量热量,胰腺断面表层组织脱水碳化、生成焦痂,这相当于在正常组织表面生成了一层绝缘层,胰腺阻抗增大,有效电流到达胰腺的深度减少,组织热效应减弱,胰管有效闭合厚度减小。电极表面电弧放电越严重,胰腺断面生成的焦痂组织就越厚,胰管有效闭合厚度也就越小。如表1所示,3种电极对应的主胰管闭合厚度为:一步刻蚀型<普通型<两步刻蚀型。因此,两步刻蚀型手术电极对应的胰管爆破压最大,一步刻蚀型电极的胰管爆破压最小(图5)。可见,手术电极表面疏水化能提升胰管的闭合效果。值得注意的是,3种手术电极对应的胰腺断面焦痂组织的表面孔洞尺寸均匀性存在明显差别(图4),大小顺序为:一步刻蚀型<普通型<两步刻蚀型。这表明一步刻蚀处理在304不锈钢手术电极表面构建的微米级凹坑结构会加剧表面电弧放电不均,而两步刻蚀处理构建的微纳双级结构则有助于减轻表面电弧放电不均。手术电极表面电弧放电不均对胰管闭合效果的影响有待进一步研究。
需要指出的是,术后胰瘘不仅与胰管的闭合效果有关,还与胰腺组织的损伤愈合密切相关。通常,胰腺残端组织损伤越轻,胰腺组织术后愈合就越快,胰瘘的风险也就越小。高频电刀的组织热效应不可避免地会对邻近正常组织造成热损伤,热损伤程度与电极作用组织的能量大小有关。如图6所示,3种手术电极对应的胰腺残端组织损伤深度为:一步刻蚀型>普通型>两步刻蚀型。可见,手术电极表面疏水化通过减轻电极-组织界面的电弧放电,降低胰腺残端组织热损伤,这有利于胰腺组织的术后愈合,降低胰瘘风险。
综上所述,在电外科手术过程中,高频电刀手术电极表面润湿性会影响胰管闭合效果和胰腺残端组织损伤。电极表面疏水化可以有效抵抗电极作用于胰腺组织时的表面组织粘附,从而抑制电极-胰腺组织界面的电弧放电,促进胰管的有效闭合,减轻胰腺残端组织损伤,降低术后胰瘘风险。高频电刀手术电极的服役工况为高温环境,在电极表面修饰/涂覆低表面能材料容易分解失效[20]。因此,本研究通过表面化学刻蚀构建微结构来改变润湿性,润湿性的调控范围有限。下一步研究将尝试不同制备手段与工艺,改变手术电极表面微结构的拓扑形态,拓展润湿性范围,全面分析润湿性对电极-胰腺组织界面接触状态的影响规律,揭示润湿性对手术过程的影响机理。
3 结论
1)两步刻蚀处理可以在304不锈钢手术电极表面构建微纳米双级结构,电极由亲水转变为疏水。
2)在电外科手术过程中,高频电刀手术电极表面的润湿性会影响胰管闭合效果。表面疏水化可以有效抵抗电极作用于胰腺组织时的表面组织粘附,抑制电极-胰腺组织界面的电弧放电,从而促进胰管的有效闭合,减轻胰腺残端组织损伤,降低术后胰瘘风险。
[1] ISAJI S, MIZUNO S, WINDSOR J A, et al. International Consensus on Definition and Criteria of Borderline Resectable Pancreatic Ductal Adenocarcinoma 2017[J]. Pancreatology, 2018, 18(1): 2-11.
[2] KALTENMEIER C, NASSOUR I, HOEHN R S, et al. Impact of Resection Margin Status in Patients with Pancreatic Cancer: A National Cohort Study[J]. Journal of Gastrointestinal Surgery, 2021, 25(9): 2307-2316.
[3] MALLEO G, VOLLMER C M Jr. Postpancreatectomy Complications and Management[J]. The Surgical Clinics of North America, 2016, 96(6): 1313-1336.
[4] 侯国方, 金相任, 孙备, 等. 胰十二指肠切除术后胰瘘并发迟发性出血的预防及治疗[J]. 中华胰腺病杂志, 2018, 18(2): 131-134.
HOU Guo-fang, JIN Xiang-ren, SUN Bei, et al. Prevention and Treatment of Pancreatic Fistula Complicated with Delayed Bleeding after Pancreaticoduodenectomy[J]. Chinese Journal of Pancreatology, 2018, 18(2): 131-134.
[5] MIYASAKA Y, MORI Y, NAKATA K, et al. Attempts to Prevent Postoperative Pancreatic Fistula after Distal Pancreatectomy[J]. Surgery Today, 2017, 47(4): 416-424.
[6] YAO Guang, ZHANG De-yuan, GENG Da-xi, et al. Improving Anti-Adhesion Performance of Electrosurgical Electrode Assisted with Ultrasonic Vibration[J]. Ultrasonics, 2018, 84: 126-133.
[7] MASSARWEH N N, COSGRIFF N, SLAKEY D P. Electrosurgery: History, Principles, and Current and Future Uses[J]. Journal of the American College of Surgeons, 2006, 202(3): 520-530.
[8] 段亚辉. 智能高频手术电刀研制[D]. 合肥: 中国科学技术大学, 2009.
DUAN Ya-hui. Development of Intelligent Electrosurgical Generator[D]. Hefei: University of Science and Technology of China, 2009.
[9] WANG K, ADVINCULA A P. “Current Thoughts” in Electrosurgery[J]. International Journal of Gynecology & Obstetrics, 2007, 97(3): 245-250.
[10] LANDMAN J, KERBL K, REHMAN J, et al. Evaluation of a Vessel Sealing System, Bipolar Electrosurgery, Harmonic Scalpel, Titanium Clips, Endoscopic Gastrointestinal Anastomosis Vascular Staples and Sutures for Arterial and Venous Ligation in a Porcine Model[J]. The Journal of Urology, 2003, 169(2): 697-700.
[11] ADVINCULA A P, WANG Ka-ren. The Evolutionary State of Electrosurgery: Where are We Now?[J]. Current Opinion in Obstetrics & Gynecology, 2008, 20(4): 353- 358.
[12] SUH H P, PARK E J, HONG J P. Effect of Monopolar Cutting Mode Against Bipolar Diathermy on Surgical Dissection of Microvessels[J]. Journal of Reconstructive Microsurgery, 2017, 33(9): 660-669.
[13] NAGAKAWA Y, TSUCHIDA A, SAITO H, et al. The VIO Soft-Coagulation System can Prevent Pancreatic Fistula Following Pancreatectomy[J]. Journal of Hepato- Biliary-Pancreatic Surgery, 2008, 15(4): 359-365.
[14] IKEDA T, AKAHOSHI T, KAWANAKA H, et al. Evaluation of a Transection Method for Distal Pancreatectomy: A Comparative Study on the Use of Electrosurgical and Stapling Devices in Swine[J]. Fukuoka Igaku Zasshi = Hukuoka Acta Medica, 2013, 104(12): 515-522.
[15] KOCH C, FRIEDRICH T, METTERNICH F, et al. Determination of Temperature Elevation in Tissue during the Application of the Harmonic Scalpel[J]. Ultrasound in Medicine & Biology, 2003, 29(2): 301-309.
[16] 刘光, 张鹏飞, 陈华伟, 等. 载能电刀仿生防粘表面技术[J]. 机械工程学报, 2018, 54(17): 21-27.
LIU Guang, ZHANG Peng-fei, CHEN Hua-wei, et al. Bio-Inspired Anti-Adhesion Surfaces of Electrosurgical Scalpel[J]. Journal of Mechanical Engineering, 2018, 54(17): 21-27.
[17] ZHANG Peng-fei, LIU Guang, ZHANG De-yuan, et al. Liquid-Infused Surfaces on Electrosurgical Instruments with Exceptional Antiadhesion and Low-Damage Performances[J]. ACS Applied Materials & Interfaces, 2018, 10(39): 33713-33720.
[18] HSIAO W T, LIN L H, CHIANG H J, et al. Biomedical Electrosurgery Devices Containing Nanostructure for Minimally Invasive Surgery: Reduction of Thermal Injury and Acceleration of Wound Healing for Liver Cancer[J]. Journal of Materials Science Materials in Medicine, 2015, 26(2): 77.
[19] HAN Zhi-wu, FU Jia, FENG Xiao-ming, et al. Bionic Anti-Adhesive Electrode Coupled with Maize Leaf Microstructures and TiO2Coating[J]. RSC Advances, 2017, 7(72): 45287-45293.
[20] 万健飞, 郝汝飞, 龙运江, 等. PTFE涂层抗粘附电极切割效率和抗粘附性能的时变性研究[J]. 机械工程学报, 2018, 54(17): 2-7.
WAN Jian-fei, HAO Ru-fei, LONG Yun-jiang, et al. Research on the Variations of the Incision Efficiency and Anti-Sticking Performance of PTFE-Coated Electrode with Operation Time[J]. Journal of Mechanical Engineering, 2018, 54(17): 2-7.
[21] ZHAO Er-ling. Anti-Corrosion Properties of a Bioinspired Superhydrophobic Surface on Stainless Steel[J]. International Journal of Electrochemical Science, 2017: 9855-9864.
[22] 张峰, 张长宝, 田建明, 等. 猪正常胰腺的影像学表现[J]. 放射学实践, 2010, 25(2): 129-131.
ZHANG Feng, ZHANG Chang-bao, TIAN Jian-ming, et al. Imaging Features of Normal Porcine Pancreas[J]. Radiologic Practice, 2010, 25(2): 129-131.
[23] 李宵宇. 高频电刀操作参数对猪胰管闭合效果的影响研究[D]. 成都: 西南交通大学, 2018.
LI Xiao-yu. Effect of the Operating Parameters of Electrosurgical Unit on the Sealing of Porcine Pancreatic Duct[D]. Chengdu: Southwest Jiaotong University, 2018.
[24] OKHUNOV Z, YOON R, LUSCH A, et al. Evaluation and Comparison of Contemporary Energy-Based Surgical Vessel Sealing Devices[J]. Journal of Endourology, 2018, 32(4): 329-337.
[25] LIU Yan, BAI Yuan, JIN Jing-fu, et al. Facile Fabrication of Biomimetic Superhydrophobic Surface with Anti- Frosting on Stainless Steel Substrate[J]. Applied Surface Science, 2015, 355: 1238-1244.
[26] 冯西桥, 赵红平, 李博. 仿生力学前沿[M]. 上海: 上海交通大学出版社, 2020.
FENG Xi-qiao, ZHAO Hong-ping, LI Bo. Frontiers in Bionic Mechanics[M]. Shanghai: Shanghai Jiao Tong University Press, 2020.
[27] 刘韬, 刘莹, 底月兰, 等. 3Cr13不锈钢微纳表面制备及疏水机理分析[J]. 表面技术, 2020, 49(7): 112-119.
LIU Tao, LIU Ying, DI Yue-lan, et al. Preparation and Hydrophobic Mechanism Analysis of 3Cr13 Stainless Steel Surface with Micro-Nano Structure[J]. Surface Technology, 2020, 49(7): 112-119.
[28] LEE Chan, KIM A, KIM J. Electrochemically Etched Porous Stainless Steel for Enhanced Oil Retention[J]. Surface and Coatings Technology, 2015, 264: 127-131.
[29] LONG Jiang-you, ZHONG Min-lin, ZHANG Hong-jun, et al. Superhydrophilicity to Superhydrophobicity Transition of Picosecond Laser Microstructured Aluminum in Ambient Air[J]. Journal of Colloid and Interface Science, 2015, 441: 1-9.
[30] KIETZIG A M, HATZIKIRIAKOS S G, ENGLEZOS P. Patterned Superhydrophobic Metallic Surfaces[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2009, 25(8): 4821-4827.
[31] PALANKER D, VANKOV A, JAYARAMAN P. On Mechanisms of Interaction in Electrosurgery[J]. New Journal of Physics, 2008, 10(12): 123022.
Effect of Surface Wettability of Active Electrodes in High-frequency Electrosurgical Unit on Pancreatic Duct Closure
1,1,1,1,2,2
(1. School of Mechanical Engineering, Southwest Jiaotong University, Chengdu 610031, China; 2. West China Hospital, Sichuan University, Chengdu 610041, China)
In this study, the influence of the surface wettability of active electrodes on pancreatic duct closure is investigated, aiming to explore measures that could improve the anti-pancreatic fistula effect of high-frequency electrosurgical unit from the perspective of electrode surface modification.304 stainless steel active electrodes were used as electrode samples, and the surface wettability of electrode sample was changed by means of chemical etching treatment. Fresh isolated porcine pancreas was selected as biological tissue sample to do pancreatic duct closure test using a high-frequency electrosurgical unit. With respect to the electrode samples with different surface contact angles, the corresponding tissue adhesion on electrodes, the morphology of the eschar on pancreatic section, the blasting pressure of main pancreatic duct, and the tissue damage of pancreatic stump were examined after pancreatic duct closure test.Results showed that the surface contact angle was 86.1° for the original 304 stainless steel active electrode. A surface microstructure consisting of evenly distributed micron-pits was formed on the electrode surface after one step etching treatment with FeCl3solution, and the contact angle was reduced to 65.3°. After a further etching treatment with HCl solution, nano-holes were formed on the micron-pits, and the contact angle was increased to 111.5°. Under the same electrosurgery conditions, as the contact angle of the electrode surface increased, the tissue adhesion on electrode surface was reduced, the size of the hole in the eschar tissue on the pancreatic section become small, the closed thickness and blasting pressure of the main pancreatic duct were increased, and the tissue damage of the pancreatic stump was decreased. In sum, during electrosurgery, the surface wettability of active electrodes has an influence on the closure of pancreatic duct. Electrode surface hydrophobization can effectively resist the adhesion of tissue onto the electrode when the electrode acts on pancreatic tissue, thereby inhibiting the arc discharge at the electrode-pancreatic tissue interface. This helps to promote the effective closure of the pancreatic duct, reduce the tissue damage to the pancreatic stump, and then reduce the risk of postoperative pancreatic fistula.
high-frequency electrosurgical unit; active electrode; surface wettability; tissue adhesion; pancreatic duct closure
Tb17
A
1001-3660(2022)02-0367-08
10.16490/j.cnki.issn.1001-3660.2022.02.037
2021-06-18;
2021-08-29
2021-06-18;
2021-08-29
国家自然科学基金(51675356)
Supported by the National Natural Science Foundation of China (51675356)
蒋烁(1995—),男,硕士研究生,主要研究方向为生物摩擦学与表面工程。
JIANG Shuo (1995—), Male, Postgraduate, Research focus: biotribology and surface engineering.
郑靖(1974—),女,博士,研究员,主要研究方向为生物与仿生摩擦学、表面工程。
ZHENG Jing (1974—), Female, Doctor, Researcher, Research focus: bio/bionic-tribology, surface engineering.
蒋烁,杨丹,刘文韬,等. 高频电刀手术电极表面润湿性对胰管闭合效果的影响[J]. 表面技术, 2022, 51(2): 367-374.
JIANG Shuo, YANG Dan, LIU Wen-tao, et al. Effect of Surface Wettability of Active Electrodes in High-frequency Electrosurgical Unit on Pancreatic Duct Closure[J]. Surface Technology, 2022, 51(2): 367-374.
