分心木中2个新的脂肪酸酯
2022-03-03谭金燕李建丽苏琪辉程艳刚乔元彪李青山王颖莉
谭金燕,李建丽,苏琪辉,李 慧,程艳刚,乔元彪,李青山*,王颖莉*
分心木中2个新的脂肪酸酯
谭金燕1, 2,李建丽2#,苏琪辉2,李 慧2,程艳刚1, 2,乔元彪1, 2,李青山1, 2*,王颖莉1, 2*
1.山西中医药大学,基于炎性反应的重大疾病创新药物山西省重点实验室,山西 晋中 030619 2.山西中医药大学,山西省现代中药工程实验室,山西 晋中 030619
目的 研究分心木的化学成分。方法 采用正相硅胶、反相ODS、中压制备液相色谱和制备型高效液相色谱等多种色谱技术和手段进行分离和纯化,通过1D和2D-NMR、HR-ESI-MS等谱学数据分析鉴定化合物结构。结果 从分心木中共分离得到5个脂肪酸类成分,分别鉴定为胡桃酸酯A(1)、胡桃酸酯B(2)、pinellic acid(3)、()-11,12,13-trihydroxy-9-octadecenoate(4)和9,12,13-三羟基十八烷-10,15-二烯酸(5)。结论 化合物1和2为新的脂肪酸酯类化合物,化合物3~5为首次从胡桃中分离得到。
分心木;胡桃;脂肪酸;十八烷酸;胡桃酸酯A;胡桃酸酯B;9,12,13-三羟基十八烷-10,15-二烯酸
分心木为胡桃科植物胡桃L.果核内的木质隔膜,又名核桃隔膜、核桃瓣膜[1-2]。传统中医学认为分心木具有涩精、健脾固肾、利尿清热等功效,可用于治疗遗精、尿频、尿血以及暑热泻痢等疾病[3-4]。现代药理学研究发现,分心木对糖尿病也能起到较好的预防和治疗作用[5-6]。此外,长期服用分心木茶,可缓解老年人的腰膝酸软症状,并有助于睡眠和提高免疫力[7]。目前,从分心木中分离得到的化合物主要集中在黄酮类、酚酸类和醌类化学成分,其中黄酮类成分在分心木中具有较高含量[8]。分心木资源丰富,但其作为核桃的副产物主要被制作成燃料或大部分被丢弃,利用率低、资源浪费现象严重[9-10]。为了更好利用分心木药用资源,寻找新的活性成分,本实验对分心木70%乙醇提取物的醋酸乙酯萃取部位进行研究,最终共分离得到5个脂肪酸类化合物,分别鉴定为胡桃酸酯A(juglans acid ester A,1)、胡桃酸酯B(juglans acid ester B,2)、pinellic acid(3)、()-11,12,13-trihydroxy-9-octadecenoate(4)和9,12,13-三羟基十八烷-10,15-二烯酸(9, 12,13-trihydroxyoctadeca-10,15-dienoic acid,5),其中化合物1和2为新的脂肪酸酯类化合物。
1 仪器与材料
Bruker Ascend-600 MHz型核磁共振波谱仪(德国Bruker公司);Triple TOFTM5600 MS/MS液质联用色谱仪(美国ABSciex公司);Büchi pump Manager C-610型中压色谱仪(瑞士Büchi公司);Waters 2695-2998-2414分析型高效液相色谱仪(美国Waters公司);岛津Essentia LC-16P制备型高效液相色谱仪(日本SHIMADZU公司);Sharpsil-U C18分析型色谱柱(250 mm×4.6 mm,5 µm);Sharpsil-U C18制备型色谱柱(250 mm×21.2 mm,5 µm);柱色谱硅胶(200~300、80~120目,青岛海洋化工厂);柱色谱ODS(日本YMC公司);色谱级甲醇(瑞典OCEANPAK公司);其他试剂均为分析纯(天津市致远化学试剂有限公司)。
分心木于2021年3月购自河北安国中药材市场,经山西中医药大学裴香萍教授鉴定为胡桃科植物胡桃L.果实的干燥木质隔膜。样品标本(20210301)放置于山西中医药大学现代中药工程实验室。
2 提取与分离
取分心木5 kg,用8倍量70%乙醇加热回流提取3次(每次2 h),合并提取液,减压浓缩得总浸膏1.1 kg。浸膏加入适量蒸馏水使其混悬分散,依次用石油醚(60~90 ℃)、醋酸乙酯和水饱和正丁醇等体积反复萃取3次,回收溶剂得到石油醚、醋酸乙酯和正丁醇3个萃取部位。取醋酸乙酯萃取部位(约260 g)经硅胶柱色谱,二氯甲烷-甲醇(50∶0、50∶1、20∶1、10∶1、5∶1、3∶1、2∶1、1∶1、0∶1)系统分离得到8个组分A~H。组分B经ODS中压制备液相分离(甲醇-水10%~100%),得到15个流分B-1~B-15。B-12经制备型高效液相色谱分离(64%甲醇)得到化合物1(1.2 mg,R=22.9 min)和2(2.5 mg,R=23.7 min);组分C经ODS中压制备液相分离(10%~100%甲醇),共得到13个流分C-1~C-13。C-9经制备型高效液相色谱分离(61%甲醇)得到化合物3(7.7 mg,R=23.5 min),C-10经制备型高效液相色谱分离(70%甲醇)得到化合物5(6.6 mg,R=25.2 min),C-11经制备型高效液相色谱分离(75%甲醇)得到化合物4(7.3 mg,R=27.1 min)。
3 结构鉴定
化合物1:无色油状物;[α]20 D+32.0° (0.05, MeOH);HR-ESI-MS给出准分子离子峰/259.153 8 [M+H]+(计算值为259.154 5);结合1H-NMR和13C-NMR谱推测分子式为C13H22O5,不饱和度为3。通过1H-NMR谱数据(表1)可以判断化合物1含有2个连氧次甲基质子信号[H4.30 (1H, ddd,= 8.2, 5.5, 2.8 Hz) 和4.20 (1H, m)] 和1个甲氧基质子信号[H3.65 (3H, s)]。13C-NMR结合DEPT图谱显示13个碳信号,包括2个酯羰基碳信号(C176.0和178.1)、2个连氧碳信号(C89.8和72.2) 和1个甲氧基碳信号(C51.9),此外还可以观察到8个亚甲基碳信号(C38.1, 34.7, 33.8, 30.1×2, 30.0, 26.4, 25.9)。经文献查阅,发现化合物1与文献中已知化合物sorcomic acid[11]的核磁数据非常相似,其1D-NMR主要差异在于化合物1中多出1组甲氧基碳信号,并且C-1的位移值略微向高场区移动。这提示化合物1可能是sorcomic acid羧基上的羟基被甲氧基取代形成酯而得到的。这一推论被化合物1的分子式(C13H22O5)及其二维相关谱(图1)所证实。

表1 化合物1的1H-NMR (600 MHz, CD3OD) 和13C-NMR (150 MHz, CD3OD)数据
在化合物1的HMBC谱中,H-OCH3(H3.65)与C-1(C176.0)间存在明显相关,证实甲氧基与C-1相连。化合物1的相对构型可通过NOESY实验确定。在NOESY相关谱中可明显观察到H-11α和H-9、H-11β和H-10、H-10和H-8间存在相关信号,表明H-9和H-10间是反式构型。化合物1的绝对构型则通过与已知化合物sorcomic acid比对旋光度值来确定。已知化合物sorcomic acid的旋光度值为[α]25 D+28.0° (0.35, MeOH),化合物1的旋光度值为[α]20 D+32.0° (0.05, MeOH),因此确定化合物1的绝对构型与sorcomic acid一致,即为9,10。综上所述,确定了化合物1的结构如图1所示,经检索其为新化合物,命名为胡桃酸酯A。

图1 化合物1的结构及关键1H-1H COSY (粗线)和HMBC (箭头)相关
化合物2:无色油状物;[α]20 D+9.0° (0.1, MeOH);HR-ESI-MS/:577.394 8 [2M+H]+(计算值为577.395 2),同时结合1H-NMR、13C-NMR和DEPT谱推测其分子式为C15H28O5,不饱和度为2。1H-NMR谱数据(表2)中显示化合物2含有1组烯烃质子信号[H5.70 (1H, overlapped), 5.71 (1H, overlapped)],3个连氧次甲基质子信号[H4.07 (1H, q,= 6.3 Hz)、3.91 (1H, t,= 5.5 Hz) 和3.41 (1H, m)]、1个甲氧基质子信号[H3.65 (3H, s)]、1个甲基质子信号[H0.91 (3H, s)] 以及信号严重重叠的亚甲基质子信号。13C-NMR结合DEPT图谱显示15个碳信号,包括1个酯羰基碳信号(C175.8)、1组烯碳信号(C136.2和131.4)、3个连氧碳信号(C76.5、75.7和72.6)、1个甲氧基碳信号(C52.0) 和1个甲基碳信号(C14.4),此外还可以观察到7个亚甲基碳信号(C37.6, 34.6, 33.6, 33.1, 26.6, 23.7, 22.7)。
在化合物2的HMBC谱中,可以清晰地看到H-OCH3(H3.65) 与C-1 (C175.8) 信号呈远程相关,由此可以确定甲氧基连接在C-1位上。此外,可以通过NOESY谱确定出C6-C7间双键为反式构型[12]。经过上述分析并结合不饱和度值推测化合物2为链式脂肪酸酯类化合物,平面结构为()-5,8,9-三羟基-6-十四烯酸甲酯,这一推论可以通过HSQC、1H-1H COSY和HMBC相关谱进行验证,如图2所示。通过查阅文献发现,化合物2中C-5和C-8的绝对构型可以根据H-6和H-7在1H-NMR中的偶合模式进行推测。当C-5和C-8的绝对构型一致时,即为5, 8或5, 8,则H-6和H-7的化学位移值非常相近;当C-5和C-8的绝对构型相反时,即为5, 8或5, 8则H-6和H-7的化学位移值相隔较远[11]。在化合物2中,H-6和H-7的化学位移几乎重叠,因此推测C-5和C-8的绝对构型为5, 8或5, 8。化合物2绝对构型的确定由于缺少直接证据加之其量较少,因此还有待于进一步测定。综上所述,确定了化合物2的结构如图2所示,经检索其为新化合物,命名为胡桃酸酯B。

表2 化合物2的1H-NMR (600 MHz, CD3OD) 和13C-NMR (150 MHz, CD3OD)数据
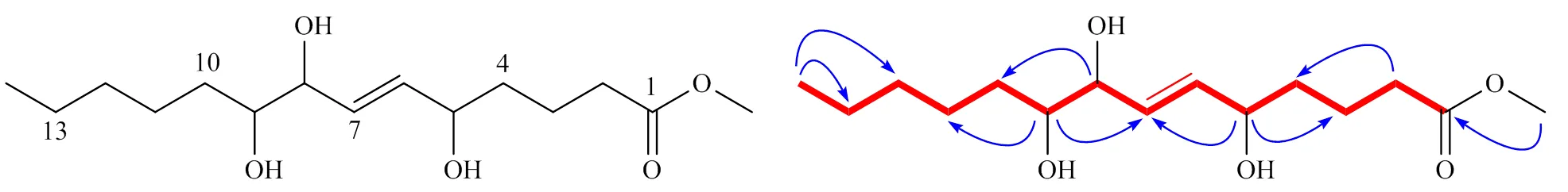
图2 化合物2的结构及关键1H-1H COSY (粗线) 和HMBC (箭头)相关
化合物3:无色油状物,ESI-MS/: 329.3 [M-H]−。1H-NMR (600 MHz, CD3OD): 5.74~5.66 (2H, m, H-10, 11), 4.06 (1H, q,= 6.2 Hz, H-9), 3.91 (1H, t,= 5.7 Hz, H-12), 3.42 (1H, m, H-13), 2.28 (2H, t,= 7.4 Hz, H-2), 1.64~1.58 (2H, m, H-3), 1.53 (2H, m, H-8), 1.34 (16H, m, H-4~7, 14~17), 0.91 (3H, t,= 6.9 Hz, H-18);13C-NMR (150 MHz, CD3OD): 178.2 (C-1), 136.5 (C-11), 131.1 (C-10), 76.5 (C-12), 75.8 (C-13), 73.0 (C-9), 38.2 (C-8), 35.3 (C-2), 33.6 (C-14), 33.1 (C-16), 30.4, 30.3, 30.2 (C-4 or C-5 or C-6), 26.6 (C-15), 26.4 (C-7), 26.2 (C-3), 23.7 (C-17), 14.4 (C-18)。以上数据与文献报道基本一致[13],故鉴定化合物3为pinellic acid。
化合物4:白色无定形粉末,ESI-MS/: 353.2 [M+Na]+,[α]22 D−8.3 (1.0, MeOH)。1H-NMR (600 MHz, CD3OD):5.57~5.50 (2H, m, H-9, 10), 4.59 (1H, dd,= 8.2, 3.9 Hz, H-11), 3.58 (1H, m, H-13), 3.25 (1H, dd,= 6.4, 3.9 Hz, H-12), 2.27 (2H, t,= 7.4 Hz, H-2), 2.18~2.07 (2H, m, H-8), 1.59~1.50 (4H, m, H-4, 14a, 15a), 1.47~1.27 (14H, m, H-3, 5~7, 14b, 15b, 16, 17), 0.92 (3H, t,= 7.0 Hz, H-18);13C-NMR (150 MHz, CD3OD): 178.0 (C-1), 133.3 (C-10), 130.9 (C-9), 78.9 (C-12), 72.7 (C-13), 67.9 (C-11), 35.2 (C-2), 33.8 (C-14), 33.2 (C-16), 30.7 (C-7), 30.3 (C-5, 6), 30.2 (C-3), 28.8 (C-8), 26.6 (C-15), 26.2 (C-4), 23.8 (C-17), 14.4 (C-18)。以上数据与文献报道基本一致[14],故鉴定化合物4为()-11,12,13-trihydroxy-9-octadecenoate。
化合物5:无色油状物,ESI-MS/: 329.2 [M+H]+,[α]22 D−15.0 (1.0, MeOH)。1H-NMR (600 MHz, CD3OD): 5.76~5.70 (2H, m, H-10, 11), 5.49~5.43 (2H, m, H-15, 16), 4.06 (1H, m, H-9), 3.96 (1H, t,= 5.3 Hz, H-12), 3.46 (1H, m, H-13), 2.32~2.28 (2H, m, H-3), 2.28 (2H, t,= 7.2 Hz, H-2), 2.12~2.07 (1H, m, H-14), 2.07 (1H, m, H-17), 1.60 (2H, m, H-7), 1.47~1.35 (1H, m, H-8), 1.34 (6H, m, H-4~6), 0.97 (3H, t,= 7.6 Hz, H-18);13C-NMR (150 MHz, CD3OD): 177.8 (C-1), 136.5 (C-10), 134.3 (C-16), 131.1 (C-11), 126.4 (C-15), 75.9 (C-13), 75.8 (C-12), 73.0 (C-9), 38.3 (C-8), 35.2 (C-2), 31.5 (C-14), 30.6 (C-4), 30.5 (C-5), 30.2 (C-6), 26.5 (C-7), 26.2 (C-3), 21.7 (C-17), 14.6 (C-18)。以上数据与文献报道基本一致[15],故鉴定化合物5为9,12,13-trihydroxy- octadeca-10,15-dienoic acid。
利益冲突 所有作者均声明不存在利益冲突
[1] 洪茜茜, 叶永丽, 张银志, 等.核桃分心木化学成分及功能活性研究进展 [J].食品研究与开发, 2021, 42(7): 194-202.
[2] 洪茜茜, 耿树香, 张银志, 等.核桃分心木镇静催眠活性成分研究 [J].天然产物研究与开发, 2021, 33(6): 964-970.
[3] 曾诗榆, 苏薇薇, 王永刚.核桃分心木的研究进展 [J].药学研究, 2021, 40(8): 524-527.
[4] Meng Q R, Li Y H, Xiao T C,.Antioxidant and antibacterial activities of polysaccharides isolated and purified fromjuglandis fructus [J]., 2017, 105(Pt 1): 431-437.
[5] 李国艳, 程艳刚, 曾桐春, 等.基于网络药理学的分心木总黄酮抗2型糖尿病作用机制研究及关于AKT/FoxO1信号通路的细胞实验验证 [J].药物评价研究, 2019, 42(1): 30-40.
[6] 胡佳卉, 钱会南, 杨凤, 等.从肝论治方药治疗2型糖尿病有效性和安全性的系统评价[J].世界中医药, 2020, 15(18): 2709-2716.
[7] 沙玉欢, 毛晓英, 吴庆智, 等.核桃分心木黄酮物质的组分及其抗氧化性分析 [J].食品科学, 2021, 42(12): 91-98.
[8] 何旭华, 阚欢, 黄陆繄, 等.云南核桃分心木黄酮提取及抗氧化性研究 [J].现代食品, 2020(19): 204-209.
[9] Liu R X, Zhao Z Y, Dai S J,.Identification and quantification of bioactive compounds injuglandis fructus by UHPLC-Q-orbitrap HRMS and UHPLC-MS/MS [J]., 2019, 67(13): 3811-3825.
[10] Hu Q, Liu J, Li J,.Phenolic composition and nutritional attributes ofjuglandis fructus and shell of walnut (L.) [J]., 2020, 29(2): 187-196.
[11] Kim C S, Suh W S, Subedi L,.Neuroprotective fatty acids from the stem bark of[J]., 2016, 51(8): 989-995.
[12] Shirahata T, Sunazuka T, Yoshida K,.Total synthesis, elucidation of absolute stereochemistry, and adjuvant activity of trihydroxy fatty acids [J]., 2006, 62(40): 9483-9496.
[13] 张艳军, 聂辉, 周德雄, 等.桂野桐化学成分的研究 [J].中草药, 2017, 48(11): 2172-2176.
[14] Fang Y S, Liu S X, Ma Y C,.A new phenylpropanoid glucoside and a chain compound from the roots of[J]., 2017, 31(1): 70-76.
[15] Qiu Y K, Zhao Y Y, Dou D Q,.Two new α-pyrones and other components from the cladodes of[J]., 2007, 30(6): 665-669.
Two new fatty acid esters from
TAN Jin-yan1, 2, LI Jian-li2, SU Qi-hui2, LI Hui2, CHENG Yan-gang1, 2, QIAO Yuan-biao1, 2, LI Qing-shan1, 2, WANG Ying-li1, 2
1.Shanxi Key Laboratory of Innovative Drug for the Treatment of Serious Diseases Basing on the Chronic Inflammation, Shanxi University of Chinese Medicine, Jinzhong 030619, China 2.Shanxi Modern Chinese Medicine Engineering Laboratory, Shanxi University of Chinese Medicine, Jinzhong 030619, China
Objective To study the chemical constituents from.Methods The chemical constitutes were isolated and purified by silica gel, ODS, preparative MPLC and preparative HPLC.Their structures were elucidated based on 1D-NMR, 2D-NMR, and HR-ESI-MS.Results Five fatty acids compounds were isolated and identified from.The structures of 1 and 2 were established and named juglans acid ester A (1) and juglans acid ester B (2), respectively.The other compounds were identified as pinellic acid (3), ()-11,12,13-trihydroxy-9-octadecenoate (4), and 9,12,13-trihydroxy-octadeca-10,15-dienoic acid (5).Conclusions Compounds 1 and 2 are new fatty acid esters.Compounds 3—5 are isolated fromfor the first time.
;L.; fatty acids; octadecanoic acid; juglans acid ester A; juglans acid ester B; 9,12,13-trihydroxy-octadeca-10,15-dienoic acid
R284.1
A
0253 - 2670(2022)05 - 1360 - 05
10.7501/j.issn.0253-2670.2022.05.010
2022-01-05
山西省卫生健康委科研项目(2020094);基于炎性反应的重大疾病创新药物山西省重点实验室开放基金资助项目(2021sxcxyw10);中央引导地方科技发展资金项目(YDZX20201400001518)
程艳刚(1992—),博士,研究方向为中药及复方药效物质基础。E-mail: 931313534@qq.com
通信作者:王颖莉(1967—),博士,教授,博士研究生导师,研究方向为中药药效物质基础。E-mail: wyltyut@163.com
李青山(1965—),博士,教授,博士研究生导师,研究方向为中药与天然药物药效物质基础与作用机制。E-mail: sxlqs2012@163.com
#并列第一作者:李建丽(1997—),硕士研究生,研究方向为中药及复方药效物质基础。E-mail: lijianli1124ljl@163.com
[责任编辑 王文倩]
