CTGF 和IL-32 对先天性心脏病相关肺动脉高压的联合诊断价值*
2022-03-02刘文世吕文静郑冬冬李晓飞
张 伟,刘文世 ,吕文静,花 颖,郑冬冬,黄 荣,李晓飞***
(1 南通大学附属医院心血管内科,南通 226001;2 南通大学医学院;3 福建省厦门市第五医院心血管内科)
先天性心脏病(congenital heart disease,CHD)是胚胎早期心脏血管发育异常或障碍所致心血管畸形,在世界范围内影响0.8%~1.2%的活产婴儿[1]。肺动脉高压(pulmonary arterial hypertension,PAH)是一种公认的CHD 严重并发症,其特点在于内皮细胞功能障碍和炎症介质失衡是死亡的主要原因。而早期准确的诊断是提高总体存活率的关键。目前,右心导管检查是诊断PAH 的金标准,但因其为有创检查且需住院治疗费用较高,所以无法用于PAH 患者的长期随访及反复评估。临床上多采用经胸超声心动图作为右心导管检查的替代方法,其通过三尖瓣反流速度来估算肺动脉收缩压(pulmonary artery systolic pressure,PASP),弊端是无法直接测量平均肺动脉压(mean pulmonary arterial pressure,PAPm)和肺血管阻力(pulmonary vascular resistance,PVR),不适合筛查轻度无症状的PAH,易发生漏诊。尽管已经在PAH中已探索了多种生物标志物[2],但只有B 型利钠肽(B type natriuretic peptide,BNP)和N 末端前体脑利钠肽是常规实践以及临床试验中广泛使用的仅有的生物标志物[3],但其诊断特异性不高。研究[4]表明,联合使用多种生物标志物比单一的生物标志物具有更大的诊断及预后价值,因此,本课题组一直寻找一些微创、客观、高效的生物标志物用于CHD-PAH 患者的早期联合诊断及严重程度的评估。
炎症信号通路激活及内皮细胞功能障碍在CHD-PAH 中起重要作用。白细胞介素-32(interleukin-32,IL-32)最初被称为NK4 转录本,主要由病原体和促炎性细胞因子[IL-2、IL-12、IL-18、IL-1β 和γ-干扰素(interferon-γ,IFN-γ)等]诱导,可进一步调节包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6 或IL-1β 在内的等多种炎症途径,是一种新型促炎性细胞因子,在最近一项包含18 例系统性硬化症相关PAH 和15 例特发性PAH患者的研究[5]指出,血清IL-32 可能是筛查WHO 第Ⅰ类PAH 患者的有效生物标志物。然而,在CHD 等Ⅰ类PAH 患者中,IL-32 是否可以作为单独的生物标记物进行早期诊断和评估病情仍需进一步验证。
结缔组织生长因子(connective tissue growth factor,CTGF)是CCN 家族成员之一,是一种富含半胱氨酸,分子质量为34~38 ku 的分泌肽,参与创伤修复,血管生成,细胞增殖、迁移及分化等多种病理生理过程。E.HELLA 等[6]研究发现儿童CHD-PAH 患者的血浆CTGF 水平高于单纯CHD 患儿及对照组,且与PAPm 和PVR 呈正相关,表明血浆CTGF 对儿童CHD-PAH 具有良好的诊断和预测价值。但考虑到儿童和成人PAH 在血管的结构及功能、病程的长短、靶向药物治疗的反应性等方面存在明显差异,CTGF 能否作为CHD-PAH 患者的生物标志物还有待进一步验证。本研究将检测CTGF、IL-32 在CHDPAH 中表达量并研究其诊断价值。
1 资料与方法
1.1 研究对象 观察组纳入2019 年1 月—2021 年6 月收住于南通大学附属医院的CHD 患者52 例,其中房间隔缺损40 例,动脉导管未闭10 例,室间隔缺损2 例。根据右心导管测定的PAPm 将其分为CHD-PAH 组(PAPm≥25 mmHg)、CHD 组(PAPm <25 mmHg)。纳入标准:(1)年龄>18 岁;(2)诊断为CHD。排除标准:(1)其他原因导致的肺高压;(2)其他原因引起的PAH;(3)全麻手术者;(4)严重的肝肾功能不全;(5)感染性疾病;(6)恶性肿瘤;(7)其他可能影响血清IL-32、血浆CTGF 水平的疾病;(8)PAH 靶向药物治疗者。对照组纳入同期于南通大学附属医院体检的健康成人25 名(根据观察组年龄、性别等构成比将对照组分层,每层随机抽取健康成年人)。纳入标准:(1)年龄>18 岁;(2)超声心动图测得的PASP 在正常范围之内。排除标准:(1)诊断为CHD;(2)严重的肝肾功能不全;(3)感染性疾病;(4)恶性肿瘤;(5)其他可能影响血清IL-32、血浆CTGF 水平的疾病;(6)合并其他可能引起PAH 的情况。本研究已获得南通大学附属医院伦理委员会批准(2016-52),受试者或其家属均签署知情同意书。
1.2 临床资料 收集观察组CHD 患者的一般资料,包括:年龄、性别、身高、体质量,入院后完善血常规、肝肾功能、血电解质、血糖、血脂、BNP、血气分析、血沉、心肌标志物、超声心动图、胸部CT 等,记录右心导管术测得的血流动力学参数(PASP、PAPm、PVR 等)。对照组主要收集年龄、性别、身高、体质量、血常规、血生化、超声心动图等信息。
1.3 检测方法 观察组患者入院后次日清晨(无药物治疗),在空腹状态下无菌操作抽取肘正中静脉血装入一次性抗凝管或血清管,于2 h 内3 000 r/min 离心10 min,收集上清液,保存于-80 ℃超低温冰箱。采用酶联免疫吸附试验检测各组血清IL-32 及血浆CTGF 的水平。
1.4 统计学方法 采用IBM SPSS Statistics 26.0 软件进行数据分析,正态分布的计量资料以表示,两组间比较采用独立样本t 检验,多组间比较采用单因素方差分析(ANOVA)。若不符合正态分布,计量资料以中位数和四分位数间距(IQR)表示,两组间数据的比较,采用Mann-Whitney U 检验,多组间数据的比较,采用Kruskal-Wallis 检验。计数资料以例数或百分比表示,组间比较采用χ2检验或Fisher 精确检验。Spearman 秩相关分析用于变量之间的相关性分析。根据血清中IL-32、血浆CTGF 水平绘制受试者工作特征曲线(receiver operating characteristic curve,ROC 曲线)。多因素Logistic 回归分析以筛选CHDPAH 的独立危险因素。Graphpad Prism 5 用于绘制图片,P<0.05 表示差异有统计学意义。
2 结果
2.1 一般资料及IL-32 和CTGF 水平比较 3 组左心房内径、左心室收缩末、舒张末内径、左心室射血分数、红细胞分布宽度、BNP、PAPm、PASP、混合静脉血氧饱和度(mixed venous oxygen saturation,SvO2)以及PVR 的差异均有统计学意义(均P<0.05)。而各组在性别构成、年龄、体质量指数(body mass index,BMI)、肌酐、血糖、肺体循环血量之比(Qp/Qs)等方面差异均无统计学意义(均P>0.05),见表1。3 组IL-32和CTGF 水平比较差异均有统计学意义(均P<0.05),CHD-PAH 组较CHD 组及对照组显著升高,见表1。
表1 各组临床资料比较(n,%,,IQR)

表1 各组临床资料比较(n,%,,IQR)
注:与CHD-PAH 组比较,*P<0.05,**P<0.01,***P<0.001。
2.2 相关性分析 CHD 患者血清IL-32 水平与PAPm、PASP 呈正相关(r=0.376、0.131,P<0.01),而与BNP、PVR、SvO2、Qp/Qs 无相关性。CHD 患者的血浆CTGF 水平与PASP、PAPm、PVR 呈正相关(r=0.620、0.662、0.652,P <0.05),CHD患者的IL-32水平与CTGF 呈正相关(r=0.409,P<0.05),见图1。
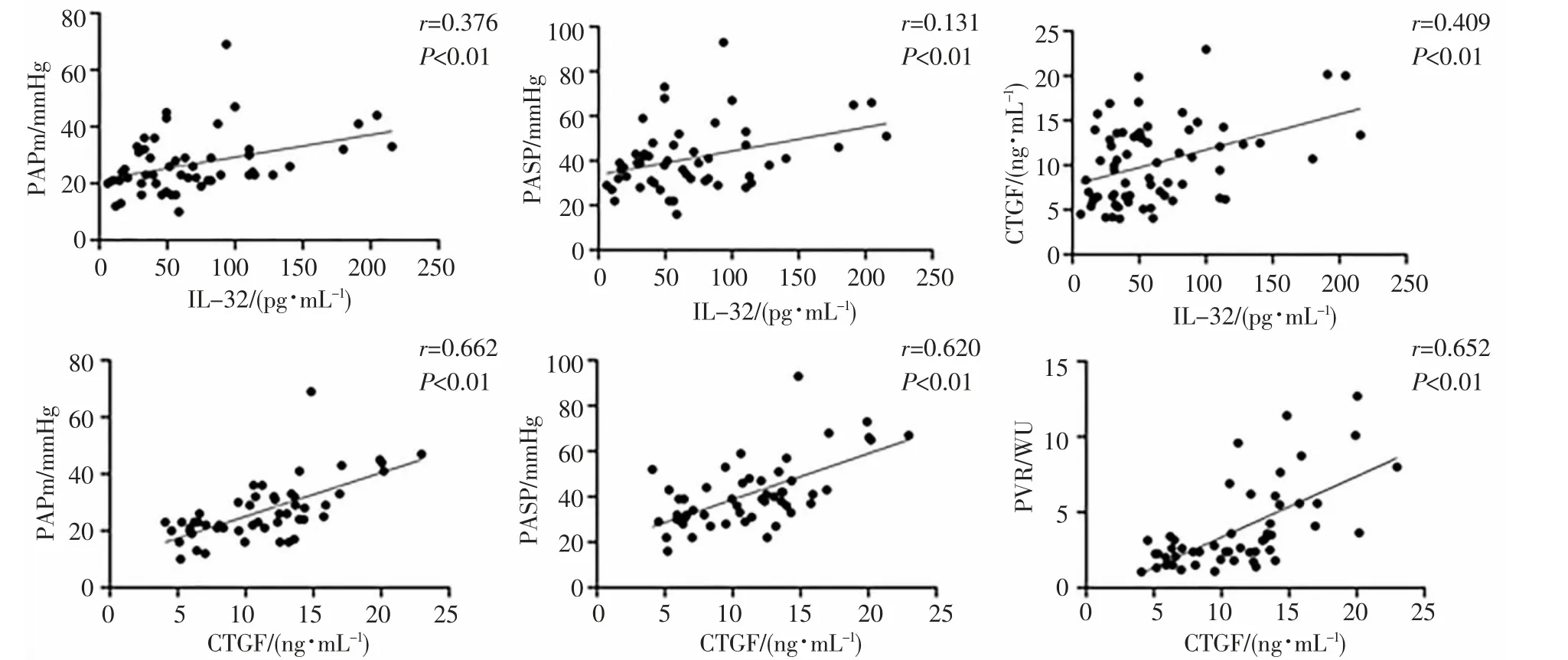
图1 血清IL-32 水平和血浆CTGF 水平相关性分析
2.3 IL-32 和CTGF 诊断CHD 合并PAH 的效能分析 通过ROC 曲线分析IL-32 和CTGF 的最佳截断值分别为81.07、10.12 pg/mL,两项指标联合检测的灵敏度、特异度、准确率及约登指数分别为95.8%、71.4%、89.0%及0.672,除特异度外均明显高于两项指标单独检测,见表2、图2。
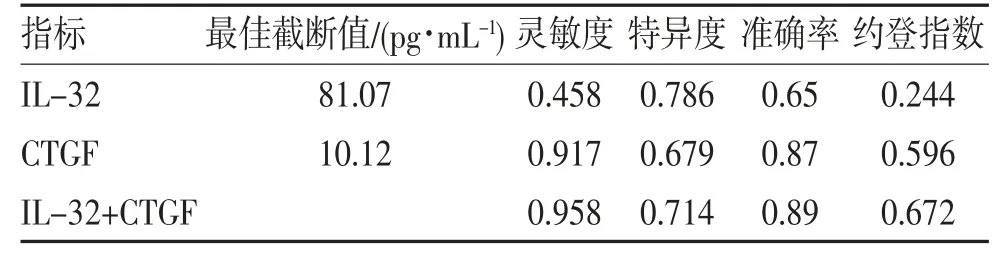
表2 IL-32 和CTGF 诊断CHD 合并PAH 的效能分析
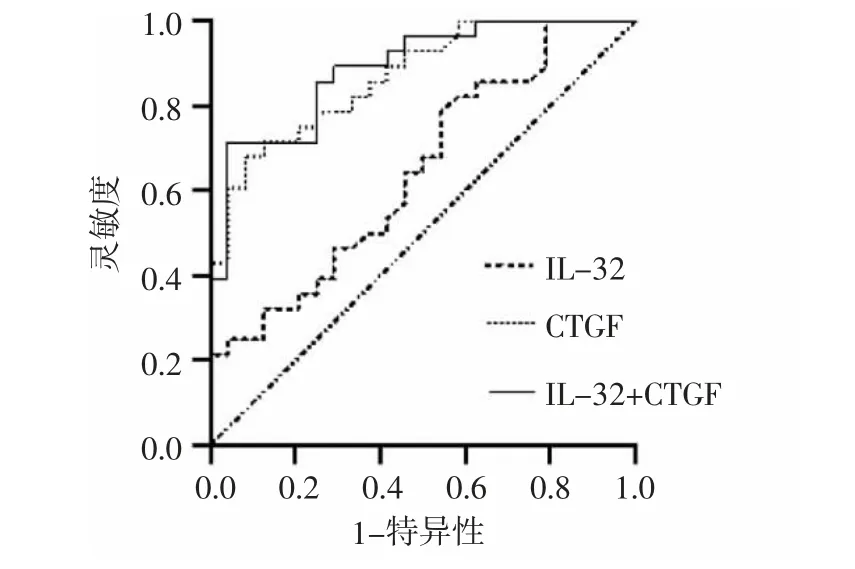
图2 血清IL-32、血浆CTGF 及联合诊断PAH 的ROC 曲线分析
2.4 单因素和多因素Logistic 回归分析 单因素Logistic 回归分析发现左心房内径、左心室收缩末内径、左心室舒张末内径、SvO2、BNP、IL-32 及CTGF 是CHD-PAH 的危险因素,将单因素分析中P<0.05 的变量纳入多因素Logistic 回归分析,结果发现在进行多变量调整后,血浆CTGF、血清IL-32 均是CHDPAH 的独立危险因素,见表3。
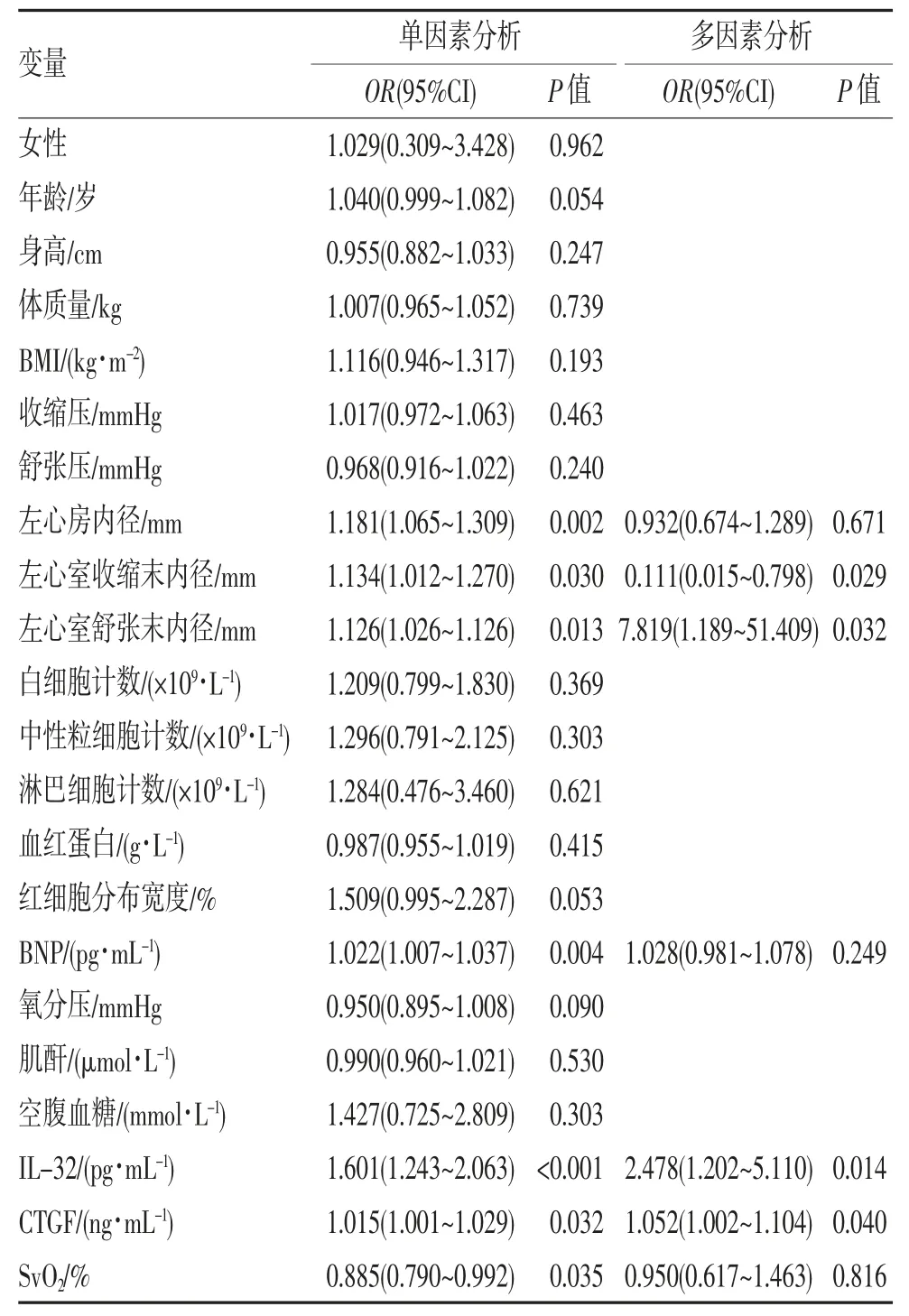
表3 CHD-PAH 患者的单因素及多因素Logistic 回归分析
3 讨论
PAH 是左向右分流CHD 最常见的并发症,其发病机制多且复杂,包括胞质钙增多、线粒体功能障碍、骨形态发生蛋白受体2 基因突变、慢性炎症、纤维化等。在临床实践中,通常由于患有PAH 的患者症状缺乏特异性而出现漏诊误诊,错过了最佳的诊疗时间。理想情况下,生物标志物水平随时间的变化能更准确地反映疾病进展。因此为了寻找可以诊断并评估PAH 的新型生物标志物,本研究选择了IL-32和CTGF 作为全新的联合诊断指标。
通过比较对照组、CHD 组、CHD-PAH 组患者的临床资料发现,左心房内径、左心室舒张末、收缩末内径、红细胞分布宽度、BNP、PVR、SvO2、IL-32、CTGF等组间具有差异。CHD 患者如室间隔缺损,动脉导管未闭等,分流量大者,可造成不同程度的左心室、左心房肥大,PAH。有趣的是,还发现氧分压组间差异无统计学意义,而SvO2差异有统计学意义,这可能是因为混合静脉血一般在行右心导管时直接于肺动脉内抽取行血气分析,其能更直观动态反映CHD-PAH 患者氧平衡的变化,而氧分压一般抽取外周动脉血,其对CHD-PAH 患者不同组别之间微小氧浓度差异的敏感性较SvO2低。IL-32 可通过诱导其他促炎细胞因子包括TNF-α、IL-1β、IL-6 和IL-8 来促进炎症,活化的炎症因子如IL-6 可通过激活成纤维细胞生长因子途径,刺激内皮细胞的凋亡和平滑肌增殖并破坏BMPR2 信号传导途径来连续激活炎症反应[7]。本研究表明CHD-PAH 患者的血清IL-32 水平高于无PAH 的CHD 患者及对照组,证明IL-32 在CHD-PAH 发病过程中发挥了作用,而且经ROC 曲线分析结果,IL-32 的最佳截断值为81.07 pg/mL,灵敏度为45.8%,特异度为78.6%。单因素及多因素回归分析发现血清IL-32 是CHDPAH 的独立危险因素(P<0.05)。在D.J.SON 等[8]研究中提出IL-32α 通过上调Timp3 和Reck 抑制microRNA-205 的产生而抑制内皮炎症及血管平滑肌细胞活化,与本课题组目前设想的不同,他们认为IL-32α 是一种抗炎的细胞因子,这可能是因为IL-32有9 种不同的同工型,其中IL-32α、IL-32β 和IL-32γ是最具代表性的形式。而在本研究中,使用的ELISA试剂盒能够识别3 种主要同工型(α、β 和γ)。考虑本研究主要目标是评估是否可以用IL-32 作为新的相关生物标志物来早期诊断CHD-PAH,因此没有分析其具体作用于何种同工型,后续可进一步研究来确定每种同工型在PAH 发展过程中的具体机制。CTGF 具有促进细胞有丝分裂、黏附、迁移,诱导细胞外基质合成和纤维化的作用。其过度表达与多种纤维化疾病有关,如肝纤维化、心肌纤维化、肾纤维化[9-11]。近年来,多项研究[12-13]表明CTGF 能诱导细胞外基质的沉积和肺动脉血管平滑肌的增殖并最终导致肺血管重塑。本研究发现,CHD-PAH 患者的血浆CTGF 水平高于单纯CHD 患者及对照组,CTGF 的最佳截断值为10.12 ng/mL,灵敏度为91.7%,特异度为67.9%,结果表明CTGF 是反映CHD-PAH 的有效指标及CHD-PAH 的独立危险因素。
血流动力学参数是诊断及评估PAH 的关键指标。本研究发现,血清IL-32 水平与PAPm、PASP 呈正相关,这与既往研究结论[5]相似,提示IL-32 可能参与了疾病进程,血清IL-32 具有评估CHD-PAH患者严重程度的潜力。血浆CTGF 水平与PASP、PAPm 及PVR 均呈正相关,这与G.LI 等[14]的研究结论不同,部分原因可能是儿童与成人CHD-PAH 的差异性。且发现IL-32 与CTGF 呈正相关,提示IL-32可能具有血管生成特性,参与了肺丛状病变的异常内皮细胞的激活与增殖,而过度增生的内皮细胞有助于肺动脉重塑,导致血管腔闭塞。
当前,临床研究越来越倾向于多项生物标志物联合检测以提高对疾病诊断的准确性。本研究将IL-32 联合CTGF 作为一个全新的组合,发现这两项指标联合检测的灵敏度、准确率及约登指数均高于两项指标单独检测,因此IL-32、CTGF 联合检测可提高CHD-PAH 早期诊断的效率,指导临床尽快采取干预治疗,改善患者预后。但本研究是单中心研究,样本量较少,后续研究需扩大样本量来明确其真正的诊断效果,并可研究生物标志物是否能够评价PAH 治疗的效果。
