乳酸/酸性环境促进HMY2-CIR 淋巴母细胞致瘤的机制研究*
2022-03-02黄一烝胡亚娥蒋永莹刘爱芬
周 楠,黄一烝,胡亚娥,蒋永莹,刘爱芬,杨 萍*
(南通大学医学院病理生理学系,南通 226001)
自从O.WARBURG 在1956 年提出著名的“无氧糖酵解理论”,认为无氧糖酵解在肿瘤的发生中发挥了至关重要的作用,无氧代谢也被认为是肿瘤的标志物之一[1-2]。即使在氧存在的情况下,肿瘤细胞也主要依赖分解糖原产生能量,导致高浓度乳酸的产生和堆积[3-4]。一方面,无氧糖酵解能产生能量,维持肿瘤细胞的生长和其他活动;另一方面,糖酵解产生的乳酸能使肿瘤微环境的pH 值降低,创造一个能促进肿瘤发生发展和转移的酸性环境[5-7]。在多种肿瘤如淋巴瘤[8]、乳腺癌[9]、胰腺癌[10]和前列腺癌[11]中,组织和细胞中乳酸浓度和肿瘤的发生、转移及肿瘤患者的预后密切相关。因此,乳酸含量和酸性微环境已被公认为是肿瘤诊断和抗肿瘤治疗的标志物[12]。
乳酸通过促进细胞干性相关基因或转录因子如SP1、MAZ、MEIS1 等高表达或过表达使细胞重编程。但是,乳酸促进淋巴瘤发生的机制还不明确。二代测序技术和基因表达谱分析表明,淋巴瘤的起始和发展与原癌基因的多位点突变导致肿瘤发生相关信号通路的激活密切相关[1,13-14]。此外,高浓度的乳酸和酸性肿瘤微环境也常见于淋巴瘤患者,对病情恶化起了一定的推动作用。乳酸可能是通过促进淋巴瘤发生过程中关键原癌基因的表达来实现的,而这些原癌基因有哪些迄今尚未见报道。
本课题组采用无致瘤性的B 淋巴母细胞HMY2-CIR 作为细胞模型来研究乳酸是否能促进淋巴母细胞的致瘤性及其机制,以期为乳酸引起细胞干性和致瘤性的原因提供新视角。
1 材料与方法
1.1 材料 乳酸购于Sigma(上海)公司。HMY2-CIR细胞株购于ATCC(Manassas,VA)。RNase-free DNaseⅠ购于Qiagen(上海)。TaqTMDNA 聚合酶购买于TaKaRa Biotechnology Co.,Ltd。RevertAidTMFirst Strand cDNA Synthesis 试剂盒购于南京诺维赞公司。Methocult H4230 methylcellulose 甲基纤维素购于Stem Cell Technologies。聚合酶链式反应(polymerase chain reaction,PCR)引物由上海生工生物技术有限公司订购。
1.2 细胞培养 HMY2-CIR 细胞株的培养液是在DMEM高糖培养基中加入10%胎牛血清、100 U/mL青霉素和100 μg/mL 链霉素,且调节成不同pH 值。培养条件为5%CO2,37 ℃,每3 d 换1 次培养基,持续8 周。
1.3 低pH 培养基制备 20 mmol/L 乳酸溶解于DMEM 中,用pH 计测试溶液的pH 值,且在培养基中加入盐酸将溶液的pH 值调至5.6 和6.0。
1.4 细胞形态学检测 HMY2-CIR 细胞分别用pH=7.4、6.0 和5.6 的培养基培养8 周,每3 d 换1 次培养基,然后利用甩片机将细胞黏附到玻片上,用瑞姬氏染液进行染色。
1.5 细胞增殖测定 采用Alamar Blue 法进行检测:将相同数量的HMY2-CIR 细胞加入96 孔培养板中,并在每个孔中加上述不同pH 值的培养基,200 μL/孔,用二甲基亚砜作为对照,培养3 d 后,在每个孔中加入10 μL 的Alamar Blue 染液。并在37 ℃,5%CO2的条件下继续培养2 h,用Spectra-Max M5 multi-detection reader 读取560~590 nm 的吸光度值。
1.6 集落生成实验 HMY2-CIR 细胞在不同pH 值的培养液中培养8 周后,用新鲜培养基洗2 遍,重悬计数。取1×103个活细胞与Methocult H4230 methylcellulose(甲基纤维素)混合后置于30 mm 培养皿中,于37 ℃和5%CO2条件下培养。14 d 后,对克隆的数量进行计数(细胞>50 个为克隆),并用体视显微镜(SZX16,OLYMPUS)进行拍照。
1.7 反转录-聚合酶链式反应(reverse transcriptionpolymerase chain reaction,RT-PCR) 从用乳酸处理过的HMY2-CIR 细胞中提取总RNA。然后用RevertAid First Strand cDNA Synthesis 试剂盒和oligo(dT)引物进行逆转录,20 μL 反应体系中含有5 μg 总RNA,还需加入RNase-free DNase Ⅰ。25 μL 的RTPCR 反应体系中含有1 μL cDNA 和1 μL TaKaRa Taq DNA 聚合酶。反应条件为94 ℃4 min,94 ℃30 s,58~68 ℃30 s,25~35 个循环,72 ℃1 min。RT-PCR产物用1.5%琼脂糖凝胶电泳进行分离,所用的引物序列见表1。

表1 引物序列
1.8 统计学方法 每个实验均重复3 次,采用SPSS 16.0 软件进行数据分析,数据均以表示,采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 乳酸和酸性环境对细胞形态和细胞增殖的影响 在20 mmol/L 乳酸、培养基pH=6.0 或5.6 的条件下,细胞形态发生了明显变化,明显的特征是细胞核变大、细胞质变少,显示出细胞去分化的形态特征(图1A)。Alamar Blue 法的结果证实,含有20 mmol/L乳酸的培养基能显著促进HMY2-CIR 细胞增殖(图1B)。因此,乳酸和酸性环境能诱导B 淋巴母细胞HMY2-CIR 细胞去分化,并能促进其增殖。
2.2 乳酸和酸性环境使无致瘤性的HMY2-CIR 获得致瘤性 集落生成实验14 d 后,在正常的培养基(pH=7.4)中培养的HMY2-CIR 细胞没有集落生成的能力,不能形成集落;相反,在经过20 mmol/L 乳酸和酸性培养基(pH=6.0)培养后,HMY2-CIR 细胞的集落生成能力提高了150 倍(图2A),且将培养基pH调至5.6 后,集落生成的数量达(200±37)个(图2B),提示乳酸和酸性环境均可增加无致瘤性的淋巴母细胞的肿瘤形成能力。

图2 乳酸和酸性环境增强人B 淋巴母细胞HMY2-CIR 的致瘤性
2.3 乳酸和酸性环境诱导细胞干性和致瘤性的机制研究 对乳酸和酸性环境诱导后,许多原癌基因的表达被上调。干细胞标志基因ALDH1A1 被上调了9倍之多,EpCAM 的表达量上调了3.7 倍,Nestin、Oct4和KLF4 分别上调了3.2、2.8 和3.1 倍;然而,CD34、C-KIT、MYC 和Nanog 等基因表达无明显上调(图3)。这些证据表明,乳酸和酸性环境选择性地使B 淋巴母细胞中部分原癌基因的表达上调,从而增加细胞的干性和致瘤性。
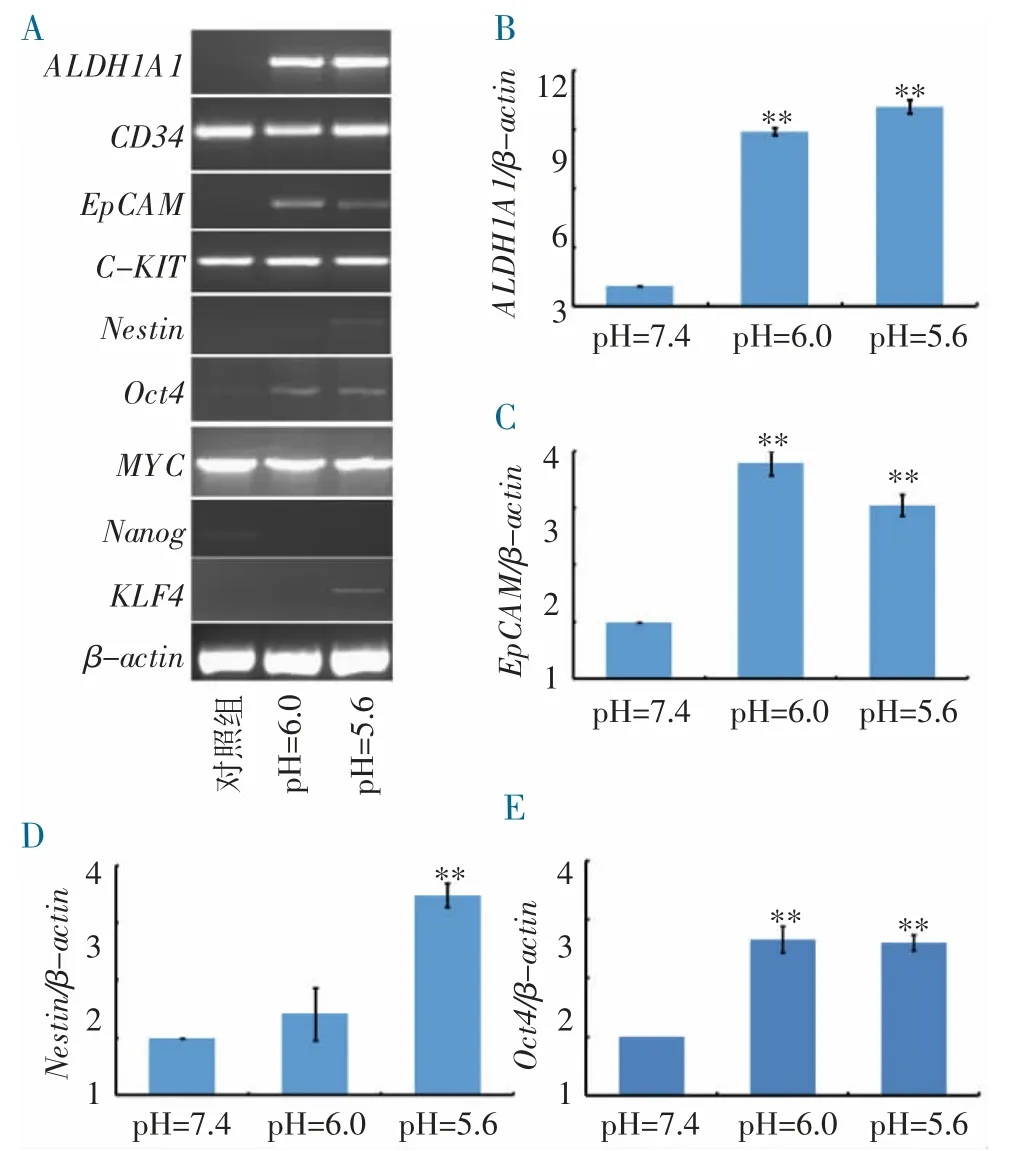
图3 乳酸和酸性环境促进HMY2-CIR 细胞中多个与细胞致瘤性相关基因过表达
3 讨论
乳酸在细胞的许多活动中起着重要作用,包括能量调节、免疫耐受、细胞记忆、损伤修复等[15]。另外,乳酸可促进肿瘤细胞生长和转移,高浓度乳酸和酸性环境与淋巴瘤的恶化和预后差密切相关[16-17]。本研究结果显示,乳酸能促进许多与肿瘤干性和发生相关的原癌基因过表达,从而使无致瘤性的B 淋巴母细胞去分化,增强其致瘤的能力。乳酸能够引起基因重编程,从而促进细胞的干性,为乳酸诱导的肿瘤发生提供新的依据。
ALDH1A1 被广泛认为是一个干细胞的标志物,在肿瘤的发生发展中起了重要作用。这个基因属于乙醛脱氢酶家族,ALDH1A1 的过表达和胃癌、卵巢癌、多发性骨髓瘤、结直肠癌、乳腺癌、非小细胞肺癌和淋巴瘤的发生发展和预后相关。本研究发现,乳酸可诱导ALDH1A1 的表达量提高9 倍以上,从而提高B 淋巴母细胞的致瘤性。另外,上调较多的基因包括Oct4、EpCAM、KLF4 和Nestin 均为与细胞干性相关的促瘤基因。EpCAM 一直被用作淋巴瘤诊断的标志物之一[18];Nestin 是一种著名的干细胞标志基因,在乳腺癌、非小细胞肺癌、胶质瘤、子宫内膜癌和淋巴瘤中,它与细胞的增殖、肿瘤的生长和转移均相关。Nestin 在B 淋巴母细胞中的上调能使其获得干细胞的特性。Oct4 和KLF4 均为转录因子,能诱导“诱导多能干细胞”的形成,且在乳酸的作用下均上调,增加了细胞的干性和致瘤性。因此将培养液的pH 调到6.0 左右,可能用作诱导“诱导多能干细胞”的一个新的方法,还需进一步研究。
综上所述,乳酸诱导无致瘤性的B 淋巴母细胞去分化,通过上调ALDH1A1、Nestin、Oct4、KLF4 和EpCAM 等促癌基因的表达,增强其致瘤性。本研究阐明了乳酸可能对基因进行重编程,为乳酸诱导细胞的致瘤性提供新的思路。
