选择性半肝血管阻断与Pringle法在肝肿瘤肝切除术中的应用效果比较
2022-03-02刘旭赵建国董勤
刘旭,赵建国,董勤
(内蒙古医科大学附属医院肝胆胰脾外科,呼和浩特 010050)
肝肿瘤包括原发性肝癌(primary liver cancer,PLC)、肝转移癌和肝良性肿瘤,其中PLC最多见,它是我国第四大常见恶性肿瘤,亦是第三大肿瘤致死病因,严重威胁人们的生命和健康[1-2]。肝脏是最常见的血行转移器官,消化道恶性肿瘤发生转移时,往往首先累及肝脏,其中以结肠癌或直肠癌的发生率最高,据统计,临床1/4~1/2的结肠癌或直肠癌在影像及肠镜明确诊断时已存在肝脏转移,虽然胃癌发生率低于结直肠癌,但仍应引起重视[3]。随着恶性肿瘤发病年龄的逐渐年轻化,肝转移癌外科手术治疗的应用也逐渐增多。肝良性肿瘤较恶性肿瘤少见,其治疗主要取决于肿瘤的大小、部位、生长速度、有无临床症状及癌变可能等,目前在严格把握手术指征且尽量保证患者最大获益的前提下,肝肿瘤的治疗仍以肝部分切除为主[4]。肝脏血流丰富,术中减少出血量和输血量是手术成功的关键,其中肝血流阻断技术是最主要的术中出血控制方法,可有效降低术中出血量,做到“无血切肝”,但可导致缺血再灌注损伤(ischemia reperfusion injury,IRI),故如何减轻肝IRI是目前肝切除术的研究重点。目前临床上采用的主要术中肝血流阻断方法为半入肝血流阻断(hemihepatic vascular occlusion,HHO)和Pringle法,两种方法的操作难度、适应证以及对患者的术后影响等均不同,故选择时仍有争议。本研究旨在比较HHO和Pringle对肝肿瘤患者术中和术后临床指标的影响,以期为肝肿瘤肝切除术中血流阻断方式的选择提供参考。
1 资料与方法
1.1一般资料 选取2018年10月至2020年7月于内蒙古医科大学附属医院肝胆胰脾外科行手术治疗的50例肝肿瘤患者,按照随机数字表法分为Pringle组(22例)和HHO组(28例)。Pringle组男12例、女10例;年龄24~74岁,平均(52±16)岁;体质指数19.4~29.7 kg/m2,平均(24.9±2.7) kg/m2,其中6例合并乙型肝炎,6例合并高血压、糖尿病等;HHO组男21例、女7例,年龄24~72岁,平均(55±14)岁;体质指数18.2~29.0 kg/m2,平均(24.4±2.6) kg/m2,其中7例合并乙型肝炎,13例合并高血压、糖尿病等。两组性别、年龄等一般资料比较差异无统计学意义(P>0.05)。本研究获得内蒙古医科大学附属医院伦理委员会批准。
1.2纳入和排除标准 纳入标准:①影像学诊断肝肿瘤拟行手术治疗者,包括术前诊断PLC、肝转移瘤和肝良性肿瘤者;②符合肝肿瘤手术切除指征[1,3-4];③术前评估可耐受手术者;④术前肝功能Child分级[5]均为A级或B级(经严格内科治疗转为A级者);⑤既往未行化疗者;⑥患者及家属均签署了知情同意书。排除标准:①伴腹水等恶病质;②两侧半肝同时存在肿瘤病灶或已发生远处转移者;③妊娠或哺乳期妇女;④伴凝血功能障碍者。
1.3方法 两组均采用静脉-吸入复合麻醉,麻醉后术区常规消毒,入腹后依次探查肝脏、腹腔,并游离肝周韧带,确定无腹腔肿瘤转移和肝脏周围侵犯并明确肿瘤所在肝段位置后,游离需要断开的所有肝周韧带,充分暴露肿瘤所在肝段,再次根据肿瘤的位置、范围以及肿瘤所在肝段与周围血管、肝十二指肠韧带的关系明确切除范围,使用电刀标记预切线。Pingle组:术中游离肝十二指肠韧带后,在肝十二指肠韧带下预置8号导尿管,切肝时收紧导尿管,入肝血流阻断时间不超过20 min,若需阻断20 min以上,应与复流5 min循环进行。HHO组:术中游离并暴露肝十二指肠韧带,明确门静脉、肝固有动脉、肝总管以及门静脉左右支的解剖位置,使用血管钳阻断病侧肝动脉、门静脉,直至肿瘤全部切除后复流,如行半肝切除可直接结扎病侧肝动脉、门静脉和肝胆管分支。使用超声刀联合钳夹法离断肝实质,放置腹腔引流管后关腹。
1.4观察指标 记录术中血管阻断时间、断肝面积、出血量、总手术时间。比较两组术前、术后第1天、第3天、第7天的肝功能指标,包括丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、前白蛋白、白蛋白、总胆红素和结合胆红素。记录术后并发症发生情况,包括术后胸腔积液、腹水、肺炎、腹腔出血、胆漏、切口感染等。

2 结 果
2.1两组术中临床指标比较 Pingle组左半肝切除6例(2例肝血管瘤、4例PLC),右半肝切除4例(1例肝血管瘤、3例PLC),肝段或肝叶切除12例(6例PLC、5例肝良性肿瘤、1例肝转移瘤)。HHO组左半肝切除8例(5例肝良性肿瘤、3例PLC),右半肝切除2例(均为PLC),肝段或肝叶切除18例(7例PLC、8例肝良性肿瘤、3例肝转移瘤)。两组术中肝血流阻断时间、手术时间、出血量、单位面积出血量、输血和半肝切除比例比较差异无统计学意义(P>0.05)。见表1。

表1 两组肝肿瘤患者术中临床指标比较
2.2两组术后相关指标比较 术后病理显示,Pingle组PLC 12例、肝转移瘤2例、肝血管瘤和肝脏局灶性结节增生共8例;HHO组PLC 11例、肝转移瘤4例、肝血管瘤和肝脏局灶性结节增生共13例。两组肿瘤最大直径、肿瘤病理组织学类型比较差异无统计学意义(P>0.05),HHO组住院时间、住院费用均少于Pringle组(P<0.01)。见表2。

表2 两组肝肿瘤患者术后相关指标比较
2.3两组术前、术后肝功能比较 两组术前各项肝功能指标比较差异均无统计学意义(P>0.05),见表3。HHO组术后第1天、第3天、第7天ALT、AST水平均低于Pringle组(P<0.01),但两组白蛋白、前白蛋白、总胆红素、结合胆红素比较差异无统计学意义(P>0.05),见表4、表5、表6。

表3 两组肝肿瘤患者术前肝功能指标比较

表4 两组肝肿瘤患者术后第1天肝功能指标比较

表5 两组肝肿瘤患者术后第3天肝功能指标比较 [M(P25,P75)]
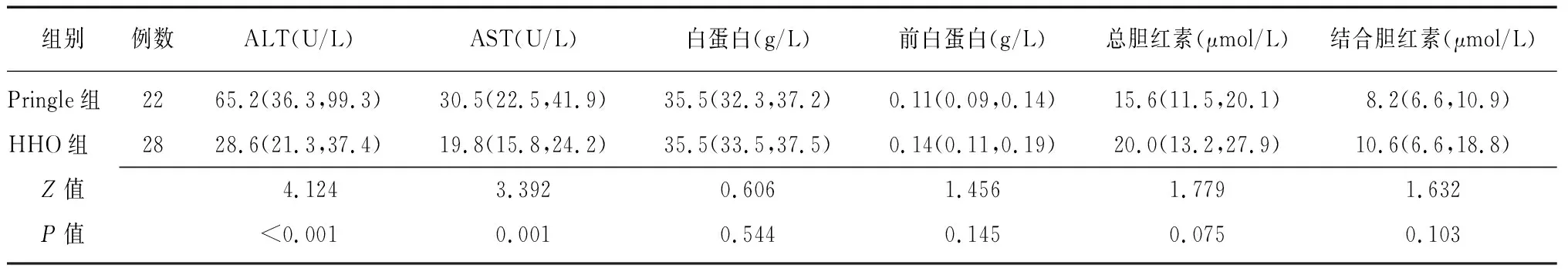
表6 两组肝肿瘤患者术后第7天肝功能比较 [M(P25,P75)]
2.4两组术后并发症发生率比较 Pringle组术后发生切口感染3例、肺炎和胸腔积液3例、腹水1例,总并发症发生率为31.8%(7/22);HHO组术后发生切口感染1例、肺炎1例、腹水3例,总并发症发生率为17.9%(5/28),两组总并发症发生率比较差异无统计学意义(χ2=1.317,P=0.251)。出院时患者所有并发症均治愈。
3 讨 论
肝切除术中面临的主要问题是出血,Pringle具有操作简单、高效省时、术中出血控制效果可靠、安全性高等优点而被广泛应用[6-7]。但Pringle在控制肝脏出血的同时,还可诱发肝细胞IRI,导致代谢、免疫学和微血管改变,阻断门静脉后,门静脉压力骤升,胃肠道淤血,胃肠道血管微循环改变,严重时可致肠道细菌移位入血引起感染[8-9]。此外,Pringle对恶性肿瘤复发和预后的长期影响尚有争议,有研究表明,Pringle可能增加肿瘤复发风险,且危及患者术后长期生存[10]。Lee等[11]对行肝切除术肝细胞癌患者的前瞻性研究显示,间断Pringle治疗的患者较非Pringle生存期更长、远期预后更好,但这种益处在肝硬化患者中并不明显。此外,肝脏对热缺血和Pringle诱导的IRI耐受性可能与血管阻断的持续时间有关,故在Pringle基础上发展了间断入肝血流阻断(intermittent Pringle maneuver,IPM),IPM是Pringle的改良术式,其血流控制效果与Pringle相当,但预防IRI的效果优于Pringle,并可减轻部分残余肝的缺血损伤,从而延长肝对缺血的总耐受时间[12-14]。但目前关于每次阻断时间和总阻断时间仍有争论,普遍认为单次阻断时间15~20 min 较安全,但有研究认为,IPM阻断时间超过60~120 min仍安全[15]。
为了避免Pringle造成的IRI和胃肠道淤血等问题,提倡使用HHO控制术中出血,该法保留了健侧肝脏的正常入肝血流量,有助于保持术中机体血流动力学稳定,尤其在合并肝炎和大范围肝切除时,目前推荐使用HHO[16-18]。
本研究中两组患者术中临床指标结果显示,HHO组患者断肝单位面积出血量较Pringle组略有增加,可能是由于HHO开放健侧血管所致,但并不影响术野和手术进程,且HHO持续的血流阻断,避免了术中血管阻断和复流,使手术更加流畅,缩短了切肝时间和血管阻断时间。但由于HHO手术操作较复杂,总体手术时间长于Pringle。此外,本研究术后临床指标显示,HHO组由于健侧血管的开放和整体切肝时间的缩短,术中肝脏IRI明显减轻,术后患者恢复较快。两组术后ALT、AST水平均明显升高,说明术后肝脏损伤较重,但该损伤可逆;HHO组患者术后肝功能恢复明显快于Pringle组,说明与Pringle相比,HHO阻断患者肝功能损伤较小,恢复更快,进而减少术后相关并发症和住院费用、缩短住院时间。美国一项回顾性研究对以肝切除术为目标的外科质量改进计划数据库中的患者进行分析,结果显示,与非IPM相比,Pringle患者的住院时间延长;与其他肝血流阻断方法(包括HHO)相比,Pringle可延长患者住院时间,说明Pringle对肝肿瘤患者的术后恢复有一定影响[6]。另一项关于肝肿瘤患者的前瞻性随机试验显示,接受IPM人群的亚临床腹水和胸腔积液的发生率高于非IPM组人群,但IPM对患者术后住院时间无显著影响[19]。
大范围肝切除可导致术中大出血以及术后严重并发症,最终导致治疗失败,故认为大范围肝切除是肝癌术后复发和死亡的影响因素之一[20]。在肝肿瘤切除术中,肝段切除范围较大病例的术中出血量大,对术者操作的要求较高,随着医疗水平的提高,目前应用HHO能够有效控制术中出血量,并能够顺利完成肝切除术。研究表明,在肝细胞缺氧时,合并肝炎、肝硬化的肝肿瘤患者的肝脏对IRI的耐受较差[21],短时间的血管阻断即可导致肝细胞IRI,因此合并肝炎肝硬化的肝肿瘤患者对Pringle的耐受较差,术后恢复较慢,而HHO开放健侧血管,提高了肝脏对缺血的耐受。但本研究纳入乙型肝炎病例有限,故未探讨HHO和Pringle对合并肝炎肝硬化的肝肿瘤患者的影响。
在肝肿瘤肝切除术中,Pringle和HHO操作均可较好地控制术中出血量。虽然HHO的手术操作难度高于Pringle,操作更复杂,但不需要阻断健侧肝血流,可维持健侧肝正常血供、保持血流动力学稳定、减轻肝脏IRI,患者术后恢复更快,有助于减轻患者经济负担。因此,相对于Pringle,推荐将HHO作为肝肿瘤切除时术中控制出血量的肝血管阻断方法,尤其对于合并肝脏基础疾病(如乙型肝炎、肝硬化)和需要大范围肝切除的患者。本研究存在样本量较小等不足,研究数据可能存在偏倚,因此研究结果仍需大样本、多中心研究的进一步证实。
综上所述,HHO是肝肿瘤切除术中一种安全、可行的血管阻断方式,其用于肝肿瘤切除术中肝血管阻断,可使术野更清晰、肿瘤更好地暴露,并减轻残肝IRI,加快患者术后肝功能恢复,减少术后并发症发生,并在一定程度上减轻患者的经济负担。
