大蒜几丁质酶基因AsCHI1的鉴定及其对盐胁迫的响应
2022-03-02张宇阳刘灵艺许吴俊任旭琴王广龙熊爱生
张宇阳,周 雪,刘灵艺,许吴俊,任旭琴,王广龙,熊爱生
(1淮阴工学院生命科学与食品工程学院,江苏淮安 223003;2淮阴工学院应用技术学院,江苏淮安 223003;3南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室,南京 210095)
0 引言
植物受到病原菌侵染时,会引发一系列复杂的防御反应,提高自身的抗性。几丁质酶是最早被鉴定的一类病程相关蛋白,在植物、细菌、真菌等生物体中广泛存在[1-3]。其主要通过降解菌类细胞壁或虫类外骨骼角质层上的几丁质,破坏其生长发育并影响繁殖能力,达到防治的目的[4]。
几丁质酶在植物抗菌和抗虫过程中具有重要作用,且在农业病害防治中得到了应用。将杜仲EuCHIT1基因转入番茄,提高了几丁质酶活性和对灰霉病的抗性[5]。类似地,水稻中转入苦瓜几丁质酶基因McCHIT1降低了纹枯病病害指数[6]。由于昆虫外骨骼角质层中含有大量几丁质,研究人员认为可利用几丁质酶基因创制抗虫植物材料,并验证了这一推论。用含有烟草天蛾几丁质酶基因的转基因烟草喂养烟芽夜蛾幼虫,发现烟芽夜蛾幼虫取食困难,生长状况恶化[7]。几丁质酶基因的过量表达导致拟南芥中的几丁质酶、苯丙氨酸解氨酶和多酚氧化酶的活性增强,胼胝质含量增加,拟南芥植株对桃蚜的抗性提高[8]。
越来越多的研究表明,几丁质酶也参与了植物应对环境胁迫的过程。在兴安落叶松中克隆得到1个编码几丁质酶的基因LgChi2,其受到低温胁迫的诱导,将该基因转入拟南芥后,转基因植株对低温的耐受性增强[9]。在芸薹属鉴定的30个几丁质酶基因中,有16个可以响应非生物胁迫的诱导[10]。
大蒜(Allium sativum L.)是重要的蔬菜作物,同时也是重要的调味品,具有丰富的营养物质和药用功能[11-12]。然而,大蒜在栽培过程中容易受到盐渍化的危害,造成产量和经济上的重大损失。因此,通过挖掘抗逆基因,培育耐盐种质资源,是提高大蒜耐盐性的有效途径。几丁质酶在抗病以及抗逆等方面的功能为大蒜抗逆育种提供了新的思路和方向,但关于几丁质酶参与植物应对盐胁迫的报道较少,其是否参与大蒜植株抵御盐胁迫的过程尚不清楚。本研究以大蒜品种‘苍山四六瓣’为试材,克隆几丁质酶基因AsCHI1,分析序列特征,并研究其在盐胁迫条件下的表达特性,以期为大蒜的抗逆栽培和育种提供理论依据。
1 材料与方法
1.1 植物材料和试验设计
试验所用大蒜品种‘苍山四六瓣’具白色外皮,多为4~6瓣,蒜瓣均匀,质地脆,品质好。大蒜种植参照之前的方法[13],具体地,将蒜瓣播种于蛭石和有机质混合的基质中。20天后将大蒜转移到Hoagland营养液中进行培养,缓苗7天后分别对大蒜进行0、1、4、12 h的盐胁迫(200 mmol/L NaCl)处理,每个处理3次重复,分别取大蒜植株叶片、蒜瓣和根用液氮冻样,并保存在-80℃中。
1.2 大蒜RNA提取及cDNA合成
采用RNAsimple总RNA提取试剂盒(北京天根生化科技有限公司)提取大蒜RNA。利用HiScript QRT SuperMix for qPCR反转录试剂盒(南京诺唯赞生物科技有限公司)将合成的RNA反转为cDNA。
1.3 AsCHI1基因的克隆
以其他植物已鉴定的几丁质酶基因,比对大蒜‘苍山四六瓣’转录组数据库[14],检索并拼接出大蒜AsCHI1基因序列,设计1对克隆引物AsCHI1-F(5′-ATGAAAACAGTCTTCCTGGTAA-3′)和 AsCHI1-R(5′-TCAAAAATGAGCCTGATTACCACAG-3′),以“苍山四六瓣”cDNA为模板进行扩增。反应体系为:Green Taq Mix(南京诺唯赞生物科技有限公司)10 μL,ddH2O 7.2 μL,上下游引物各0.4 μL,模板2 μL。PCR反应程序设置:94℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸50 s,共35个循环;72℃ 10 min。PCR产物经1.5%琼脂糖凝胶电泳并回收。将目的基因与pMD19-T载体(大连TaKaRa公司)连接后转化至大肠杆菌DH5α中,提取质粒并通过PCR鉴定,交由南京金斯瑞生物科技有限公司测序。
1.4 序列分析
采用软件BioXM 2.6将AsCHI1核苷酸序列翻译为相应的氨基酸;利用ProtParam预测分子式、等电点、相对分子质量和亲/疏水性;利用DNAMAN对大蒜和其他植物的CHI序列进行比对;采用SignalP 5.0预测信号肽;通过SOPMA进行蛋白质二级结构预测,采用SWISS-MODEL预测蛋白质三级结构;在NCBI数据库中获得其他各类植物的几丁质酶氨基酸序列进行同源性分析,利用MEGA5构建进化树探讨几丁质酶的系统进化关系并生成图形。
1.5 实时荧光定量PCR
实时荧光定量PCR反应在CFX 96 Touch系统(Bio-rad,美国)上进行。以大蒜SAND基因为内参基因[15],与目标基因一起扩增。根据从大蒜中分离的AsCHI1 cDNA序列,设计表达引物BD-CHI-F(5′-CCAACAATGCGGTAGCCAAGGA-3′)和 BDCHI-R(5′-GTTCCGAAGCCACCGAATGAGT-3′)。按照ChamQ SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技有限公司)的说明进行实时荧光定量PCR,采用 2-ΔΔCt法分析基因相对表达量[16]。
2 结果与分析
2.1 大蒜AsCHI1基因的克隆
以大蒜cDNA为模板,AsCHI1-F和AsCHI1-R为上下游引物进行扩增,得到1个约900 bp的产物(图1)。测序结果表明大蒜中克隆得到的几丁质酶基因AsCHI1开放阅读框全长933 bp,编码310个氨基酸(图2),AsCHI1可能的分子式为C1439H2121N391O450S20,分子量为32.74 kDa,理论等电点(pI)为5.64,不稳定指数为29.19,属于稳定蛋白。亲/疏水性分析表明,该蛋白属于亲水性蛋白。

图1 大蒜AsCHI1基因的RT-PCR扩增图谱

图2 AsCHI1的核苷酸序列及其预测的氨基酸序列
2.2 大蒜AsCHI1的氨基酸序列及理化性质分析
NCBI BLAST结果显示,AsCHI1属于几丁质酶Class Ⅰ类,同时也是糖苷水解酶19家族的成员,并且在氨基酸40~51位点间分布有6个糖类结合位点(图3)。酸性氨基酸(天冬氨酸和谷氨酸)占5.81%,碱性氨基酸(赖氨酸、精氨酸和组氨酸)占6.13%。Signal IP 5.0软件预测该蛋白属于信号肽蛋白,剪切位点在21~22氨基酸位点之间。

图3 大蒜AsCHI1氨基酸序列保守域分析
使用DNAMAN对大蒜与麝香百合(Lilium longiflorum,QBZ68892.1)、茶 (Camellia sinensis,XP_028075045.1)、番 茄 (Solanumlycopersicum,XP_004248635.1)、马 铃 薯 (Solanumtuberosum,XP_006367375.1)、黄 瓜 (Cucumissativus, XP_004134833.1)、南 瓜 (Cucurbitamoschata, XP_022949792.1)、 西 葫 芦 (Cucurbitapepo,XP_023544979.1)、玉米(Zea mays,AYK28287.1)、高羊茅(Lolium arundinaceum,ACJ23248.1)、梅(Prunus mume,XP_008241979.1)、苹 果 (Malusdomestica,NP_001280823.1)和桃(Prunus persica,XP_007202270.1)等12个物种CHI氨基酸序列进行比对,结果表明,来自大蒜的AsCHI1与同为百合科的麝香百合CHI一致性最高,达到67.82%,与玉米的CHI一致性为64.08%,与黄瓜的一致性最低(图4)。

图4 AsCHI1基因推导的氨基酸序列与其他物种CHI序列比对
2.3 大蒜AsCHI1的二级结构与三级结构预测
利用SOPMA在线软件预测AsCHI1的二级结构类型,其中半数以上是无规则卷曲,占比51.29%。其次是α螺旋,占25.81%,延伸链和β转角较少,分别占15.16%和7.74%(图5)。

图5 AsCHI1基因编码的蛋白二级结构预测
以夸斯苦木CHI1(ID:6lnr.1.A)三级结构为模板,利用SWISS-MODEL预测AsCHI1的三级结构(图6),并得到以下数据:序列一致性为55.87%,GMQE值为0.74,相似性为47%,覆盖率为91%,覆盖区域在22~310位。
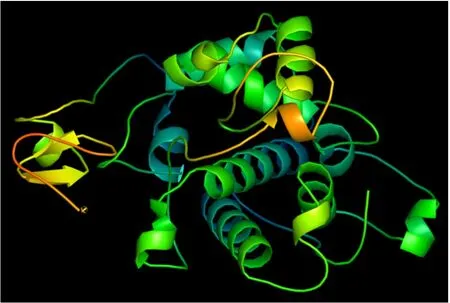
图6 AsCHI1基因编码的蛋白三级结构预测
2.4 AsCHI1的系统进化树分析
利用MEGA5软件构建大蒜几丁质酶AsCHI1与麝香百合、茶和玉米等CHI序列的进化树。如图7所示,大蒜与麝香百合(Lilium longiflorum,QBZ68892.1)和茶(Camellia sinensis,XP_028075045.1)处于同一个分支,其次与玉米(Zea mays,AYK28287.1)和高羊茅(Lolium arundinaceum,ACJ23248.1)亲缘关系较近,与茄科、葫芦科和蔷薇科的植物的CHI亲缘关系相对较远。

图7 大蒜与其他植物CHI氨基酸序列的系统进化树
2.5 AsCHI1基因在盐胁迫下的表达分析
为了鉴定AsCHI1基因对盐胁迫的响应情况,采用荧光定量PCR对AsCHI1基因在不同盐胁迫时间和不同组织间的表达进行了分析(图8)。非胁迫条件下,AsCHI1基因在蒜瓣、叶、根中均能表达,且在根中表达最高。盐胁迫改变了AsCHI1基因在各组织中的表达情况,随着处理时间的延长,蒜瓣中AsCHI1转录水平呈现先下降后升高的趋势,并在处理1和12 h后分别达到最低和最高;在叶中,AsCHI1基因在盐胁迫处理4 h后升至最高;根中AsCHI1基因的表达趋势和在蒜瓣中类似,盐胁迫处理12 h后其基因表达量是对照的2.65倍(图8)。

图8 盐胁迫下AsCHI1基因的表达分析
3 讨论
盐碱、干旱、极端温度等非生物胁迫严重制约作物的生长发育,不仅影响作物产量,而且很大程度上降低了作物品质,最终造成不可逆的经济损失[17-19]。越来越多的研究表明通过转入抗逆基因可提高作物的抗性,改善作物在逆境条件下的生长状况。本研究从大蒜中分离到一个编码几丁质酶的基因AsCHI1,发现其可以响应盐胁迫的诱导,说明该基因可能参与大蒜植株抵御盐胁迫的过程,研究结果为利用几丁质酶基因创制抗逆新品种提供了新的遗传资源。
按照系统发育的分类方法,植物几丁质酶可分为Ⅰ~Ⅶ类。其中,Ⅲ类和Ⅴ类植物几丁质酶隶属于GH18糖苷水解酶家族,Ⅰ、Ⅱ、Ⅳ、Ⅵ和Ⅶ类植物几丁质酶属于GH19家族[20]。不同种类的几丁质酶分子量差异较大,从20 k~90 kDa不等,等电点在3~10之间,但大多数几丁质酶蛋白具有保守的结构域[21]。本研究鉴定的AsCHI1属于Class Ⅰ类几丁质酶,且隶属于GH19糖苷水解酶家族,其在N端具有大多数几丁质酶具有的信号肽区域,不同物种的几丁质酶氨基酸序列在C端一致性较高。
植物几丁质酶通过降解几丁质抵御病原真菌和昆虫对植物的攻击[22-24]。最新的研究表明,植物几丁质酶能够响应干旱和极端温度等非生物胁迫,并在植物抗性形成过程中发挥重要作用。研究发现草莓几丁质酶基因FaChi可以响应干旱胁迫和脱落酸信号,说明其可能参与草莓植株抵御非生物胁迫的过程[25]。从沙棘中分离和鉴定的基因HrCHI1可能通过ICE-CBF信号途径参与植物冷胁迫响应[26]。将柳树Ⅲ类几丁质酶基因SlChi转入拟南芥,能够促进转基因植株在高盐条件下的种子萌发和幼苗生长[27]。本研究中,大蒜AsCHI1基因可以响应盐胁迫的诱导,且在根和蒜瓣中响应较为强烈,这些结果说明该基因可能在大蒜植株抵御盐胁迫的过程中发挥重要作用。但其如何发挥功能?其具体的作用机制是怎样的?这些问题还有待进一步研究和解决。后续工作可重点研究AsCHI1基因发挥功能作用的机制以及其在其他非生物胁迫中的功能。
4 结论
本研究从大蒜中克隆得到几丁质酶基因AsCHI1,其开放阅读框全长933 bp,编码蛋白属于几丁质酶Class I类,隶属GH19家族,N端具备信号肽区域。在亲缘关系上与同属百合科的麝香百合以及山茶科的茶较为接近。AsCHI1基因在大蒜根、蒜瓣和叶片中均有表达,在根中表达最高,且能响应盐胁迫的诱导,说明该基因可能在大蒜对盐胁迫的响应中发挥重要的调节作用。
