miR-9通过调控β-tubulin Ⅲ、GFAP对神经干细胞增殖的影响
2022-02-22阚伯红史慧妍
王 煜,赵 岚,阚伯红,史慧妍
神经干细胞(neural stem cells,NSCs)是哺乳动物神经组织中的一种能够通过自身的分裂、更新、持续增殖以及多向分化的特性产生充足的脑组织细胞的细胞群体[1]。该细胞的发现和分离实验的成功给帕金森病、脑卒中和多发性硬化等神经退化性疾病的治愈提供了希望[2]。有报道[3]显示miR-9的表达上调与NSCs向神经元分化有关。β-微管蛋白-Ⅲ(β-tubulin-Ⅲ)是细胞骨架家族神经细胞的特异性蛋白,在现阶段的研究中被证实是神经元早期发育的标志[4]。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是一种存在于星形胶质细胞内的中间丝蛋白,其表达升高往往预示着星形胶质细胞的活化[5]。目前关于三者在NSCs定向分化为神经元的过程中的相关性研究较少。该研究重点探讨miR-9是否通过调控β-tubulin Ⅲ、GFAP影响NSCs增殖。
1 材料与方法
1.1 实验分组32只约240 g的健康SPF级SD孕鼠购自上海灵畅生物科技公司,许可证号:SCXX(沪)2018-0003,孕鼠进行NSCs分离,将分离出的NSCs随机分为4组:NO组常规培养;NN组转染miR-9 无意义序列;NM组转染miR-9模拟物;NI组转染miR-9抑制剂。
1.2 实验仪器与试剂GFAP 抗体(上海士峰生物科技有限公司,货号:sc-33673);β-tubulin Ⅲ 抗体(北京百奥莱博科技有限公司,货号:A0303);电泳仪(型号:EPS-300)、PCR仪(型号:DP1000)(上海启步生物科技有限公司);miR-9 mimics、miR-9-NC、miR-9 inhibitor(上海启因生物科技有限公司,货号:219600);MTT试剂盒(上海臻科生物公司,货号:4890-50-K);PVDF膜(美国Millipore公司,货号:Millipore IPVH 00010);流式细胞仪(东莞南寻进出口公司,型号:SP6800);恒温摇床(河南信诺仪器设备公司,型号:TS-100C)。
1.3 大鼠NSCs的分离、培养麻醉大鼠(2%戊巴比妥钠),取出胎鼠,分离并剪碎脑室管膜、脑室下区、海马组织。加0.25%胰蛋白酶消化20 min,过滤,用含胎牛血清的培养液终止消化,将浓度为5×108/L的细胞接种至6孔板,进行胰蛋白酶消化,1 600 r/min离心5 min,收集、重悬并培养细胞。
1.4 细胞转染将数量为1×104个的NSCs细胞株接种到96孔中,15 h后,待细胞重复融合,在EP管中加入200 μl转染液体和4 μl脂质体,后加入5 μg的miR-145 mimics、miR-9 inhibitor、miR-145-NC,充分混合后,转染 9 h后,继续培养4 h采用qRT-PCR法检测是否转染成功。
1.5 细胞免疫荧光鉴定细胞数量、接种、培养同1.4项。2 d后使用多聚甲醛(40 g/L)固定,25 ℃固定10 min,PBS洗涤,5 min/次,共3次;0.5% Triton X-100打孔5 min,PBS洗涤同上;1% BSA 25 ℃孵育0.5 h后,加Anti-Nestin抗体(1 ∶200)4 ℃孵育过夜,PBS洗涤同上;加Anti-Rabbit荧光二抗(1 ∶100)25 ℃避光孵育1 h,PBS洗涤同上;DAPI避光染色10 min,PBS洗涤同上,封固,荧光显微镜观察。
1.6 RT-PCR检测miR-9、β-tubulin Ⅲ、GFAP含量把保存在-80 ℃环境中的NSCs细胞取出进行研磨,用TRIzol进行总RNA的提取,逆转录参照说明书执行;将逆转后所得的cDNA进行荧光反应实验。所有反应严格按照反应条件进行扩增,内参采用GAPDH,95 ℃变性3 min,95 ℃变性5 s,60 ℃退火1 min,共40个循环。取平均值计算Ct值,计算方法用2-△△Ct法。见表1。

表1 引物序列
1.7 MTT细胞活力检测细胞数量、接种培养同1.4。置于5% CO2、37 ℃培养 12 h后,在0、24、48、72 h时,更换培养基,孵育4 h,吸弃培养液,每孔加入150 μl DMSO,振荡孵育10 min。酶联免疫检测仪492 nm测定吸光度(optical density,OD)值,每组实验至少重复3次并收集数据。
1.8 流式细胞仪检测细胞凋亡细胞数量、接种培养同1.4。0.01 mol/L PBS洗涤,2 500 r/min离心5 min,室温避光静置15 min,收集细胞,保存,PBS洗涤3次,100 μl接种于5 ml流式试管中,加入AnnexinV-FITC 5 μl、碘化丙啶染色液 10 μl充分混合,4 ℃避光孵育0.5 h,流式细胞仪检测NSCs凋亡情况。
1.9 Western blot检测β-tubulin Ⅲ、GFAP蛋白表达将NSCs细胞进行裂解并提取核蛋白,并对核蛋白的浓度进行测量,分装后,-20 ℃保存。将提取出的蛋白溶液和缓冲溶液混匀,按照4 ∶1的比例,为了让蛋白质变性需将蛋白溶液全部煮沸变性处置。将电泳后50 μm的蛋白样品置于PVDF膜上,加脱脂奶粉加封。1 h后加一抗β-tubulin Ⅲ(1 ∶500)、GFAP(1 ∶500),然后PBS漂洗3次,间隔10 min。最后加入封闭液稀释辣根过氧化物酶(HRP)标记的二抗(1 ∶2 000),25 ℃封闭1 h。取出PVDF膜漂洗(同上),DAB显色后照相。
1.10 统计学处理采用SPSS 25.0软件对数据进行分析,四组NSCs生物活性及β-tubulin Ⅲ、GFAP蛋白、mRNA等比较采用单因素方差分析,组间两两比较行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠NSCs特征性标志蛋白Nestin鉴定免疫荧光染色结果显示细胞传代后24 h NSCs检测指标Nestin在90%的细胞中呈现阳性,且与细胞核共定位,提示NSCs分离成功。见图1。
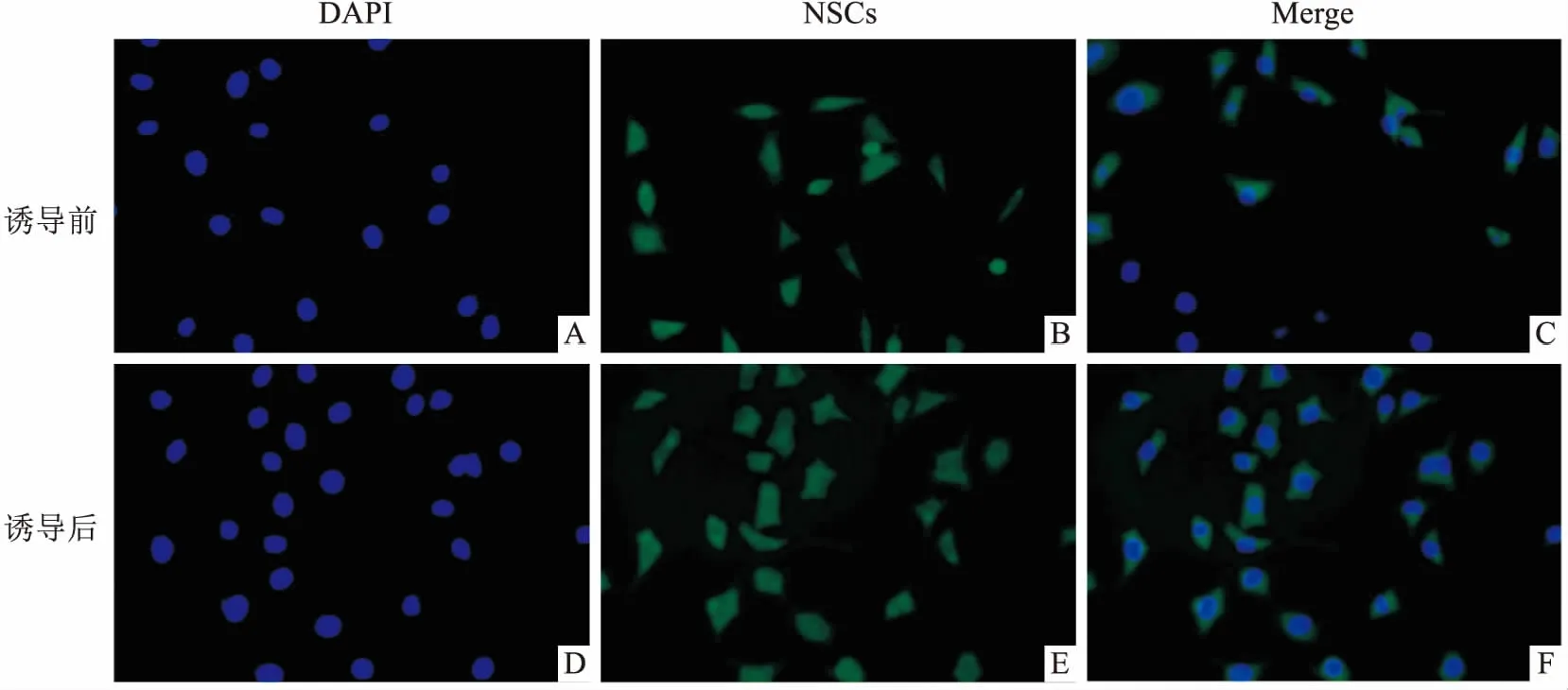
图1 细胞株复苏传代后Nestin染色×400A~C:诱导前细胞的荧光染色;D~F:诱导1 d时细胞的荧光染色;蓝色:DAPI对照;绿色:NSCs;蓝色与绿色重叠越多表明阳性率越高
2.2 各组miR-9、β-tubulin Ⅲ、GFAP的基因表达NM组NSCs中miR-9 mRNA表达量最高,与NN组、NO组、NI组相比,差异有统计学意义(F=165.807,P<0.01),说明转染成功。四组中NM组β-tubulin Ⅲ mRNA表达量最高,GFAP mRNA表达量最低,NI组则相反(Fβ-tubulin Ⅲ=113.627,FGFAP=174.025,P<0.01);NN组与NO组对比上述三个指标数据差异无统计学意义。见图2。
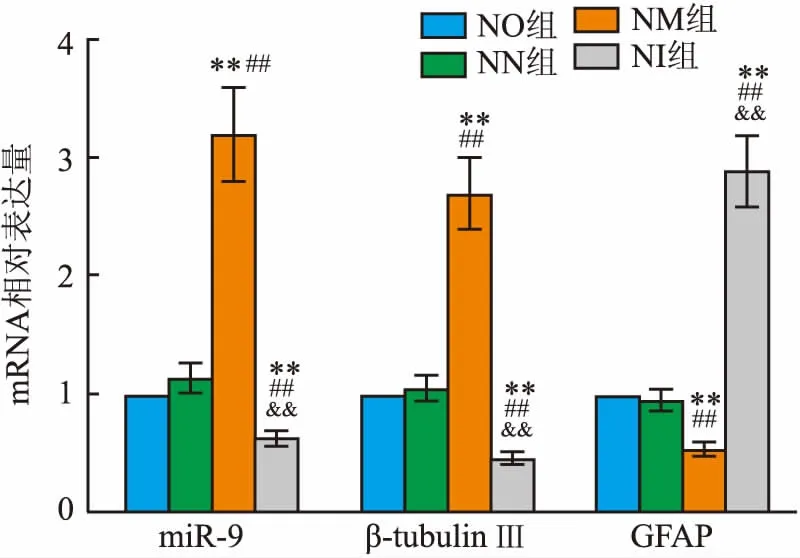
图2 4组NSCs细胞中miR-9、β-tubulin Ⅲ、GFAP表达量与NO组比较:**P<0.01;与NN组比较:##P<0.01;与NM组比较:&&P<0.01
2.3 各组β-tubulin Ⅲ、GFAP蛋白含量与NO组、NN组、NI组相比,NM组β-tubulin Ⅲ蛋白含量最高,GFAP蛋白含量最低(Fβ-tubulinⅢ=108.253,FGFAP=167.406,P<0.01)。四组中NI组β-tubulin Ⅲ蛋白表达量降低,GFAP蛋白表达升高;NO组β-tubulin Ⅲ、GFAP蛋白含量与NN组对比差异无统计学意义。见图3。

图3 各组细胞中β-tubulinⅢ、GFAP的蛋白表达比较与NO组比较:**P<0.01;与NN组比较:##P<0.01;与NM组比较:&&P<0.01
2.4 各组NSCs增殖情况24 h后各组细胞活性对比差距较大(F=74.078,P<0.01)。与NN组、NO组、NI组相比,NM组NSCs增殖活性最强且呈现随时间延长而逐渐增强的趋势(P<0.01),NI的细胞活性较其他三组相比减弱,差异有统计学意义(P<0.01),NO组NSCs的活性略低于NN组,差异无统计学意义。见图4。
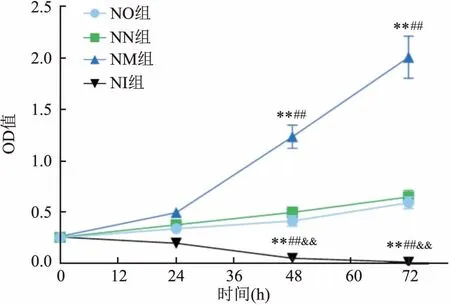
图4 各组NSCs细胞增殖情况与NO组比较:**P<0.01;与NN组比较:##P<0.01;与NM组比较:&&P<0.01
2.5 各组NSCs细胞凋亡情况NO组、NN组、NM组、NI组细胞凋亡率见图5。其中NM组细胞凋亡率少于其他三组(P<0.01),NI的细胞凋亡率较其他三组相比升高(P<0.01),NO组与NN组胞凋亡数量差异无统计学意义。
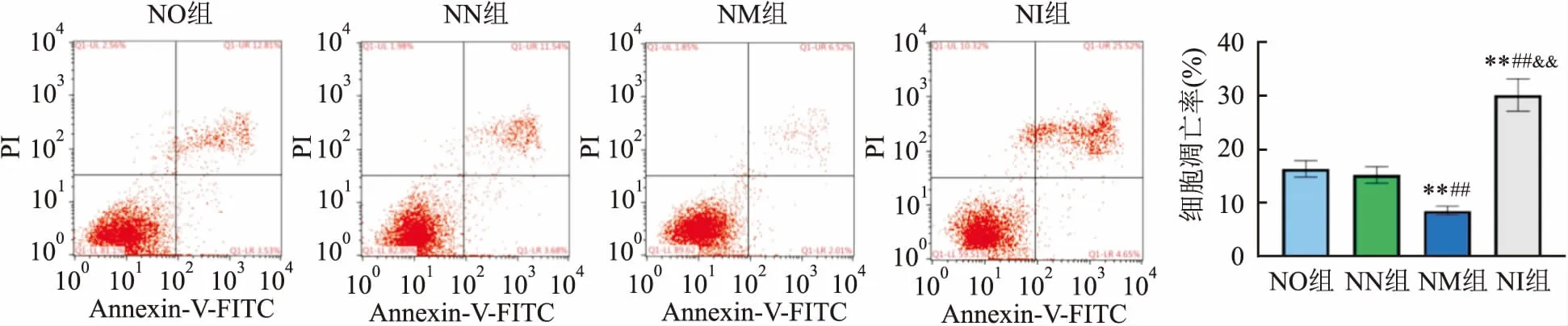
图5 4组细胞凋亡情况比较与NO组比较:**P<0.01;与NN组比较:##P<0.01;与NM组比较:&&P<0.01
3 讨论
早期的研究中提示,正常情况下哺乳动物大脑皮质神经细胞不可再生。然而近些年的研究[6]表明NSCs作为神经前体细胞不但自身具有更新能力,而且能够分化为大脑细胞。这一发现为神经退化性疾病的治疗带来了新的希望。有报道[7]显示NSCs的分化机制较为复杂,受机体内某些信号调控影响,寻找干细胞增殖和分化的途径和方法成为研究的关键。
miRNAs是一种高度保守的非编码RNA,具有调控细胞的生物学行为的作用。有研究[8]表明其在哺乳动物大脑中普遍存在,提示其可能在神经功能中具有重要意义。miR-9是一种新型的保守miRNA,在人类以及多类生物体内广泛存在。有报道[9]显示miR-9在神经系统中特异性表达,发挥调节神经发育的作用。另外,miR-9在近些年的多种肿瘤细胞的研究中呈现表达失调,提示其与癌细胞的生物学行为有关。同时研究[10]表明miR-9在神经系统退行性病变的神经元中表达缺失。以上结果皆提示miR-9与神经系统发育以及疾病的发生过程相关,可能是两者的重要调控因子。本研究显示NM组NSCs活性最强且呈现随时间延长而逐渐增强的趋势。此结果提示过表达miR-9能够增加NSCs细胞活性,减少其凋亡。
李彩霞 等[11]对龟板提取物在NSCs向神经元细胞分化的过程中的作用进行探讨,结果表明过表达miR-9能够通过调节Notch 1的表达在间充质细胞分化为神经元的过程中发挥促进作用。何玲 等[12]研究表明脑络通通过上调β-tubulin Ⅲ、降低GFAP的表达促进NSCs增殖、分化。NSCs向神经元分化进程中细胞的形态变化以及迁移需要细胞骨架的配合[13]。细胞骨架最主要的组成部分为微管,微管是一种管状物,主要成分为微管蛋白,其中β-tubulin不仅仅是微管的组成成分之一,也是构成神经元的主要成分。其改变受NSCs向神经元分化影响。β-tubulin的所有同源体中β-tubulinⅢ具备神经元特异性,作为神经元标志物之一被广泛应用于神经生物学研究[14]。GFAP被发现于星形胶质细胞内,属于Ⅲ型中间丝蛋白。作为星形胶质细胞骨架的主要成分在细胞形态功能维持、神经生理功能及疾病过程中广泛参与,引起研究者的关注。免疫组化检测显示在健康的生物机体组织中GFAP大多呈现阴性表达,而在神经系统受损后,机体组织中的星形胶质细胞迅速增多发挥保护作用,但其增长过多时造成的胶质瘢痕在神经元的活动联结中成为了阻碍。GFAP作为星形胶质细胞的主要成分其表达随着星形胶质细胞的激活增长。因此GFAP蛋白激活被当做神经系统星形胶质细胞活化的标志物,在临床可用作急性神经损伤的判断指标。本研究结果显示,NM组细胞中β-tubulinⅢ mRNA蛋白表达量在四组中最高,而GFAP mRNA和蛋白表达量最低,提示miR-9通过调控β-tubulin Ⅲ、GFAP的表达促进NSCs增殖。本研究与上述研究结果相似。
综上所述,过表达的miR-9通过促进β-tubulin Ⅲ表达、抑制GFAP表达,从而促进NSCs增殖。该实验尚有一些不足,如样本量受限、未对所有类型的NSCs进行试验,不能排除细胞种类对实验所带来的影响,在今后的研究中应加入更多的实验方法对NSCs生物活性进行检测,为神经退化性疾病的治疗提供更有利的实验依据。
