hsa_circ_0006370促进高糖诱导的人肾小管上皮细胞(HK‑2)铁死亡
2022-02-22熊轩严跃红杨倩沈美妊钟小仕
熊轩,严跃红,杨倩,沈美妊,钟小仕
(1.广州医科大学附属顺德医院肾脏内科,广东 佛山 528315;2.广州医科大学附属第五医院肾脏内科,广东 广州 510799;3.暨南大学附属广州红十字会医院肾脏内科,广东 广州 510220)
糖尿病肾病(diabetic kidney disease,DKD)一直是导致慢性肾病和肾功能衰竭的主要原因。在过去的20年里,DKD的发病率和死亡率在世界范围内迅速上升[1]。随着肾脏的损伤,糖尿病患者经常会出现多种并发症,如视网膜病变、神经病变和心血管疾病,所有这些因素都会导致死亡的风险升高[2]。DKD除了给患者带来健康问题外,还会给社会带来沉重的负担。目前对DKD的发病机制的研究已大大增加,但引起DKD发生和发展的分子机制仍有待阐明。因此,寻找新发病机制和治疗靶点可能为DKD患者治疗提供新的方法。研究表明糖尿病肾病中肾小管病变在早期就已经出现,甚至早于肾小球病变,还有研究表明肾小管损伤要早于蛋白尿的出现[3]。肾小管损伤会影响肾小球滤过功能、导致氧化应激、缺氧、慢性炎症以及纤维化,从而推动糖尿病肾病的进展[4]。以上研究表明肾小管上皮细胞是治疗DKD的重要靶点。铁死亡(ferroptosis)是一种新型的非凋亡调节的细胞死亡,由脂质修复酶谷胱甘肽过氧化物酶4(GPX 4)调控,由严重的脂质过氧化所驱动,这依赖于活性氧(ROS)的产生和铁的超载[5]。虽然铁死亡的生理功能尚不清楚,但它与多种人类疾病的关系已得到证实,如铁死亡在缺血再灌注所致的急性肾损伤中起着重要作用,也是其他急性肾损伤模型的致病因素之一[6]。因此,调节肾小管上皮细胞铁死亡可能具有治疗DKD的潜力。环状RNA(CircRNA)是一类在真核细胞中具有发育/组织特异性表达的非编码RNA,通过连接3′端和5′端被环化。最近,有证据表明,circRNA在包括DKD在内的各种疾病的发生和发展过程中起着不可或缺的作用[7]。hsa_circ_0006370是一种新发现的circRNA,其表达和其是否通过调节肾小管上皮细胞铁死亡来参与DKD发生发展的作用尚未见报道。本研究通过分析hsa_circ_0006370在肾小管上皮细胞中的表达,研究其在高糖环境下对细胞铁死亡作用,寻找调控肾小管上皮细胞的铁死亡潜在靶点,以期为DKD的临床治疗策略提供重要线索。
1 材料与方法
1.1 主要材料
人近曲肾小管上皮细胞株(HK‑2细胞)购于中国科学院上海生命科学研究院细胞资源中心;DMEM培养液、D‑葡萄糖(2.5 mol/L)溶液、青‑链霉素溶液、磷酸盐缓冲液(PBS)和胎牛血清均购自美国GⅠBCO公司;铁诱导的细胞死亡激活剂Erastin购于美国Sigma公司;Trizol和Lipofectamine 2000试剂盒购于美国Ⅰnvitrogen公司;Prime Script RT reagent Kit和SYBR Green RealtimePCR试剂盒购自日本TaKaRa公司;MTS细胞增殖检测试剂盒购于美国Promega公司;hsa_circ_0006370干扰序列(si‑hsa_circ_0006370)和对照序列(si‑NC)均购于上海吉玛制药公司。细胞内ROS检测试剂盒、铁离子检测试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒、丙二醛(malondialdehyde,MDA)含量检测试剂盒、谷胱甘肽过氧化物酶(GSH‑Px)测定试剂盒、RⅠPA lysis buffer均购于上海碧云天生物公司;增强型化学发光试剂(electroche‐miluminescence,ECL)购自美国Sigma公司;抗人GPX4抗体、抗人xCT抗体、抗人FT抗体、抗人TFR抗体、抗人NRF2抗体、抗人HO‑1抗体和抗人GAPDH抗体购于美国Santa Cruz公司。
1.2 实验方法
1.2.1 HK‑2细胞培养 采用含有10%(φ)胎牛血清的DMEM培养液进行培养,添加1%青‑链霉素双抗溶液,然后置于37℃含5%(φ)CO2的培养箱中培养,待细胞长至对数生长期时用于后续实验。HK‑2细胞培养分为以下4组:(1)正常培养组:细胞在正常条件下培养;(2)PBS培养组:细胞在正常条件下培养同时添加与第(3)和(4)等体积的PBS;(3)高糖培养组:细胞在正常条件下培养同时添加1%的D‑葡萄糖(2.5 mol/L)溶液;(4)Erastin培养组:细胞在正常条件下培养同时添加1%的Erastin(100μmol/L)溶液。以上各组细胞培养24 h后,RT‑qPCR检测各组细胞中hsa_circ_0006370相对表达水平。
1.2.2 细胞转染 HK‑2细胞转染按照Lipo‐fectamine 2000转染试剂说明书操作,将hsa_circ_0006370干扰序列(si‑hsa_circ_0006370)和对照序列(si‑NC)转染进入HK‑2细胞。实验分为4组:(1)高糖+干扰对照组(高糖+si‑NC):高糖培养组细胞培养24 h后,转染si‑NC序列;(2)高糖+干扰hsa_circ_0006370组(高糖+si‑hsa_circ_0006370):高糖培养组细胞培养24 h后,转染si‑hsa_circ_0006370序列;(3)Erastin+干扰对照组(Erastin+si‑NC):Erastin培养组细胞培养24 h后,转染si‑NC序列;(4)Erastin+干扰hsa_circ_0006370组(Erastin+si‑hsa_circ_0006370):Erastin培养组细胞培养24 h后,转染si‑hsa_circ_0006370序列。以上各组细胞经37℃含5%CO2条件下培养12 h后,检测各组细胞中hsa_circ_0006370相对表达水平、细胞增殖水平、细胞ROS、LDH、MDA、GSH‑Px水平以及GPX4、xCT、FT、TFR、NRF2、HO‑1蛋白表达水平。
1.2.3 RT‑qPCR 分别收集各组经培养或转染后的HK‑2细胞,Trizol试剂抽提细胞内的总RNA,采用Prime Script RTreagent Kit将总RNA逆转录成cDNA,根据SYBR Green Realtime PCR试剂盒说明书配置qPCR体系进行qPCR,检测各组细胞中hsa_circ_0006370表达水平。以U6作为内参,根据2-ΔΔCt法计算各组细胞中hsa_circ_0006370相对表达水平。
1.2.4 MTS法检测细胞增殖 MTS法检测各组转染后的HK‑2细胞增殖,将上述培养的4组细胞:(1)高糖+si‑NC组、(2)高糖+si‑hsa_circ_0006370组、(3)Erastin+si‑NC组、(4)Erastin+si‑hsa_circ_0006370组细胞(1×104个/孔)接种至96孔板中,37℃含5%CO2的条件下培养7 d后,按照MTS检测试剂盒方法检测各细胞在490 nm波长下的吸光度(A),计算细胞生存率。细胞生成率=si‑hsa_circ_0006370组A/si‑NC组A×100%。
1.2.5 细胞内铁离子、ROS、LDH、MDA、GSH‑Px活性水平检测 将上述培养的4组细胞1×106个/孔接种至12孔板中,37℃含5%CO2的条件下培养12 h后,收集各组细胞,分别按照胞内铁离子检测试剂盒、ROS检测试剂盒、LDH活性检测试剂盒、MDA含量检测试剂盒、GSH‑Px测定试剂盒说明书操作,检测各组细胞内ROS、LDH、MDA、GSH‑Px活性水平。
1.2.6 Western blot将上述培养的4组细胞1×106个/孔接种至12孔板中,37℃含5%CO2条件下培养12 h后,收集各组细胞,先用RⅠPA裂解缓冲液裂解细胞,离心收集上清,测定蛋白质浓度。各组按等量(30μg)进行上样,SDS‑PAGE电泳分离蛋白,并将蛋白电转至PVDF膜上,室温封闭2 h后,分别加入抗人GPX4抗体、抗人xCT抗体、抗人FT抗体、抗人TFR抗体、抗人NRF2抗体、抗人HO‑1抗体、抗人GAPDH抗体,4℃孵育过夜。次日洗膜、室温孵育二抗2 h,经洗膜后化学发光ECL显影、曝光、成像。
1.2.7 统计学方法 所有实验数据采用SPSS 22.0软件进行统计分析,实验数据以表示,两组间比较采用t检验,多组比较采用单因素方差分析,然后两两比较采用LSD‑t检验。P<0.05为差异有统计学意义。
2 结果
2.1 高糖和Erastin处理对HK‑2细胞中hsa_circ_0006370表达的影响
和正常培养组相比,PBS培养组细胞中hsa_circ_0006370相对表达水平无明显差异(P>0.05),高糖培养组和Erastin培养组细胞中hsa_circ_0006370相对表达水平显著升高(P均<0.01);和PBS培养组相比,高糖培养组和Erastin培养组细胞中hsa_circ_0006370相对表达水平显著升高(P均<0.01)。见表1。
表1 RT‑qPCR检测高糖和Erastin处理后HK‑2细胞中hsa_circ_0006370表达水平Table 1 The expression level of hsa_circ_0006370 detected by RT‑qPCRin HK‑2 cells after treatment with high glu‐cose and Erastin(±s,n=3)

表1 RT‑qPCR检测高糖和Erastin处理后HK‑2细胞中hsa_circ_0006370表达水平Table 1 The expression level of hsa_circ_0006370 detected by RT‑qPCRin HK‑2 cells after treatment with high glu‐cose and Erastin(±s,n=3)
与正常培养组比较:*P<0.01;与加PBS培养组比较:#P<0.01。
?
2.2 干扰hsa_circ_0006370表达效果检测
高糖+si‑hsa_circ_0006370组细胞中hsa_circ_0006370相对表达水平显著低于高糖+si‑NC组(P<0.01);Erastin+si‑hsa_circ_0006370组细胞中hsa_circ_0006370相对表达水平显著低于Erastin+si‑NC组(P<0.01)。见表2。
表2 RT‑qPCR检测细胞中hsa_circ_0006370相对表达水平Table 2 The relative expression of hsa_circ_0006370 in cells detected by RT‑qPCR(±s,n=3)

表2 RT‑qPCR检测细胞中hsa_circ_0006370相对表达水平Table 2 The relative expression of hsa_circ_0006370 in cells detected by RT‑qPCR(±s,n=3)
与高糖处理si‑NC组比较:*P<0.01;与Erastin处理si‑NC组比较:#P<0.01。
?
2.3 干扰hsa_circ_0006370表达对细胞增殖以及细胞内铁离子、ROS、LDH、MDA、GSH‑Px活性水平的影响
与 高 糖+si‑NC组 相 比,高 糖+si‑hsa_circ_0006370组细胞的增殖能力显著增强(P<0.01),细胞内铁离子、ROS、LDH和MDA活性水平均显著降低,而GSH‑Px活性水平显著升高(P<0.01);与Eras‐tin+si‑NC组相比,Erastin+si‑hsa_circ_0006370组细胞的增殖能力显著增强(P<0.01),细胞内铁离子、ROS、LDH和MDA活性水平均显著降低,而GSH‑Px活性水平显著升高(P<0.01)。见表3。
表3 干扰hsa_circ_0006370表达对细胞增殖以及细胞内铁离子、ROS、LDH、MDA、GSH‑Px活性水平的影响Table 3 Effects of the interference of hsa_circ_0006370 on cell proliferation,intracellular Fe2+,ROS,LDH,MDA and the activity of GSH‑Px(±s,n=3)
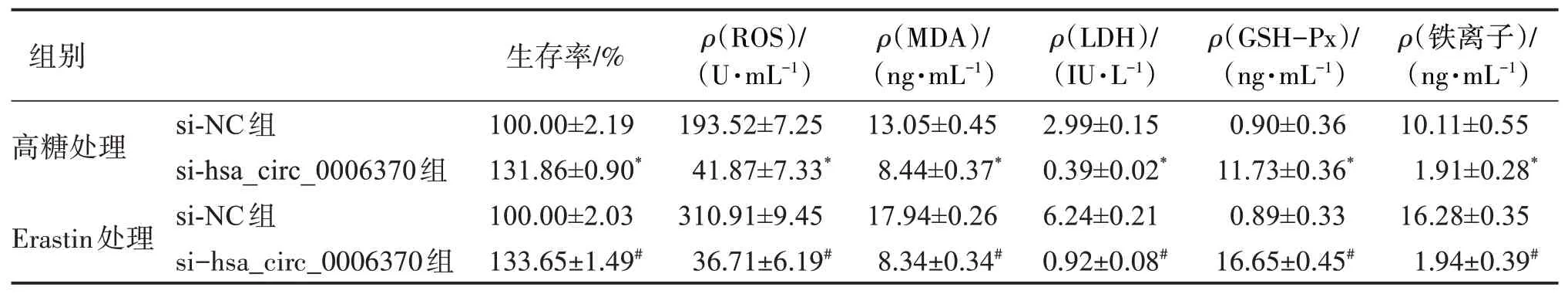
表3 干扰hsa_circ_0006370表达对细胞增殖以及细胞内铁离子、ROS、LDH、MDA、GSH‑Px活性水平的影响Table 3 Effects of the interference of hsa_circ_0006370 on cell proliferation,intracellular Fe2+,ROS,LDH,MDA and the activity of GSH‑Px(±s,n=3)
与高糖处理si‑NC组比较:*P<0.01;与Erastin处理si‑NC组比较:#P<0.01。
?
2.4 干扰hsa_circ_0006370表达对细胞内铁死亡标志和相关通路蛋白表达的影响
与 高 糖+si‑NC组 相 比,高 糖+si‑hsa_circ_0006370组细胞中的GPX4、胱氨酸/谷氨酸转运蛋白(cystine/glutamate antiporter system Xc‑,xCT)、铁蛋白(ferritin,FT)、相关蛋白核因子E2相关因子2(nuclear factor E2‑related factor‑2,NRF2)和血红素氧合酶1(hemeoxygenase‑1,HO‑1)蛋白表达水平明显上升,转铁蛋白受体(transferrin receptor,TFR)蛋白表达水平显著下降;与Erastin+si‑NC组相比,Erastin+si‑hsa_circ_0006370组 细 胞 中 的GPX4、xCT、FT、NRF2、HO‑1蛋白表达水平明显上升,TFR蛋白表达水平明显下降。见图1和表4。
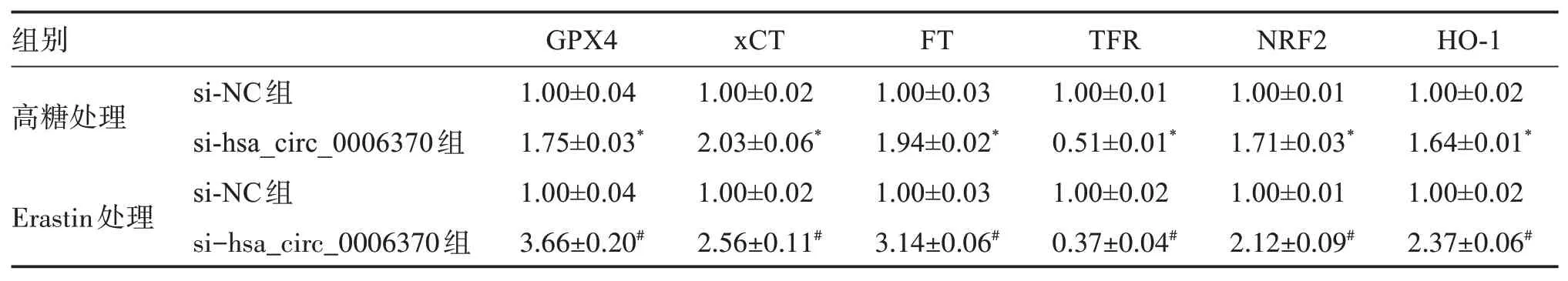
表4 干扰hsa_circ_0006370表达对细胞GPX4、xCT、FT、TFR、NRF2、HO‑1蛋白表达的影响Table 4 Effects of the interference of hsa_circ_0006370 on the expression of GPX4,xCT,FT,TFR,NRF2,and HO‑1(n=3)
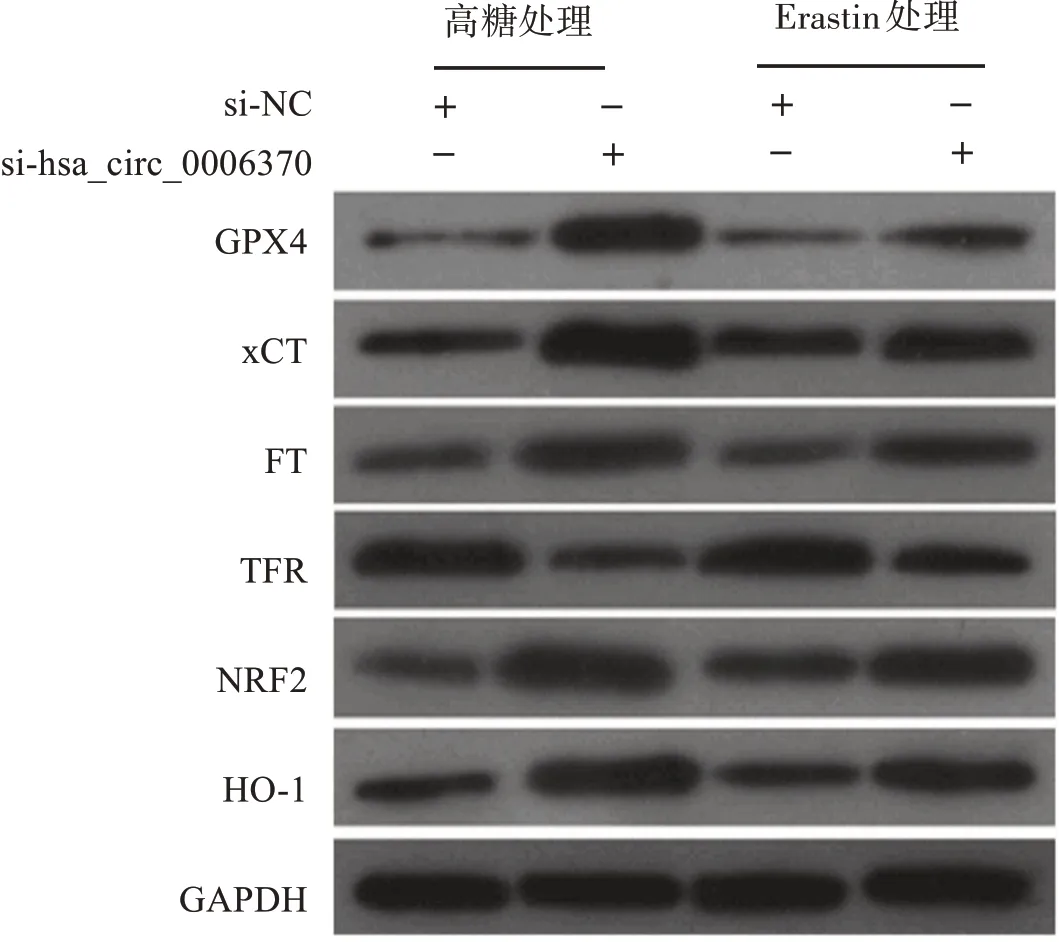
图1 Western blot检测各组细胞中GPX4、xCT、FT、TFR、NRF2、HO‑1蛋白表达Figure 1 The expressions of GPX4,xCT,FT,TFR,NRF2,and HO‑1ineach group detected by Western blot
3 讨论
DKD是目前最常见的终末期肾病病因,但DKD的具体机制尚不清楚。由于DKD的进展涉及到许多途径,因此单纯的血糖或血压控制不足以预防及治疗DKD。针对其各种危险因素采用的如血管紧张素转换酶抑制剂等各种药物无论是单独使用还是联合治疗均无法缓解或逆转DKD[8]。因此,糖尿病肾病的发病机制有待深入研究。
近年来,circRNAs引起了人们的广泛关注。circRNAs是一类由反向剪接产生的非编码RNAs,与线性非编码RNAs相比,circRNAs由于其闭环结构而具有更高的稳定性。越来越多的证据证实,cir‐cRNAs可能通过发挥非编码或编码RNA的作用而发挥不同的生物学作用。由于circRNAs比线性RNA更稳定,具有更长的半衰期和对RNase的抗性,它们可以作为线性RNA的竞争对手,在基因表达中发挥调节作用[9],同时也使其成为诊断性生物标记物和治疗靶点的潜在候选分子。近年来,大量的研究揭示了它们在人类各种疾病发生和发展过程中的独特表达特征和重要的生物学作用,如癌症[10]、心血管疾病[11]、肾病[12]。最近有一些关于异常表达的circRNAs在DKD中的研究,如Peng等[7]研究发现在高糖培养的肾脏系膜细胞和肾小管上皮细胞中,circ_010383的表达明显下调,circ_010383可以通过下调miR‑135a的表达促进DKD肾纤维化的发生。circ_0080425的表达与DKD的进展相关,对系膜细胞的增殖和纤维化有积极作用,其通过海绵化miR‑24‑3p和靶向成纤维细胞生长因子11抑制DKD细胞增殖和纤维化[13]。hsa_circ_0006370是一种新发现的circRNA,目前与其相关的研究报道较少。本研究发现在高糖培养的HK‑2细胞中hsa_circ_0006370表达水平显著升高,表明hsa_circ_0006370在高糖培养的HK‑2细胞中异常表达。Erastin作为细胞铁死亡的诱导剂,在添加有Erastin培养的HK‑2细胞中同样存在hsa_circ_0006370表达水平异常升高的现象,表明hsa_circ_0006370可能与DKD中调节肾小管上皮细胞铁死亡的机制有关。此外,本研究还发现在高糖和Erastin培养的HK‑2细胞中干扰hsa_circ_0006370表达,能够促进细胞的增殖,对细胞生长有保护作用,进一步证实hsa_circ_0006370在DKD病理进程中可能有调节肾小管上皮细胞铁死亡的作用。
铁死亡是一种新发现的由铁依赖性脂质过氧化引起的调节性细胞死亡,它在遗传学、生物化学和形态学上不同于其他调节性细胞死亡[14]。近年来,铁死亡被发现参与了包括DKD在内许多疾病的发展过程[15‑16]。氧化还原性铁的积累、抗氧化能力的丧失和含有多不饱和脂肪酸的磷脂酶的过氧化都是铁死亡的特征性变化,这些指标可以用来评估铁死亡的程度[17]。ROS积聚是导致铁死亡的主要原因,ROS诱导含磷脂细胞膜发生脂质过氧化,产生MDA,直接引起细胞毒性,进而诱发铁死亡[18]。本研究发现在高糖和Erastin培养的HK‑2细胞中干扰hsa_circ_0006370表达,能够降低细胞内铁离子、ROS、LDH和MDA积聚,同时增加GSH‑Px水平,从而减轻其对细胞的毒性。GPX4和SLC7A11(xCT的催化亚基)被认为是铁死亡的重要生物标志物,因为缺乏它们可能导致大量ROS产生和GSH生物合成功能障碍[19]。TFR‐1和FTH‐1是参与铁代谢稳态的2个关键基因,与铁死亡的发生密切相关[20]。NRF2在转录水平上调节与铁储存和转运相关,同时,NRF2通过调节一系列信号蛋白和酶的表达来维持细胞氧化还原稳态和氧化介质的平衡,在抗氧化应激中发挥重要的调节作用[21]。HO‑1可由多种线索诱导,包括炎症介质、氧化剂,是对细胞氧化还原状态作出反应的关键调节物[22]。本研究发现在高糖和Erastin培养的HK‑2细胞中干扰hsa_circ_0006370表达能够增加GPX4、xCT、FTH、NRF2和HO‑1蛋白表达水平,抑制TFR蛋白表达水平,进一步证实hsa_circ_0006370在高糖环境中能够促进肾小管上皮细胞发生铁死亡。本研究虽然证实了hsa_circ_0006370在高糖环境中能够促进肾小管上皮细胞发生铁死亡,但是其具体的分子调控机制仍需进行深入的研究。
综上所述,本研究证实了hsa_circ_0006370在高糖培养的HK‑2细胞中高表达,干扰hsa_circ_0006370表达显著促进细胞的增殖、减轻细胞内ROS等活性物质产生,提高抗氧化能力,抑制细胞发生铁死亡。本研究为DKD的诊治提供了新的潜在作用靶点,可能具有较好的应用前景。
