缺素培养对杜仲幼苗生长及橡胶生物合成的影响*
2022-02-19毛永洁赵德刚
毛永洁,赵德刚
(1.贵州大学 农业生物工程研究院/生命科学学院/山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025;2.贵州省农业科学院 贵州省植物保育技术应用工程研究中心,贵州 贵阳 550006)
杜仲(EucommiaulmoidesOliver)又名胶木,是杜仲科(Eucommiaceae)杜仲属(Eucommia)植物,在其叶、茎和果皮中能产生不溶于水的天然高分子化合物——杜仲胶(TPI)[1-2],因其独特的理化性质而被高度重视。研究发现杜仲胶的合成前体是异戊烯基焦磷酸(Isopentenyl diphosphate,IPP)[3],IPP与其同分异构体生成牻牛儿基焦磷酸(Geranyl diphosphate,GPP),进一步添加IPP生成法尼基焦磷酸(Farnesyl diphosphate,FPP)。FPP被认为是橡胶生物合成的起始物[4],由法尼基焦磷酸合酶(Farnesyl diphosphate synthase,FPS/FPPS)催化IPP和GPP共同合成橡胶。FPS是产胶植物直接参与橡胶生物合成的关键酶[5],Mn2+或Mg2+作为酶促反应的必需辅助因子[6],通过调节橡胶转移酶活性来影响IPP多聚化反应[7]。一些二价阳离子被发现具有激活甜椒FPS的能力[8],Mg2+或Mn2+存在时,FPS活性最大。在银胶菊(PartheniumhysterophorusL.)中,橡胶转移酶对Mg2+浓度的依赖与巴西橡胶树橡胶转移酶类似,但在程度上没有那么明显[9]。在巴西橡胶树(Heveabrasiliensis)中,金属离子还会影响橡胶的分子量[4]。在杜仲的生长发育和杜仲胶生物合成中,必需元素是生长发育的基础营养物质,也有可能是杜仲胶合成的相关酶类辅基。
本实验室通过对杜仲组织培养再生体系优化为杜仲功能基因的研究提供了技术支持[10],克隆了橡胶合成相关基因[11],但在缺素对杜仲幼苗及橡胶合成影响方面的研究较少。因此,本研究以Hoaglang营养液基本配方配制缺乏某一种必需元素的培养液,用于培养杜仲幼苗,分析杜仲幼苗的生长发育特征以及对杜仲胶含量及分子量的影响,为杜仲栽培管理提供理论依据。
1 材料与方法
1.1 试验材料
试验用种子均为购自山西运城惠民苗木种子的‘华仲15号’,为2020年10月采集的当年生种子。
1.2 试验方法
1.2.1 试验用杜仲幼苗的培养
将种子浸泡过夜,用10%NaClO4消毒20 min,用无菌水清洗4~5次,种子两侧切掉约1 mm,放于铺满湿润无菌纸的水培盆(245 mm×375 mm×93 mm)中培养,用保鲜膜封住盆口防止水分蒸发。参照杜仲适宜生长条件[12],将上述种子放置于人工气候室中,设置条件为温度(22±2)℃、光周期16 L/8 D、湿度80%、光强2 000 Lx。每盆约300颗种子,预准备30余盆,种子密度约3 cm2/颗。待子叶全展,选择一叶一心且生长一致的杜仲幼苗作为缺素培养试验用苗。
1.2.2 营养液的配制
为防止沉淀,预先将各试剂配成一定倍数的浓缩液,现用现配,配方参照霍格兰(Hoagland)营养液配方。以下用CK表示霍格兰全营养液,每一种缺素营养液前以“-”表示以霍格兰营养液为基础营养液并缺少该元素(表1)。
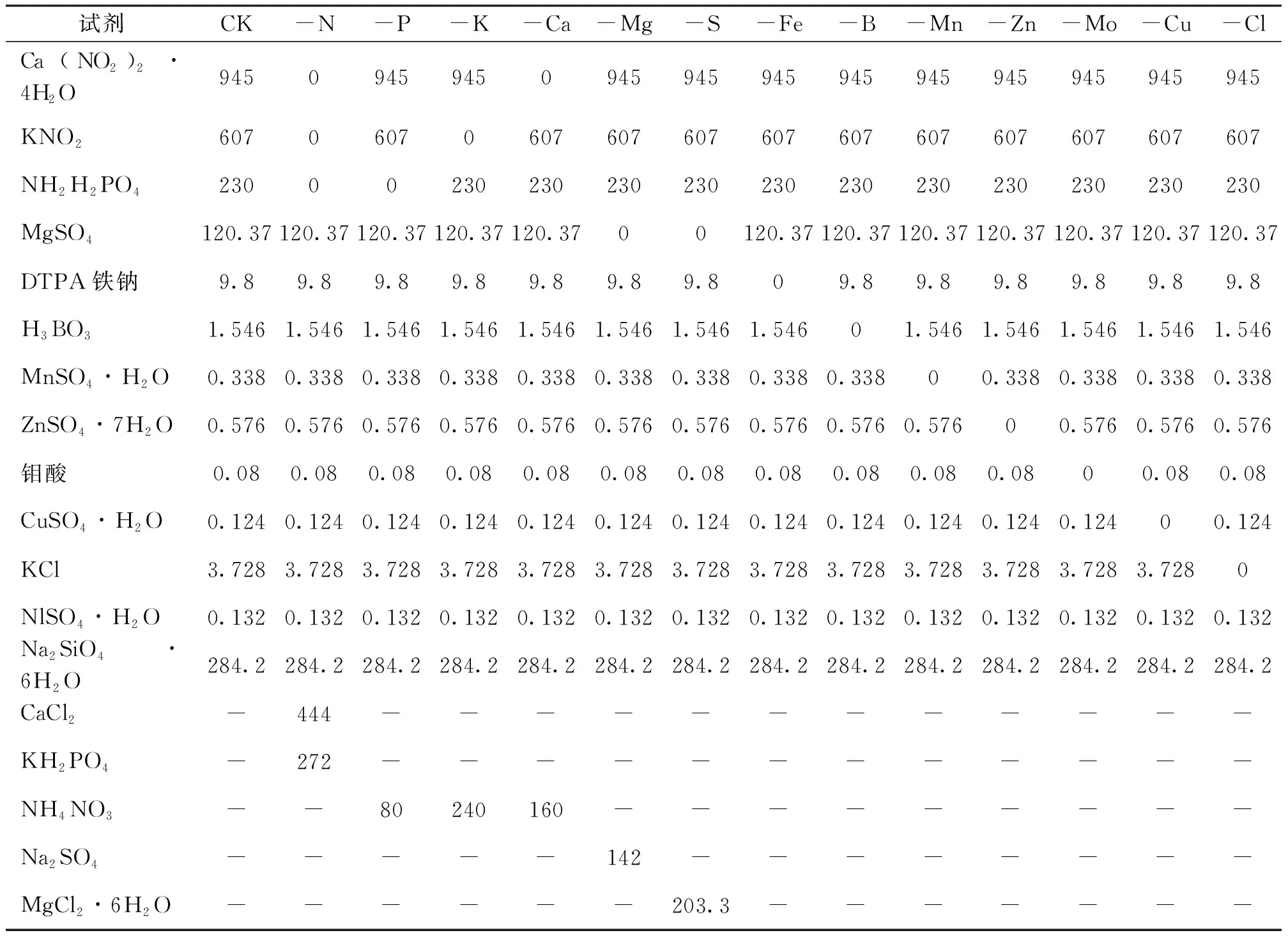
表1 缺素及全营养液配方Tab.1 Nutrient deficiency and total nutrient solution formula mg/L
1.2.3 杜仲幼苗形态测定
测量叶片长和宽 幼苗在缺素溶液中培养40 d后,每组处理随机取10株,测量自下而上第3片叶(即第一片真叶)的长和宽,叶长取叶尖到叶基之间的长度,叶宽量取叶片最宽部分。
测量根长茎长 用刻度尺和细线测量茎干长度和主根长度;分别测量地上、地下部分鲜重以计算根冠比。每组缺素处理选取10株幼苗,用滤纸吸干其根部的水分,分别称取其地上部分(顶叶到茎的部分)和地下部分(根)的鲜重,计算其均重,根冠比=地下部分鲜重/地上部分鲜重[13]。
1.2.4 测定色氨酸转氨酶活性
参照上海酶联生物有限公司的植物色氨酸转氨酶(TAA1)试剂盒的提取方法,任取9株杜仲幼苗测定整株色氨酸转氨酶TAA1活性。以标准物浓度为横坐标,OD值为纵坐标,用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度乘以稀释倍数即为样品实际浓度。
1.2.5 杜仲幼苗橡胶含量及其分子量测定
杜仲胶的提取及测定参照前人的方法做适当修改[14-15],取分别用全营养液和13种缺素营养液培养40 d后的杜仲幼苗各50株,设置3次重复,分别对叶、茎、根3个部位进行烘干称重提胶,并提取14种杜仲幼苗总含胶量,将提取所得的不同部位的胶用于分子排阻色谱仪测定分子量。
2 结果与分析
2.1 缺素培养对杜仲幼苗生长发育的影响
2.1.1 缺素培养对杜仲幼苗根和茎生长的影响
研究表明,必需元素的每一种元素缺乏都会对杜仲幼苗根和茎的生长产生影响。全营养条件下培养40 d,在13种必需元素中,缺Mg对茎长和根长影响最小,茎长比全营养液幼苗减少8.86%,差异达显著水平(P<0.05),根长减少29.14%,差异均达极显著水平(P<0.01);缺大量元素Ca对幼苗茎和根生长影响最大,分别比全营养液幼苗减少23.44%和41.84%,差异均达到极显著水平(P<0.01);缺乏微量元素Zn对杜仲幼苗茎和根生长影响最大,分别比全营养液幼苗的茎和根长减少23.23%和36.10%,差异均达极显著水平(P<0.01),见表2。

表2 缺素处理对杜仲幼苗茎和根生长的影响Tab.2 The effect of nutrient deficiency on the stem and root growth of E.ulmoides seedlings
2.1.2 缺素培养对杜仲幼苗叶片长和宽的影响
缺素处理下杜仲幼苗叶片长和宽均减小(表3),缺N时叶片长仅为20.7 mm,减少17.86%,差异达极显著水平(P<0.01),叶宽为9.4 mm,较全营养液培养植株叶片减小11.32%,未达到显著差异;缺Mg时对幼苗叶片生长影响最大,叶片长仅为14.3 mm,叶宽为5.8 mm,比全营养液培养植株叶片分别减小43.25%,44.53%,差异均达到极显著水平(P<0.01)。

表3 缺素处理对杜仲幼苗叶片生长的影响Tab.3 The effect of nutrient deficiency on the leaf growth of E.ulmoides seedlings
2.1.3 缺素培养对杜仲幼苗根冠比的影响
在对杜仲幼苗分别进行13种必需元素缺素培养40 d发现,缺素导致杜仲幼苗地上部分鲜重减少,缺P、缺Ca、缺Mg、缺B培养时地上鲜重最低,为0.14 g,比全营养液培养减少22.22%,差异达极显著水平(P<0.01),见表4。
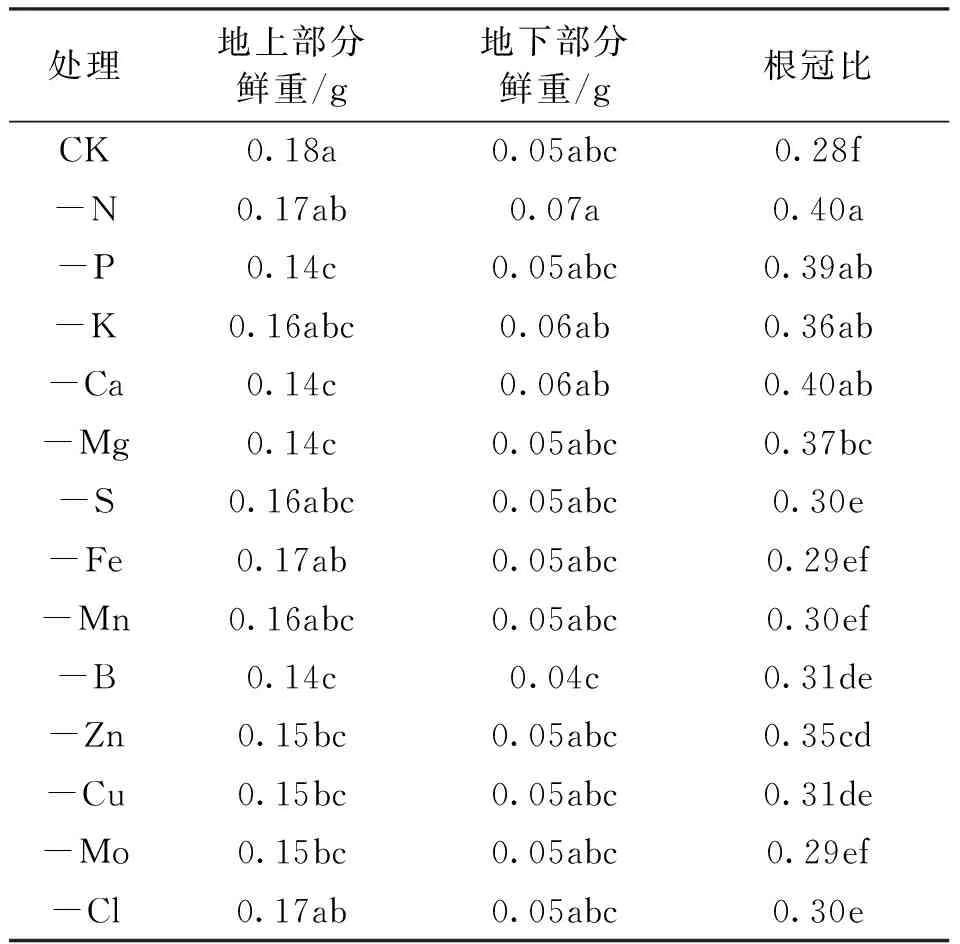
表4 缺素处理对杜仲幼苗地上部分和地下部分生长的影响Tab.4 The effect of nutrient deficiency on the growth of the aboveground and underground parts of E.ulmoides seedlings
缺Mg、缺S、缺Fe、缺Mn、缺B、缺Cu、缺Mo培养的幼苗均与全营养液培养的幼苗地下部分鲜重差异达显著水平(P<0.05)。对照根冠比为0.28,缺素培养下幼苗的根冠比均较全营养液培养幼苗根冠比提高,除缺Fe、缺Mn、缺Mo、缺Cl培养时幼苗根冠比与全营养液培养的幼苗根冠比差异达显著水平(P<0.05)外,其余缺素培养下幼苗的根冠比均与全营养液培养的幼苗根冠比差异达到极显著水平(P<0.01)。缺N或缺Ca培养时幼苗根冠比最高,说明N元素与Ca元素的缺乏对茎与叶的生长起到严重抑制作用,使地上部分与地下部分生长不协调从而使根冠比提高。
2.2 杜仲幼苗缺素症状
杜仲幼苗在缺N营养液中培养第8 d时开始缺绿,真叶从叶尖沿叶脉向基部出现缺绿症状,有的缺绿出现在单侧叶边缘,呈灼烧状,叶片先变黄后变白,在缺素第14 d即整叶白化。叶尖发白后逐渐变暗灰,最后叶尖焦枯变黑(图1B和图2B)。缺P营养液培养的杜仲幼苗叶片从中部边缘缺绿,向叶脉和叶基部扩展,植株生长矮小,叶小,叶边缘皱缩(图1C和图2C)。杜仲幼苗缺K症状在培养的第13 d时出现,从叶中部边缘开始缺绿,逐渐向内扩展,叶片表面变皱缩;也有的从叶尖开始变白,逐渐向叶基部扩展。整叶白化后,叶尖焦枯(图1D和图2D)。杜仲幼苗缺Ca症状出现较晚,嫩叶生长小,叶片中部及基部变黄,植株矮小(图1E和图2E)。杜仲幼苗缺Mg培养到第18 d时生长点坏死,叶片窄小,已长出的新叶从叶尖开始枯萎,叶片卷曲,缺绿从叶尖开始沿叶脉逐渐向基部扩展,叶尖狭长(图1F和图2F)。杜仲缺S症状出现较晚,在缺素培养第27 d后出现缺素症状,叶片畸形,叶基发黄(图1G和图2G)。杜仲幼苗缺Fe培养时,从叶尖或叶边缘开始缺绿,向叶基部扩展直至全叶白化,有的叶片边缘出现坏死斑点直至全叶焦枯(图1H和图2H)。杜仲幼苗在缺微量元素Mn时,叶生长不对称,叶小,培养一段时间后叶尖出现黑点,植株矮小,叶脉发黄,叶片皱缩,叶尖焦枯(图1I和图2I)。缺B培养的杜仲幼苗叶片出现黑斑点,叶小,嫩叶变黑焦枯死亡(图1J和图2J)。缺Zn培养的幼苗矮小,叶片窄细狭长,叶片出现坏死斑点,叶色暗沉,卷曲,或叶尖焦枯(图1K和图2K)。杜仲幼苗缺Cu培养的症状出现较晚,在缺素培养第32 d后才出现缺素症状,叶尖出现黑斑点,叶色较深,叶小,叶面不平整(图1L和图2L)。缺Mo杜仲植株叶片畸形,缺绿呈灼烧斑状从叶尖逐渐向基部扩展(见图1M和图2M)。杜仲缺Cl培养时从叶尖开始缺绿逐渐向基部扩展,叶片卷曲畸形,新叶纵向弯曲,叶不对称且小(图1N和图2N)。

图1 体视显微镜下杜仲缺素叶片注:A为CK,B为-N,C为-P,D为-K,E为-Ca,F为-Mg,G为-S,H为-Fe,I为-Mn,J为-B,K为-Zn,L为-Cu,M为-Mo,N为-Cl,Bar=1 cm。下同。Fig.1 E.ulmoides leaves under a stereo microscope

图2 杜仲幼苗缺乏必需元素形态Fig.2 E.ulmoides seedlings lack essential element morphology
2.3 缺素培养对杜仲幼苗生长素合成关键酶活性的影响
在13种必需元素下,每一种缺素营养液培养的杜仲幼苗生长素合成关键酶——色氨酸氨基转移酶(TAA1)活性极显著低于全营养液植株(P<0.01)(图3),所有缺素处理的TAA1酶活浓度均低于对照。全营养液培养下植株的TAA1活性为0.88 U/g,缺Mn营养液培养的杜仲植株TAA1酶活性最低,为0.39 U/g,较全营养液培养的植株减少55.68%。另外,缺P和缺Zn时TAA1活性也较低,分别为0.42 U/g和0.44 U/g,较全营养液培养植株降低52.28%、50.00%。可能是Mn、P、Zn的缺少影响了色氨酸氨基转移酶的合成,使其活性降低,Zn2+还是色氨酸氨基转移酶的辅基,对酶活性至关重要。

图3 缺素处理对杜仲幼苗TAA1活性的影响注:**表示在α=0.01水平差异显著;*表示在α=0.05水平差异显著。Fig.3 Effects of different nutrient deficiency on water content of E.ulmoides seedlings
2.4 缺素培养对杜仲幼苗橡胶含量及分子量的影响
研究结果表明,杜仲幼苗缺少大量元素N、K、Ca、Mg、S以及微量元素Mn、B、Mo时其含胶量均有不同程度的减小。缺S营养液培养植株含胶量减少最多,为0.10‰,比全营养液培养的植株下降95.88%;缺Ca营养液培养的杜仲幼苗叶片含胶量减少最多,为0.01‰,比全营养液培养的植株下降99.42%;缺K营养液培养的杜仲幼苗幼茎含胶量减少最多,为0.01‰,比全营养液培养的植株下降97.06%;缺Mn营养液培养的杜仲幼苗根部含胶量减少最多,为0.01‰,比全营养液培养的植株下降95.45%(表5)。
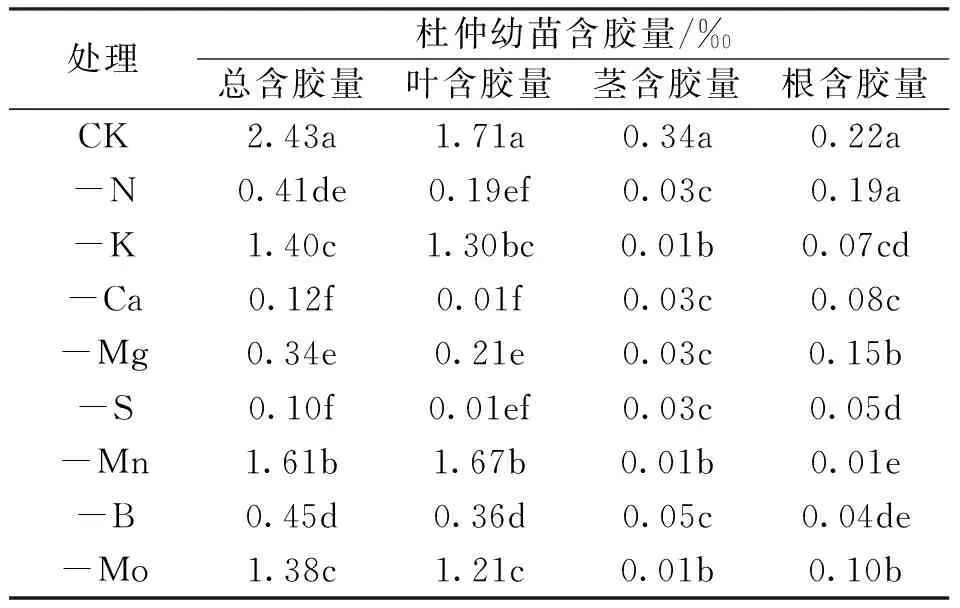
表5 缺素处理对杜仲幼苗含胶量的影响Tab.5 The effect of nutrient deficiency on the gum content of E.ulmoides seedlings
杜仲幼苗缺大量元素K以及微量元素Fe、Mn、B、Zn、Cu、Cl时,杜仲胶分子量出现不同程度的减小,全营养液培养的杜仲幼苗叶、茎、根中橡胶的相对分子量分别为73.56×104、10.36×106、70.58×105Da;缺Mn时叶片中橡胶分子量最小,为0.10×104Da,下降99.86%;缺Fe时叶片橡胶分子量下降相对较少,为24.5×104Da,比对照下降66.69%。缺B时幼茎中橡胶分子量减小最大,为854 Da,下降99.99%;缺Fe时幼茎中橡胶分子量下降较小,为5.13×104Da,下降99.50%。缺B时根部分子量下降最大,为30.00×102Da,也下降99.96%,其他缺素植株橡胶分子量均有不同程度下降(表6)。

表6 缺素处理对杜仲幼苗橡胶分子量的影响Tab.6 The effect of nutrient deficiency on the rubber molecular weight of E.ulmoides seedlings
3 讨论与结论
通过对13种必需元素分别缺素培养的缺素症状和橡胶生物合成进行分析,发现缺素处理影响杜仲幼苗的生长发育和形态,使植株生长受到抑制,变矮小,叶片减小,这可能与生长素合成的关键酶活性减小有关。缺素处理还使其中几种缺素培养下的杜仲幼苗的胶含量或橡胶分子量降低。
在缺N培养14 d后杜仲幼苗整叶白化,这是由于叶绿素合成减少或光系统中现有叶绿素结合蛋白的分解,使得黄化病在整个叶片中传播均匀[16]。缺N时使根冠比提高,是由缺N对植株地上部分生物量的抑制大于对地下生物量的抑制导致的,这与其他植物缺N植株表现特征的结果一致[17-18],而缺Fe时杜仲幼苗全叶黄白化较缺N培养下速度更慢,并呈现叶片由上而下白化,叶尖最后焦枯。P是植物细胞内重要化合物核酸、磷脂、辅酶、ATP等物质的必需组分[19-20]。杜仲幼苗缺P时出现叶片暗绿、皱缩并伴有边缘白化出现,这些缺P症状与其他植物的相同[20-21]。与油菜(BrassicachinensisL.)缺P时由于糖分运输受阻,叶片积累大量糖分,有利于花色素苷的形成而叶片变红不同[22],在缺P营养液中培养40 d的杜仲幼苗叶片暂未出现发红症状,这可能是由于缺素培养时间不够。K元素主要集中在植物生命最活跃的部位,如生长点、幼叶、形成层的幼嫩组织。杜仲幼苗在缺K时表现出叶面皱缩,弯曲不平整,是缺K的显著特征[23-24]。Mn在植物体中作为酶的辅助因子参与呼吸作用、光合作用中水光解等生理生化过程[19],缺Mn时杜仲幼苗叶尖变黑坏死,色淡,叶脉变黄,这些缺Mn症状与‘南丰蜜橘’(Citrusreticulata‘Kinokuni’)、玉米(ZeamaysL.)缺Mn时相同[25-26]。
杜仲胶是在含胶细胞中合成[1],生长素对细胞分裂、分化以及伸长等均有调控作用,可作为细胞增殖的信号决定器官的大少和形状。吲哚-3-丙酮酸途径是植物生长素合成的主要途径之一,色氨酸转氨酶(tryptophan aminotransferase,TAA)是催化生长素合成的关键酶[27]。IAA的合成前体——色氨酸的合成需要锌[28],缺锌时导致植物体内生长素合成锐减;Mn能促进吲哚乙酸加速氧化,缺锰将导致IAA加快分解,阻碍植物体内的IAA合成及极性运输[29]。杜仲幼苗缺Mn后,生长素合成关键酶TAA1活性是所有缺素植株中最低,缺Mn时TAA1活性降低,影响生长素合成。此外,有研究证实,生长素促进植物生物量的积累[30],当植物必需营养元素缺乏时,生物量和产量均受到较大影响[31-32]。缺素处理下杜仲幼苗的正常生长受到影响,主要表现为叶小和植株矮化,必需元素缺乏时,杜仲植株地上部分受抑制更加严重,使根冠比有所提高;缺N、缺K、缺Ca、缺Mg、缺S、缺Mn、缺B、缺Mo下培养的杜仲植株中橡胶含量均明显减少,叶、茎、根含胶量减少最多的分别是缺Ca、缺K、缺Mn营养液培养的植株。研究发现EuREF1表达量越高,橡胶分子量越大[11]。缺K、缺Fe、缺Mn、缺B、缺Zn、缺Cu、缺Cl时培养的杜仲幼苗,其杜仲胶分子量均较全营养液培养的明显减小,尤其是缺Mn时叶片中杜仲胶分子量最小;而缺B时茎与根中橡胶分子量最小,其中的内在机理还有待深入研究。
