棉花色素腺体发育相关基因GhERF105-like的克隆与表达分析
2022-02-15钱玉源王广恩权月伟崔淑芳米换房李俊兰
张 曦,钱玉源,王广恩,刘 祎,权月伟,崔淑芳,米换房,李俊兰
(1.河北省农林科学院 棉花研究所,农业部黄淮海半干旱区棉花生物学与遗传育种重点实验室,国家棉花改良中心河北分中心,河北 石家庄 050051;2.邯郸市农业科学院,河北 邯郸 056001)
棉花是关系国计民生重要的经济作物。棉花纤维是重要的纺织工业原料,棉籽油、棉籽蛋白、棉籽壳等棉副产品在食品、养殖、工业等领域具有巨大应用潜力[1]。但由于棉花根、茎、叶、花、种子等器官中含有棉酚等毒性物质,能够对血管、神经、内脏及生殖系统等造成损害,严重限制了棉副产品的综合利用[2]。棉花色素腺体(Pigment gland)又称棉酚腺体,是贮藏棉酚及其衍生物质的细胞间隙[3]。棉酚等酚醌类物质由色素腺体中的分泌细胞产生[4]。通常棉酚含量与棉花色腺体数量正相关[5]。敲除色素腺体形成相关基因可显著降低棉酚含量[6-10]。棉花色素腺体也是选育低酚棉品种的重要指示性状[11]。因此,发掘和利用棉花色素腺体发育相关基因,解析其对腺体发育和棉酚合成的调控机制,可以为高效开展低酚棉育种提供基因资源和理论依据。
研究表明,棉花色素腺体形成主要由gl1~gl6基因位点控制,一些基因位点还存在相应的复等位基因[12]。gl1位点控制下胚轴、茎秆、叶柄和棉铃无腺体性状。Zang等[13]图位克隆了gl1位点候选基因GoSPGF。GoSPGF编码1个GRAS(GAI-RGA-and-SCR)转录因子,沉默该基因后植株茎秆无腺体、棉酚含量显著降低。gl2、gl3以及Gl2e位点控制植株各部位无腺体性状[14]。Ma等[6]和Cheng等[15]分别精细定位了显性无腺体基因Gl2e,筛选到1个bHLH-MYC转录因子在有腺体和无腺体材料间显著差异表达。Ma等[6]克隆了该基因,命名为GoPGF(Gossypium pigment gland formation gene)。沉默GoPGF基因后植株表现全株无腺体。在gl2gl3突变体中,GoPGF基因发生单核苷酸突变,造成翻译提前终止,植株呈隐性无腺体表型。GoPGF在A亚组中的同源基因CGF3(Cotton Gland Formation 3)编码区存在1个转座子插入突变,在D亚组中同源基因的启动子区存在大量变异[7]。在子叶色素腺体延缓发生的比克氏棉(G.bickiiProkh)中,GoPGF基因也与腺体形成相关[16]。除GoPGF和GoSPGF外,还发现一些腺体发育相关基因在不同程度上影响棉花腺体形成及棉酚代谢。澳洲棉(G.australe)GRAS蛋白基因GauGRAS1影响茎和叶柄中色素腺体形成及棉酚合成[9]。MYB转录因子CGP1(Cotton Gland Pigmentation 1)在色素腺体中特异表达。敲除CGP1基因植株呈现类似无腺体表型,但CGP1并不影响腺体结构和腺体密度,而是影响棉酚合成与腺体中的色素沉积。CGP1可与GoPGF互作形成异二聚体,进而调控棉花棉酚合成及其他代谢[8]。CGF1编码1个bHLH转录因子,沉默CGF1基因导致植株色素腺体数量减少78%。CGF2基因编码NAC转录因子,沉默CGF2影响色素密度、腺体结构及腺体发育。沉默CGF1、CGF2及CGF3基因均可显著降低植株棉酚含量[7]。此外,一些基因如GhWD40[17]、RanBP2[18]、GhNAC201[19]等,在腺体发育过程中或不同腺体类型棉花间显著差异表达,可能与棉花色调腺体形成或棉酚合成密切相关。
APETALA2/ethylene response factor(AP2/ERF)转录因子存在于所有植物中,参与植物营养生长、生殖生长、生物和非生物胁迫应答等生命活动[20]。研究发现,AP2/ERF基因在有腺体和无腺体棉间或色素腺体发育过程中显著差异表达,暗示AP2/ERF转录因子在棉花色素腺体发育或棉酚代谢过程中也发挥重要作用[6-8,21-22]。姜鹏飞等[23]对有腺体棉Z12及其隐性无腺体近等基因系Z12YW的幼嫩叶片进行转录组测序,筛选到13个差异表达转录因子,其中7个为AP2/ERF转录因子。Wu等[10]克隆1个在有腺体和无腺体近等基因系间显著差异表达的AP2/ERF家族基因GhERF105(GH_A12G2166),沉默GhERF105后新生叶片叶脉的腺体数量减少,新生茎部仍密生腺体。叶片棉酚含量水平显著降低。河北省农林科学院棉花研究所品种资源研究室对有腺体棉中棉所12和无腺体棉中棉所12显性无腺体幼胚进行转录组测序,筛选到1个显著差异表达的AP2/ERF转录因子(Gh_A12G1784),该基因在其他不同腺体类型棉花材料间也显著差异表达[7-8]。
本研究克隆了Gh_A12G1784基因,命名为GhERF105-like(GenBank登录号:MZ239205),并对其基因序列及表达模式进行了分析,旨在为探析AP2/ERF转录因子在棉花色素腺体发育中的生物学功能提供数据基础,为开展低酚棉分子育种提供候选基因。
1 材料和方法
1.1 植物材料与处理
有色素腺体棉花品种中棉所12(中12)、辽棉7号、邯5158及无色素腺体棉花品种/系中棉所12显性无腺体(中12显无)、辽棉7号显性无腺体(辽7显无)和新陆中1号由中国农业科学院棉花研究所提供;无色素腺体棉花品种邯无198由邯郸市农业科学院提供。
中12和中12显无在大田种植,常规管理。挂牌标记自交时间,分别取16,26,35 DPA(Days post anthesis)幼胚,液氮速冻,-80 ℃保存,用于验证GhERF105-like在2个材料幼胚发育过程中的表达变化。
所有供试有腺体和无腺体棉品种/系在光照培养室中用营养钵土培至第2片真叶完全展开时取叶片,液氮速冻,-80 ℃保存,用于分析基因在有腺体和无腺体棉间表达水平的差异。
中12和中12显无分别在种子萌发期、苗期和开花期取样,液氮速冻,-80 ℃保存,用于分析基因的时空表达模式。种子萌发期:种子胚根长约1 cm左右时剥去棉籽壳,取整粒棉籽。苗期:用霍格兰营养液种植水培苗,在第2片真叶完全展开时分别取子叶、根、茎及叶片。开花期:取大田种植棉花的当天盛开花和长约1 cm的幼蕾。
中12在光照培养室中用营养钵培养至第2片真叶完全展开时分别喷施脱落酸(Abscisic acid,ABA,100 μmol/L)、茉莉酸甲酯(Methyl jasmonate,MeJA,400 μmol/L)和油菜素内酯(Brassinosteroid,BR,1 μmol/L),于处理后0,3,6 h分别取叶片;乙烯利(400 mg/L)处理0,3,6,9,12,24 h分别取叶片。中12水培至第2片真叶完全展开时分别用含200 mmol/L NaCl或20% PEG-6000的营养液处理幼苗,于处理0,3,6,9 h分别取叶片。所有样品液氮速冻,-80 ℃保存,用于分析基因的表达变化。
1.2 棉花总RNA提取和cDNA第一链合成
使用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技(北京)有限公司)提取样品总RNA,琼脂糖凝胶电泳检测其质量,-80 ℃保存备用。使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa)合成cDNA第一链,-20 ℃保存备用。
1.3 基因表达分析
用NCBI Primer-BLAST工具(https://www.ncbi.nlm.nih.gov/)设计GhERF105-like的荧光定量PCR引物(qGhERF105-like-F:5′-CATGGAAACTCCA
CCACCCT-3′和qGhERF105-like-R:5′-AACCGGGTTT
GGGCTTATGT-3′),以Histone3(qHiston3F:5′-CGGT
GGTGTGAAGAAGCCTCAT-3′和qHiston3R:5′-AATT
TCACGAACAAGCCTCTGGAA-3′)[6]为内参基因。qRT-PCR使用2×Sybr Green qPCR Mix(北京艾德莱生物科技有限公司),反应体系及反应参数参照试剂盒说明书。每个样品3次重复,用2-ΔΔCt法计算基因相对表达量。
1.4 基因序列克隆
根据TM-1(NAU-NBI_v1.1)序列,使用NCBI Primer-BLAST工具设计克隆引物(fGhERF105-like-F:5′-CACCACGCTCCCCAATTTCCACT-3′和fGhERF105-like-R:5′-GCTTAGGCTTTAGGCATCCCATC
C-3′)。以中12叶片cDNA第一链为模板进行PCR扩增。PCR反应体系:cDNA模板1 μL,正反向引物(10 μmol/L)各1 μL,10×LA PCR Buffer Ⅱ(Mg2+plus) 5 μL,2.5 mmol/L dNTP Mixture 8 μL,5 U/μL TaKaRa LA Taq 0.5 μL,补充ddH2O至总体积50 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃总延伸10 min。PCR产物与pGEM-T Easy载体(Promega)连接后转化大肠杆菌DH5α菌株。阳性克隆送苏州金唯智生物科技有限公司测序。
1.5 序列生物信息学分析
将获得的GhERF105-like序列在GenBank数据库中进行BlastX比对,利用MEGA 7.0比对GhERF105-like同源蛋白序列和构建系统进化树。使用在线网站分析GhERF105-like蛋白理化性质(http://www.expasy.org/tools/protparam.html)、二级结构(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)、三级结构(http://www.sbg.bio.ic.ac.uk/phyre2/html/)、蛋白功能域(http://smart.embl-heidelberg.de/)、蛋白磷酸化位点(http://www.cbs.dtu.dk/services/NetPhos/)及蛋白氨基酸序列的保守基序(http://meme-suite.org)等。
2 结果与分析
2.1 GhERF105-like在有腺体和无腺体棉花间的表达分析
在有腺体棉幼胚中,色素腺体在14~20 DPA开始发育[7,24]。GhERF105-like在无腺体棉中棉所12显性无腺体(中12显无)幼胚中表达量极低,在幼胚发育不同时期差异不显著;在有腺体棉中棉所12(中12)的16,26,35 DPA幼胚中表达量逐步极显著增加(P<0.01),且在26,35 DPA极显著高于中12显无(图1)。GhERF105-like在不同有腺体棉品种/系叶片中的表达量不同,且均显著高于显性或隐性无腺体棉品种/系(P<0.05)(图2)。表明GhERF105-like与棉花色素腺体发育或棉酚合成密切相关。

不同大写字母表示1%水平差异显著(P<0.01)。图7同。Different capital letters are significantly different at 1% level(P<0.01).The same as Fig.7.

不同小写字母表示5%水平差异显著(P<0.05)。图7同。Different letters are significantly different at 5% level(P<0.05).The same as Fig.7.
2.2 GhERF105-like基因的克隆与序列分析
以中12叶片cDNA为模板,利用引物fGhERF105-like-F和fGhERF105-like-R,用RT-PCR的方法获得目的片段(图3)。
GhERF105-like编码区为711 bp,编码236个氨基酸(图4)。GhERF105-like蛋白的分子质量为26.3 ku,理论等电点pI为7.72,为不稳定性(不稳定系数70.44)亲水(总平均亲水性-0.611)蛋白。SOPMA预测GhERF105-like的二级结构包括22.88%的α-螺旋,13.14%的延伸链,3.81%的β-转角和60.17%的无规则卷曲。GhERF105-like在第91—155位氨基酸存在1个AP2结构域(图4)。用NetPhos 3.1预测潜在磷酸化位点,表明GhERF105-like有23个丝氨酸、7个苏氨酸和2个酪氨酸潜在修饰位点。其中第92位氨基酸处的酪氨酸磷酸化位点、第121,124位氨基酸处的苏氨酸磷酸化位点及第142位氨基酸处的丝氨酸磷酸化位点位于AP2结构域内(图4)。三维结构预测表明,GhERF105-like 87~208位氨基酸序列与乙烯应答因子ERF096蛋白序列高度匹配(52%覆盖度,100%置信度)。根据ERF096晶体结构预测GhERF105-like的三维结构见图5。

彩色箭头方向为N→C末端。模型维度 X.40.874;Y.48.799;Z.44.154。Image coloured by rainbow N→C terminus.Model X.40.874;Y.48.799;Z.44.154.
2.3 GhERF105-like同源蛋白进化及保守基序分析
将GhERF105-like与其他植物中同源AP2/ERF蛋白构建系统进化树,结果表明,GhERF105-like与棉属及其他双子叶植物中同源蛋白的序列相似度高于单子叶植物中同源蛋白(图6-A)。进一步对这些蛋白的保守基序进行分析,可以发现GhERF105-like在棉属黄褐棉(TYJ42243.1)、达尔文氏棉(TYH24288.1)、雷蒙德氏棉(XP 012439108.1)、海岛棉(KAB2053713.1)中蛋白基序组成一致。基序1和基序2在不同物种中高度保守,除基序10外其他基序保守性也较高。单子叶植物中AP2/ERF蛋白基序组成与双子叶植物明显不同(图6-B)。
2.4 GhERF105-like的时空表达模式
GhERF105-like在中12不同组织中的表达量除在茎中显著高于中12显无外(P<0.05),在其他组织中均极显著高于中12显无(P<0.01),且在2个棉花材料的子叶和蕾中丰度均较高,表明GhERF105-like表达水平与植株是否存在腺体密切相关,并且倾向于在幼嫩组织中高丰度表达(图7-A)。在中12叶片中,GhERF105-like受BR诱导上调表达,处理6 h的表达量显著高于处理0 h对照。在ABA处理下,GhERF105-like表达量先下调再上调,处理6 h显著高于处理3 h。在MeJA处理下,GhERF105-like下调表达,在处理3 h达极显著水平(P<0.01),之后表达略有上升(图7-B)。喷施Eth后,GhERF105-like也呈下调表达趋势,在处理3,9 h的表达极显著低处理0 h对照(图7-C)。NaCl和PEG胁迫处理下GhERF105-like下调表达。NaCl处理3 h,GhERF105-like表达与对照相比极显著下降(P<0.01),之后表达量略有上升后又降低,在处理9 h再次极显著低于对照(P<0.01)。GhERF105-like在PEG处理下的表达变化趋势与NaCl处理相同,但在处理3,9 h与对照的差异仅达显著水平(P<0.05)。以上结果表明,在本试验浓度下,ABA和BR诱导GhERF105-like上调表达,而MeJA、Eth、NaCl、PEG等因素对GhERF105-like的表达起抑制作用。
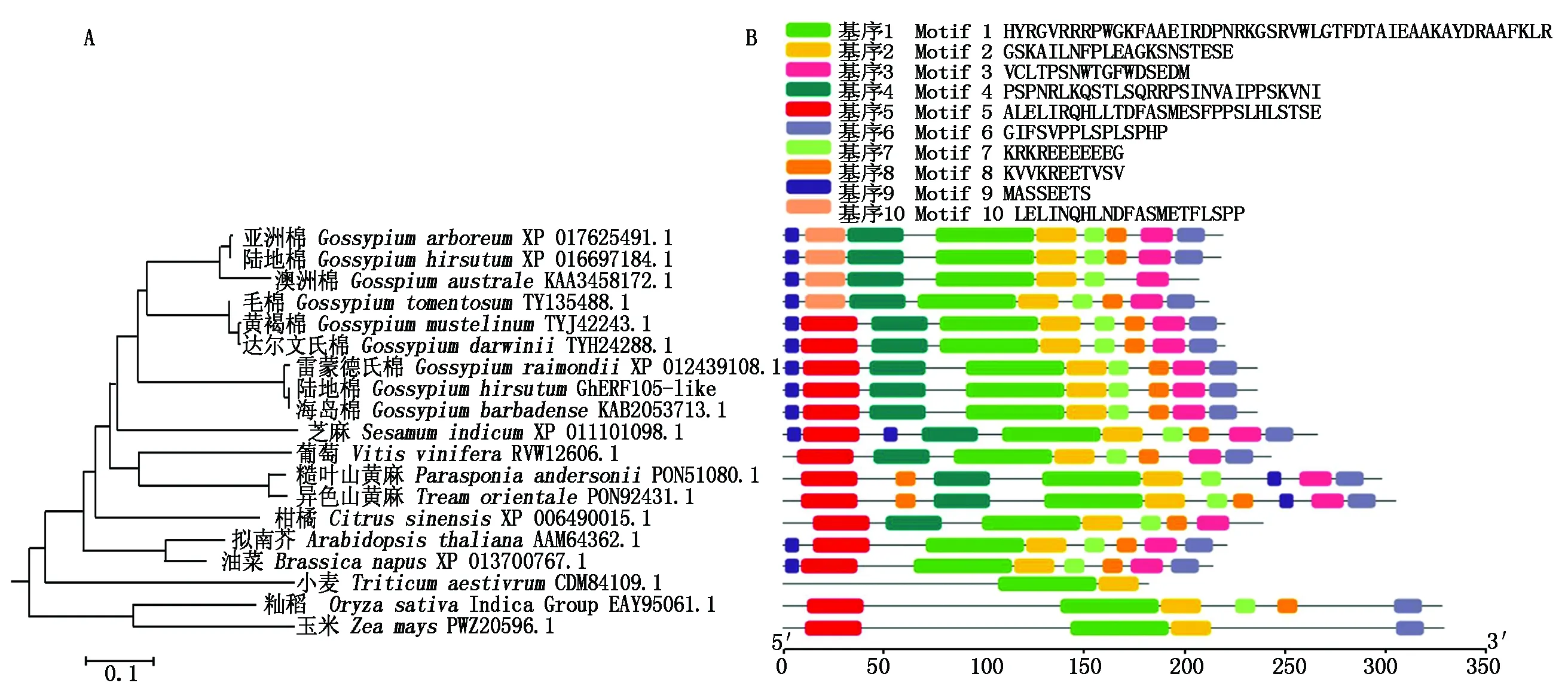
图6 GhERF105-like同源蛋白的进化树(A)及保守基序(B)分析Fig.6 Phylogenetic(A)and motif composition(B)analysis of GhERF105-like homologous proteins

A.GhERF105-like在有腺体棉中棉所12和中棉所12显性无腺体同一组织部位的表达差异;B、C.中棉所12中GhERF105-like受植物激素诱导的表达模式;D.中棉所12中GhERF105-like非生物胁迫下的表达模式。A.Differential expression of GhERF105-like in same tissue of two cotton germplasms;B,C.Expression patterns of GhERF105-like under hormone treatment in Zhongmiansuo 12;D.Expression patterns of GhERF105-like under NaCl or PEG treatment in Zhongmiansuo 12.
3 结论与讨论
棉酚的生物毒性限制了棉籽、棉株等棉副产品的综合利用[1]。棉花色素腺体的有无及数量与棉酚含量显著相关,通常腺体有无影响棉酚代谢,但棉酚合成并不影响腺体形成[5-6]。研究棉花色素腺体发育相关基因及其对棉酚合成的调控机制,可为低酚棉分子育种提供理论依据和基因资源。
AP2/ERF转录因子超家族主要存在于植物中,在植物生长发育、胁迫应答、物质代谢等生命活动中发挥重要作用[20]。转录组分析检测到AP2/ERF转录因子在不同腺体类型材料间差异表达[6-8,22-23]。陆地棉GhERF105基因影响叶片等部分器官腺体形成及棉酚合成[10]。表明AP2/ERF转录因子也参与调控棉花色素腺体发育及棉酚代谢。本研究中,AP2/ERF转录因子GhERF105-like(Gh_A12G1784)基因在不同有腺体棉品种中的表达及在有腺体棉中12不同器官中的表达均显著或极显著高于无腺体棉。Gh_A12G1784在其他研究中也因在有腺体和无腺体棉花间的显著差异表达而被作为候选基因[7-8]。以上结果表明,GhERF105-like与棉花色素腺体形成或棉酚代谢密切相关。
GhERF105-like在拟南芥中的同源基因ERF105主要参与冷害[25]、强光[26]、病害[27]等应答途径。系统进化分析表明,拟南芥ERF102~ERF105基因非常相近,其对激素的应答、生物学功能等也相似[25]。ERF102在病原毒素刺激下通过ETH和JA路径参与生物胁迫应答[28]。ERF105通过ABA路径在抵御丁香假单胞杆菌(Pseudomonassyringae)过程中发挥作用[27]。ERF103~ERF105通过影响色氨酸衍生次生代谢物合成显著抑制真菌增殖,但不影响植株生长[29]。超表达ZmERF105基因增强玉米大斑病抗性及PR(Pathogenesis-related)基因表达[30]。棉花受病虫害侵染后色素腺体密度和棉酚含量会发生改变[31]。本研究中,GhERF105-like应答ABA、BR、Eth、MeJA等激素及NaCl和PEG胁迫处理,可能通过这些激素介导的信号路径参与调控腺体形成、棉酚代谢或胁迫应答反应。
ERF102还参与病原毒素刺激下的细胞程序性死亡(Programmed cell death,PCD)[28]。伴随陆地棉色素腺体发育,中心分泌细胞逐渐溶解形成腔体,可观察到细胞壁膨胀、DNA断裂和降解、液泡中出现自溶体等PCD现象[32]。本研究中,GhERF105-like在中12 16 DPA幼胚中的表达量极低,随着色素腺体的发育表达量逐步极显著增加,其在Stoneville 7A有腺体及其无腺体近等基因系间也有相似的表达趋势[7],表明GhERF105-like可能在腺体发育中后期或棉酚代谢过程中发挥作用。腺体发育过程中的PCD现象也发生在腺体发育的中后期,推测GhERF105-like也可能参与PCD过程。
综上所述,GhERF105-like与棉花色素腺体发育或棉酚代谢密切相关,可能通过ABA、BR、Eth、MeJA等路径参与调控腺体发育、棉酚代谢及生物/非生物胁迫应答。
