恒清Ⅱ号方对阿尔茨海默病模型小鼠学习记忆能力的作用及机制研究
2022-02-15孟胜喜陈慧泽李文涛潘卫东张云云
孟胜喜,陈慧泽,刘 雨,王 兵,李文涛,潘卫东,张云云
阿尔茨海默病(Alzheimer′s disease,AD)是一种神经退行性疾病,其特征为β淀粉样蛋白(amyloid-β,Aβ)以老年斑的形式在细胞外的蓄积和过度磷酸化tau蛋白以神经原纤维缠结的形式在细胞内蓄积,从而呈现进行性神经元丢失和脑萎缩[1-5]。AD严重威胁病人的日常生活质量,给病人家庭和社会带来了沉重的照顾负担和经济负担。目前还没有改善AD的有效治疗方法[6]。中医药在防治AD方面发挥着不可替代的作用,其优势也逐渐被重视和关注[7]。恒清Ⅱ号方(HQ)是本课题组长期用于临床防治AD疗效确切的经验方,前期做过大量相关的临床试验和动物实验研究,已经验证了恒清Ⅱ号方对于AD具有确切的疗效[8-11],且已申请了国家专利(专利号:201910371018.5),但是其作用机制仍需要进一步深入研究。鉴于此,本研究以淀粉样前体蛋白(APP)/早老素1(PS1)小鼠为AD动物模型,探讨恒清Ⅱ号方对其作用及机制。
1 材料与方法
1.1 实验动物 雄性24周龄APP/PS1双转基因小鼠,体质量(27±2)g,无特定病原体(SPF)级,由南京大学模式动物研究所提供,许可证号:SCXK(苏)2010-0001;雄性24周龄C57BL/6小鼠,体质量(26±3)g,SPF级,购买于上海灵畅生物科技有限公司,动物生产许可证号:SCXK(沪)2018-003。
1.2 药物、试剂与仪器
1.2.1 药物 恒清Ⅱ号方组成:益智仁30 g,黄芪15 g,菟丝子10 g,川芎10 g,熟地黄15 g,桑寄生10 g,煅石决明10 g,杜仲10 g,地龙10 g,天麻10 g,钩藤10 g。由上海市第六人民医院中药房提供。按以上恒清Ⅱ号方处方比例称取全部药材,加入10倍量的水浸泡0.5 h,煎煮3次,每次40 min,过滤,合并以上3次滤液,在37 ℃水浴中加热浓缩,根据临床实际用药情况,对所得药液进行浓缩处理,浓缩至0.535 g/mL匹配临床的实际用药浓度,置于4 ℃冰箱中贮存备用。
1.2.2 主要试剂与仪器 PI3 Kinase p85(19H8)Rabbit mAb(CST公司,美国),Akt Antibody(CST公司,美国),Phospho-Akt(Ser473)(D9E)XP®Rabbit mAb(CST公司,美国),mTOR(S2442)polyclonal antibody(Bioworlde公司,美国),Phospho-mTOR(Ser2448)(D9C2)XP®Rabbit mAb(CST公司,美国),二喹啉甲酸(BCA)蛋白浓度测定试剂盒(P0012S,上海碧云天生物技术有限公司,中国),anti-β-actin(北京中杉金桥生物技术有限公司,中国),二抗辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司,中国)。Morris全自动水迷宫测试系统购自上海吉量软件科技有限公司(型号:JLBehv-MWMG-1)。
1.3 分组及给药 按照随机数字表法将20只雄性24周龄APP/PS1双转基因小鼠随机分为模型组、HQ 组,每组10只,同时另设立同周龄、同背景的C57BL/6小鼠10只为正常对照组。HQ 组小鼠每天给予HQ 40 mg/kg灌胃,正常对照组和模型组小鼠给予等体积的生理盐水灌胃,均为每日1次,连续灌胃8周。然后进行Morris水迷宫实验检测。
1.4 观察指标
1.4.1 Morris水迷宫实验评价APP/PS1小鼠学习记忆能力与空间位置认知能力 Morris水迷宫实验连续进行5 d,前4 d(定位航行实验)将实验小鼠分别从3个不同的入水点面朝池壁依次置于水中,依次记录每只小鼠的逃避潜伏期(escape latencies,EL)、游泳路径长度。第5天(空间探索实验),先撤去平台,将小鼠于同样的3个入水点依次置于水中,依次记录小鼠在90 s内跨越平台的次数(number of cross-platform,NCP)[12]。计算机摄像系统自动监测Morris水迷宫实验水池中的小鼠游泳情况,然后采用软件对相关数据进行处理。
1.4.2 蛋白质印迹法(Western Blot)检测小鼠海马组织磷脂酰肌醇-3激酶(phosphoinositide3-kinases,PI3K)、蛋白激酶 B(protein kinase B,Akt)、磷酸化蛋白激酶 B(p-Akt)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)的蛋白表达水平 灌胃8 周后,用0.3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,断头,冰盘上开颅取脑,分离海马组织,-80 ℃冰箱保存。检测时取出小鼠海马组织,加RIPA裂解缓冲液,研磨均匀,冰上30 min,取上层液,4 ℃离心15 min(12 000 r/min),提取总蛋白,测蛋白浓度。每组蛋白上样40~60 μg,电泳,转膜,封闭,一抗孵育,过夜后,二抗孵育,扫描,图像导出,采用Image J软件分析。

2 结 果
2.1 各组小鼠Morris水迷宫实验结果比较
2.1.1 定位航行实验 第1天至第4天,与正常对照组比较,模型组小鼠的EL均明显延长,差异均有统计学意义(P<0.01);第1天、第2天,与模型组比较,HQ 组小鼠EL均缩短,但差异无统计学意义(P>0.05);第3天、第4天,与模型组比较,HQ 组小鼠EL均明显缩短,差异均有统计学意义(P<0.01)。详见表1。

表1 各组小鼠EL比较 (±s) 单位:s
第1天至第4天,与正常对照组比较,模型组小鼠的定位航行路径长度均明显增加,差异均有统计学意义(P<0.01);第1天、第2天,与模型组比较,HQ组小鼠定位航行路径长度缩短,但差异无统计学意义(P>0.05);第3天、第4天,与模型组比较,HQ 组小鼠定位航行路径长度均明显缩短,差异有统计学意义(P<0.01)。详见表2。

表2 各组小鼠定位航行路径长度比较 (±s) 单位:m
2.1.2 空间探索实验 与正常对照组比较,模型组小鼠NCP明显减少,差异有统计学意义(P<0.01);与模型组比较,HQ 组小鼠NCP明显增加,差异有统计学意义(P<0.01)。详见表3。

表3 各组小鼠NCP比较(±s) 单位:次
2.2 各组小鼠海马组织PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平比较 与正常对照组比较,模型组小鼠海马组织 PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平均明显升高,差异均有统计学意义(P<0.01);与模型组比较,HQ组小鼠PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平均明显降低,差异均有统计学意义(P<0.05或P<0.01)。详见图1、表4。
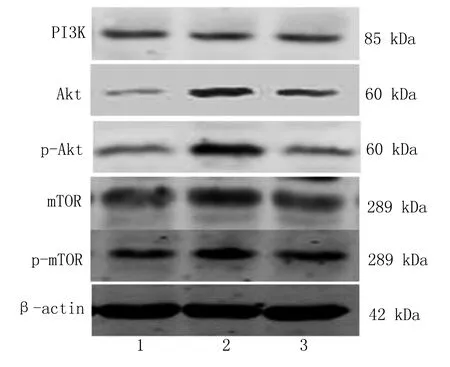
图1 各组小鼠海马组织PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达(1为正常对照组;2为模型组;3为HQ组)

表4 各组小鼠海马组织PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平比较 (±s)
3 讨 论
自噬可减少Tau蛋白的过度磷酸化延缓AD进展。在AD病人中线粒体自噬增加,自噬与神经炎性反应之间有着密切的联系。目前已知PI3K/Akt/mTOR是细胞自噬的重要转导通路,其通过调节神经系统的凋亡和自噬管理着细胞的存活。抑制PI3K/Akt/mTOR则可以诱导自噬,而自噬可能对细胞产生保护作用。PI3K/Akt/mTOR信号通路异常激活与AD的病理学改变有关[13]。PI3K和其下游分子Akt所构成的信号途径作为一个经典抗凋亡、促存活的信号传导途径,通过激活下游mTOR来调节自噬[14];PI3K的下游直接靶点蛋白Akt调节细胞代谢和存活,PI3K的激活可使Akt磷酸化[15],而激活后的Akt蛋白可以启动通路下游的级联反应,可以进一步磷酸化一系列下游底物,通过多种机制促细胞存活、抗细胞凋亡[16];mTOR是一种丝/苏氨酸蛋白激酶,是控制细胞生长、增殖、代谢和凋亡的关键调节物[17],也是PI3K信号通路下游分子之一。
AD在中医学中属“呆病”“善忘”“痴呆”“健忘”等范畴。清代医家王清任在《医林改错·脑髓说》提出,肾虚、脑髓失养是本病的主要病因。《伤寒论》的“其人善忘者,必有蓄血”以及清末名医唐容川的 “凡心有瘀血,亦令健忘”“血在上,则浊蔽不明矣”(《血证论》),均提示瘀血是痴呆的重要形成因素。明代医药学家李时珍的“痰生百病”(《频湖脉学》),痰迷神窍可致痴呆。清代医家陈士铎的“治呆无奇法,治痰即治呆”(《辨证录》)。 痰饮和瘀血相互影响,痰可致瘀,瘀也可成痰。痰瘀互结,元神失养,则生本病。因此,AD的病机根本为肾虚,病机关键在痰瘀,治疗上应以补肾为主,辅以化痰祛瘀。恒清Ⅱ号方是本课题组根据长期临床观察总结而来的治疗AD的经验效方,全方具有补肾、化痰祛瘀的作用,从而治疗AD[8-11]。
益智仁的主要成分诺卡酮对脑室内注射脂多糖(LPS)诱发的AD小鼠模型具有较好的神经保护作用[18]。黄芪的主要成分黄芪甲苷(astragaloside Ⅳ, AS-Ⅳ)作为一种天然的过氧化物酶体增殖活化受体(PPARγ)可抑制Aβ1-42诱导的APP/PS1小鼠的记忆障碍和海马神经细胞凋亡,可能是通过促进PPARγ/脑源性神经营养因子(BDNF)信号通路而引起的[19],也可以减轻Aβ1-42诱导的氧化应激、神经炎症、线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)开放[20-21]。菟丝子提取物可以改善衰老模型小鼠的学习记忆能力[22]。川芎挥发油中的主要成分丁基苯酞则可通过调节Akt、 信号转导和转录活化因子3(STAT3)信号通路等[23],从而抗神经细胞凋亡、抗脑缺氧、增强认知能力等。熟地黄可抑制血浆皮质醇含量和海马糖皮质激素受体mRNA表达,提高学习记忆能力,上调海马神经生长因子、c-fos的基因表达[24]。小鼠Morris水迷宫实验和被动回避实验表明桑寄生可以逆转东莨菪碱所致的记忆障碍[25]。牡蛎水提液可以延缓去卵巢大鼠脑衰老[26]。杜仲对受到脂多糖刺激的小神经胶质细胞BV-2具有抗炎活性[27]。地龙提取液可清除丙二醛(MDA)、超氧化物歧化酶,阻断Ca2+内流,保护缺血再灌流损伤[28]。天麻的主要有效成分巴利森苷C可以改善Aβ1-42诱导的大鼠脑损害后长时程增强抑制,调节海马神经元N-甲基-D-天冬氨酸(NMDA)受体介导电流[29]。钩藤水提物、异钩藤碱可以改善Aβ蛋白变性导致的神经细胞损伤[30]。
本研究结果显示,第1天至第4天,与模型组比较,恒清Ⅱ号方组小鼠EL、定位航行路径长度均明显缩短,NCP明显增加(P<0.01),表明恒清Ⅱ号方可以明显改善AD小鼠的学习记忆能力。与正常对照组比较,模型组小鼠的海马脑区PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平均明显升高,差异均有统计学意义(P<0.01);与模型组比较,HQ组小鼠的海马脑区PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平均降低(P<0.05),其中,不仅Akt和mTOR总量表达下降,p-Akt和p-mTOR水平也明显降低,表明自噬效应明显增强。表明恒清Ⅱ号方可以有效抑制PI3K/Akt/mTOR信号通路,Western Blot检测结果也表明自噬现象明显增强。说明恒清Ⅱ号方可以抑制PI3K/Akt/mTOR信号通路,增强自噬。
综上所述,恒清Ⅱ号方可以改善APP/PS1小鼠的学习记忆功能,可能是通过抑制PI3K/Akt/mTOR信号通路、增强自噬而发挥抗AD作用的。
