转铁蛋白修饰雷公藤甲素脂质体的制备与体外评价
2022-02-14杨一帆梁艺瑶刘保保苏雪蓉狄留庆赵晓莉
杨一帆,梁艺瑶,刘保保,苏雪蓉,乔 萍,狄留庆,赵晓莉
·药剂与工艺·
转铁蛋白修饰雷公藤甲素脂质体的制备与体外评价
杨一帆,梁艺瑶,刘保保,苏雪蓉,乔 萍,狄留庆,赵晓莉*
南京中医药大学药学院,江苏省中药高效给药系统工程技术研究中心,江苏 南京 210023
制备转铁蛋白(transferrin,Tf)修饰的雷公藤甲素(triptolide,TP)脂质体(Tf-TP@Lip),并对其进行质量评价和体外靶向性研究。采用薄膜分散法制备Tf-TP@Lip,以包封率和载药量为考察指标,通过单因素考察和星点设计-效应面优化法筛选处方和最佳制备工艺;采用超滤离心法测定药物包封率;透射电子显微镜(TEM)观察脂质体微观形态;激光粒度仪测定脂质体的粒径、多分散指数(polydispersity index,PDI)和Zeta电位;并对其体外释放情况进行考察;采用流式细胞仪和荧光显微镜探究细胞摄取情况。优化后Tf-TP@Lip的处方和工艺:脂药比为5.72∶1,脂胆比为8.11∶1,磷脂与DSPE-PEG2000的质量比为6∶1,成膜溶剂为无水乙醇,成膜温度60 ℃。制得的Tf-TP@Lip平均粒径为(130.33±1.89)nm,PDI为0.19±0.03,Zeta电位为(−23.20±0.64)mV,包封率和载药量分别为(85.33±0.41)%和(9.96±0.21)%,TEM下呈球形,大小均匀、圆整。体外释放研究表明,Tf-TP@Lip相比游离TP具有一定缓释效果。与非靶向雷公藤甲素脂质体(TP@Lip)相比,转铁蛋白的修饰明显增加了SMMC-7721对脂质体的摄取效率。制备Tf-TP@Lip稳定、可行,粒径小、外观圆整且具备较高的包封率和载药量,可用于进一步的实验研究。
雷公藤甲素;转铁蛋白;修饰;脂质体;星点设计-效应面法;质量评价;细胞摄取;体外靶向性;薄膜分散法;超滤离心法
雷公藤甲素(triptolide,TP),又称雷公藤内酯醇,是从卫矛科植物雷公藤中分离纯化得到的一种环氧二萜内酯类化合物。现代研究表明,雷公藤甲素具有广泛高效的抗肿瘤活性[1],但存在水溶性差、生物利用度低以及治疗窗窄等问题[2],导致其对体内靶器官产生不同程度的毒性作用[3]。为克服以上问题,研究者通过增强TP水溶性的结构修饰[4],也尝试改进剂型或改变给药方式[5]以提高TP的水溶性,减缓TP体内释放,增加TP的靶向性。脂质体具备磷脂双分子层结构,能够增加难溶性药物的溶解度,降低血液清除率,延长药物在体内的半衰期,从而提高生物利用度[6]。
通过在脂质体表面引入与肿瘤细胞有特异性结合的靶向分子(如多肽、单糖、多糖、叶酸、抗体、抗体片段等),可促进纳米药物在肿瘤组织处的滞留,从而增强纳米药物的内吞效率和肿瘤细胞内的富集[7]。由于铁代谢异常,多种肿瘤细胞包括人肝癌SMMC-7721细胞、人乳腺癌MDA-MB 231细胞、人神经胶质瘤U87-MB细胞和人肺癌A549细胞均过表达转铁蛋白受体(transferrin receptor,TfR)[8]。目前,已经报道转铁蛋白(transferrin,Tf)修饰的纳米制剂包括脂质体[9]、聚合物囊泡[8]、聚合物纳米粒[10]等。本实验采用薄膜分散法制备转铁蛋白修饰雷公藤甲素脂质体(transferrin modified triptolide liposome,Tf-TP@Lip),通过响应面设计优化处方制剂工艺,对其形态、粒径、包封率以及体外释放进行评价,并进一步通过细胞摄取实验考察Tf-TP@ Lip的体外靶向性。
1 仪器与材料
1.1 仪器
梅特勒MS105十万分之一电子天平,瑞士梅特勒-托利多公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;SHB-III循环水式多用真空泵,南京文尔仪器设备有限公司;SM-1000D超声波细胞破碎仪,南京舜玛仪器设备有限公司;ZS90型纳米粒径测定仪,英国马尔文仪器有限公司;Waters 2695高效液相色谱仪,美国Waters公司;高速台式离心机,上海安亭科学仪器厂;HT7800透射电子显微镜(TEM),日本日立公司;Nikon Ti倒置显微镜,日本Nikon有限公司;Gallios流式细胞仪,美国贝克曼库尔特公司。
1.2 材料
雷公藤甲素对照品,质量分数98%,批号FY105B201,南通飞宇生物科技有限公司;氢化大豆磷脂酰胆碱(HSPC,批号B60455)、胆固醇(CHO-HP,批号B80859)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000,批号B90396),上海艾伟拓医药科技有限公司;Traut试剂,批号4781-83-3,南京金益柏生物科技有限公司;磷脂聚乙二醇马来酰亚胺(Mal-PEG2000-DSPE,批号RD0200708),西安瑞禧生物科技有限公司;磷酸盐缓冲液(PBS,批号P1010),索莱宝生物科技有限公司;聚山梨酯80(批号9005-65-6)、MTT(批号I1810035),南京晚晴化玻仪器有限公司;香豆素-6,碧云天有限公司;DMEM培养液、0.25%胰蛋白酶、青-链霉素溶液,美国Hyclone公司;胎牛血清,美国Gibco公司。无水乙醇、甲醇、氯仿为分析纯;乙腈为色谱纯。
2 方法与结果
2.1 DSPE-PEG2000-Tf的合成与鉴定[11]
称取约20 mg转铁蛋白溶于2 mL pH 8的PBS中,在PBS中加入EDTA,螯合溶液中的二价金属,防止巯基氧化。另称取4 mg Traut试剂溶于1 mL的pH 8.0的PBS中,向转铁蛋白溶液中加入20倍物质的量过量的Traut试剂,避光摇床内反应1 h。取9.0 mg Mal-PEG2000-DSPE溶于2.5 mL pH 6.5的PBS中,按一定的物质的量比例将硫醇化的转铁蛋白与Mal-PEG2000-DSPE在避光条件下反应过夜,即获得DSPE-PEG2000-Tf(合成流程见图1)。通过SDS-PAGE电泳法和紫外-可见光谱法对合成物进行表征,结果见图2,DSPE-PEG2000-Tf电泳条带在100 000左右,而转铁蛋白条带在77 000左右,证明合成物中包含转铁蛋白,图3表明合成物具有与转铁蛋白相似的紫外吸收曲线,其中转铁蛋白最大吸收波长为280 nm,DSPE-PEG2000-Tf最大波长在278 nm发生了蓝移,以此证明转铁蛋白偶联成功。

图1 DSPE-PEG2000-Tf的合成流程

1-Marker 2-DSPE-PEG2000-Tf(Mal-Tf物质的量比为10∶1) 3-转铁蛋白
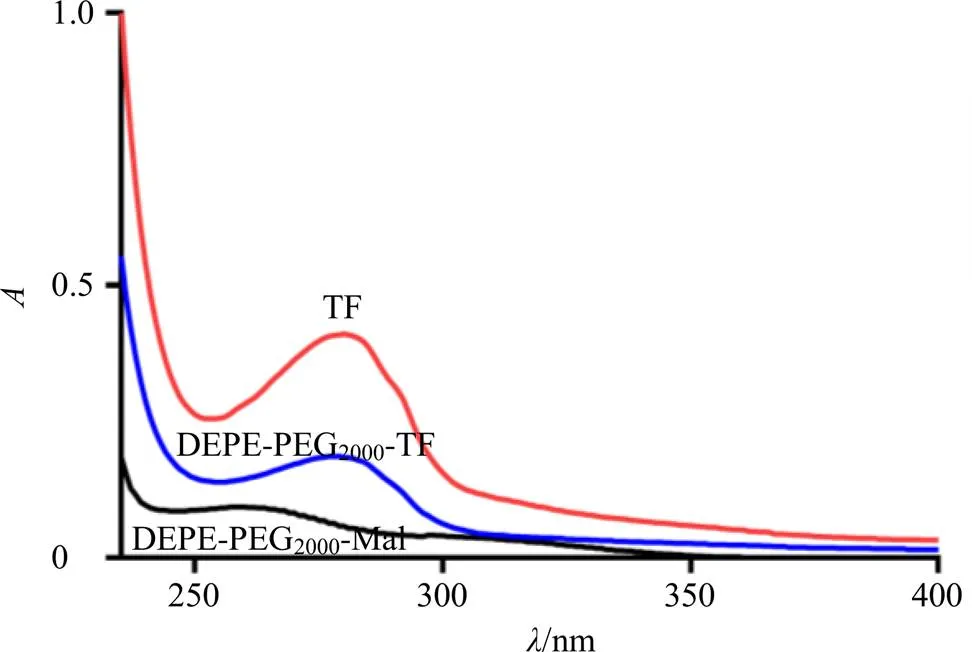
图3 合成物的紫外吸收曲线
2.2 雷公藤甲素脂质体(triptolide liposomes,TP@Lip)和Tf-TP@Lip的制备
采用薄膜分散法制备载药脂质体,精密称取适量氢化大豆卵磷脂、胆固醇、DSPE-mPEG2000和雷公藤甲素于茄形瓶中,加入适量有机溶剂超声使其全部溶解,在一定温度下减压旋转蒸发,形成均匀类脂薄膜后继续抽真空30 min,并放置过夜,以除尽残留的痕量有机溶剂;再加入适量去离子水,常压旋转水化30 min后,置于超声波细胞粉碎机中超声依次经过0.2、0.1 μm聚碳酸纤维脂膜挤压6次,即得TP@Lip脂质体溶液,于4 ℃冰箱中保存,备用[12]。将制得的TP@Lip脂质体与Tf-PEG2000-DSPE在60 ℃温育2 h,制备Tf-TP@Lip。
2.3 脂质体包封率的测定
通过超滤离心法将未包封的药物与脂质体溶液分离,并采用“2.4.1”项下色谱条件检测并计算Tf-TP@Lip的包封率[13]:精密量取40 μL脂质体溶液,加入20倍量的甲醇,超声20 min破乳,测定TP的总量(drug)。另精密量取0.2 mL脂质体溶液于超滤离心管(截留相对分子质量30 000),4500 r/min离心(离心半径9 cm)5 min,得到游离的TP,测定游离的药物含量(drug),计算包封率和载药量。
包封率=(drug-drug)/drug
载药量=(drug-drug)/脂质总量
2.4 TP含量测定方法建立
2.4.1 色谱条件 色谱柱为Waters X-Bridge C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(35∶65);体积流量1.0 mL/min;检测波长218 nm;柱温28 ℃;进样量20 μL。
2.4.2 对照品溶液制备 精密称取TP对照品2.45 mg,置于2 mL量瓶中,加入适量无水乙醇超声溶解并稀释至刻度,配制成质量浓度为1.225 mg/mL的对照品储备液,备用。
2.4.3 供试品溶液制备 精密量取40 μL TP@Lip溶液,加入20倍量的甲醇,超声破乳20 min,12 000 r/min离心(离心半径11 cm)15 min,取上清液,即得TP@Lip破乳液。
2.4.4 线性关系考察 精密吸取“2.4.2”项下TP对照品储备液,用无水乙醇稀释配制成质量浓度分别为12.25、6.12、3.06、1.53、0.77、0.38 μg/mL的系列对照品溶液,按“2.4.1”项下色谱条件进样测定,记录峰面积。以TP对照品溶液的质量浓度为横坐标(),峰面积的积分值为纵坐标(),绘制标准曲线,进行线性回归,得TP线性回归方程=84 273+8 031.6,2=0.999 9。结果表明TP在0.38~12.25 μg/mL线性关系良好。
2.4.5 精密度试验 精密量取适量的TP对照品储备液,加适量甲醇配制低、中、高(5、50、250 μg/mL)3个质量浓度的对照品溶液。按“2.4.1”项下色谱条件进样6次,考察其精密度。结果低、中、高3个质量浓度TP峰面积的RSD分别为0.61%、0.36%、0.28%,表明仪器精密度良好。
2.4.6 重复性试验 取同一批TP@Lip样品6份,按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件进样测定。结果TP峰面积的RSD为2.90%,表明该方法重复性良好。
2.4.7 加样回收率试验 取空白脂质体6份,每份0.2 mL,分别加入TP对照品溶液(1.02 mg/mL)0.2 mL,涡旋混匀,取40 μL,按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件进样测定。结果平均回收率为93.3%,RSD为1.84%。
2.4.8 稳定性试验 取TP@Lip破乳液,分别于放置0、2、4、8、16、24 h时进样测定,结果TP@Lip破乳液峰面积RSD为2.6%,表明TP@Lip破乳液24 h内稳定性良好。
2.5 Tf-TP@Lip制备工艺及处方的单因素考察
2.5.1 成膜条件考察 薄膜分散法制备脂质体的关键是成膜性的好坏[14]。固定其他因素不变,选取不同的成膜溶剂对应适宜的成膜温度,按“2.2”项下方法制备脂质体,按“2.3”项下方法计算包封率,结果如表1所示,在3种条件下脂质体成膜性均良好且包封率无明显差异,出于安全性考虑,选择成膜溶剂为无水乙醇,温度为60 ℃。另由于药物及膜材在无水乙醇中溶解度小,需进行恒温(45 ℃)超声处理,可较快溶解。
表1 薄膜分散法成膜条件及结果(, n = 3)
Table 1 Film forming conditions and results of film dispersion method (, n = 3)
成膜溶剂成膜温度/℃包封率/% 无水乙醇6078.2±1.6 氯仿4079.2±2.4 甲醇5576.5±1.9
2.5.2 磷脂质量浓度的考察 设置水化溶剂的体积为2.5 mL,固定处方组成比例及其他制备工艺条件,磷脂质量浓度分别设置为0.5、1.0、2.0 mg/mL,按“2.2”项下方法制备脂质体,各平行试验3份,包封率分别为(83.9±2.2)%、(74.8±1.4)%、 (67.5±1.6)%。以上结果表明,当磷脂浓度过高,包封的药物达到饱和,包封率反而下降,因此,选择磷脂质量浓度为0.5 mg/mL。
2.5.3 药脂比的考察 固定处方的其他条件不变,改变投药量,设定药脂比为1∶30、1∶20、1∶10、1∶5、1∶2。按“2.1”项下方法制备脂质体,各平行试验3份,结果包封率分别为(59.2±1.9)%、(75.2±1.6)%、(82.9±0.4)%、(80.0±1.2)%、(62.9±2.5)%。由以上结果可知,当药脂比小于1∶5时,其包封率随着投药量的增加而增大,但由于氢化大豆卵磷脂对TP的负载能力有限,当药脂比大于1∶5时,负载达到饱和,继续增加投药量,其包封率开始下降,因此选择药脂比1∶5左右范围继续考察。
2.5.4 脂胆比的考察 胆固醇是脂质体中重要组成部分,具有维持脂质体稳定等作用,但过量存在影响人体健康的隐患[15]。固定处方其他条件不变,改变脂胆比,设置磷脂与胆固醇的质量比为10∶1、5∶1、2∶1,按“2.2”项下方法制备脂质体,各平行试验3份,结果包封率分别为(75.2±1.6)%、(71.2±2.7)%、(66.5±1.8)%。
2.5.5 磷脂与DSPE-PEG2000质量比的考察 处方中加入DSPE-PEG2000能够避免静脉给药后血液中巨噬细胞对脂质体的吞噬作用,提高脂质体的稳定性。但DSPE-PEG2000加入量过多则易与磷脂形成混合胶束,造成脂质体中药物的渗漏[16]。固定其他条件不变,改变DSPE-PEG2000加入量,设置磷脂与其比例分别为8∶1、4∶1、1∶1,按“2.2”项下方法制备脂质体,各平行试验3份,结果包封率分别为(73.2±0.7)%、(75.9±0.4)%、(69.9±1.1)%。
2.6 星点设计优化处方
2.6.1 星点试验设计表及结果 应用Design Expert 8.0.6.1软件进行响应面设计,在前期单因素试验的基础上,以雷公藤甲素脂质体包封率(1)和载药量(2)为响应值,影响较为显著的药脂比(1)、脂胆比(2)和磷脂与DSPE-PEG2000质量比(3)3个因素为考察对象,采取3因素5水平的星点设计-效应面优化法,确定最佳制备工艺。考察因素水平、试验设计及结果见表2。
2.6.2 模型拟合 以包封率、载药量为响应面,对星点试验结果进行拟合,得到方程为1=29.919 9+12.122 561+2.761 692-3.414 073-0.126 6012+0.293 5013+0.166 7523-0.809 8612-0.161 7422+0.171 3432;2=2.148 55-0.056 3981+0.671 422+1.834 333-0.054 10012+0.021 25013-0.048 12523-0.018 58812-8.677 58×10−322-0.082 51932。方差分析见表3。模型<0.05,具有显著性影响,而失拟项>0.05,表明失拟不显著。模型的相关系数(2)为0.962 2、0.891 6,表明该模型与实际试验拟合程度良好,用该模型分析和预测脂质体的制备工艺是合适的。
表2 星点试验设计与结果
Table 2 Design and results of CCD method
试验号X1X2X3包封率/%载药量/%试验号X1X2X3包封率/%载药量/% 15.0 (0)10 (0)7.36 (+1.682)84.9911.09115.0 (0)10 (0)4 (0)76.969.08 25.0 (0)10 (0)4 (0)78.738.91125.0 (0)10 (0)4 (0)80.3810.52 37.5 (+1)15 (+1)6 (+1)78.976.60135.0 (0)10 (0)0.64 (−1.682)76.314.36 45.0 (0)10 (0)4 (0)74.998.88142.5 (−1)5 (−1)2 (−1)58.968.66 59.2 (+1.682)10 (0)4 (0)81.425.99155.0 (0)1.59 (−1.682)4 (0)69.326.90 62.5 (−1)15 (+1)2 (−1)55.7510.28167.5 (+1)5 (−1)2 (−1)81.175.48 75.0 (0)10 (0)4 (0)76.409.06177.5 (+1)15 (+1)2 (−1)66.165.05 85.0 (0)18.41 (+1.682)4 (0)65.239.19180.8 (−1.682)10 (0)4 (0)47.3710.67 95.0 (0)10 (0)4 (0)74.118.05192.5 (−1)5 (−1)6 (+1)59.2311.71 107.5 (+1)5 (−1)6 (+1)81.849.61202.5 (−1)15 (+1)6 (+1)57.2212.06
表3 包封率和载药量方差分析
Table 3 Analysis of variance of entrapment efficiency and drug loading
来源自由度包封率载药量 离均差平方和均方F值P值离均差平方和均方F值P值 模型92 095.09232.7928.31<0.000 184.659.419.140.000 9 A11 319.611 319.61160.50<0.000 141.6241.6240.45<0.000 1 B165.8165.818.000.017 90.420.420.400.539 5 C165.1065.17.920.018 334.8934.8933.910.000 2 AB120.0320.032.440.149 63.663.663.560.088 7 AC117.2317.232.100.178 30.090.090.0880.773 1 BC122.2422.242.710.131 01.851.851.800.209 3 A21369.22369.2244.91<0.000 10.190.190.190.672 9 B21235.61235.6128.660.000 30.680.680.660.435 8 C216.776.770.820.385 51.571.571.530.245 0 残差1082.228.22 10.291.03 失拟项555.0811.022.030.227 97.091.422.210.202 1 纯误差527.145.43 3.200.64 总差192 177.30 94.94
2.6.3 效应面分析 通过Design Expert 8.0.6.1软件对各因素之间的交互作用进行效应面分析,绘制效应面曲线图。结果见图4~5。
2.6.4 效应面优化与预测 为了得到最佳处方,以脂质体包封率和载药量处于最大值为优化指标,权重设置1∶1。通过Design Expert 8.0.6.1软件进行分析优化,得到最佳处方为脂药比为5.72∶1,脂胆比为8.11∶1,磷脂与DSPE-PEG2000的质量比为6∶1。
2.7 最佳工艺验证
确定Tf-TP@Lip最优处方为脂药比为5.72∶1,脂胆比为8.11∶1,磷脂与DSPE-PEG2000的质量比为6∶1。按照该处方工艺条件制备3批雷公藤甲素脂质体样品,各批样品包封率分别为84.98%、86.14%、84.86%,载药量为10.21%、9.55%、10.11%。将检测结果与拟合方程的预测值进行对比,按公式[相对偏差=(预测值-实测值)/预测值]计算相对偏差,结果表明实测值与预测值之间的相对偏差<5%,说明优选的处方工艺稳定可行。
2.8 Tf-TP@Lip的质量评价
2.8.1 Tf-TP@Lip的外观与形态 在日光下检视,按最佳工艺制备得到的Tf-TP@Lip外观澄清透明,呈淡蓝色乳光,结果见图6(左)。将Tf-TP@Lip混悬液滴入铜网,然后用2%磷钨酸染色制备样品,在台灯下对样品进行干燥处理后,置于TEM下观察。Tf-TP@Lip呈球形,圆整,分布均匀,如图6(右)所示。

图4 基于效应曲面法不同因素对包封率的影响

图5 基于效应面法不同因素对载药量的影响
2.8.2 粒径与电位考察 将适量最优工艺制备所得脂质体稀释一定倍数后,于激光粒度分析仪下测定粒径、多分散系数(PDI)及Zeta电位,平行测定3次。Tf-TP@Lip的平均粒径和PDI分别为(130.33±1.89)nm和0.19±0.03(图7),Zeta电位为(−23.20±0.64)mV(图7)。结果表明,该脂质体粒径分布均匀且具备良好的负电性。
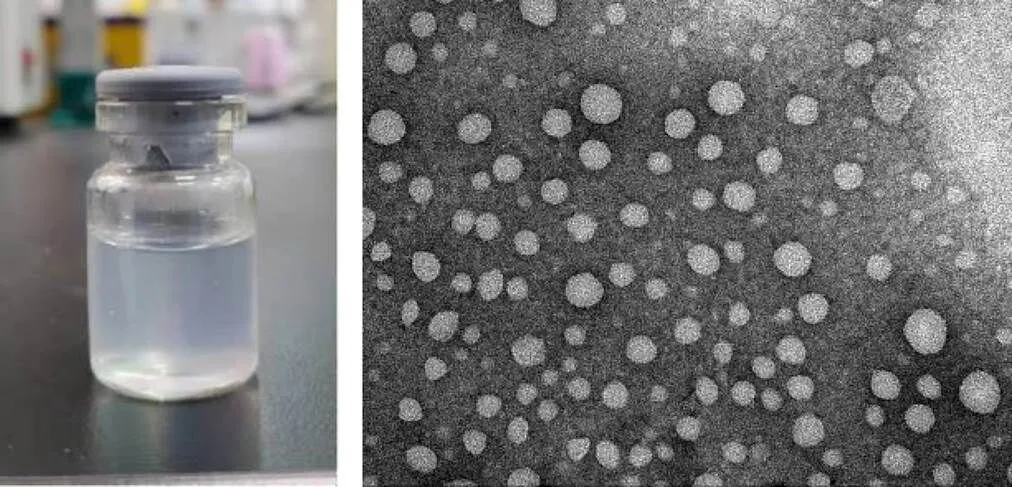
图6 Tf-TP@Lip的表观形态 (左)和TEM图 (右)

图7 Tf-TP@Lip的粒径分布(a)和Zeta电位(b)
2.8.3 体外释放 采用透析袋法考察游离TP、TP@ Lip和Tf-TP@Lip的体外释放情况[17]。取5 mL脂质体溶液置于透析袋中,加入释放介质(含1%吐温80的PBS溶液,pH 7.4)200 mL,于37 ℃、100 r/min恒温震荡。分别于0.25、0.5、1、2、4、6、8、10、12 h取样2 mL(同时补充等温等量释放介质),用HPLC法测定雷公藤甲素含量,计算各时间点的累积释放率并作图(=3)。结果如图8所示,由于脂质体表面携带的雷公藤甲素迅速释放,使药物存在突释阶段,1 h之后进入缓释期,4 h后药物释放基本平稳,12 h测得的累积释放率为70.8%,表明药物在体外释放呈先快后慢的规律,能够维持较长的释放周期,呈现缓释现象。

图8 Tf-TP@Lip的释放曲线
2.9 细胞摄取实验
2.9.1 香豆素-6储备液制备 精密称取香豆素-6适量于2 mL量瓶中,三氯甲烷溶解定容至刻度,制成2 mg/mL的香豆素-6溶液,过0.22 μm微孔滤膜,即得。
2.9.2 荧光脂质体的制备 取脂质体膜材HSPC、CHO和DSPE-PEG2000,加入用无水乙醇稀释至一定浓度的香豆素-6溶液溶解完全,按照“2.2”项下制备方法分别制备得到靶向荧光脂质体(Tf-C6@ Lip)、非靶向荧光脂质体(C6@Lip)。
2.9.3 细胞摄取 将靶向荧光脂质体(Tf-C6@ Lip)、非靶向荧光脂质体(C6@Lip)与肝癌SMMC- 7721细胞在5% CO2、37 ℃环境中孵育4 h。之后,用PBS洗涤细胞,DAPI染色10 min。使用流式细胞仪对细胞进行分析,同时使用荧光显微镜观察细胞,以验证流式细胞仪的分析结果。流式细胞术测试结果显示(图9-A),靶向脂质体在SMMC-7721细胞中的荧光强度明显高于非靶向脂质体,荧光显微镜的测试结果与流式细胞仪一致(图9-B),说明转铁蛋白的修饰增强了SMMC-7721细胞对脂质体的摄取。

图9 Tf-TP@Lip的流式细胞仪分析 (A) 和荧光显微镜图像 (B)
3 讨论
转铁蛋白靶向脂质体递送化合物载药系统是一种有潜力的肿瘤治疗药物。筛选得到有良好抗肿瘤活性的化合物,通过转铁蛋白脂质体载药系统的包载能克服原化合物难于吸收,直接给药效果差等缺点,达到延长循环时间,肿瘤靶向的作用效果。本研究将转铁蛋白与雷公藤甲素脂质体相结合,构建主动靶向纳米传递系统,结合了天然药物与分子靶向药物的优点,并且处方中选用常用、安全的氢化大豆卵磷脂和胆固醇作为脂质体材料,价廉易得,便于后续产品放大和临床应用。
本实验采用薄膜分散法制备Tf-TP@Lip,制备脂质体的过程中成膜性的好坏是关键,应注意成膜性的考察。选取无水乙醇、氯仿、甲醇3种成膜溶剂研究其对脂质体包封率的影响。不同溶剂在相同的成膜温度下成膜效果差异大,为防止旋蒸过程中溶剂暴沸影响成膜效果,某些溶剂如氯仿,在成膜时,温度需控制在磷脂相变温度(55 ℃)之下后采用脂质体挤出器控制粒径[18],与超声破碎法相比粒径更小分散更均匀,稳定性好。在转铁蛋白修饰脂质体方法上,文献报道[19]有3种与脂质体偶联的方法,本实验中利用活化DSPE-PEG2000-MAL中的马来酰胺基团为巯基与转铁蛋白中的氨基反应从而将转铁蛋白连接到磷脂分子上,并通过SDS-PAGE以及紫外分光度法等评价手段证明合成物偶联成功。
在细胞摄取实验中,利用荧光显微镜和流式细胞术考察SMMC-7721细胞对不同脂质体的摄取情况。结果显示转铁蛋白修饰的脂质体的摄取显著高于未修饰的脂质体,这是由于转铁蛋白与SMMC-7721细胞中丰富的TfR能够特异性结合,转铁蛋白修饰在脂质体表面通过受体介导的内吞作用透过细胞,但是具体的内吞机制还有待进一步研究。综上所述,本研究通过响应面法优化制备了粒径小、分布均匀、负电性好的Tf-C6@Lip,具备一定的缓释特性和良好的体外靶向性,为该制剂体内外的进一步研究等工作打下了坚实地基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 黄宇, 马全鑫, 凌云. 雷公藤甲素抗肿瘤药理作用的研究进展 [J]. 药物评价研究, 2018, 41(2): 328-333.
[2] 宋基正, 刘宇灵, 林龙飞, 等. 雷公藤甲素抗肿瘤新型给药系统研究进展 [J]. 中草药, 2019, 50(5): 1269-1275.
[3] 宋祎, 刘琰, 方冰倩, 等. 雷公藤甲素抗肿瘤作用及其配伍减毒机制的研究进展 [J]. 南京中医药大学学报, 2021, 37(3): 457-464.
[4] Noel P, von Hoff D D, Saluja A K,. Triptolide and its derivatives as cancer therapies [J]., 2019, 40(5): 327-341.
[5] 余雅婷, 朱卫丰, 金晨, 等. 雷公藤甲素的剂型改进及给药方式研究进展 [J]. 中国新药杂志, 2016, 25(12): 1359-1362.
[6] 郝宁, 于佳. 基于叶酸表面修饰的蓝萼甲素长循环脂质体的制备与药效学评价 [J]. 沈阳药科大学学报, 2021, 38(6): 553-558.
[7] 罗尧尧, 石金凤, 陈梁, 等. 雷公藤甲素功能化纳米递药系统用于抗肿瘤的研究进展 [J]. 中国中药杂志, 2019, 44(21): 4566-4572.
[8] Wei Y H, Gu X L, Cheng L,. Low-toxicity transferrin-guided polymersomal doxorubicin for potent chemotherapy of orthotopic hepatocellular carcinoma[J]., 2019, 92: 196-204.
[9] Wang K, Shang F, Chen D,. Protein liposomes- mediated targeted acetylcholinesterase gene delivery for effective liver cancer therapy [J]., 2021, 19(1): 31-46.
[10] Sakpakdeejaroen I, Somani S, Laskar P,. Regression of melanoma following intravenous injection of plumbagin entrapped in transferrin-conjugated, lipid- polymer hybrid nanoparticles [J]., 2021, 16: 2615-2631.
[11] 周毓麟. 虫草素及其转铁蛋白靶向脂质体的抗肿瘤活性研究 [D]. 长春: 吉林大学, 2017.
[12] 关延彬, 韩冰, 田雨冬, 等. 姜黄素脂质体的制备及质量评价 [J]. 中药材, 2019, 42(2): 385-389.
[13] 庄英华, 张中文, 韩伟, 等. 超滤离心法测定连翘酯苷脂质体包封率 [J]. 中国新药杂志, 2012, 21(18): 2209-2211,2216.
[14] 黄念. 负载蜂毒素和蟾毒灵的复方免疫脂质体的构建及其抑制肝癌Sorafenib耐药协同效应机制研究 [D].上海:中国人民解放军海军军医大学, 2019.
[15] 陈李霞, 丁越, 沈征武, 等. 胆固醇在脂质体中作用及甾醇、皂苷对其替换的研究进展 [J]. 中草药, 2020, 51(24): 6396-6404.
[16] 任婧. 转铁蛋白修饰姜黄素脂质体的制备及神经保护作用的研究 [D].石家庄:河北科技大学, 2019.
[17] 李思敏, 吴文瀚, 高丽娜, 等. 柠檬苦素脂质体的制备和制剂学评价 [J]. 中草药, 2019, 50(24): 5957-5962.
[18] 任婧. 转铁蛋白修饰姜黄素脂质体的制备及神经保护作用的研究 [D]. 石家庄: 河北科技大学, 2019.
[19] Kong L, Li X T, Ni Y N,. Transferrin-modified osthole PEGylated liposomes travel the blood-brain barrier and mitigate Alzheimer’s disease-related pathology in APP/PS-1 mice [J]., 2020, 15: 2841-2858.
Preparation of transferrin modified triptolide liposomeandevaluation
YANG Yi-fan, LIANG Yi-yao, LIU Bao-bao, SU Xue-rong, QIAO ping, DI Liu-qing, ZHAO Xiao-li
Jiangsu Engineering Research Center for Efficient Delivery System of TCM, School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
To prepare transferrin (Tf) modified triptolide (TP) liposome (Tf-TP@Lip) and evaluate the quality andtargeting.The Tf-TP@Lip were prepared by thin-film dispersion method. With encapsulation efficiency and drug loading as indicators, single factor experiments and CCD-RSM were used to optimized the formulation and optimum preparation of Tf-TP@Lip; The drug entrapment efficiency was determined by ultrafiltration centrifugation; And the microscopic morphology of liposomes were observed under the transmission electron microscope (TEM); The particle size, polydispersion index (PDI), and Zeta potential were determined by laser particle size analyzer, and investigating therelease of liposomes; flow cytometry and microscope were utilized for exploring the cellular uptake.The optimized preparation process and formulation were as follow: lipid /drug ratio was 5.72:1, lipid/cholesterol ratio was 8.11:1, the mass ratio of phospholipid to DSPE-PEG2000was 6:1, the film-forming solvent was absolute ethanol and the temperature was 60 ℃. The mean particle size, PDI and Zeta potential of optimized TP@Lip were (130.33 ± 1.89) nm, 0.19 ± 0.03, (−23.2 ± 0.64) mV, respectively. The encapsulation efficiency and drug loading were (85.33 ± 0.41)% and (9.96 ± 0.21)%, respectively. The resulting liposomes exhibited spherical shape and were narrow in size distribution. Therelease studies showed that Tf-TP@Lip has sustained-release effect compared with free TP. And in contrast of non targeted triptolide liposomes (TP@Lip), Tf modification significantly increased the uptake efficiency of liposomes by SMMC-7721.The preparation is stable and feasible, the obtained liposomes have a uniform particle size, round appearance and high encapsulation efficiency and drug loading, which can be used for further research.
triptolide; transferrin; modified; liposomes; central composite design-response surface method;quality evaluation; cellular uptake;targeting;thin-film dispersion method; ultrafiltration centrifugation
R283.6
A
0253 - 2670(2022)03 - 0687 - 09
10.7501/j.issn.0253-2670.2022.03.006
2021-08-30
国家自然科学基金青年基金项目(81102815)
杨一帆(1996—),女,硕士研究生,研究方向为生物药剂学与药代动力学。E-mail: 773429209@qq.com
赵晓莉,女,副研究员,硕士生导师,研究方向为中药高效给药系统剂型设计与评价研究。Tel: (025)85811517 E-mail: xlee_zhao@njucm.edu.com
[责任编辑 郑礼胜]
