前胡与紫花前胡的化学成分和药理作用研究进展
2022-02-14宋芷琪田琨宇张会永
宋芷琪,李 斌,田琨宇,洪 霖,吴 威*,张会永, 4*
前胡与紫花前胡的化学成分和药理作用研究进展
宋芷琪1,李 斌2#,田琨宇1,洪 霖3,吴 威3*,张会永1, 4*
1. 辽宁中医药大学,辽宁 沈阳 110847 2. 大连医科大学,辽宁 大连 116044 3. 珠海科技学院,广东 珠海 519041 4. 辽宁中医药大学附属医院,辽宁 沈阳 110032
前胡和紫花前胡分别为伞形科植物白花前胡与紫花前胡的干燥根,为临床常用中药材,二者均含有香豆素类、黄酮类、挥发油类等多种化学成分,其中白花前胡活性成分以角型吡喃香豆素类化合物为主,而紫花前胡所含活性成分以线型呋喃香豆素为主。现代药理学研究表明,白花前胡主要具有抗心衰、降血压、抗心肌缺血等药理活性,而紫花前胡抗肿瘤、抗凝血作用更佳。虽在《中国药典》2020年版白花前胡和紫花前胡的功能主治描述相同,但从现代药学对2种前胡化学成分及药理作用研究进展来看,二者之间存在明显差异,故对白花前胡和紫花前胡的化学成分和药理作用进行系统总结,以期对2种常用前胡药材的现代临床应用及深入药效学机制研究提供参考。
白花前胡;紫花前胡;香豆素;抗心衰;降血压;抗凝血;抗癌
前胡为传统中药材,始载于《名医别录》。文中言“前胡:味苦,微寒,无毒。主治痰满,胸肋中痞,心腹结气,风头痛,去痰实下气。治伤寒寒热,推陈致新,明目,益精”[1]。后《本草图经》《本草纲目》等历代本草及《中国药典》(下简称《药典》)均有记载。前胡于1963年首次收录于《中国药典》中,其基原植物为伞形科植物白花前胡Dunn或紫花前胡(Miq.) Maxim的干燥根[2],在《中国药典》2005年版中,仅纳入白花前胡为前胡的植物来源[3]。而后紫花前胡作为一味新增药材纳入《中国药典》2010年版[4]并延续至《中国药典》2020年版中[5]。前胡性味苦、辛,微寒,归肺经,具有降气化痰、散风清热的功效,常用于治疗痰热喘满,咯痰黄稠,风热咳嗽痰多等证。《中国药典》2020年版中对白花前胡与紫花前胡功效及主治描述相同,但现代研究表明白花前胡与紫花前胡中所含化学成分及药理作用却不尽相同。故本文对白花前胡和紫花前胡的化学成分和药理作用进行系统综述,以期对2种前胡的现代临床应用及深入药效学机制研究提供参考。
1 化学成分
1.1 香豆素类
前胡中含有香豆素类、黄酮类以及挥发油类等多种化学成分,香豆素类为其主要成分,可分为简单香豆素、呋喃香豆素以及吡喃香豆素3类。呋喃香豆素和吡喃香豆素因异戊烯基与香豆素母核成环后稠合方式的不同,又可以分为线型和角型两类。白花前胡与紫花前胡都含有线型和角型香豆素,但其中所含化合物结构特征及含量均有差异。本文归纳总结共得到116个香豆素类化合物,其中简单香豆素14个,呋喃香豆素37个,吡喃香豆素65个。
1.1.1 简单香豆素类 1989年,Okuyama等[6]最先在白花前胡中发现了2种简单香豆素类化合物,分别为skimmin和scopolin。迄今,从白花前胡中已发现11个简单香豆素类化合物。紫花前胡中共发现4个简单香豆素类化合物,其中东莨菪内酯(scopoletin)为白花前胡与紫花前胡共有的化学成分。具体信息见表1。
表1 白花前胡与紫花前胡中的简单香豆素类化合物
Table 1 Simple coumarin compounds from and
编号化合物名称来源文献 1伞形花内酯(umbelliferone)A7 2异莨菪亭(isoscopoletin)A7 3东莨菪内酯(scopoletin)A、B8-9 4东莨菪苷(scopolin)A6 5前胡醇[(−)-peucedanol]A10 6甲氧基欧芹酚(osthole)B11 7花椒素(suberosin)B12 8茵芋苷(skimmin)A6 9洋芫荽茵芋苷(apiosylskimmin)A13 10异秦皮啶(isofraxidin)A13 11ostruthinB14 12hymexelsinA13 138-carboxy-7-hydroxy coumarinA13 14eleutheroside B1A15
A-白花前胡 B-紫花前胡,下同
A-B-, same as below
1.1.2 呋喃香豆素类 孔令义课题组[8-10]自90年代起对前胡的活性成分进行了较为系统的研究,结果表明香豆素为白花前胡与紫花前胡的主要活性成分,但所含的香豆素类型却不相同。到目前为止,已从白花前胡中发现19个线型呋喃香豆素以及6个角型呋喃香豆素,从紫花前胡中共获得13个线型呋喃香豆素及7个角型呋喃香豆素,其中有8个呋喃香豆素为白花前胡与紫花前胡二者共有,见表2。
1.1.3 吡喃香豆素类 白花前胡的主要活性成分为角型吡喃香豆素,其中以白花前胡甲素含量最高,由陈政雄等[28]于1979年首次发现,该团队还同时发现了其他3种角型吡喃香豆素,分别为白花前胡乙素、白花前胡丙素以及白花前胡丁素。截至目前,从白花前胡中共发现了42个角型吡喃香豆素和6个线型吡喃香豆素,紫花前胡中共有6个角型吡喃香豆素和17个线型吡喃香豆素,见表3。
表2 白花前胡与紫花前胡中的呋喃香豆素类化合物
Table 2 Furanocoumarin compounds fromand
香豆素类主要成分的结构式见图1。
1.2 其他类
白花前胡与紫花前胡中除香豆素类化合物,还含有黄酮类、脂肪酸类、苯甲酸类以及甾体类等成分。2012年张村等[52]在白花前胡中首次发现了黄酮类化合物4-1-benzopyran-4-one,5-hydroxy-6-methoxy-2-phenyl- 7-α-glucuronyl methyl ester和4-1-benzopyran-4- one, 5-hydroxy-6-methoxy-2-phenyl-7-α--glucuronyl acid。白花前胡与紫花前胡中挥发油含量也较高,其中以烷烃、酯、酮、倍半萜为主,现已鉴定的成分有百余种[53-56]。具体信息见表4,结构式见图2。
2 药理作用
根据《中国药典》2020年版中记载,白花前胡和紫花前胡均具有降气化痰、散风清热的作用,主要用于治疗痰热喘满、咯痰黄稠、风热咳嗽痰多等症。虽白花前胡与紫花前胡所含化学成分不同,但主要活性成分均为香豆素类化合物。现代药理学研究表明香豆素类化合物具有抗凝血、抗氧化、抗菌、抗癌、抗炎等多方面的药理活性[59]。
表3 白花前胡与紫花前胡中的吡喃香豆素类化合物
Table 3 Pyranocoumarin compounds fromand
表4 白花前胡与紫花前胡中的其他类化合物
Table 4 Other constituents from P. praeruptorum and P. decursivum
编号化合物名称来源文献 1174H-1-benzopyran-4-one,5-hydroxy-6-methoxy-2-phenyl-7-O-α-D-glucuronyl methyl esterA52 1184H-1-benzopyran-4-one,5-hydroxy-6-methoxy-2-phenyl-7-O-α-D-glucuronyl acidA52 119丹参酮I(tanshinone I)A46 120丹参酮IIA(tanshinone IIA)A46 1219,10-dihydrophenanthrinic acidA57 122β-谷甾醇(β-sitosterol)A、B9, 16 123Pd-saponin-IB58 124Pd-saponin-IIB58 125Pd-saponin-IIIB58 126Pd-saponin-IVB58 127Pd-saponin-VB58 128胡萝卜苷(daucosterol)A、B9-10 129阿魏酸(ferulic acid)B11 130香草酸(vanillic acid)A21 131没食子酸(gallic acid)A21 132深黄水芹酮(crocatone)B12 133二十四烷酸(tetracosanoic acid)A18 1342,6-二甲基喹啉(2,6-dimethyl quinoline)A18 135腺苷(adenoside)A15 136ostenolB12 137白花前胡苷(baihuaqianhuoside)A22 138丁酸(butyric acid)A15 139棕榈酸(palmitic acid)A18 140半乳糖醇(galactitol)A10 141(−)-sclerodinA18 142acetylatractylodinolA46 143α-D-glucopyranose-1-hexadecanoateA15 144D-mannitol monohexadecanoateA15
2.1 祛痰平喘作用
前胡在《中药学》中归为化痰止咳平喘药,临床上常用于治疗咳嗽痰多等症。刘元等[60]和孟宪丽等[61]将酚红溶液注射入小鼠腹腔,以光密度表达酚红溶液浓度,结果表明白花前胡和紫花前胡均可增加酚红排泌量,并且采用毛细玻管排痰法研究发现紫花前胡与白花前胡均具有祛痰作用,而紫花前胡优后关福兰等[64]进一步探究白花前胡甲素对高钾及乙酰胆碱诱发的家兔气管平滑肌预收缩有较强的松驰作用,对高钾所致收缩的抑制效果更为明显,表明白花前胡具有平喘作用。张村等[65]通过小鼠祛痰酚红法、氨水喷雾致咳法以及豚鼠磷酸组胺喷雾致喘法,发现白花前胡蜜炙前后均能增加小鼠酚红排泌量,并且对氨水引起的小鼠咳嗽有抑制作用,进而说明白花胡具有祛痰、镇咳、平喘作用,而蜜炙后的白花前胡作用更加明显。熊友谊等[66]发现紫花前胡同样具有平喘作用,其团队通过对雌性BALB/c小鼠ip卵白蛋白,加以雾化吸入卵白蛋白模仿人类的哮喘模型,实验数据表明紫花前胡苷能显著降低气道阻力,并且下调白介素-4、白介素- 5、白介素-13细胞等炎性因子的表达,还可以抑制P65的核转位及磷酸化影响核因子-κB通路,从而发挥平喘抗炎作用。
2.2 对心血管的影响
2.2.1 抗心衰及抗心律失常作用 吴欣等[67]研究发现白花前胡丙素具有抑制离体豚鼠心房的自律性和氯化钙正性频率的作用,在临床观察中发现白花前胡丙素可增加心肌肥厚患者的心肌舒张振幅时间指数并且提高射频波相对振幅,表明白花前胡丙素对肥厚心肌的顺应性具有一定的改善作用,其作用机制可能是通过拮抗Ca2+实现。Kozawa团队[68]早在1980年最先发现白花前胡甲素可以抑制K+刺激引起的豚鼠结肠收缩,因而推测白花前胡甲素具有阻止Ca2+流入的活性。常天辉等[69]通过多导记录仪同步连续观测发现白花前胡水醇提取液可立即制止氯化钡诱发的大鼠心律失常的发作,且抗心律失常的时间可持续(8.50±5.01)min。在此基础上,该团队[70]通过全细胞膜片钳技术研究发现白花前胡甲素可使钙电流峰值变小,并且呈浓度相关性,提示白花前胡甲素抗心律失常作用可能是通过对钙电流的阻断作用。而由于心室肌动作电位平台期的形成有Ca2+内流和K+外流同时存在,所以该团队进一步验证白花前胡甲素是否对K+外流存在影响。同样利用全细胞膜片钳技术观察发现白花前胡甲素能促进K+通道开放,以剂量依赖的方式增加迟发性外向钾离子电流,从而抑制心律失常[71]。除此之外,吴晓冬等[72]发现白花前胡素E对氯化钾引起的离体兔主动脉条收缩有选择性的抑制作用,还可以抑制右心房自发性收缩节律和肾上腺素诱发的异位自律性,提示白花前胡素E可能具有抗心衰和抗心律失常的作用。

图1 白花前胡与紫花前胡中香豆素类成分化学结构

图2 白花前胡与紫花前胡中其他类成分化学结构
2.2.2 抗心肌缺血及保护心肌作用 常天辉等[40, 73-75]以结扎麻醉开胸猫左冠状动脉前降支诱发急性心肌梗塞为模型,发现白花前胡醇提物可增加冠脉流量,降低冠脉阻力、心肌耗氧量和心肌氧摄取率等指标,并且同时降低心肌缺血时血清中乳酸脱氢酶、肌酸激酶及其同功酶的活性和心肌梗死面积,呈剂量依赖趋势。基于此,该团队[76-78]利用大鼠在体心肌缺血再灌注模型,发现白花前胡甲素能改善缺血再灌注所致的心肌细胞结构的损伤,并且可增加超氧化物歧化酶(superoxide dismutase,SOD)活性,降低丙二醛(malondialdehyde,MDA)含量,减少白介素-6水平及B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,BAX)蛋白的表达,提示白花前胡醇提物及白花前胡甲素可抗心肌缺血再灌注损伤,对心肌具有一定的保护作用。刘小叶等[79]同样通过结扎大鼠冠状动脉左前降支建立心肌缺血再灌注损伤模型,研究发现白花前胡丙素同样可以增加SOD活性,减少MDA表达,并与剂量呈正相关,表明白花前胡丙素可以通过抗氧化损伤对心肌缺血再灌注损伤起到保护作用。林娜等[80]采用大鼠实验性自身免疫心肌炎模型,发现白花前胡甲素能增加巢蛋白表达,缓解心肌组织的炎性改变,同时降低血清天门冬氨酸转移酶和肌酸激酶值,从而起到保护心肌作用。
在细胞层面上,涂乾等[81-84]体外培养乳鼠心肌细胞,发现白花前胡醇提物可以抑制核转录因子c-Jun蛋白的表达,缩小肥大心肌细胞表面积,降低肥大心肌细胞蛋白质含量与心房钠尿肽(atrialnatriureticpeptide,ANP)的表达,上调心肌细胞Bcl-2蛋白表达,从而发挥保护心肌的作用,并且遏制肥大心肌细胞的心衰恶化进程。陈开祥等[85]通过培养乳鼠细胞的缺氧复氧模型来模拟缺血再灌注损伤模型,发现白花前胡丙素能降低细胞内钙浓度,并且减少细胞凋亡,表明白花前胡丙素对缺氧复氧损伤后的心肌细胞具有保护作用。该团队[86]进一步探究其机制,发现白花前胡丙素可以减轻心肌细胞模拟缺氧再灌注时的Ca2+超载,从而缓解缺氧再灌注对心肌细胞的损伤。除此之外,郑皓等[87]发现白花前胡丙素可以保护Na2S2O4和H2O2损伤的心肌细胞,降低心肌细胞死亡率,同时抑制心肌细胞受损时乳酸脱氢酶(lactase dehyarogenase,LDH)的释放,并且对正常的心肌细胞无影响,表明白花前胡丙素可能通过抑制脂质过氧化反应起到保护心肌细胞的作用。
2.2.3 降血压作用
(1)改善原发性高血压:饶曼人等[88]通过自发性高血压大鼠模型(spontaneously hyertensive rat,SHR)实验发现白花前胡丙素可抑制血管中膜层增厚,维持细胞内[Ca2+]i稳态,从而抑制血管收缩。除此之外,白花前胡丙素还可以促进平滑肌细胞释放一氧化氮(nitric oxide,NO),进一步扩张血管,降低血压。周四桂等[89]以SHR为模型,采用光电比色法测定心肌组织ATP酶活性发现白花前胡丙素可增加单位质量心肌组织ATP酶含量,但对酶与底物ATP的亲和力无影响,从而抑制高血压的进展。汪文杰等[90-93]同样利用SHR模型,发现白花前胡丙素可降低大鼠尾动脉收缩压,减轻心肌细胞肌丝排列紊乱现象,改善线粒体破坏程度及间质纤维化,并进一步研究发现白花前胡丙素还可上调SHR心肌肌浆网受磷蛋白的基因表达,以此逆转心室重构,改善心脏质量指数和左室质量指数。
(2)改善肾性高血压:季勇等[94]以肾性高血压左室肥厚(left ventricular hypertrophy,LVH)大鼠为模型发现白花前胡浸膏能减少LVH大鼠左心室肌线粒体和尾动脉条的钙含量,提示白花前胡浸膏的有效成分可阻滞细胞外钙内流,降低外周血管阻力以达到扩张冠脉、降低血压的作用。吴冬梅[95]采用两肾一夹法造肾性高血压大鼠模型,实验发现白花前胡丙素可以降低肾性高血压大鼠血压,并且降低肾性高血压大鼠尾动脉对氯化钾和去甲肾上腺素(norepinephrine,NE)所致收缩的反应性,提示白花前胡丙素可能通过松弛血管平滑肌作用而降低血压。除此之外,郭永强等[96]发现白花前胡乙素也可以降低肾性高血压大鼠血压,用药15 d后收缩压比给药前降低了28%。饶曼人等[88, 97]在实验中发现白花前胡丙素对肾性高血压大鼠模型(renal hypertensive rats,RHR)主动脉肥厚具有抑制作用,并且可以降低主动脉环对氯化钾量效反应敏感性,表明白花前胡丙素通过逆转左室肥厚,使血管松弛而降低血压。该团队[98-99]进一步探究,发现白花前胡香豆素组分可预防及逆转RHR左室肥厚,减少心肌细胞内钙含量,增加ATP酶活性,并且可以改善LVH大鼠心脏舒张功能,降低心肌胶原含量,从而降低血压。周四桂等[89, 100]采用两肾一夹RHR模型发现白花前胡丙素可以增加K+-ATP酶及Ca2+-ATP酶活力,升高酶的最大反应速度,实验数据表明白花前胡丙素给药4周时大鼠的收缩压下降23.2%,给药9周后收缩压降至空白组水平,提示白花前胡丙素不仅可以通过调节心肌ATP酶活力改善心脏功能,还可以通过改善心脏收缩功能起到降血压的作用。
(3)改善肺动脉高压:赵乃才等[101]通过犬低氧性肺动脉高压模型发现白花前胡石油醚提取物可以降低静息状态下肺动脉平均压(pulmonary arterial mean pressure,PAMP)、平均血压和舒张期血压,同时降低低氧所引起的肺总阻力以及体循环总阻力升高,表明白花前胡石油醚提取物能减少低氧引起的肺血管阻力增加和肺动脉压升高。康健等[102]对10名慢阻肺继发性肺动脉高压患者,采用右心漂浮导管的实验方法发现白花前胡水煎液可以降低总外周血管阻力(total peripheral vascular resistance,TPVR)和PAMP,提示白花前胡水煎液可能是通过主动扩张肺血管而降低肺血管阻力。席思川等[103]利用缺氧性肺动脉高压大鼠模型发现白花前胡提取液可以降低右心室收缩压和右心室肥大指数,表明白花前胡提取液有降低肺动脉压力的作用。除此之外,王秋月等[104-105]通过临床试验发现白花前胡提取物可以降低慢性缺氧性肺动脉高压患者的PAMP、TPVR以及肺血管阻力,同时降低血浆内皮素-1的水平,提示白花前胡提取物可能通过降低内皮素-1的合成或分泌降低肺动脉高压。王怀良等[106-110]采用野百合碱诱导的慢性炎症性肺动脉高压大鼠为模型,发现白花前胡提取物可以抑制肺动脉压升高,减少血管壁厚度,增加血管内径,提示白花前胡提取物能通过改善肺微循环,降低野百合碱诱导的慢性炎症性肺动脉高压。除上述体内实验外,白花前胡甲素在体外实验当中也被证实具有降低肺动脉高压的作用。徐磊等[111]采用双波长测定法,发现白花前胡甲素可以减少大鼠肺动脉平滑肌细胞中基础钙的含量,同时抑制钙池操纵性钙内流,表明白花前胡甲素可能是通过控制细胞内钙离子浓度,改善肺动脉高压。熊璐琪等[112]通过肺动脉平滑肌细胞发现白花前胡甲素可上调Kv1.5和Kv2.1 mRNA的表达,维持细胞膜电位的平衡,进而改善肺动脉高压。在离体实验中也表明白花前胡具有降血压的作用。Rao等[113]在离体猪冠状动脉条及豚鼠左心房研究中发现白花前胡丙素和白花前胡素E可以通过抑制钙离子进入平滑肌细胞,降低猪冠状动脉和豚鼠左心房的收缩作用。该团队[67, 114]进一步研究发现白花前胡丙素可以抑制5-羟色胺诱导的依外钙性收缩,从而舒张血管、降低血压,并进一步发现白花前胡丙素在控制流量与压力情况下,降低锥动脉阻力作用最强,呈剂量依赖性降低血压,推测其降压作用可能是通过降低外周阻力实现的[97]。康健等[115]以人离体肺动脉环为标本,发现白花前胡石油醚萃取物对NE预收缩的人肺动脉环有舒张作用,可使原张力下降25%。该团队[116]进一步以兔离体肺动脉环为研究对象发现白花前胡水煎剂与石油醚萃取物均可降低NE和氯化钾作用于肺动脉环的收缩反应,提示白花前胡中发挥舒张肺动脉作用的有效成分可能存在于极性较小的石油醚萃取物中。
紫花前胡中的活性成分也具有舒张血管的作用。欧前胡素是白花前胡与紫花前胡共同含有的活性成分,Nie等[117]发现欧前胡素可以抑制去氧肾上腺素引起的小鼠胸主动脉收缩,并且受一氧化氮合酶(nitric oxide synthase,NOS)抑制剂的影响,表明欧前胡素舒张血管可能是通过调节NO的表达。Li等[118]研究发现紫花前胡中补骨脂呋喃香豆精可以抑制去氧肾上腺素诱导的大鼠主动脉收缩,且补骨脂呋喃香豆精可以增加环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)的表达,而这种作用可以被NOS抑制剂L-NAME预处理阻断,表明补骨脂呋喃香豆精改善血管扩张功能与NO/cGMP信号通路密切相关。
2.2.4 抗凝作用 Matano等[119]最早发现紫花前胡中的紫花前胡苷III和IV具有抗血小板凝集作用。该团队研究心血管病患者新鲜血样发现紫花前胡苷III和IV可以抑制初级和次级血小板的凝集,呈剂量依赖性。Okuyama等[120]发现紫花前胡苷和苷元均可抑制二磷酸腺苷(adenonisine disphosphate,ADP)诱发的人初级和次级血小板凝集。在此基础上,孔令义等[58]通过人新鲜血样再次证实紫花前胡苷III、紫花前胡苷IV以及紫花前胡苷和紫花前胡苷元对血小板聚集均有抑制作用。除人血清外,孟宪丽等[61, 121]通过研究新西兰家兔血样发现不同产地的紫花前胡和白花前胡水煎剂对家兔血小板聚集均有抑制作用,并进一步对其机制进行探究发现紫花前胡苷可以通过抑制血小板活化因子(platelet activ ating factor,PAF)活性从而起到抗凝血作用。
白花前胡中的白花前胡甲素对ADP、PAF、花生四烯酸以及胶原所诱导的兔血小板聚集均具有抑制作用,其中对PAF所诱导的血小板聚集抑制效果更明显,提示白花前胡甲素可能为PAF类血小板聚集抑制剂[122]。但孔令义等[58]在实验中发现白花前胡甲素对血小板聚集具有促进作用。除此之外,胡荣等[123]通过大鼠实验发现欧前胡素还可以抑制由ADP和凝血酶引起的血小板聚集。
2.3 抗癌作用
Gawron等[124]选用人宫颈癌HeLa-S3细胞评价多种化合物的抗癌作用,实验结果显示白花前胡与紫花前胡均含有的异回芹内酯对HeLa-S3细胞的抑制率为69.7%。孔令义等[58]发现白花前胡乙素、白花前胡丙素以及紫花前胡次素能抑制由细胞外调节激酶-丝裂原活化蛋白激酶信号通路激活剂12-O-十四酰基-大戟二萜醇-13-乙醇酯(12--tetradecanoyl phorbol-13-acetate,TPA)所导致的磷脂磷酰化作用,而白花前胡甲素、白花前胡香豆精II以及北美芹素也均有不同程度的抑制作用。Wu等[125]研究发现,白花前胡中的吡喃香豆素可以引起KB-3-1细胞和对多药耐药(multiple drug resistance,MDR)的KB-V1细胞凋亡,IC50分别为(41.9±2.8)、(17.3±8.2)µmol/L,且吡喃香豆素处理24 h后,KB-V1细胞中的MDR1 mRNA和P-糖蛋白表达减少,提示白花前胡吡喃香豆素可能是潜在的MDR逆转剂。Fong等[126-127]发现白花前胡丙素可以抑制细胞周期蛋白依赖性激酶抑制剂p27的表达,使G1期细胞比例增加,表明白花前胡丙素是HL-60细胞分化的有效诱导物,该团队进一步发现白花前胡丙素可以使HL-60细胞发生DNA凋亡和核碎裂,并且降低线粒体膜电位和细胞色素C,增加总细胞数量以及线粒体Bax蛋白表达,刺激半胱天冬酶依赖的Bcl-2分裂增加,提示白花前胡丙素可能是通过上调促凋亡基因Bax表达以及下调抑制凋亡基因Bcl-2含量,诱导HL-60细胞凋亡。除此之外,陈清阁等[128]还发现白花前胡丙素能通过下调B7H3启动子区转录,下调人肺癌A549细胞mRNA转录。薛乃铭等[129]发现白花前胡乙素对人卵巢癌细胞增殖具有抑制作用,其机制可能是通过固醇调节元件结合蛋白-1c/脂肪酸合成酶信号通路调节人卵巢癌细胞能量代谢,从而抑制细胞增殖。Lin等[130]研究发现白花前胡乙素可以抑制人肾细胞癌的迁移和侵袭,其机制主要是通过下调组织蛋白酶C、组织蛋白酶V的mRNA和蛋白以及磷酸化丝裂原活化蛋白激酶的表达,同时降低表皮生长因子受体的磷酸化,从而抑制人肾细胞癌的迁移。
紫花前胡具有更强的抗癌作用。Cho等[131]发现紫花前胡醇提物可增加C6大鼠胶质瘤细胞中caspase-3、caspase-7和caspase-9的蛋白水解过程,提示紫花前胡醇提物能抑制C6大鼠胶质瘤细胞的生长。除此之外,欧前胡素对多种癌细胞生长均有抑制作用。李华、俞方红等[132-133]通过实验发现欧前胡素可诱导Mcl-1降解,激活Bak/Bax复合物,从而诱导肝癌细胞凋亡。陈虹[134]通过MTT法检测发现欧前胡素可以抑制人乳腺癌细胞株MCF-7的细胞活力,并且欧前胡素同样可以抑制细胞中Mcl-1的表达。刘明娟等[135]发现欧前胡素能抑制人前列腺癌PC3细胞增殖、侵袭迁移,并促进其凋亡,其机制可能是通过降低PC3细胞中ROCK1、RhoA mRNA以及蛋白的表达,抑制RhoA/ROCK1信号通路,从而促进PC3细胞凋亡。紫花前胡苷为紫花前胡与白花前胡共有的化学成分,付琼等[136]通过细胞实验发现紫花前胡苷可以上调HeLa细胞内的促凋亡蛋白水平升高,下调抗凋亡蛋白Bcl-2表达,提示紫花前胡苷可抑制HeLa细胞增殖活性并促进凋亡。
在体内实验中,叶祖光[137]通过4-硝基喹啉-1-氧化物造ddY小鼠肺肿瘤模型,结果表明白花前胡甲素可以减少每只小鼠的平均肺肿瘤数量。该团队进一步发现白花前胡甲素、白花前胡乙素以及白花前胡丙素对TPA所致小鼠背部皮肤肿瘤模型也具有抑制作用,其对小鼠皮肤肿瘤平均数量的抑制率分别为48%、35.6%和49.7%。李华[132]将R-HepG2细胞注射到裸小鼠体内,通过测量肿瘤大小发现欧前胡素可以在体内抑制MDR肝癌细胞的生长。
2.4 抗炎、抗氧化作用
王德才等[138]用二甲苯涂抹大鼠耳廓致炎,结果表明白花前胡总香豆素可以抑制耳廓肿胀程度,且白花前胡总香豆素可以抑制皮下注射蛋清所致大鼠足跖肿胀,并呈浓度依赖性。该团队[139]进一步探究发现白花前胡香豆素组分能清除羟自由基和超氧阴离子自由基,并且抑制小鼠肝匀浆脂质过氧化反应,表明白花前胡香豆素组分具有抗氧化作用。Menghini等[140]发现白花前胡甲素可以抑制巴豆油引起的小鼠耳部炎症。除此之外,白花前胡与紫花前胡共有的丝立尼亭亦可以抑制小鼠耳部炎症反应,降低肿胀率。王焱等[141]利用脂多糖(lipopolysaccharide,LPS)诱导人脐静脉内皮细胞表达炎症因子,发现白花前胡甲素可以抑制内皮细胞中肿瘤坏死因子-α、白介素-1β的表达,并且上调过氧化物酶体增殖物激活受体-α的表达,提示白花前胡甲素可能是通过此抑制炎症反应。
紫花前胡也具有抗炎抗氧化作用。Souri等[142]采用Furuta方法测定,发现补骨脂呋喃香豆精有抗氧化能力,其IC50值为44.03 µg。该实验还发现白花前胡与紫花前胡共有的佛手苷内酯也可以抑制亚油酸过氧化,效果优于补骨脂呋喃香豆精,其IC50值为38.39 µg。Kang等[143]采用LPS刺激人结肠癌细胞HT-29致炎,实验发现紫花前胡呋喃香豆素libanoridin可以降低诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶-2(cyclooxygenase-2,COX-2)、肿瘤坏死因子-α和白介素-1β等炎症因子在HT-29细胞中的表达,进而说明libanoridin具有抗炎作用。郑立娟等[144]通过大鼠牙齿根尖周炎模型发现,紫花前胡素可以减少大鼠根尖病灶面积,并且抑制经内毒素处理的RAW264.细胞的增殖能力,同时降低白介素-6和骨桥蛋白的表达,从而抑制炎症反应。唐晋等[145]通过百草枯中毒大鼠,发现紫花前胡素还能促进急性肾损伤肾脏中HSF1 mRNA和蛋白高表达,进而抑制肾炎症反应。Jayakumar等[146]发现紫花前胡中的哥伦比亚内酯可以降低LPS诱导的RAW 264.7细胞以及小鼠肝脏中肿瘤坏死因子-α、白介素-1β、iNOS和NO的表达,同时抑制核转录因子p65的磷酸化及核转位,从而改善炎症反应。
白花前胡与紫花前胡药理作用图见图3和图4。
2.5 其他作用
王德才[147]发现白花前胡总香豆素可延长小鼠被戊巴比妥钠催眠的时间,呈剂量相关性,且可以抑制肝微粒体苯胺羟化酶和氨基比林-脱甲基酶活性,提示白花前胡总香豆素组分能抑制小鼠肝药酶活性。Kim等[148]通过被动避暗回避反射试验、Y迷宫实验以及水迷宫实验测试紫花前胡苷对东莨菪碱诱导的小鼠学习和记忆障碍的影响,研究发现紫花前胡苷可逆转东莨菪碱引起的认知障碍,并且在水迷宫测试中减少了小鼠的逃跑潜伏期。在体外实验中发现紫花前胡苷可以抑制乙酰胆碱酯酶活性达6 h,表明紫花前胡苷可能通过增强胆碱能信号治疗认知障碍。Ali等[149]研究发现紫花前胡醇提物能够下调胰岛素抵抗HepG2细胞中PTP1B的表达,增强胰岛素敏感度,从而增加HepG2细胞对葡萄糖的摄取,进而改善细胞的胰岛素抵抗。Xie等[150]发现紫花前胡中的花椒素和佛手苷内酯具有抗菌作用,佛手苷内酯对葡萄赤霉病有较好的抑制作用,当浓度为30 µmol/L时,其抑制率为99.8%。佛手苷内酯以及花椒素还具有抗真菌作用,在30 µmol/L浓度时,其抑制率分别为61.0%和88.3%,提示白花前胡与紫花前胡具有抗菌作用。

箭头表示促进作用,T(丄)表示抑制作用,↑表示上调或激活,↓表示下调或失活,下图同
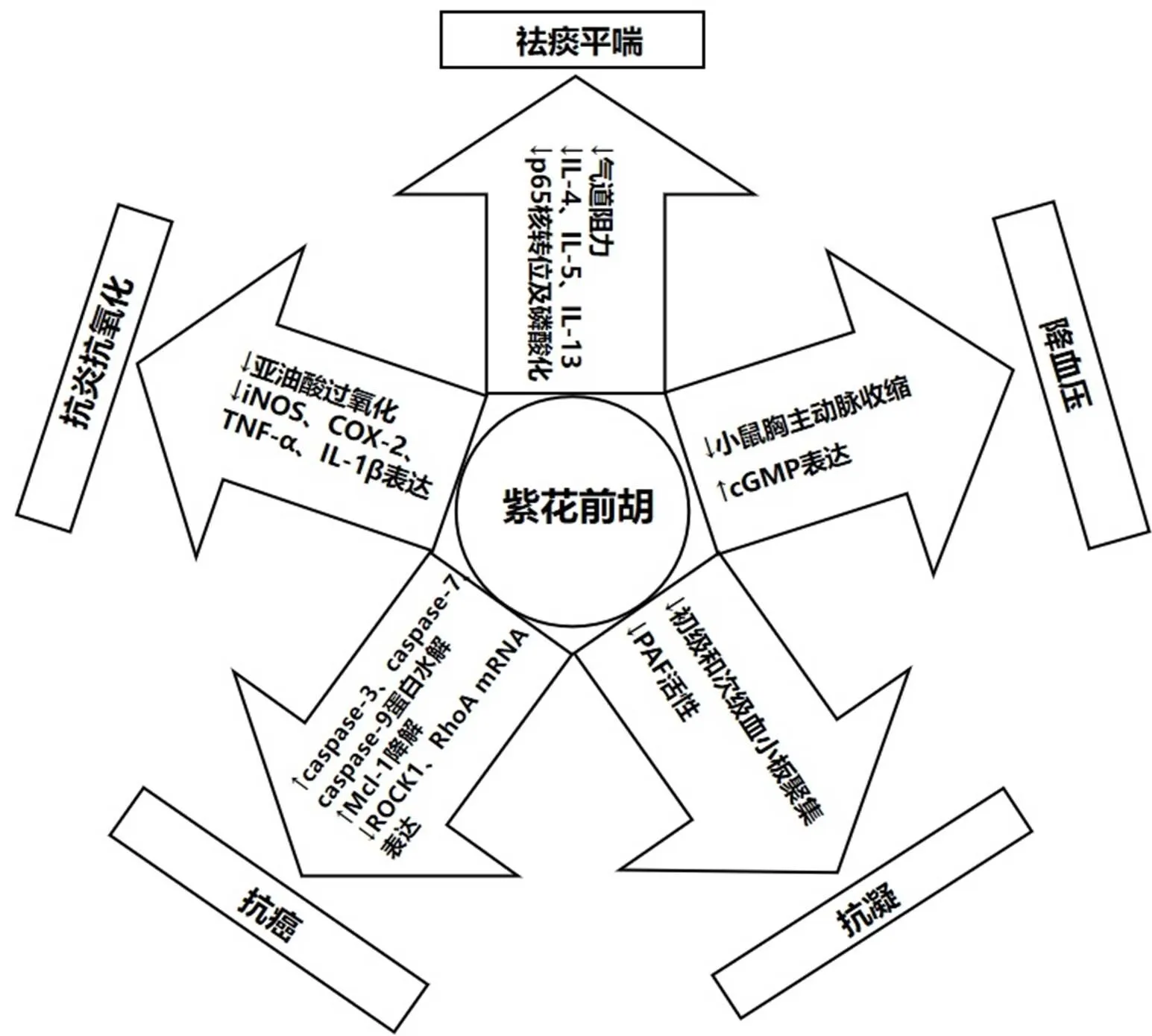
图4 紫花前胡的药理作用
3 结语
白花前胡与紫花前胡共同作为前胡的植物来源纳入《中国药典》1963年中,而历代均以白花前胡作为前胡的正品,紫花前胡是作为当归的替代品出现,并在民间广为流传,得名“土当归”,说明其功效应与当归相近,但《中国药典》2020年版中对白花前胡与紫花前胡功效记载一致,故本文通过化学成分以及药理作用对白花前胡与紫花前胡进行分析。现代药理学研究表明前胡中所含的活性成分主要为香豆素类化合物,白花前胡主要作用于心血管系统,具有抗心衰、降血压以及祛痰平喘等药理作用,其中白花前胡甲素以及白花前胡丙素是白花前胡发挥药理作用的主要活性成分;紫花前胡药理作用以抗凝、祛痰平喘、抗肿瘤为主,主要活性成分是线型呋喃香豆素紫花前胡苷和紫花前胡苷元。故以化学成分和药理作用进行分析,白花前胡与紫花前胡功效应存在差异,但现有文献未对紫花前胡临床疗效及药理作用进行充分研究,因而需进一步加大对紫花前胡的现代药学研究,以明确紫花前胡的临床功效及药理作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 梁·陶弘景集尚志钧辑校. 名医别录 [M]. 北京: 人民卫生出版社, 1986: 122.
[2] 中国药典 [S]. 一部. 1963: 178.
[3] 中国药典 [S]. 一部. 2005: 187.
[4] 中国药典 [S]. 一部. 2010: 248, 317-318.
[5] 中国药典[S]. 一部. 2020: 277, 352.
[6] Okuyama T, Takata M, Shibata S. Structures of linear furano- and simple-coumarin glycosides of Bai-Hua Qian-Hu [J]., 1989, 55(1): 64-67.
[7] Kong L Y, Li Y, Min Z D,. Coumarins from[J]., 1996, 41(5): 1423-1426.
[8] 孔令义, 李铣, 裴月湖, 等. 白花前胡中前胡香豆素D和前胡香豆素E的分离和鉴定 [J]. 药学学报, 1994, 29(1): 49-54.
[9] 许剑锋, 孔令义. 紫花前胡茎叶化学成分的研究 [J]. 中国中药杂志, 2001, 26(3): 178-180.
[10] 孔令义, 裴月湖, 李铣, 等. 白花前胡化学成分的研究(V) [J]. 中草药, 1993, 24(8): 401-404,446.
[11] 孙希彩, 张春梦, 李金楠, 等. 紫花前胡的化学成分研究 [J]. 中草药, 2013, 44(15): 2044-2047.
[12] 廖志超, 姜鑫, 田文静, 等. 紫花前胡中化学成分的研究 [J]. 中国中药杂志, 2017, 42(15): 2999-3003.
[13] Ishii H, Okada Y, Baba M,. Studies of coumarins from the Chinese drug Qianhu, XXVII: Structure of a new simple coumarin glycoside from Bai-Hua Qianhu,[J]., 2008, 56(9): 1349-1351.
[14] Liu R M, Sun Q H, Shi Y R,. Isolation and purification of coumarin compounds from the root of(Miq.) Maxim by high-speed counter-current chromatography [J]., 2005, 1076(1/2): 127-132.
[15] 张村, 肖永庆, 谷口雅彦, 等. 白花前胡化学成分研究III [J]. 中国中药杂志, 2009, 34(8): 1005-1006.
[16] 孔令义, 裴月湖, 李铣, 等. 前胡香豆素A的分离和结构鉴定 [J]. 药学学报, 1993, 28(6): 432-436.
[17] 常海涛, 李铣. 白花前胡化学成分的研究(V) [J]. 中草药, 1999, 30(6): 414-416.
[18] 张村, 肖永庆, 谷口雅彦, 等. 白花前胡化学成分研究II [J]. 中国中药杂志, 2006, 31(16): 1333-1335.
[19] Chang H T, Okada Y, Ma T J,. Two new coumarin glycosides from[J]., 2008, 10(5/6): 577-581.
[20] Kong L Y, Li Y, Min Z D,. Coumarins from[J]., 1996, 41(5): 1423-1426.
[21] 孔令义, 李铣, 裴月湖, 等. 白花前胡中白花前胡甙和Pd-C-I的分离和鉴定 [J]. 药学学报, 1994, 29(4): 276-280.
[22] Asahara T, Sakakibara I, Okuyama T,. Studies on coumarins of a Chinese drug “Qian-hu” V. coumarin-glycosides from “Zi-Hua Qian-hu”1[J]., 1984, 50(6): 488-492.
[23] Liu J L, Wang X Y, Zhang L L,. Two-dimensional countercurrent chromatography × high performance liquid chromatography with heart-cutting and stop-and-go techniques for preparative isolation of coumarin derivatives fromDunn [J]., 2014, 1374: 156-163.
[24] Asahara T, Sakakibara I, Okuyama T,. Studies on coumarins of a Chinese drug “Qian-hu” V. coumarin-glycosides from “Zi-HuaQian-hu” 1 [J]., 1984, 50(6): 488-492.
[25] 汪康, 聂竹霞, 孙云鹏, 等. 白花前胡化学成分研究 [J]. 安徽中医药大学学报, 2018, 37(5): 83-85.
[26] 张村, 李丽, 肖永庆, 等. 白花前胡中香豆素类成分的分析 [J]. 中华中医药杂志, 2011, 26(9): 1995-1997.
[27] Chang H T, Okada Y, Okuyama T,. 1H and13C NMR assignments for two new angular furanocoumarin glycosides from[J]., 2007, 45(7): 611-614.
[28] 陈政雄, 黄宝山, 佘其龙, 等. 中药白花前胡化学成分的研究: 四种新香豆素的结构 [J]. 药学学报, 1979, 14(8): 486-496.
[29] 孙希彩, 张春梦, 李金楠, 等. 紫花前胡的化学成分研究[J]. 中草药, 2013, 44(15): 2044-2047.
[30] Okuyama T, Shibata S. Studies on coumarins of a Chinese drug “Qian-Hu” [J]., 1981, 42(1): 89-96.
[31] 姚念环, 孔令义. 紫花前胡化学成分的研究 [J]. 药学学报, 2001, 36(5): 351-355.
[32] Avramenko L G, Nikonov G K, Pimenov M G. Andelin-A new dihydropyranocoumarin from the roots of[J]., 1970, 6(2): 186-189.
[33] 叶锦生, 张涵庆, 袁昌齐. 中药白花前胡根中香豆素白花前胡素(E)的分离鉴定 [J]. 药学学报, 1982, 17(6): 431-434.
[34] Takata M, Shibata S, Okuyama T. Structures of angular pyranocoumarins of Bai-HuaQian-Hu, the root of1[J]., 1990, 56(3): 307-311.
[35] Kong L Y, Li Y, Min Z D,. Coumarins from[J]., 1996, 41(5): 1423-1426.
[36] Kong L Y, Min Z D, Li Y,. Qianhucoumarin I from[J]., 1996, 42(6): 1689-1691.
[37] Hou Z G, Luo J G, Wang J S,. Separation of minor coumarins fromusing HSCCC and preparative HPLC guided by HPLC/MS [J]., 2010, 75(2): 132-137.
[38] Takata M, Okuyama T, Shibata S. Studies on coumarins of a Chinese drug, “Qian-hu”; VIII1. structures of new coumarin-glycosides of “Bai-Hua Qian-hu” [J]., 1988, 54(4): 323-327.
[39] Konoshima M, Chi H J, Hata K. Coumarins from the root ofNakai [J]., 1968, 16(6): 1139-1140.
[40] Niwa M, Kong L Y, Yao N H. Two new xanthyletin-type coumarins from[J]., 2000, 53(9): 2019.
[41] Lee J, Lee Y J, Kim J,. Pyranocoumarins from root extracts ofDunn with multidrug resistance reversal and anti-inflammatory activities [J]., 2015, 20(12): 20967-20978.
[42] 常海涛, 李铣. 白花前胡中的香豆素类成分 [J]. 沈阳药科大学学报, 1999, 16(2): 103-106.
[43] Li X Y, Zu Y Y, Ning W,. A new xanthyletin-type coumarin from the roots of[J]., 2020, 22(3): 287-294.
[44] 孔令义, 裴月湖, 李铣, 等. 前胡香豆素B和前胡香豆素C的分离和鉴定 [J]. 药学学报, 1993, 28(10): 772-776.
[45] Jong T T, Hwang H C, Jean M Y,. An antiplatelet aggregation principle and X-ray structural analysis of-khellactone diester from[J]., 1992, 55(10): 1396-1401.
[46] 张村, 肖永庆, 谷口雅彦, 等. 白花前胡化学成分研究(I) [J]. 中国中药杂志, 2005, 30(9): 675-677.
[47] 朱国元, 陈光英, 李庆洋, 等. HPLC/MS/MS技术在中药白花前胡成分鉴定中的应用 [J]. 中国天然药物, 2004, 2(5): 304-308.
[48] Kim C T, Kim W, Jin M H,. Inhibitors of melanogenesis from the roots of[J]., 2002, 33(4): 395-398.
[49] Kong L Y, Li Y, Niwa M. A new pyranocoumarin from[J]., 2003, 60(8): 1915.
[50] Lou H X, Sun L R, Yu W T,. Absolute configuration determination of angular dihydrocoumarins from[J]., 2004, 6(3): 177-184.
[51] 常海涛. 中药白花前胡降肺动脉高压成分的研究[D]. 沈阳药科大学, 1998.
[52] 张村, 肖永庆, 李丽, 等. 白花前胡化学成分研究(V) [J]. 中国中药杂志, 2012, 37(23): 3573-3576.
[53] 王玉玺, 刘训红, 杨巷菁. 泰山前胡与前胡的挥发油化学成分比较 [J]. 中草药, 1992, 23(6): 329,332.
[54] 孔令义, 侯柏玲, 王素贤, 等. 白花前胡挥发油成分的研究 [J]. 沈阳药学院学报, 1994, 11(3): 201-203.
[55] 俞年军, 刘守金, 梁益敏, 等. 不同产地白花前胡饮片挥发油化学成分的比较 [J]. 安徽中医学院学报, 2007, 26(1): 44-45.
[56] 雷华平, 邹书怡, 张辉, 等. 三种前胡挥发油成分分析 [J]. 中药材, 2016, 39(4): 795-798.
[57] Zhang C, Li L, Xiao Y Q,. A new phenanthraquinone from the roots of[J]., 2010, 21(7): 816-817.
[58] 孔令义, 裴月湖, 于荣敏, 等. 中药前胡的化学和药理研究概况 [J]. 国外医药: 植物药分册, 1991, 6(6): 243-254.
[59] Barot K P, Jain S V, Kremer L,. Recent advances and therapeutic journey of coumarins: Current status and perspectives [J]., 2015, 24(7): 2771-2798.
[60] 刘元, 韦焕英, 姚树汉, 等. 中药前胡类祛痰药理作用比较 [J]. 湖南中医药导报, 1997, 3(1): 40-43.
[61] 孟宪丽, 贾敏如, 张艺, 等. 不同品种中药前胡药理作用研究 [J]. 中药药理与临床, 1997, 13(1): 35-38.
[62] 刘元, 李星宇, 宋志钊, 等. 白花前胡丙素和紫花前胡苷祛痰作用研究 [J]. 时珍国医国药, 2009, 20(5): 1049.
[63] 金鑫, 章新华, 赵乃才. 白花前胡石油醚提取物对家兔离体气管平滑肌的作用 [J]. 中国中药杂志, 1994, 19(6): 365-367.
[64] 关福兰, 金万宝, 章新华, 等. 白花前胡甲素对高钾、乙酰胆碱预收缩的离体家兔气管平滑肌的作用 [J]. 中国医科大学学报, 1994, 23(6): 549-552.
[65] 张村, 殷小杰, 李丽, 等. 白花前胡蜜炙前后的药效学比较研究 [J]. 中国实验方剂学杂志, 2010, 16(15): 146-148.
[66] 熊友谊, 时维静, 俞浩, 等. 紫花前胡苷抑制哮喘小鼠气道炎性反应和NF-κB信号传导通路 [J]. 基础医学与临床, 2014, 34(5): 690-694.
[67] 吴欣, 饶曼人. 前胡丙素对离体豚鼠心房及人体心肌顺应性的影响[J]. 中国药理学报, 1990, 11(3):235-238.
[68] Kozawa T, Sakai K, Uchida M,. Calcium antagonistic action of a coumarin isolated from “Qian-Hu”, a Chinese traditional medicine [J]., 1981, 33(5): 317-320.
[69] 常天辉, 王玉萍, 于艳凤, 等. 中药白花前胡防治心律失常作用的实验研究I: 对氯化钡诱发大鼠心律失常的影响 [J]. 中国医科大学学报, 1991, 20(5): 337-339,343.
[70] 郝丽英, 李金鸣, 常天辉, 等. 白花前胡甲素对豚鼠单一心室肌细胞钙电流的频率依赖性阻断作用 [J]. 中国药理学与毒理学杂志, 1996, 10(1): 17-20.
[71] 王丽娟, 李金鸣, 常天辉, 等. 白花前胡甲素对豚鼠心室肌单细胞迟发性外向钾电流的影响 [J]. 中国药理学与毒理学杂志, 1995, 9(3): 192-195.
[72] 吴晓冬, 贺广远, 尹琰. 前胡E素对离体豚鼠心房和兔主动脉条的作用 [J]. 南京铁道医学院学报, 1996, 15(4): 250-252.
[73] 常天辉, 陈磊, 姜明燕, 等. 白花前胡对麻醉开胸猫急性心肌梗塞的影响 [J]. 中国医科大学学报, 2000, 29(2): 84-87.
[74] 姜明燕, 常天辉, 徐亚杰. 中药白花前胡对麻醉猫急性心肌梗死的保护作用 [J]. 中国医科大学学报, 2004, 33(1):22-23.
[75] 姜明燕, 徐亚杰, 沈君. 中药白花前胡及其有效成分前胡甲素对大鼠急性心肌缺血/再灌注损伤时血清酶活性的影响 [J]. 中国药学杂志, 2004, 39(6): 475-475.
[76] 姜明燕, 徐亚杰, 杜震, 等. 大鼠急性心肌缺血-再灌注损伤时心肌超微结构的变化与白花前胡及前胡甲素的保护作用 [J]. 沈阳药科大学学报, 2004, 21(1): 59-61.
[77] 姜明燕, 徐亚杰, 沈君. 白花前胡及前胡甲素对大鼠急性心肌缺血/再灌注损伤时血清中SOD, MDA的影响 [J]. 中国药学杂志, 2002, 37(8): 623-624.
[78] 常天辉, 章新华, 邢军, 等. 白花前胡及前胡甲素对心肌缺血再灌注大鼠IL-6水平及Fas、bax、bcl-2蛋白表达的影响 [J]. 中国医科大学学报, 2003, 32(1): 1-3.
[79] 刘小叶, 王国贤. 白花前胡丙素对心肌缺血再灌注损伤的影响[J]. 中国心血管病研究, 2009, 7(2):146-148.
[80] 林娜, 徐赫童, 杜子婧, 等. 前胡甲素上调实验性自身免疫心肌炎巢蛋白表达 [J]. 中药药理与临床, 2007, 23(3): 21-23.
[81] 涂乾, 涂欣, 全国芳. 白花前胡提取液含药血清抗内皮素1诱发心肌细胞肥大的实验研究 [J]. 湖北中医学院学报, 2006, 8(2): 5-7.
[82] 涂乾, 涂欣, 王颖. 白花前胡提取液含药血清对心肌细胞生长的影响 [J]. 山西中医, 2006, 22(4): 53-55.
[83] 涂乾, 涂欣. 白花前胡提取液含药血清抗ET-1诱发体外培养心肌细胞改变及ANP表达作用的研究 [J]. 浙江中医杂志, 2006, 41(4): 230-232.
[84] 涂乾, 涂欣, 田齐武, 等. 白花前胡提取液含药血清对ET-1诱发体外培养心肌细胞肥大及凋亡的影响 [J]. 山东中医杂志, 2006, 25(5): 342-344.
[85] 陈开祥, 祝宝华. 缺氧预适应和前胡丙素对心肌细胞的保护作用及机制[J]. 实用临床医药杂志, 2007, 11(01):35-38.
[86] 于晓頔, 祝宝华, 王金桂. 激光共聚焦显微镜观察前胡丙素对新生大鼠缺氧再灌注心肌细胞内游离钙的影响 [J]. 实用临床医药杂志, 2008, 12(5): 38-41.
[87] 郑皓, 王秋娟, 潘志伟, 等. 白花前胡丙素对实验性心肌缺血损伤的影响 [J]. 中国新药与临床杂志, 2007, 26(6): 409-412.
[88] 饶曼人, 刘宛斌, 刘培庆. 前胡丙素对高血压大鼠血管肥厚、细胞内钙、胶原及NO的影响 [J]. 药学学报, 2001, 36(3): 165-169.
[89] 周四桂, 黄河清, 陈少锐, 等. 前胡丙素对自发性及肾性高血压大鼠心肌组织ATP酶活性及酶促动力学参数的影响 [J]. 中国病理生理杂志, 2006, 22(6): 1074-1078.
[90] 孙黎明, 汪文杰, 陈开祥, 等. 前胡丙素对自发性高血压大鼠心肌受磷蛋白表达及磷酸化水平的影响 [J]. 南京医科大学学报: 自然科学版, 2013, 33(4): 467-470.
[91] 汪文杰, 孙黎明. 前胡丙素对自发性高血压大鼠心室重构的影响 [J]. 中国老年学杂志, 2011, 31(19): 3734-3735.
[92] 汪文杰. 前胡丙素对自发性高血压大鼠心室重构及心肌受磷蛋白表达的影响[D]. 安徽:蚌埠医学院, 2010.
[93] 汪文杰, 孙黎明. 前胡丙素对自发性高血压大鼠血压及心肌受磷蛋白表达的影响 [J]. 重庆医学, 2012, 41(14): 1392-1393.
[94] 季勇, 饶曼人. 白花前胡浸膏对肾型高血压大鼠左室肥厚的预防作用 [J]. 中草药, 1996, 27(7): 413-416.
[95] 吴冬梅, 李庆平, 饶曼人. 前胡丙素对肾型高血压大鼠血压及尾动脉反应性的影响 [J]. 中国药理学通报, 1997, 13(3): 242-243.
[96] 郭永强, 陈建鸣. 前胡乙素对肾性高血压大鼠外周血管反应性的影响 [J]. 山西临床医药, 2000, 9(7): 510-511.
[97] 饶曼人, 陈丹. 前胡丙素对高血压大鼠血压及犬血管阻力的影响 [J]. 药学学报, 2001, 36(11): 803-806.
[98] 饶曼人, 孙兰, 张晓文. 前胡香豆素对肾型高血压大鼠左室肥厚及心肌胞内钙、Na+, K+-ATP酶和Ca2+, Mg2+-ATP酶活性的影响 [J]. 药学学报, 2002, 37(6): 401-404.
[99] 饶曼人, 孙兰, 张晓文. 前胡香豆素组分对心脏肥厚大鼠心脏血流动力学、心肌顺应性及胶原含量的影响 [J]. 中国药理学与毒理学杂志, 2002, 16(4): 265-269.
[100] 周四桂, 黄河清, 陈少锐, 等. 前胡丙素对两肾两夹肾性高血压大鼠心脏重构及心功能的影响 [J]. 中国药理学通报, 2006, 22(5): 543-547.
[101] 赵乃才, 王怀良, 金鑫, 等. 白花前胡对犬低氧性肺动脉高压血流动力学及血气的影响 [J]. 中国医科大学学报, 1994, 23(3): 197-199.
[102] 康健, 于润江. 白花前胡降低慢阻肺继发性肺动脉高压的临床观察 [J]. 中国医科大学学报, 1994, 23(2): 122-125.
[103] 席思川, 阮英茆, 张连庄, 等. 前胡对大鼠缺氧性肺动脉高压逆转效应的实验观察 [J]. 中国中西医结合杂志, 1996, 16(4): 218-220.
[104] 王秋月, 李尔然, 赵桂喜, 等. 白花前胡提取物对慢性阻塞性肺疾病继发性肺动脉高压的影响 [J]. 中国医科大学学报, 1998, 27(6): 588-590.
[105] 王秋月, 康健, 李尔然, 等. 白花前胡提取物对缺氧性肺动脉高压病人血浆内皮素-1的影响 [J]. 中国医科大学学报, 2001, 30(1): 28-30.
[106] 王健勇, 王怀良, 章新华, 等. 白花前胡对野百合碱所致大鼠肺动脉高压的影响 [J]. 中国药学杂志, 2000, 35(2): 90-92.
[107] 洪洋, 邢军, 王怀良, 等. 白花前胡对大鼠血流动力学和流变学作用研究 [J]. 中国医学物理学杂志, 2001, 18(3): 176-177.
[108] 周荣, 王怀良, 章新华. 白花前胡对肺动脉高压大鼠肺循环血液流变学、血液动力学的影响及相关性分析 [J]. 中国现代应用药学, 2001, 18(4): 263-266.
[109] 周荣, 王怀良, 章新华, 等. 白花前胡对肺动脉高压大鼠肺循环血液流变学及血流动力学的影响 [J]. 中国医科大学学报, 2001, 30(5): 325-327.
[110] 杨春光, 王怀良, 裴汨, 等. 白花前胡对肺动脉血管的收缩作用 [J]. 中国公共卫生, 2004, 20(5): 567-568.
[111] 徐磊, 张敏, 付秀华. 白花前胡甲素对大鼠肺动脉平滑肌细胞钙浓度的影响[J]. 国际呼吸杂志, 2015, 35(13):1004-1007.
[112] 熊璐琪, 邓惠萍, 肖毅频. 白花前胡甲素对低氧诱导的大鼠肺动脉平滑肌细胞Kv1.5和Kv2.1表达的影响 [J]. 广东医学, 2015, 36(20): 3119-3122.
[113] Rao M R, Shen X H, Zou X. Effects of praeruptorin C and E isolated from ′Qian-Hu′ on swine coronary artery and guinea-pig atria [J]., 1988, 155(3): 293-296.
[114] 吴欣, 饶曼人. 前胡丙素对豚鼠心房和兔主动脉条的钙拮抗作用 [J]. 中国药理学与毒理学杂志, 1990, 4(2): 104-106.
[115] 康健, 于润江, 章新华, 等. 白花前胡石油醚提取物对人离体肺动脉环的舒张作用 [J]. 中国医科大学学报, 1993, 22(2): 120-122.
[116] 魏敏杰, 章新华, 赵乃才. 前胡对兔离体肺动脉的作用 [J]. 中草药, 1994, 25(3): 137-139.
[117] Nie H, Meng L Z, Zhou J Y,. Imperatorin is responsible for the vasodilatation activity ofvar.regulated by nitric oxide in an endothelium-dependent manner [J]., 2009, 15(6): 442-447.
[118] Li X, Lee Y J, Kim Y C,. Bakuchicin induces vascular relaxation via endothelium-dependent NO-cGMP signaling [J]., 2011, 25(10): 1574-1578.
[119] Matano Y, Okuyama T, Shibata S,. Studies on coumarins of a Chinese drug “Qian-hu” ; VII. Structures of new coumarin-glycosides of Zi-Hua Qian-hu and effect of coumarin-glycosides on human platelet aggregation [J]., 1986(2): 135-138.
[120] Okuyama T, Kawasaki C, Shibata S,. Effect of oriental plant drugs on platelet-aggregation. II. Effect of Qian-hu coumarins on human platelet aggregation [J]., 1986(2): 132-134.
[121] 张艺, 贾敏如, 孟宪丽, 等. 中药紫花前胡抗血小板活化因子(PAF)作用的研究 [J]. 成都中医药大学学报, 1997, 20(1): 39-40.
[122] Aida Y, Kasama T, Takeuchi N,. The antagonistic effects of khellactones on platelet-activating factor, histamine, and leukotriene D4 [J]., 1995, 43(5): 859-867.
[123] 胡荣, 李祖伦, 杨金荣, 等. 白芷提取物欧前胡素对洗涤血小板功能的影响 [J]. 成都中医药大学学报, 2012, 35(2): 86-87,94.
[124] Gawron A, Głowniak K. Cytostatic activity of coumarins[J]., 1987, 53(6): 526-529.
[125] Wu J Y, Fong W F, Zhang J X,. Reversal of multidrug resistance in cancer cells by pyranocoumarins isolated fromPeucedani [J]., 2003, 473(1): 9-17.
[126] Fong W F, Zhang J X, Wu J Y C,. Pyranocoumarin (±)-4′--Acetyl-3′--angeloyl--khellactone induces mitochondrial-dependent apoptosis in HL-60 cells [J]., 2004, 70(6): 489-495.
[127] Zhang J X, Fong W F, Wu J Y C,. Pyranocoumarins isolated fromas differentiation inducers in human leukemic HL-60 cells [J]., 2003, 69(3): 223-229.
[128] 陈清阁, 王雄彪. 白花前胡丙素对人肺癌A549细胞B7H3表达的调节作用[J]. 医药前沿, 2018, 8(4):123.
[129] 薛乃铭, 柴梦钰, 杨万山, 等. 白花前胡乙素通过SREBP1c/FASN信号通路抑制卵巢癌SK-OV-3细胞增殖的作用 [J]. 中国老年学杂志, 2021, 41(13): 2773-2777.
[130] Lin C L, Hung T W, Ying T H,. Praeruptorin B mitigates the metastatic ability of human renal carcinoma cells through targeting CTSC and CTSV expression [J]., 2020, 21(8): E2919.
[131] Cho S H, Kim D K, Kim C S,. Induction of apoptosis byextract is associated with the activation of caspases in glioma cells [J]., 2009, 52(3): 241-246.
[132] 李华. 欧前胡素抑制人耐药性肝癌细胞增殖及其分子机制研究 [D]. 杭州: 浙江大学, 2014.
[133] 俞方红, 黄晓燕. 欧前胡素下调Mcl-1蛋白表达诱导人肝癌细胞HepG2凋亡实验研究 [J]. 浙江中西医结合杂志, 2015, 25(4): 334-336.
[134] 陈虹. 欧前胡素体外诱导人乳腺癌细胞株MCF-7凋亡 [J]. 浙江实用医学, 2015, 20(3): 177-179.
[135] 刘明娟, 韩瑞霞, 李铁, 等. 欧前胡素对人前列腺癌PC3细胞增殖凋亡及RhoA/ROCK1信号通路的影响 [J]. 河北医学, 2021, 27(3): 362-367.
[136] 付琼, 殷金凤, 颜爱华. 紫花前胡苷抗宫颈癌细胞作用研究 [J]. 安徽医药, 2021, 25(5): 858-862.
[137] 叶祖光. 天然产物抗促癌活性的研究(8): 白花前胡中的香豆素对二阶段致癌的抑制作用 [J]. 国外医学: 中医中药分册, 1995, 17(6): 33-34.
[138] 王德才, 马健, 孔志峰, 等. 白花前胡总香豆素解热镇痛抗炎作用的实验研究 [J]. 中国中医药信息杂志, 2004, 11(8): 688-690.
[139] 王德才, 张显忠, 冯蕾. 白花前胡香豆素组分体外抗氧化活性研究 [J]. 医药导报, 2008, 27(8): 899-901.
[140] Menghini L, Epifano F, Genovese S,. Antiinflammatory activity of coumarins fromMill. subsp.(Guss.) Tammaro (Apiaceae) [J]., 2010, 24(11): 1697-1699.
[141] 王焱, 杨翠, 常贺, 等. 前胡甲素通过PPARα抑制LPS诱导的内皮细胞的炎症反应 [J]. 中国药理学通报, 2012, 28(11): 1594-1597.
[142] Souri E, Farsam H, Sarkheil P,. Antioxidant activity of some furanocoumarins isolated from[J]., 2004, 42(6): 396-399.
[143] Kang K H, Kong C S, Seo Y,. Anti-inflammatory effect of coumarins isolated fromin HT-29 human colon carcinoma cells [J]., 2009, 47(8): 2129-2134.
[144] 郑立娟, 李浩然, 刘健伟, 等. 紫花前胡素通过降低OPN表达抑制根尖周炎进程 [J]. 口腔医学研究, 2021, 37(3): 213-217.
[145] 唐晋, 彭超华, 陈雪梅, 等. 紫花前胡素对百草枯中毒大鼠急性肾损伤的保护作用及肾组织HSF1表达的影响 [J]. 中国中西医结合肾病杂志, 2020, 21(9): 759-763,847.
[146] Jayakumar T, Hou S M, Chang C C,. Columbianadin dampensinflammatory actions and inhibits liver injury via inhibition of NF-κB/MAPKs: Impacts on∙OH radicals and HO-1 expression [J]., 2021, 10(4): 553.
[147] 王德才, 赵晓民, 李同德, 等. 白花前胡中总香豆素组分对小鼠肝药酶活性的影响 [J]. 医药导报, 2004, 23(8): 522-524.
[148] Kim D H, Kim D Y, Kim Y C,. Nodakenin, a coumarin compound, ameliorates scopolamine-induced memory disruption in mice [J]., 2007, 80(21): 1944-1950.
[149] Ali M Y, Jannat S, Jung H A,. Insulin-mimetic dihydroxanthyletin-type coumarins fromwith protein tyrosine phosphatase 1B and α-glucosidase inhibitory activities and docking studies of their molecular mechanisms [J]., 2021, 10(2): 292.
[150] Xie Q, Li S, Liao D,l. Bio-pesticidal and antimicrobial coumarins from(Fisch. Ex Hoffm) [J]., 2016, 10(3):294-306.
Research progress on chemical constituents and pharmacological activities ofand
SONG Zhi-qi1, LI Bin2, TIAN Kun-yu1, HONG Lin3,WU Wei3, ZHANG Hui-yong1, 4
1. Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China 2. Dalian Medical University, Dalian116044, China 3. Zhuhai College of Science and Technology, Zhuhai 519041, China 4. Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110032, China
Qianhu () and Zihuaqianhu () are the dried roots ofand, respectively. Both of which contain similar chemical constituents, such as coumarins, flavonoids and volatile oil. However, the main active ingredients ofandare angular pyrancoumarins and linear furocoumarins, respectively. Modern pharmacology research showedexhibited a range of biological activities including anti-heart failure, antihypertensive and anti-myocardial ischemia; whileexhibited better anti-tumor and anticoagulant effects. Although the functions and indications ofandwere described in the same way in Chinese Pharmacopoeia, there were differences in the chemical constituents and pharmacological effects based on the data from the modern researches on them. In this review, the chemical constituents and pharmacological activities ofandwere systematically summarized, in order to provide a reference for modern clinical applications and in-depth pharmacodynamic mechanism researches on the two commonly usedmedicinal materials.
Dunn;(Miq.) Maxim; coumarins; anti-heart failure; antihypertensive effect; anticoagulant effect; anti-tumor
R286
A
0253 - 2670(2022)03 - 0948 - 17
10.7501/j.issn.0253-2670.2022.03.035
2021-08-09
广东省自然科学基金项目(2021A1515011485);沈阳市中青年科技创新人才支持计划项目(RC190281)
宋芷琪(1996—),女,硕士研究生在读,研究方向为中医药疗效评价方法。E-mail:song161117@163.com
吴 威(1983—),女,教授,研究方向为基于中医理论的传统中药和方剂的药理学研究,中药及天然药物活性化学成分研究。E-mail: 15998871701@163.com
张会永(1983—),男,主任中医师,教授,研究方向为中医古典方剂的文献整理研究及经典方剂的临床应用与实验研究。E-mail: aaa925@163.com
#共同第一作者:李 斌(1983—),女,讲师,研究方向为中药药效物质基础。E-mail: eleven_lb@126.com
[责任编辑 时圣明]
