青风藤化学成分和药理作用的研究进展及其质量标志物(Q-Marker)的预测分析
2022-02-14罗艳群沈小兰蔡三金梅志刚冯知涛
罗艳群,沈小兰,蔡三金,梅志刚,冯知涛, 3*
青风藤化学成分和药理作用的研究进展及其质量标志物(Q-Marker)的预测分析
罗艳群1,沈小兰1,蔡三金1,梅志刚2*,冯知涛1, 3*
1. 三峡大学医学院,湖北 宜昌 443002 2. 湖南中医药大学中西医结合学院,湖南 长沙 410208 3. 三峡大学国家中医药管理局中药药理科研三级实验室,湖北 宜昌 443002
青风藤主要含有生物碱、挥发油、脂和甾体等活性成分。以青藤碱为代表的异喹啉类生物碱目前研究居多,其在风湿痹痛、关节肿痛、麻痹瘙痒中显示出良好的临床效果。青风藤在临床中应用越来越广泛,其质量评价方法亟需建立。根据中药质量标志物(quality marker,Q-Marker)新概念,从植物亲缘学和化学成分特有性、有效性、药性相关性、化学成分可测性等方面对青风藤Q-Marker进行预测分析,青藤碱、木兰花碱、蝙蝠葛任碱、左旋千金藤啶碱、千金藤宁碱、去甲乌药碱、尖防己碱等多种生物碱及挥发油、甾醇、蒽醌、菲及酚类物质可作为青风藤的主要Q-Marker,为青风藤质量评价体系的建立提供依据和相关新药研发提供参考。
青风藤;青藤碱;木兰花碱;蝙蝠葛任碱;左旋千金藤啶碱;千金藤宁碱;去甲乌药碱;尖防己碱
青风藤,又名寻风藤、青藤,是防己科植物青藤(Thunb) Rehd et Wils.及毛青藤(Thunb) Rehd. et Wils. var.Rehd. et Wils.的干燥藤茎,其性味苦、辛、平,归肝、脾经,始载于宋代《本草图经》。据《中国药典》2020年版记载,青风藤具有祛风湿、通经络、利小便等功效,临床主要用于治疗风湿痹痛、关节肿胀、麻痹瘙痒[1]。近年来,随着青风藤在临床应用推广,其药理作用与机制研究也越来越多,然而其质量评价方法是亟需解决的临床关键问题。青藤碱为青风藤有效成分中含量最高、活性最强的化合物,常作为青风藤的质量评价指标。网络药理学预测发现,青风藤不仅有多个化合物作用于同一个靶蛋白,同时还有单个化合物作用于多个靶蛋白、多个通路发挥疗效,因此仅以单一成分青藤碱作为质量控制指标显然是不完善的[2-3]。故本文旨在对青风藤的化学成分和药理作用的研究进展进行综述,并根据中药质量标志物(quality marker,Q-Marker)进行预测分析,为青风藤的质量评价和相关产品研发提供科学依据。
1 化学成分
青风藤含有多种化学成分,主要包括生物碱、挥发油、脂、蒽醌、菲、甾体及酚类等成分,其中生物碱类成分为目前的研究热点,挥发油、蒽醌等类成分的相关研究相对较少,脂和甾体等物质的研究尚待进一步加强[4-5]。
1.1 生物碱
生物碱是目前认为的青风藤中主要的药理活性成分,目前从中已提取63个生物碱,其结构类型主要有异喹啉类、阿朴啡类、吗啡烷类和其他骨架生物碱,具有免疫调节、镇痛、抗炎等作用[5]。占主要成分的为异喹啉类、阿朴啡类生物碱,包含木兰花碱等能逆转多药耐药;吗啡类生物碱如2,2′-双青藤碱对肿瘤细胞具有较弱的抑制作用;其他骨架结构的生物碱有原小檗碱类生物碱如青藤胺H、莲花烷类生物碱如青藤胺K、氧化异阿朴菲类生物碱如青藤胺D、苯并喹啉类生物碱如青藤胺F、原阿朴啡类生物碱如青藤胺M等,从生物碱系列结构可看出,菲核结构为其共性,且这一系列生物碱在生物合成和药理作用方面都有一定共性[6-7]。随着对青风藤更深入的研究,13种新的生物碱结构也陆续被发现[8-10]。其中以青藤碱为代表的生物碱类是青风藤中有效成分含量最高、活性最强的化合物,青风藤部分生物碱见表1,部分生物碱的化学结构见图1。
1.2 挥发油
青风藤中挥发油类物质研究较少。据最新研究,通过气相色谱-质谱联用技术对青风藤中挥发油成分进行分离鉴定,共鉴定出匹配化合物63个,主要成分为脂肪酸、甾醇、烯烃以及少量的醛类等物质,含量最多的为十八烷酸和十六烷酸[11]。研究发现酯类化合物依据其链长对生物活性有影响且呈现出一定规律性,链长越长能明显的抑制一氧化氮生成且无明显的细胞毒性,并能够抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及白细胞介素-6(interleukin-6,IL-6)等炎症细胞因子的生成[12],化合物名称见表2。
表1 青风藤中部分生物碱
Table 1 Some alkaloids inSinomenii Caulis
编号化合物名称文献编号化合物名称文献 1青藤碱415四氢巴马亭 7 2双青藤碱416表小檗碱 7 3尖防己碱417telitoxine 7 4四氢表小聚碱418去氢碎叶紫堇碱 7 5土藤碱4191-hydroxy-10-oxo-sinomenine 7 6光千金藤碱4202,2-双青藤碱 8 7白兰花碱421蝙蝠葛宁 8 88,14-二氢萨鲁塔里定碱422青藤胺H 8 9青风藤碱423青藤胺K 8 10千金藤宁424青藤胺F 8 11紫堇杷明碱725青藤胺M 8 128-8-氧代小檗碱726青藤胺D 8 13N-甲酰基番荔枝碱727蝙蝠葛任碱10 14N-甲酰基原荷叶碱728木兰花碱10
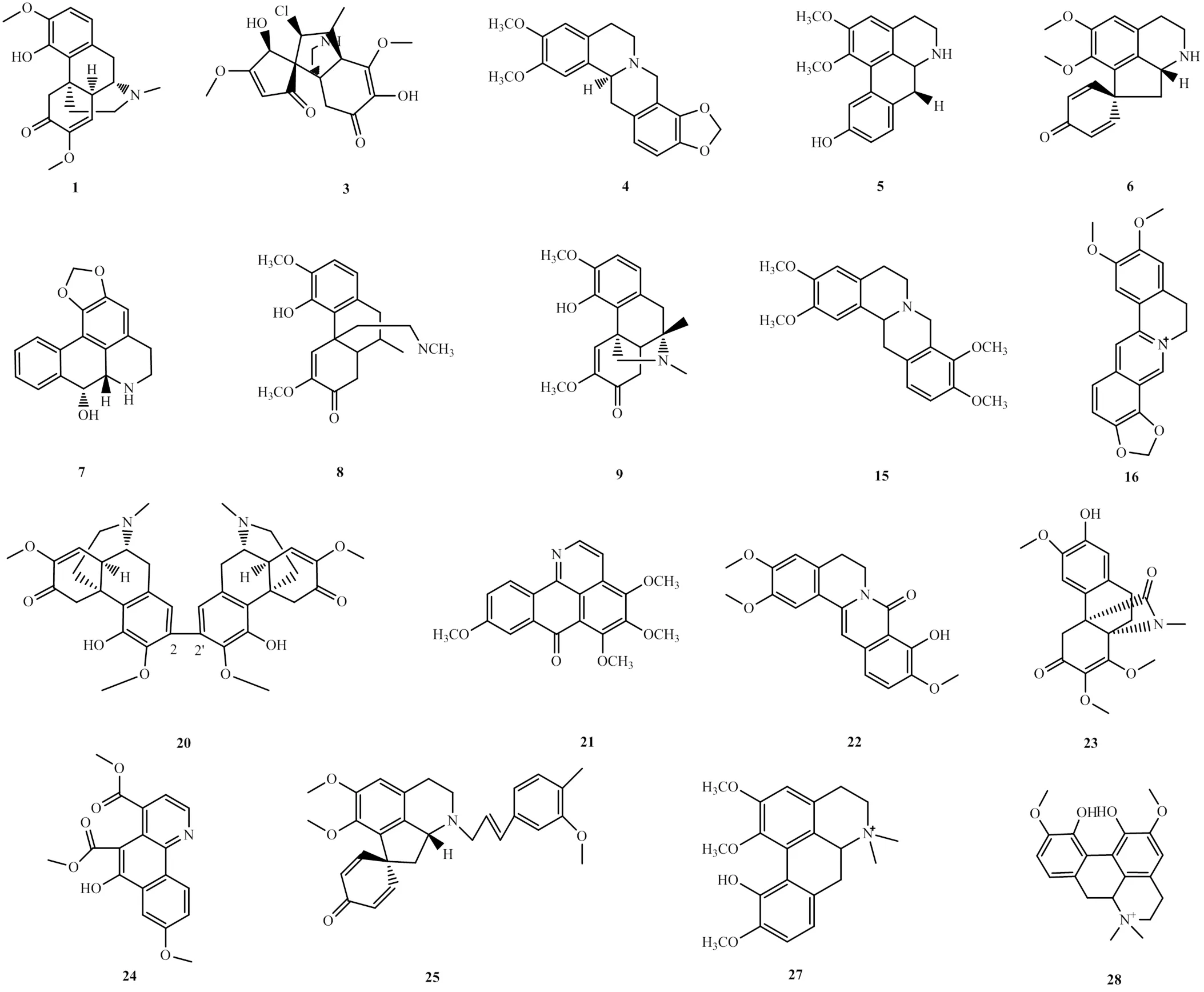
图1 青风藤中部分生物碱的化学结构
1.3 其他
吕海宁等[13]从青风藤中分离出19种非生物碱化合物,包括3种菲类化合物(3-羟基-2,6,7-三甲氧基菲、3,5-二羟基-2,6-二甲氧基菲、巴豆黄素)、6种蒽醌类化合物(大黄素、钝叶素、橙黄决明素、6,8-二羟基-1,2,7-三甲氧基-3-甲基蒽醌、决明素、黄决明素)和10种酚类化合物[对羟基苯甲醛、香兰素、丁香醛、乙酰香草酮、异乙酰香草酮、丙基丁香酮、丁香酸甲酯、丁香酸乙酯、3,4,5-三甲氧基苯酚、()-3,3′-二甲氧基-4,4′-二羟基二苯乙烯]。以上研究提示青风藤中含有多种有效成分,并可能会成为新的潜在研究方向。
2 药理作用
青风藤具有多种生物学活性,根据《中国药典》记载,青风藤具有祛风湿、通经络及利小便作用,而随着现代药理学研究的深入,发现青风藤还具有抗炎、镇痛、免疫抑制等多种药理作用,且可通过多种途径在肿瘤、心血管、免疫及神经系统等多种疾病的治疗中发挥一定效用。
2.1 抗炎
基于青风藤抗炎、镇痛及免疫抑制的作用,其在治疗自身免疫性疾病中发挥着显著作用。而传统中医著作中对此作用也早已有了记载。明代《本草纲目》载:“风湿流注,历节鹤膝,麻痹瘙痒,损伤疮肿,入酒药中用”。清朝张秉承著《本草便读》,其中记载青风藤:“凡藤蔓之属,皆可通经入络,此物善治风疾,故一切历节麻痹皆治之,浸酒尤妙。以风气通于肝,故入肝,风胜湿,湿气又通于脾也”。清朝龙柏《药性考》也有记载:“湿痹骨痛,脚腿转筋,鹤膝风痿,麻木风疼,熬膏浸酒,治风有灵”。据此,可知基于青风藤的祛风湿、通经络的传统药效,古人将其最先用于风湿性疾病的治疗。而随着现代研究的深入,青风藤逐渐被应用到更多的免疫系统疾病治疗中。
表2 青风藤中挥发油类成分
Table 2 Volatile oil in Sinomenii Caulis
编号化合物名称文献编号化合物名称文献 29庚醛11602,6,10-三甲基-十五烷11 302,5,6-三甲基癸烷1161十四烷11 31(Z)-2-庚醛11622,6,10-三甲基十四烷11 32顺-4-癸烷1163cyclotridecane11 332,6,7-三甲基癸烷11643-甲基-5-丙基壬烷11 341,4-二氯苯11653,7,11-三甲基-1-十二醇11 35dodecanese11662,4-bis(1,1-dimethylethyl)-phenol11 362,6-二甲基癸烷11672-十六烷醇11 373,7-二甲基-1-辛醇11687-甲基十五烷11 384,7-二甲基十一烷1169二十烷11 393,7-二甲基癸烷1170(Z,Z)-9,12-十八碳二烯-1-醇11 403,3-二甲基-6-苯基己腈1171顺-7-十二烯-1-醇11 41(S)-2-甲基-1-十二烷醇11729,12,15-十八烷三醛11 42(R)-4-萜品醇1173(Z)-3-十七碳烯11 432,4,6-三甲基辛烷11743,5,3′,5′-四甲基11 442,6-二甲基-十一烷11752,6,10,15-四甲基十七烷11 45p-menth-1-en-8-ol11763,4-diethyl-1,1′-biphenyl11 462,7,10-三甲基十二烷1177methoxyacetic acid,2-trideyl ester11 47十五烷11782-十五烷11 482,3,5,8-四甲基癸烷1179(E)-1,2,3-三甲基-4-丙烯基萘11 494,6-二甲基十二烷1180十八醛11 502,6,10,14-四甲基十七烷1181四十四烷11 51十一烷11822-甲基-1-十六烷醇11 5210-甲基十九烷11832,6-二甲基十七烷11 532,6,11-三甲基十二烷118417-octadecenal11 54(E)-1-(2,6,6-三甲基-1,3-环己二烯-1-基)-2-11856,10,14-三甲基-2-十五烷酮11 丁烯-1-酮 862-(十八烷基)-乙醇11 551-十三醇1187甲基十六烷酸甲酯11 56十六烷1188labda-8(20),12,14-triene11 57十七烷1189n-棕榈酸11 584-甲基十四烷1190(Z,Z)-9,12-十八烷二烯酸11 59十二烷1191异薄荷酮11
研究表明,青风藤对于蛋白性、化学性、细菌性等多类炎症均有抗炎作用,生物碱类成分具有良好的抗炎作用,其中青藤碱为其主要抗炎物质。通过谱效关系和化学计量学方法鉴定青风藤中的抗炎成分,结果表明青风藤中的青藤碱、木兰花碱、蝙蝠葛任碱、千金藤宁碱为青风藤的主要抗炎成分[10]。通过网络药理学方法对青风藤治疗类风湿关节炎的药理机制进行探究,发现青风藤发挥治疗类风湿关节炎的成分可能是拉兹马宁碱、千金藤啶碱、β-谷甾醇、青藤碱等[3]。木兰花碱可分别通过调控核因子κB(nuclear factor kappa-B,NF-κB)、丝裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)和磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol- 3-hydroxy kinase/protein kinase B,PI3K/Akt)信号通路而发挥免疫抑制作用对抗炎症,且可延缓软骨退化及防止骨关节炎的进展[14-15]。微粒体前列腺素E合酶1(microsomal prostaglandin E synthase-1,mPGES-1)是前列腺素E2的末端合酶,能催化环氧化酶-1(cyclooxygenase-1,COX-1)和COX-2衍生的前列腺素H2转化为前列腺素E2,在类风湿关节炎、癌症、动脉粥样硬化等多种慢性疾病中皆有表达,Zhou等[16]研究表明青藤碱为mPGES-1的选择性抑制剂,通过动物实验与细胞培养验证,发现青藤碱可抑制脂多糖激活的巨噬细胞产生炎症介质和细胞因子,且不影响细胞活力,并能选择性下调脂多糖激活的巨噬细胞mPGES-1的表达以及抑制炎症大鼠足爪组织mPGES-1的表达;成纤维样滑膜细胞的过度增殖及炎性反应致类风湿关节炎患者关节滑膜组织增生,加重了患者负担。王中扬等[17]发现不同浓度青藤碱均能抑制脂多糖诱导成纤维样滑膜细胞的增殖,且呈浓度相关性。脂多糖是一种重要的炎性物质,青藤碱可通过降低脂多糖诱导的毒性发挥抗炎作用,其机制可能为其调控miR-101、miR-192、丝裂原活化蛋白激酶磷酸酶-1及应激活化蛋白激酶通路等来减轻脂多糖诱导的炎症损伤和脂多糖介导的软骨细胞ATDC5损伤[18-20]。Zhao等[21]通过化学修饰法合成青藤碱新型衍生物,发现其比青藤碱更能显著抑制炎症因子IL-1β和IL-6在转录和翻译水平的表达,并且以3.250 mg/kg的剂量可使二甲苯所致的小鼠局部耳水肿减轻,表现出显著的抗炎活性。Ni等[22]通过化学修饰合成青藤碱-4-羟基-棕榈酸酯,通过动物实验研究发现其可促进巨噬细胞重编程为M2样表型,并可减少小鼠内毒素血症的发生。
2.2 镇痛
目前研究青风藤发挥镇痛作用的药效物质主要为生物碱类物质青藤碱及其衍生物,其他物质尚未有深入研究。青藤碱与吗啡结构相似,且无成瘾性,在抗炎镇痛方面有较好效果,临床常用于类风湿关节炎的治疗[23],且对中枢性、外周性疼痛及癌性疼痛等均有一定效果。青藤碱可通过减少滑膜炎性因子TNF-α的表达而有效缓解佐剂性关节炎大鼠的关节疼痛[24]。Gao等[25]将青藤碱联合加巴喷丁或盐酸川芎嗪用于患有光化学诱导的坐骨神经损伤的小鼠和患有光化学诱导的脊髓损伤的大鼠,评估联合治疗的有效性,发现青藤碱可增强加巴喷丁或盐酸川芎嗪在外周和中枢神经性疼痛啮齿动物模型中的疗效,且不会产生耐受性,亦无其他明显不良反应,另青藤碱还可呈剂量相关性抑制电压门控钠电流发挥外周镇痛作用[26]。-去甲基青藤碱是青藤碱的-去甲基化产物,为青风藤中提取的天然成分,已被鉴定为青藤碱的主要代谢产物,Ou等[27]通过动物实验发现-去甲基青藤碱对小鼠术后机械性疼痛与异常性疼痛均有剂量相关性的持续镇痛作用,且不会产生镇痛耐受性和残留效应,并有研究发现青藤碱对于大鼠术后疼痛亦具有显著的镇痛活性,这表明二者具有控制术后疼痛的潜能[28]。嘌呤能受体P2X3为一种双跨膜蛋白,在疼痛等多种涉及神经信号传导的疾病中发挥作用,Rao等[29]研究表明青藤碱对糖尿病性神经病理性疼痛具有抑制作用,通过2型糖尿病大鼠给药发现,青藤碱可抑制P2X3受体的上调,并可减轻大鼠因p38 MAPK激活而增强的痛觉过敏[30]。且青藤碱在抑制癌性疼痛方面也具有一定潜能,Chen等[31]通过实验发现其可通过抑制小胶质细胞非受体型酪氨酸蛋白激酶(Janus kinase 2,JAK2)/信号传导与活化转录因子3(signal transducers and activators of transcription 3,STAT3)和神经元钙调蛋白激酶II(calmodulin-dependent kinase II,CAMKII)/环腺苷酸反应元件结合蛋白(cAMP response element binding protein,CREB)级联来减轻癌症诱导的骨痛。
2.3 免疫抑制
青风藤具有多种免疫调节作用,其可抑制淋巴细胞的活化与增殖,保护损伤器官等,目前研究主要集中于青藤碱及其衍生物对T淋巴细胞的增殖及与炎性细胞因子分泌的抑制,而其他药效物质研究较少。青藤碱可通过降低细胞因子水平抑制破骨细胞分化的相关信号通路、调节多种炎症细胞因子和单核/巨噬细胞亚群的分泌以及抑制巨噬细胞的经典活化通路等多途径发挥免疫抑制作用而用于治疗类风湿关节炎[32-34]。青藤碱对同种异体胰岛刺激的淋巴细胞具有免疫抑制作用,且其保持胰岛细胞活性及分泌功能优于他克莫司,并能同时减轻胰岛的免疫损伤[35]。通过给予过敏性鼻炎小鼠青藤碱,发现小鼠血清和鼻黏膜组织中的转化生长因子-β(transforming growth factor-β,TGF-β)表达水平增加,相关症状减轻[36]。青藤碱在慢性哮喘的治疗中也可能存在一定潜力,通过动物实验研究发现,青藤碱100 mg/kg可改善气道重塑的所有组织病理学变化,其机制可能与其调节Th2衍生细胞因子和抑制气道上皮细胞凋亡有关[37]。Fu等[38]运用主动脉缩窄致压力超负荷作为心力衰竭模型,发现青藤碱对压力负荷性心力衰竭有保护作用,其可降低血清中心钠肽水平,抑制I、III型胶原的蛋白和mRNA水平,提高IL-10/IL-17值,这提示青藤碱可能为治疗心力衰竭的靶点药物。Yan等[39]发现青藤碱衍生物1032可作用于树突状细胞而阻断IL-6产生,终止Th17细胞发育,从而显著降低脑炎T细胞的应答及诱导实验性自身免疫性脑脊髓炎动物模型的改善,由此推测青藤碱衍生物1032可能为一种新型的抗炎剂。除此之外,青藤碱可通过调控多种炎症因子如IL-1β、TGF-β等在骨关节炎、强直性脊柱炎及痛风性关节炎的治疗中具有较好的潜力和前景[40-42]。
2.4 抗心血管系统疾病
随着现代研究的深入,越来越多研究表明青风藤在心血管系统疾病的治疗中存在良好潜力,但目前对于青风藤抗心血管系统疾病的研究主要集中于青风藤主要生物活性碱青藤碱及其衍生物,而其他物质尚未见相关研究报道,是否同样具有此功效可作为将来进一步研究的方向之一。
青藤碱可通过调控炎症因子、白细胞募集、平滑肌细胞的迁移和增殖以及斑块形成等多途径抗动脉粥样硬化[43];且可抑制血管平滑肌细胞电压依赖型钙通道和受体操纵性钙通道,降低家兔血管平滑肌细胞内的游离钙水平,并调节缺血缺氧条件下血管平滑肌细胞蛋白激酶C的活性[44]。有研究将青藤碱及其衍生物青藤碱4-羟基亚麻酸酯与缺血性脑卒中的相关蛋白进行分子对接,发现其在抗缺血性脑卒中存在潜在靶点[45]。且动物实验发现青藤碱在小鼠应激负荷诱导的心力衰竭中也具有显著效果,具有成为新型抗心力衰竭药物的潜力[38]。糖尿病心肌病是糖尿病的严重并发症,Jiang等[46]研究发现青藤碱可通过阻断炎症细胞因子介导的免疫反应和使NF-κB失活而明显改善糖尿病大鼠的心功能。
2.5 抗肿瘤
现代药理学研究发现,青风藤在泌尿、生殖系统肿瘤如前列腺癌和膀胱癌等、消化系统肿瘤如肝癌和胃癌等、呼吸系统肿瘤如肺癌等以及其他多种肿瘤中均有一定的疗效,机制可能与其诱导肿瘤细胞凋亡、抑制肿瘤细胞侵袭和迁移、影响肿瘤新生血管及逆转肿瘤细胞多药耐药等有关[47]。但目前研究表明其发挥药理活性的主要物质为青藤碱,有研究发现青风藤中所提取的糖苷类成分具有抑制癌细胞增殖的活性,但其具体作用机制还有待进一步深入研究[48]。
2.5.1 泌尿生殖系统肿瘤 据传统中医相关著作记载,青风藤利小便作用曾用于治疗泌尿系病证。《中国药植志》曾记载:“除湿,祛风,行气,利水。治膀胱水肿,风肿,脚气湿肿”。且《浙江天目山药植志》中也曾载:“行水利尿,泻下焦血分湿热”。随着青风藤在临床的广泛使用及对其药理作用的深入研究发现青风藤在治疗泌尿生殖系统肿瘤中具有独特优势。
青藤碱可通过体内调控miR-23a及体外抑制前列腺癌DU145细胞的增殖而抑制前列腺癌细胞的增殖、迁移及侵袭,这为青风藤治疗前列腺癌的可能性提供一定的可行依据[49-50];且可通过激活PI3K/Akt信号通路抑制膀胱癌细胞株发生上皮-间充质转化,并具有浓度相关性[51]。PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamyc,mTOR)通路是经典的自噬通路,在维持细胞存活、结构重塑和内环境稳定等方面发挥重要作用,而Deng等[52]通过实验研究发现,青藤碱可通过PI3K/Akt/mTOR通路增强肾癌细胞的自噬,促进其凋亡,且其能力呈剂量相关性。人类卵巢癌特异性转录因子2(human ovariancancer-specific transcription factor 2,HOST2)是在卵巢癌细胞株和原位癌细胞株中均高表达的长链非编码RNA,盐酸青藤碱为青藤碱的水溶性盐酸盐,研究表明其可通过抑制HOST2的表达而发挥抗卵巢癌作用[53-54]。NF-κB可调控乳腺癌上皮-间充质的转化和转移,青藤碱可通过阻断NF-κB的激活而抑制乳腺癌细胞的侵袭和转移,同时其可通过减轻炎性反应抑制小鼠乳腺癌4T1细胞的上皮-间质转化和癌干细胞特性、通过活性氧依赖性和非依赖性途径诱导乳腺癌细胞死亡[55-57]。
2.5.2 消化系统肿瘤 随着对青风藤研究的逐渐深入,越来越多研究发现其在消化系统肿瘤的治疗中具有较好效果。盐酸青藤碱可通过线粒体途径对人胃癌BCG-823细胞增殖发挥时间和浓度相关性抑制作用,且较高浓度时可促进其凋亡,机制可能是其能激活半胱天冬酶依赖性的细胞凋亡[58]。miR-204通过多种信号通路在不同癌症中发挥作用,青藤碱可通过增强miR-204而显著抑制人胃癌MKN45和SGC-7901细胞的增殖,但其在体内实验的作用还有待进一步深入研究[59]。并且青藤碱可通过上调活化的半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)-3、活化的Caspase-9和E-钙黏蛋白及下调波形蛋白的表达而显著抑制胆管癌细胞的活性,该能力随着浓度的升高与时间的延长更加显著[60]。青藤碱对人肝癌HepG2细胞的增殖具有浓度相关性抑制作用,且能通过干扰肿瘤细胞膜受体而激活肿瘤细胞凋亡的相关因子,促进其凋亡[61]。另青藤碱可在体内通过抑制COX-2和组织细胞周期而对肠癌细胞发挥时间与浓度相关性抑制作用[62]。通过观察青藤碱和5-氟尿嘧啶在小鼠体内的肿瘤抑制作用及二者联合应用的效果,发现不仅青藤碱单药应用时具有抑制作用,二者联合应用时效果更加明显,并无明显不良反应[63]。
2.5.3 呼吸系统肿瘤 α7烟碱乙酰胆碱受体是治疗肺癌的潜在靶点,Bai等[64]通过对比青藤碱与阿托品分别对小鼠进行处理后的效果,发现青藤碱可通过抑制α7烟碱乙酰胆碱受体的表达而抑制肺癌,且其还可在体内通过下调介导己糖激酶2的有氧糖酵解而抑制人类非小细胞肺癌[65]。青藤碱通过调控抑癌基因和表达而影响肺癌细胞活性,郑化军等[66]以肺癌WALKER-256细胞悬液诱导大鼠肺癌,并通过对比青藤碱、环磷酰胺和生理盐水对肺癌大鼠的影响,结果发现青藤碱可抑制大鼠WALKER-256移植性肺癌肿瘤细胞的分化及增殖。
2.5.4 其他肿瘤 青风藤对胶质母细胞瘤与多发性骨髓瘤等也有一定抑制作用。sirtuin1是烟酰胺腺嘌呤二核苷酸依赖性脱乙酰酶家族的一员,在氧化应激、炎症、葡萄糖代谢等生物过程中发挥重要作用,青藤碱可通过促进p53的表达及下调sirtuin1的表达而发挥抗神经胶质瘤细胞的增殖作用,且在浓度为16 μmol/L时对胶质瘤U87和U251细胞的活性具有显著抑制作用,可引起G0/G1细胞周期阻滞和凋亡,但其对正常人星形胶质细胞有轻微的细胞毒性[67]。青藤碱通过活性氧生成和自噬溶酶体途径诱导U87和人脑瘤SF767细胞自噬,且在体内外均发挥抑制作用[68]。研究发现从青藤干燥藤茎中所分离的大麻素G对胶质母细胞瘤具有浓度相关性抑制作用,其能阻断胶质母细胞瘤细胞的迁移,诱导其凋亡,为进一步开发青风藤治疗人脑胶质瘤提供依据[69]。Wang等[70]发现青藤碱的衍生物YL064可直接抑制STAT3的活性而在体内外均发挥抑制多发性骨髓瘤细胞的增殖和生存能力,这预示YL064可能是治疗多发性骨髓瘤的一种有前途的候选化合物;程序性细胞死亡因子4(programmed cell death factor 4,)是一种抑癌基因,在人体多种组织中广泛表达,对肿瘤的发生发展起重要作用,青藤碱可通过调控miR-29/PDCD4等途径而抑制乳腺癌细胞增殖、迁移和侵袭,预防乳腺癌所致破骨形成和骨破坏[71-72]。青藤碱还可能为治疗骨肉瘤转移的重要辅助剂,Xie等[73]发现其可通过抑制趋化因子受体4和STAT3的磷酸化而下调基质金属蛋白酶-2、基质金属蛋白酶-9、NF-κB受体活化因子配体和血管内皮生长因子的表达,引起骨肉瘤的S期阻滞,而抑制骨肉瘤的增殖及转移。但目前对于青风藤在肿瘤微环境和肿瘤免疫中所发挥的机制尚未完全阐明,还需进一步研究,这可能也会成为青风藤在抗肿瘤方面的一个新的研究方向。
2.6 抗神经系统疾病
大量研究表明青风藤在神经系统疾病的治疗中也具有一定效果。多发性硬化症是一种慢性神经炎性疾病,青藤碱能明显降低组织中促炎细胞因子水平、抑制神经炎症[74],且可通过减少炎症和神经元细胞的死亡、调控INK4位点反义非编码RNA/miR-626通路,在阿尔茨海默症、帕金森病及其他神经退行性疾病的治疗中发挥一定作用[75-76],且通过抑制炎症和氧化应激发挥治疗脊髓损伤的作用[77]。此外,青藤碱对于防止吗啡成瘾具有一定效果,其可通过-甲基--天冬氨酸受体1/CAMKII/CREB通路在体内外表现出防止吗啡成瘾性作用[78]。Li等[79]通过实验发现青藤碱在大鼠抗慢性不可测性的轻度应激性抑郁和抗小鼠抑郁中也有一定作用,且其还可能会成为临床治疗癫痫的一种新选择,可通过干扰点燃获取、干扰核苷酸结合寡聚化结构域样受体蛋白1炎性体的炎症过程发挥抗惊厥和神经保护作用,预示该成分具有治疗癫痫的潜力[80]。青藤碱对于治疗失眠也有一定潜力,Yoo等[81]通过实验发现青藤碱可通过增强γ-氨基丁酸系统从而增强戊巴比妥所诱导的非快动眼睡眠,且与戊巴比妥共同给药时,缩短了睡眠潜伏期,并以剂量相关性方式增加总睡眠时间。
2.7 其他
通过对44种化合物抗念珠菌菌株活性效果进行评估,结果发现木兰花碱对念珠菌的生长抑制活性最高,最小抑菌浓度为50 μg/mL,可能为一种新型抗真菌药物[82]。青藤碱可通过体内与体外减轻氧化应激和炎症反应,对四氯化碳及对乙酰氨基酚诱导的小鼠急性肝损伤、大肠杆菌诱导的小鼠急性肺损伤均发挥缓解作用[83-85]。青藤碱滴眼液局部滴眼还可用于实验小鼠的干眼症,减轻眼表炎症[86]。研究发现从青风藤中所提取的东莨菪内酯成分具有抗氧化活性,预示该成分具有治疗多种疾病潜力[87]。植物甾醇是以环戊全氢菲为骨架的3-羟基化合物,结构与动物胆固醇相似,研究发现,植物甾醇类物质具有降低胆固醇、细胞抗氧化、调节免疫力、维持内环境稳定的作用,可降低心脏病的发生率,及在肺癌、胃癌、乳腺癌和前列腺癌等多种癌症中皆有一定的治疗效果,但目前关于青风藤所含甾醇类物质是否具有此功效还有待进一步深入研究[88]。综上所述,青风藤发挥药理作用的物质可能涉及青藤碱、木兰花碱、千金藤啶碱、拉兹马宁碱等多种生物碱及糖苷、东莨菪内酯等多种化学成分,且随着研究的深入,可能会有更多的药效物质被发现,而甾醇类成分可能为青风藤发挥药理作用的重要药效物质之一,可作为进一步研究青风藤药理作用的方向之一。
3 毒性研究
研究表明,青风藤具有广泛的药理作用,但随着青风藤在临床的广泛应用,其不良反应越来越引起人们的关注。《中药大辞典》中载青风藤有小毒,而早在20世纪便有文献对青风藤的毒性作用进行了相关研究与报道,研究发现,小鼠ig青藤碱,其半数致死量为(580±51)mg/kg,而犬和猴分别ig 45、95 mg/kg青藤碱后,会出现轻度胃肠道反应,iv 5~13.5 mg/kg后,会出现血压下降、呼吸困难等表现[89]。通过临床观察发现青藤碱可引起患者粒细胞缺乏症,而患者在停用青藤碱治疗后10 d内恢复到正常粒细胞水平[90]。同时,给予患者大剂量青藤碱会导致过敏反应,出现全身性荨麻疹,因此大剂量使用青风藤时,应密切观察患者各项反应,如对骨髓功能和粒细胞水平进行密切监测等[91]。但目前关于青风藤毒性反应相关研究文献还较少,可将其考虑作为进一步研究青风藤的方向之一。
4 Q-Marker预测分析
目前,因青藤碱具有良好的抗炎、镇痛及免疫抑制效果,广泛应用于多种临床疾病中,因此,青藤碱在《中国药典》《日本药典》《韩国药典》及《欧洲药典》中均被认为是青风藤的Q-Marker,但仅以一种成分反映含有多种化学成分的药物质量存在明显局限性。为了更好地解决现阶段中药质量控制体系存在的问题,刘昌孝院士[92-93]于2016年提出了Q-Marker这一新概念,即控制中药安全性和有效性的指标性物质,并且是与中药材和中药产品(包括中药提取物、中成药制剂、中药饮片、中药煎液)中原有或加工制备过程中形成的、与中药的功效属性有密切关系的化学物质。在此基础上,本文通过对大量相关文献进行分析与总结,从多方面对青风藤进行综述,并对其进行Q-Marker分析,推测更多质量评价的可能指标,为青风藤药材质量控制方法提供参考。
4.1 基于植物亲缘性与化学成分特有性的Q-Marker预测分析
中药化学成分的复杂性和化学物质分布的广泛性,同一种药材可含多种不同化学成分,而同一种化学成分也可存在于多种不同药材中,其难以反映出药材中的特异性。因此,从青风藤的亲缘性和化学成分特异性进行分析,选择其具有代表性和特有性的化学成分,以进一步预测质量控制指标,提高质量控制的针对性和指向性。
青风藤为防己科植物,防己科植物全世界约有65属350余种,主要分布在热带及亚热带,在我国有19属78种,主要分布于我国南部和西南部的山区,该科植物雌雄异株,大多为藤类植物,且是著名药用植物群,而其中含有的中药材有粉防己、金果榄、千金藤、细圆藤等。化学型是不同种类植物差异性的表现标志之一,也是防己科植物不同物种共性和个性的表现形式。目前已从中分离出生物碱、黄酮、蒽醌等化学成分,其中,生物碱是防己科植物最主要的次生代谢产物,具有广泛的植物分布和丰富的化学结构类型,主要包括双苄基异喹啉类、原小檗碱类、阿朴菲类、吗啡类和莲花烷类,且有研究发现防己科植物中还含有吡咯类生物碱,目前被认为是其主要药理活性物质。但不同化学型的植物可能会生长在同一环境下,仅从形态上难以区别开来,因其在生长环境中发生了杂化。但因遗传因素的决定性作用,植物的化学型存在不同,其临床用途也各不相同,而在这类成分变成有效成分之前往往会经过很长的合成过程,具有一定的生源前体[94-95]。因此,从青风藤的生源途径来分析其化学成分,形成特有的青风藤质量控制的Q-Marker具有实际意义。
瞿发林等[96]通过高相液相色谱法对3批不同产地的青风藤所含生物碱进行测定,发现湖南、湖北、江苏等地青风藤所含青藤碱均存在差异,最高者含量为1.90%,而最低者为0.58%,且发现其含量与该药材的采集时间、该饮片色泽度均有一定相关性。运用高效液相色谱法分析陕西省不同地区青风藤中生物碱的含量,发现陕西南郑法镇青风藤中青藤碱平均含量最高,占比可达3%,而在陕西省巴巴庙镇仅占比1.97%,且研究发现,同株青风藤不同部位青藤碱的含量也有所不同。同一株青风藤根中青藤碱的含量比藤茎中含量约高0.62%;而根的不同部位含量也有所不同,其中侧根的青藤碱含量最高,须根次之,主根的青藤碱含量最低[97]。该结果也为更合理有效地利用青风藤资源、评价青风藤药材质量提供了可靠的依据。
但就生物碱类化合物这一途径来看,可作为延胡索、川芎、黄连等多种药材的Q-Marker参考物。生物碱类化合物是广泛存在于自然界中的一类含氮有机化合物,具有抗炎、镇痛、抗肿瘤等药理活性,一般根据化合物的分子结构将生物碱类化合物分为有机胺类、吡啶类、异喹啉类、吲哚类、嘌呤类等[98]。青藤碱为青风藤中生物活性最强的异喹啉类生物碱,目前被广泛认为是青风藤的Q-Marker,具有抗炎、镇痛、免疫抑制等多种药理活性。但由于生物碱存在的广泛性,仅将其作为青风藤的Q-Marker缺乏一定代表性。而通过对防己科不同品种植物的黄酮和蒽醌类物质进行分析,目前黄酮类化合物尚仅从粉防己中分离得到2个双黄酮化合物,分别为防己双黄酮甲和防己双黄酮乙;蒽醌类在同科植物中尚只从丁克拉千金藤中分离得到1个蒽醌类化合物(芦荟大黄素)及从青风藤中分离得到6个蒽醌类化合物(大黄素、钝叶素、橙黄决明素、6,8-二羟基-1,2,7-三甲氧基-3-甲基蒽醌、决明素、黄决明素)。因此,蒽醌类物质因其较高特异性,在药物质量评价时具有代表性。因此,可考虑将黄酮和蒽醌类物质与青藤碱共同作为青风藤的Q-Marker选择。
4.2 基于有效性的Q-Marker预测分析
同一种中药往往具有多种不同的药理作用,而不同的中药也可能具有相同的功效[99],因此,一种中药可能会有多种Q-Marker的候选物质,本文将基于青风藤的传统功效对其Q-Marker进行预测分析。
4.2.1 基于祛湿功效 很多祛风湿类药材都具有祛风湿的功效如海风藤,其中常含生物碱类成分。而现代临床常将此功效用于风湿性疾病的治疗中,主要用于类风湿关节炎的治疗。据以上青风藤药理作用研究发现,其发挥抗类风湿关节炎的物质可能为拉兹马宁碱、千金藤啶碱、青藤碱、β-谷甾醇、广玉兰内酯、乌心石环氧内酯、左旋千金藤啶等;且青风藤中的青藤碱、木兰花碱、蝙蝠葛任碱、千金藤宁碱等物质为青风藤的主要抗炎化合物,可能为发挥抗类风湿关节炎的物质基础。因此,可考虑将这些物质作为青风藤Q-Marker的参考。
4.2.2 基于通经络功效 通经络是传统中医理论的表述,传统中医常用通经活络法治疗经络痹阻的病证。“痹证”是因、寒、湿、热等外邪侵袭人体,痹阻经络,气血运行不畅所致。以肌肉、筋骨、关节发生酸痛、麻木、重着、屈伸不利甚或关节肿大、灼热等为主要表现的一种病证。现代医学的类风湿关节炎、强直性脊柱炎、痛风、骨质增生、坐骨神经痛及肩周炎等疾病皆属于此范畴。目前,含青风藤的药品如痛风停胶囊、化瘀消痹胶囊、秦息痛片和正清风痛宁缓释片等用于治疗改善各类免疫系统疾病症状,临床主要用于治疗类风湿关节炎、系统性红斑狼疮及强直性脊柱炎等。而研究发现青藤碱为其发挥抗炎、镇痛、免疫抑制作用的主要活性物质[6]。
且随着研究的不断深入,现代临床还将青风藤通经络功效用于癌症、心血管疾病的治疗。药理作用研究发现,甾醇类物质具有降低胆固醇、细胞抗氧化、调节免疫力、维持内环境稳定的作用,对于降低心脏病的发生率,以及在肺癌、胃癌、乳腺癌和前列腺癌等多种癌症中皆有一定的治疗作用。因此,可考虑将青藤碱和甾醇类物质作为青风藤Q-Marker的候选。
4.2.3 基于利小便功效 利小便为我国传统中医理论的表述,即为现代医学所说利尿作用。茯苓、车前子、川木通等药材皆具有此功效,常含甾醇类物质。目前,多数具有利尿作用的药物被用于治疗心血管疾病如高血压等。研究发现,川木通中甾醇和脂肪酸类物质为发挥利尿作用的物质基础之一[100]。但关于青风藤在利小便方面的应用,目前尚未对其所含甾醇类物质有深入研究,但从传统中医著作可发现其利小便作用曾被应用于泌尿系病证的治疗,而随着现代药理学的研究,更是发现其含量最高的活性物质青藤碱在泌尿系肿瘤方面有一定疗效。据此,可进一步推测青藤碱为青风藤的Q-Marker,而其甾醇类物质是否同样具有此功效可作为进一步研究的目标。
4.3 基于与药性相关的Q-Marker预测分析
四气五味是中药药性的主要内容,也是临床用药、配伍应用的主要依据之一,可作为确定Q-Marker的重要依据。《素问》最早提出了五味和功效关系,五味不仅概括药物味道,且能反映药物功效。青风藤味辛、苦,性平,归肝、脾经。根据中药药性理论,辛味药功效为发散、行气血,从辛味药与脏腑治疗关系中可得出辛味药主要归肝、脾、肺和胃,其化学成分主要为挥发油,其次是苷类和生物碱[101]。苦味药功效为泄热、燥湿、存阴,归肝、肺、胃、心、大肠和肾经等,其化学成分主要为生物碱、苷类及苦味质[102-103]。平性是独立于寒、热、温、凉4种属性的一种药性[104],在《神农本草经》《证类本草》《本草纲目》中皆有提到,并首次被列入《中国药典》2010年版。研究表明挥发油、甾体、生物碱等类成分是平性药物的重要物质基础[105]。据此,可认为青风藤中挥发油、甾体及生物碱等类成分应是其性味归经的主要物质基础,可作为Q-Marker的主要选择,而苷类和苦味质等物质可作为进一步开展青风藤研究的方向。
4.4 基于化学成分可测性的Q-Marker预测分析
化学成分的可测性是中药Q-Marker分析的基本条件之一。目前可通过超高效液相仪、色谱法及指纹图谱的建立等方法对药材进行定性鉴别、定量测定,最后得出基于化学成分可测性的Q-Marker参考依据。通过高效液相色谱法测定双乌镇痛胶囊中青藤碱的含量,结果证明了其含量稳定、可靠、重现性好[106];通过超高效液相色谱法测定青藤散中青藤碱含量,结果亦表明青藤碱含量稳定、可靠[107]。通过高效液相色谱法,从青风藤中分离出3种酚类化合物、6种蒽醌类化合物及10种酚类化合物[12]。
但仅将一种化学成分作为药物质量评价指标存在着明显局限性,且有动物实验采用内标法计算注射青藤碱后家兔体内的血药浓度,发现青藤碱具有分布迅速、消除较快的特点[108]。此外,还有研究发现在大剂量给药过程中,青藤碱具有口服生物利用度低、血浆浓度波动大等特点;且青风藤毒性研究发现,其可能与偶尔的胃肠道毒性和过敏反应等有关,这提示青藤碱发挥治疗作用时还存在一定弊端,因此应将其化学成分的安全性考虑进去[109]。有研究通过气相色谱-质谱联用法测定出青风藤中挥发油的成分,共获得80个化合物,其匹配63个;并有研究运用索氏提取法提取青风藤中总生物碱,且运用气相-质谱联用法鉴定出青风藤中青藤碱、安贝灵碱、光千金藤碱、4-(6-甲基-3-环己烯羧基)-吗啉、(−)-6′-甲基-氮-牛心果碱和3-甲氧基-氮-可待因6种生物碱占总化合物含量达91.1%[9,110]。而有研究通过荧光分析法发现青风藤的三维荧光图谱中呈现木兰花碱的特征荧光峰,由此推测其可能含有木兰花碱。且有研究在基于化学成分安全性的基础上运用超高效液相色谱-四极杆-飞行时间质谱仪发现青藤碱、木兰花碱、去甲乌药碱、乌药碱和尖防己碱等物质的药理活性很好地代表了青风藤的主要适应症与生物活性,可作为青风藤质量的反映指标,这为青风藤质量控制指标提供了更多依据[111]。因此,可将这些物质同青藤碱共同作为青风藤Q-Marker的参考。
5 结语
青风藤为防己科植物,含有生物碱、脂、挥发油、甾体、糖苷及蒽醌和酚等类多种化学成分。目前针对青风藤的研究大多集中于以青藤碱为代表的生物活性碱方面,且大部分研究着重于青藤碱治疗肿瘤、心血管疾病、免疫性疾病及神经系统疾病等方面治疗效果的研究。而对脂、挥发油及甾体类等其他成分尚未深入研究,且随着青风藤的广泛应用,其毒性作用如过敏反应、胃肠道不适等引起关注。在此基础上,仅以单个活性化合物作为青风藤质量控制及质量评价指标仍有待商榷,因此,建立科学合理的质量控制与评价方法对于全面准确地评价青风藤的有效成分和临床疗效具有重要意义。本文在对青风藤化学成分及药理作用进行归纳总结的基础上,以Q-Marker新概念为指导,进行了植物亲缘学和化学成分特有性、有效性、药性相关性、化学成分可测性等分析,推测青风藤内青藤碱、木兰花碱、蝙蝠葛任碱、左旋千金藤啶碱、千金藤宁碱、去甲乌药碱、尖防己碱等多种生物碱、挥发油、甾体、蒽醌、菲及酚类物质可作为青风藤的质量评价指标,且青风藤内挥发油、脂、甾醇等类物质存在着良好的研究前景,而随着研究的深入,可能将有更多的青风藤生物活性物质被纳入,为青风藤Q-Marker的选择和确定提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 204.
[2] 朱卫丰, 邹斌, 管咏梅, 等. 葛根质量标志物(Q-Marker)探讨分析 [J]. 中华中医药学刊, 2019, 37(4): 775-777.
[3] 丁文聪, 韩隆胤, 钱凯, 等. 基于网络药理学阐述青风藤对类风湿性关节炎的作用机制 [J]. 中国医药导报, 2020, 17(17): 15-20.
[4] 曾茜垚, 杨华. 青风藤药用成分、药理作用及栽培繁育研究进展 [J]. 湖南生态科学学报, 2018, 5(1): 46-51.
[5] 黄筑艳, 张援虎, 周岚, 等. 青风藤化学成分的研究(II) [J]. 中草药, 2009, 40(2): 193-196.
[6] 郑湘锦, 任利文, 李婉, 等. 青风藤安全性研究进展 [J]. 医药导报, 2019, 38(11): 1430-1433.
[7] 刘溦溦, 朱尧, 汪悦. 青风藤生物碱的活性成分及药理作用研究进展 [J]. 辽宁中医杂志, 2016, 43(8): 1765-1769.
[8] 惠文其, 王新晓, 王吉利, 等. 青风藤的天然成分、临床应用及不良反应研究进展 [J]. 现代医药卫生, 2019, 35(19): 2989-2993.
[9] Lyu H N, Zeng K W, Cao N K,. Alkaloids from the stems and rhizomes offrom the Qinling mountains, China [J]., 2018, 156: 241-249.
[10] Wang L J, Jiang Z M, Xiao P T,. Identification of anti-inflammatory components inbased on spectrum-effect relationship and chemometric methods [J]., 2019, 167: 38-48.
[11] 陈俊, 周瑾, 何赟鑫, 等. 青风藤中挥发油成分的分析 [J]. 药学实践杂志, 2012, 30(2): 115-117.
[12] 滕鹏. 基于青藤碱的抗炎分子合成和生物活性研究 [D]. 南京: 南京大学, 2011.
[13] Lv H N, Zhao M B, Jiang Y,. Phenanthrenes, anthraquinones, and phenolic constituents from[J]., 2017, 26(6): 440-446.
[14] Haque M A, Jantan I, Harikrishnan H,. Magnoflorine enhances LPS-activated pro-inflammatory responses via MyD88-dependent pathways in U937 macrophages [J]., 2018, 84(17): 1255-1264.
[15] Cai Z, Feng Y, Li C T,. Magnoflorine with hyaluronic acid gel promotes subchondral bone regeneration and attenuates cartilage degeneration in early osteoarthritis [J]., 2018, 116: 266-278.
[16] Zhou H, Liu J X, Luo J F,. Suppressing mPGES-1 expression by sinomenine ameliorates inflammation and arthritis [J]., 2017, 142: 133-144.
[17] 王中扬, 吴祥, 包东桥, 等. 青藤碱对脂多糖诱导的人成纤维滑膜细胞增殖的影响 [J]. 中药药理与临床, 2019, 35(3): 46-50.
[18] Yang H F, Jiang C M, Chen X L,. Protective effects of sinomenine against LPS-induced inflammation in piglets [J]., 2017, 110: 573-577.
[19] Liu S M, Man Y G, Zhao L. Sinomenine inhibits lipopolysaccharide-induced inflammatory injury by regulation of miR-101/MKP-1/JNK pathway in keratinocyte cells [J]., 2018, 101: 422-429.
[20] Wang Y, Yu C D, Zhang H Y. Lipopolysaccharides-mediated injury to chondrogenic ATDC5 cells can be relieved by sinomenine via downregulating microRNA-192 [J]., 2019, 33(7): 1827-1836.
[21] Zhao Z J, Xiao J, Wang J C,. Anti-inflammatory effects of novel sinomenine derivatives [J]., 2015, 29(2): 354-360.
[22] Ni P, Liu Y Q, Man J Y,. C16, a novel sinomenine derivatives, promoted macrophage reprogramming toward M2-like phenotype and protected mice from endotoxemia [J]., 2021, 35: 356469918.
[23] 周莹莹, 刘宇灵, 林龙飞, 等. 青藤碱及其新剂型治疗类风湿性关节炎的研究进展[J]. 中草药, 2021, 52(24): 7709-7717.
[24] 牟慧, 蔡辉, 姚茹冰, 等. 青藤碱对佐剂性关节炎大鼠行为学特征和滑膜中TNF-α的影响 [J]. 山东医药, 2013, 53(9): 4-6.
[25] Gao T L, Shi T S, Wiesenfeld-Hallin Z,. Sinomenine facilitates the efficacy of gabapentin or ligustrazine hydrochloride in animal models of neuropathic pain [J]., 2019, 854: 101-108.
[26] Lee J Y, Yoon S Y, Won J,. Sinomenine produces peripheral analgesic effects via inhibition of voltage-gated sodium currents [J]., 2017, 358: 28-36.
[27] Ou Y T, Su M, Ling Y,. Anti-allodynic effects of-demethylsinomenine, an active metabolite of sinomenine, in a mouse model of postoperative pain [J]., 2018, 823: 105-109.
[28] Zhu Q, Sun Y H, Mao L N,. Antinociceptive effects of sinomenine in a rat model of postoperative pain [J]., 2016, 173(10): 1693-1702.
[29] Rao S Q, Liu S M, Zou L F,. The effect of sinomenine in diabetic neuropathic pain mediated by the P2X3 receptor in dorsal root ganglia [J]., 2017, 13(2): 227-235.
[30] 罗淑萍, 张云芳, 彭效祥, 等. 人P2X3蛋白结构与功能的生物信息学分析 [J]. 生命的化学, 2021, 41(4): 821-830.
[31] Chen Z, Tao Z Z, Zhou X H,. Immunosuppressive effect of sinomenine in an allergic rhinitis mouse model [J]., 2017, 13(5):2405-2410.
[32] 吉金雨, 郭哲, 黄亚光, 等. 青藤碱抑制类风湿关节炎骨破坏机制的研究进展 [J]. 实用医学杂志, 2019, 35(14): 2338-2341.
[33] Liu W W, Zhang Y J, Zhu W N,. Sinomenine inhibits the progression of rheumatoid arthritis by regulating the secretion of inflammatory cytokines and monocyte/ macrophage subsets [J]., 2018, 9: 2228.
[34] 卫智权, 包传红, 陈仪新, 等. 青藤碱增加配对免疫球蛋白受体B表达抑制巨噬细胞经典活化 [J]. 药学学报, 2021, 56(6): 1644-1652.
[35] 焦自钊, 安茂竹, 付海霞, 等. 青藤碱对同种异体胰岛刺激淋巴细胞的免疫抑制作用 [J]. 中华移植杂志: 电子版, 2018, 12(3): 106-110.
[36] Chen Z, Tao Z Z, Zhou X H,. Immunosuppressive effect of sinomenine in an allergic rhinitis mouse model [J]., 2017, 13(5): 2405-2410.
[37] Işık S, Karaman M,. Sinomenine ameliorates the airway remodelling, apoptosis of airway epithelial cells, and Th2 immune response in a murine model of chronic asthma [J]., 2018, 46(1): 67-75.
[38] Fu Y F, Li L, Fang P,. Sinomenine's protective role and mechanism in stress load-induced heart failure [J]., 2020, 72(2): 209-217.
[39] Yan L C, Bi E G, Lou Y T,. Novel sinomenine derivative 1032 improves immune suppression in experimental autoimmune encephalomyelitis [J]., 2010, 391(1): 1093-1098.
[40] Wu Y F, Lin Z, Yan Z J,. Sinomenine contributes to the inhibition of the inflammatory response and the improvement of osteoarthritis in mouse-cartilage cells by acting on the Nrf2/HO-1 and NF-κB signaling pathways [J]., 2019, 75: 105715.
[41] Lin S S, Liu C X, Zhang J H,. Efficacy and safety of sinomenine preparation for ankylosing spondylitis: A systematic review and meta-analysis of clinical randomized controlled trials [J]., 2020, 2020: 4593412.
[42] 曹沛莹, 陈维佳, 宗颖, 等. 青风藤总生物碱提取工艺及抗痛风作用研究[J]. 长春: 吉林农业大学, 2020.
[43] 邓潇, 于超, 王三荣, 等. 青藤碱治疗动脉粥样硬化的研究进展 [J]. 重庆医学, 2018, 47(31): 4059-4060.
[44] 李乐, 宋必卫. 青藤碱对家兔主动脉血管平滑肌细胞内游离钙浓度及蛋白激酶C的影响 [J]. 中国应用生理学杂志, 2007, 23(2): 129-132.
[45] 夏海平, 赵康琦, 朱锐灵, 等. 青藤碱及其衍生物SLN抗缺血性脑损伤靶点的虚拟筛选研究 [J]. 扬州大学学报: 农业与生命科学版, 2020, 41(6): 64-67.
[46] Jiang C, Tong Y L, Zhang D,. Sinomenine prevents the development of cardiomyopathy in diabetic rats by inhibiting inflammatory responses and blocking activation of NF-κB [J]., 2017, 36(1): 65-74.
[47] 姜宇懋, 王丹巧. 青藤碱抗肿瘤作用机制的研究进展 [J]. 现代药物与临床, 2016, 31(11): 1866-1870.
[48] Kim K H, Moon S R, Kim C S,. Lignan glucosides fromrhizomes [J]., 2013, 77(10): 2144-2147.
[49] 张毅, 徐小嫚, 张雁, 等. 青藤碱对人前列腺癌DU145细胞增殖、凋亡的影响 [J]. 中国医刊, 2013, 48(1): 31-33.
[50] Xu F, Li Q, Wang Z Y,. Sinomenine inhibits proliferation, migration, invasion and promotes apoptosis of prostate cancer cells by regulation of miR-23a [J]., 2019, 112: 108592.
[51] 吴磊, 黎炼, 罗志刚, 等. 青藤碱对膀胱癌细胞株T24凋亡及EMT转化的影响 [J]. 医学研究生学报, 2020, 33(9): 909-913.
[52] Deng F, Ma Y X, Liang L,. The pro-apoptosis effect of sinomenine in renal carcinoma via inducing autophagy through inactivating PI3K/AKT/mTOR pathway [J]., 2018, 97: 1269-1274.
[53] Xu Y T, Jiang T, Wang C H,. Sinomenine hydrochloride exerts antitumor outcome in ovarian cancer cells by inhibition of long non-coding RNA HOST2 expression [J]., 2019, 47(1): 4131-4138.
[54] 杜静桐, 刘巍, 李委佳, 等. HOST2在上皮性卵巢癌组织中的表达及临床意义 [J]. 哈尔滨医科大学学报, 2019, 53(3): 272-275.
[55] Song L Q, Liu D, Zhao Y,. Sinomenine inhibits breast cancer cell invasion and migration by suppressing NF-κB activation mediated by IL-4/miR-324-5p/CUEDC2 axis [J]., 2015, 464(3): 705-710.
[56] Li X, Li P P, Liu C,. Sinomenine hydrochloride inhibits breast cancer metastasis by attenuating inflammation-related epithelial-mesenchymal transition and cancer stemness [J]., 2017, 8(8): 13560-13574.
[57] Li X, Wang K, Ren Y,. MAPK signaling mediates sinomenine hydrochloride-induced human breast cancer cell death via both reactive oxygen species-dependent and-independent pathways: Anandstudy [J]., 2014, 5(7): e1356.
[58] 王新, 张旭, 李雅睿, 等. 盐酸青藤碱通过线粒体凋亡途径诱导胃癌细胞死亡 [J]. 西安交通大学学报: 医学版, 2020, 41(6): 854-858.
[59] Yuan H F, Zhang J H, Li F L,. Sinomenine exerts antitumour effect in gastric cancer cells via enhancement of miR-204 expression [J]., 2019, 125(5): 450-459.
[60] 吕彦霖, 朱昌毫, 潘耀振, 等. 青藤碱对体外人胆管癌细胞的抑制作用 [J]. 中成药, 2019, 41(11): 2601-2608.
[61] 李吉业, 辛国松, 于淼, 等. 基于肿瘤细胞膜受体干预的青藤碱抗肝癌作用机制研究[J]. 中药材, 2021, 44(3): 669-675.
[62] Yang H B, Yin P H, Shi Z,. Sinomenine, a COX-2 inhibitor, induces cell cycle arrest and inhibits growth of human colon carcinoma cellsand[J]., 2016, 11(1): 411-418.
[63] Zhang J X, Yang Z R, Wu D D,. Suppressive effect of sinomenine combined with 5-fluorouracil on colon carcinoma cell growth [J]., 2014, 15(16): 6737-6743.
[64] Bai S S, Wen W H, Hou X N,. Inhibitory effect of sinomenine on lung cancer cells via negative regulation of α7 nicotinic acetylcholine receptor [J]., 2021, 109(4): 843-852.
[65] Liu W B, Yu X F, Zhou L,. Sinomenine inhibits non-small cell lung cancer via downregulation of hexokinases II-mediated aerobic glycolysis [J]., 2020, 13: 3209-3221.
[66] 郑化军, 王贤和, 柯昌斌, 等. 青藤碱对肺癌模型大鼠抑癌基因P16和P53的影响 [J]. 世界科学技术—中医药现代化, 2017, 19(10): 1702-1706.
[67] He X Y, Maimaiti M, Jiao Y,. Sinomenine induces G1-phase cell cycle arrest and apoptosis in malignant glioma cells via downregulation of sirtuin 1 and induction of p53 acetylation [J]., 2018, 17: 1533034618770305.
[68] Jiang Y M, Jiao Y, Wang Z G,. Sinomenine hydrochloride inhibits human glioblastoma cell growth through reactive oxygen species generation and autophagy-lysosome pathway activation: Anandstudy [J]., 2017, 18(9): 1945.
[69] Zhang D B, Li C H, Li B,. Cannabisin G frominduces apoptosis in human glioblastoma cells [J]., 2020, 12(6): 823-828.
[70] Wang Y Y, Wu L L, Cai H Y,. Sinomenine derivative YL064: A novel STAT3 inhibitor with promising anti-myeloma activity [J]., 2018, 9(11): 1093.
[71] Gao G L, Liang X L, Ma W Y. Sinomenine restrains breast cancer cells proliferation, migration and invasion via modulation of miR-29/PDCD-4 axis [J]., 2019, 47(1): 3839-3846.
[72] Zhang Y Y, Zou B H, Tan Y H,. Sinomenine inhibits osteolysis in breast cancer by reducing IL-8/CXCR1 and c-Fos/NFATc1 signaling [J]., 2019, 142: 140-150.
[73] Xie T, Ren H Y, Lin H Q,. Sinomenine prevents metastasis of human osteosarcoma cells via S phase arrest and suppression of tumor-related neovascularization and osteolysis through the CXCR4-STAT3 pathway [J]., 2016, 48(5): 2098-2112.
[74] Kiasalari Z, Afshin-Majd S, Baluchnejadmojarad T,. Sinomenine alleviates murine experimental autoimmune encephalomyelitis model of multiple sclerosis through inhibiting NLRP3 inflammasome [J]., 2021, 71(2): 215-224.
[75] Singh D, Agrawal A, Singal C M S,. Sinomenine inhibits amyloid beta-induced astrocyte activation and protects neurons against indirect toxicity [J]., 2020, 13(1): 30.
[76] 霍颖浩, 王进, 殷立新. 青藤碱通过ANRIL/miR-626轴减轻MPP+诱导的SK-N-SH细胞损伤 [J]. 中国病理生理杂志, 2020, 36(8): 1404-1412.
[77] Zhang L L, Zhang W J, Zheng B B,. Sinomenine attenuates traumatic spinal cord injury by suppressing oxidative stress and inflammation via Nrf2 pathway [J]., 2019, 44(4): 763-775.
[78] Ou J Y, Zhou Y T, Li C,. Sinomenine protects against morphine dependence through the NMDAR1/CAMKII/ CREB pathway: A possible role of astrocyte-derived exosomes [J]., 2018, 23(9): 2370.
[79] Li X Q, Liu C, Jiang B,. The antidepressant-like effects of sinomenine in mice: A behavioral and neurobiological characterization [J]., 2018, 29(4): 306-315.
[80] Gao B, Wu Y, Yang Y J,. Sinomenine exerts anticonvulsant profile and neuroprotective activity in pentylenetetrazole kindled rats: Involvement of inhibition of NLRP1 inflammasome [J]., 2018, 15(1): 152.
[81] Yoo J H, Ha T W, Hong J T,. Sinomenine, an alkaloid derived frompotentiates pentobarbital-induced sleep behaviors and non-rapid eye movement (NREM) sleep in rodents [J].(), 2017, 25(6): 586-592.
[82] Kim J, Bao T H Q, Shin Y K,. Antifungal activity of magnoflorine againststrains [J]., 2018, 34(11): 167.
[83] 郭华, 裴高油, 李龙腾, 等. 青藤碱缓解氧化应激和炎症反应对四氯化碳诱导的急性肝损伤小鼠的保护作用 [J]. 中国免疫学杂志, 2019, 35(8): 939-943.
[84] Chen H, Wang Y, Jiao F Z,. Sinomenine attenuates acetaminophen-induced acute liver injury by decreasing oxidative stress and inflammatory response via regulating TGF-β/Smad pathwayand[J]., 2020, 14: 2393-2403.
[85] Liu S Z, Chen Q H, Liu J J,. Sinomenine protects against.-induced acute lung injury in mice through Nrf2-NF-κB pathway [J]., 2018, 107: 696-702.
[86] Li H, Wei F, Li S W,. The effect of sinomenine eye drops on experimental dry eye in mice [J]., 2020, 39(4): 389-395.
[87] Shaw C Y, Chen C H, Hsu C C,. Antioxidant properties of scopoletin isolated from[J]., 2003, 17(7): 823-825.
[88] 彭建, 陈刘浦, 贝亦江, 等. 植物甾醇的生理功能及在动物生产中的应用 [J]. 饲料研究, 2021, 44(5): 152-154.
[89] 傅紹萱, 張士善, 李蘊山, 等. 青藤碱的药理作用II.毒性及一般药理 [J]. 药学学报, 1963(11): 673-676.
[90] Chen J R, Zhong B, Wang Y. Agranulocytosis induced by sinomenine hydrochloride [J]., 2017, 18: 959-962.
[91] 廖跃才. 大剂量青风藤致少见全身性急性荨麻疹3例分析 [J]. 青海医药杂志, 2014, 44(1): 22.
[92] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念[J]. 中草药, 2016, 47(9): 1443-1457
[93] 刘昌孝. 中药质量标志物(Q-Marker)研究发展的5年回顾[J]. 中草药, 2021, 52(9): 2511-2518.
[94] Lv H N, Zeng K W, Zhao M B,. Pyrrolo[2,1-a]isoquinoline and pyrrole alkaloids from[J]., 2018, 20(3): 195-200.
[95] 刘耀晨, 许浚, 张洪兵, 等. 基于化学成分特有性的质量标志物发现策略及应用[J]. 中草药, 2021, 52(9): 2548-2556.
[96] 瞿发林, 董文燊, 刘蓉, 等. 不同产地青风藤中青藤碱的含量比较 [J]. 中国药业, 2010, 19(18): 32-33.
[97] 陈曦. HPLC法青风藤根中青藤碱含量的测定及其提取工艺的优化 [J]. 安徽农业科学, 2010, 38(29): 16236-16238.
[98] 罗秋林, 徐小雨, 郭梦芹, 等. 生物碱类化合物共晶的研究进展 [J]. 中国药师, 2021, 24(2): 348-353.
[99] 郑荣蕾, 戴静, 何勇志, 等. 质量标志物(Q-Marker)预测分析途径研究进展 [J]. 中草药, 2021, 52(9): 2566-2574.
[100] 叶潇, 朱萱萱, 刘婷, 等. 川木通对大鼠利尿作用及其物质基础研究 [J]. 中国中药杂志, 2019, 44(9): 1889-1894.
[101] 傅睿. 中药药性理论辛味功效及物质基础研究思路初探 [J]. 亚太传统医药, 2014, 10(9): 55-56.
[102] 孟子晗, 孙伟宁, 付晓芸, 等. 中药“苦味”产生机制及评价方法研究进展 [J]. 广东药学院学报, 2016, 32(4): 537-540.
[103] 赖昌生, 张蕙缨. 苦味中药性能及功效特点分析 [J]. 河南中医, 2015, 35(1): 166-170.
[104] 穆兰澄, 顾成娟, 徐立鹏, 等. 平性药药性及应用特点 [J]. 中医杂志, 2017, 58(1): 23-26.
[105] 陈慧, 孙慧, 杨秀艳, 等. 中药寒热平性质与其化学成分类别相关性研究 [J]. 辽宁中医药大学学报, 2016, 18(7): 103-106.
[106] 王希东, 李文俊, 郝少君, 等. HPLC法测定双乌镇痛胶囊中青藤碱的含量 [J]. 实用医药杂志, 2017, 34(3): 244-246.
[107] 王锐, 李陈雪, 胡月, 等. 超高效液相色谱法测定青藤散中青藤碱含量 [J]. 中国中医药信息杂志, 2016, 23(3): 89-91.
[108] 朱丽媛, 彭朝蕊, 赵远翠, 等. 青风藤碱血药浓度测定及其在家兔体内的药动学研究 [J]. 中国药房, 2019, 30(20): 2767-2771.
[109] Li Q, Zhou W B, Wang Y Y,. Metabolic mechanism and anti-inflammation effects of sinomenine and its major metabolites-demethylsinomenine and sinomenine--oxide [J]., 2020, 261: 118433.
[110] 吴振启, 郭剑明, 陈琴华, 等. 青风藤中总生物碱的气相色谱-质谱联用分析 [J]. 医药导报, 2012, 31(4): 495-497.
[111] Huang Y F, He F, Wang C J,. Discovery of chemical markers for improving the quality and safety control ofstem by the simultaneous determination of multiple alkaloids using UHPLC-QQQ-MS/MS [J]., 2020, 10(1): 14182.
Research progress on chemical constituents and pharmacological effects ofand predictive analysis on quality marker (Q-Marker)
LUO Yan-qun1, SHEN Xiao-lan1, CAI San-jin1, MEI Zhi-gang2, FENG Zhi-tao1,3
1. College of Medicine, China Three Gorges University, Yichang 443002, China 2. College of Integrated Traditional Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha 410208, China 3. Third-grade Pharmacological Laboratory of Traditional Chinese Medicine, State Administration of Traditional Chinese Medicine, China Three Gorges University, Yichang 443002, China
Qingfengteng () mainly contains alkaloid, volatile oil, lipid, sterols and other active ingredients. Isoquinoline alkaloids represented by sinomenine are mostly studied at present and have a good clinical effect in rheumatic arthralgia, joint swelling and pain, paralysis pruritus.is more and more widely used in clinical application, and its quality evaluation also needs to be analyzed. According to the concept of quality marker (Q-Marker) of traditional Chinese medicine, Q-Markers ofwere predicted and analyzed from the aspects of phylogenetic relationship and specificity of chemical components, efficacy, drug correlation, and measurability of chemical composition. Sinomenine, magnoflorine, menisperine,-stepholidine, stephanine, higenamine, acutumine and other alkaloids, volatile oil, sterol, anthraquinone, phenanthrene and phenols can be used as the main Q-Markers of, which provide the basis for the establishment of quality evaluation system and reference for the research and development of related new drugs.
; sinomenine; magnoflorine; menisperine;-stepholidine; stephanine; higenamine; acutumine
R282.710.5
A
0253 - 2670(2022)03 - 0898 - 14
10.7501/j.issn.0253-2670.2022.03.030
2021-09-23
国家自然科学基金资助项目(81703783);湖北省医学青年拔尖人才项目(EWT2019-48)
罗艳群,女,在读本科。Tel: (0717)6396558 E-mail: 2693541773@qq.com
冯知涛,副教授,硕士生导师。Tel: (0717)6396558 E-mail:fengzhitao2008@126.com
梅志刚,教授,博士生导师。Tel: (0731)88458285 E-mail: zhigangmei@139.com
[责任编辑 崔艳丽]
