基于高通量测序研究甘松根际细菌及药用部位内生细菌群落结构及多样性
2022-02-14钟海蓉李奕松威则日沙李文兵
李 莹,钟海蓉,李奕松,威则日沙,李文兵,刘 圆*
基于高通量测序研究甘松根际细菌及药用部位内生细菌群落结构及多样性
李 莹1, 2, 3,钟海蓉2, 4,李奕松1,威则日沙3, 5,李文兵2, 3, 6,刘 圆2, 3, 6*
1. 西南民族大学药学院,四川 成都 610041 2. 四川省羌彝药用资源保护与利用工程实验室,四川 成都 610225 3. 青藏高原民族药用资源保护与利用国家民委重点实验室,四川 成都 610225 4. 四川中医药高等专科学校,四川 绵阳 621000 5. 凉山彝族自治州第二人民医院,四川 西昌 615000 6. 西南民族大学民族医药研究院,四川 成都 610225
探析并比较野生甘松与仿野生栽培甘松的根际细菌与内生细菌的种群组成、丰富度、多样性及差异性。以野生甘松和仿野生栽培甘松的根际土壤、根及根茎为研究样本,基于Illumina MiSeq第二代高通量测序技术对根际土壤细菌、根及根茎内生细菌的16S rDNA V4-V5区进行序列测定,并进行相关生物信息学分析。各组样本基因组经16S测序,细菌群落的所有序列分别进行97%的相似水平下的物种分类单元(operational taxonomic units,OUT)分类,根际细菌共涉及22门、38纲、69目、119科、254属、268种,内生细菌共涉及16门、29纲、60目、107科、199属、145种。根际、内生细菌群落中共有的序列分别为498个、177个,主成分分析的最主要2类主成分(PC1和PC2)类群的比例综合分别接近70%、60%,其中丰度排在前4位的依次为变形菌门、放线菌门、酸杆菌门和拟杆菌门,其他类群的类别及相对丰度存在一定差异。优势细菌差异分析中,各组细菌群落组成及相对丰度差异很大。野生甘松和仿野生栽培甘松的优势促生菌群可能主要集中于变形菌门、放线菌门、酸杆菌门和拟杆菌门,可从中筛选出核心功能微生物混合菌群,对改良仿野生培育甘松土壤的微生物环境具有理论指导意义。
甘松;根际细菌;内生细菌;群落结构;多样性
甘松为败酱科植物甘松DC.的干燥根及根茎,为中藏药材,亦为古印度阿育吠陀(Ayurveda)和尤纳尼医(Unani)学体系的常用药物[1-2]。甘松广泛应用于药品、日化及香料等领域,具有较高的药用价值和经济价值。近年,甘松的野生资源逐年枯竭,匙叶甘松DC.已被列为《濒危野生动植物物种国际贸易公约》(2007、2013年版)的附录II中。由于甘松对生态环境(海拔3400~5000 m)要求较为苛刻,人工种植处于尚未起步的状态。
本课题组2015~2020年,在西南民族大学青藏基地对甘松进行了仿野生移栽驯化工作,研究发现与野生甘松相比较,仿野生栽培甘松的总根表面积、须根根尖数量均明显增加,主根变细,气味明显变弱;严重影响仿野生栽培甘松药材的品质。近年来研究发现土壤微生态,特别是细菌微生物结构和数量可能是影响根类、根及根茎类药材品质的重要因素[3-10]。其中,根际细菌中的促生菌在抑制根际病原菌、促进植物生长发育及代谢等方面起到重要作用[6-10];内生细菌不仅参与植物从土壤中吸收养分、植物次生代谢产物的合成与转化,还可独立产生次生代谢产物,在药材品质、道地性、协助植物抗逆与应对海拔、季节、气候特殊环境等方面均有重要的影响[4, 7-12]。
目前,关于甘松的根际微生物与内生菌方面的研究尚未见报道。高通量测序技术因其较传统方法具有更快速、准确、科学、全面地探析样本的微生物群落结构[13-14],本实验利用基于Illumina MiSeq平台的第二代高通量测序技术,拟对甘松根际及药用部位痕量细菌的宏基因组进行扩增测序,分析甘松根际细菌和根及根茎内生细菌群落分布和多样性;并比较仿野生栽培和野生甘松在根际细菌和内生细菌群落的异同,为进一步探究与筛选出核心功能微生物混合菌群,对改良仿野生培育甘松的土壤、调节微生物环境、帮助仿野生繁育品抵抗青藏高原的特殊恶劣环境提供科学数据。
1 仪器与试药
精密电子天平(上海卓精电子科技有限公司),振荡器vortex-5(海门市其林贝尔仪器制造有限公司),HHS-2S型电子恒温不锈钢水浴锅(上海予卓仪器有限公司),Eppendorf离心机(Eppendorf,德国),电泳仪和凝胶成像仪[Bio Rad公司,伯乐生命医学产品(上海)有限公司],ABI9700 PCR仪(ABI,Applied Biosystems 美国应用生物系统公司),Axygen凝胶回收试剂盒(Axygen公司,美国),FTC-3000TM real-time PCR(上海枫岭生物技术有限公司),Miseq测序仪(Illumina公司,美国)。
Phusion超保真PCR Master Mix(货号M0531L,NEB公司,英国),DNA Marker(货号3427A,DL9000欣百诺公司,DL2000 Takara),TB Green Premix Ex Taq(货号RR420,ATakara公司,日本),MiSeq Reagent Kits v3(货号MS-102-3003,Illumina公司,美国),MIO-BIO PowerSoil DNA Isolation Kit(货号12888-100,Mo Bio Laboratories公司,美国)。
野生甘松和仿野生栽培甘松样品及其根际土壤均于2019年7月采自四川省阿坝藏族羌族自治州红原县,其中仿野生栽培品采自西南民族大学青藏基地(2015年从野外移栽至基地后,仿野生人工栽培4年)。经西南民族大学刘圆教授鉴定为败酱科植物甘松DC.,采集信息详见表1。
2 方法
2.1 样品前处理
采集新鲜、健康的带土甘松,抖去多余泥土后,将一部分带浮土的根、根茎用剪刀(经70%乙醇消毒)剪段,装至无菌PE管保存于液氮罐中,作为检测根际细菌样品;另一部分立即用蒸馏水将根和根茎淋洗干净,用70%乙醇擦拭表面至无菌后,切段装至无菌PE管并保存于液氮罐中,作为检测内生细菌样品。
表1 甘松样品及根际土壤采集信息
Table 1 Collection information of N. jatamansi and rhizosphere soil
样本编号样品来源与部位产地海拔/m A1-1栽培甘松-土根西南民族大学青藏基地3670 A1-2栽培甘松-净根西南民族大学青藏基地3670 A1-3栽培甘松-土根茎西南民族大学青藏基地3670 A1-4栽培甘松-净根茎西南民族大学青藏基地3670 A2-1栽培甘松-土根西南民族大学青藏基地3670 A2-2栽培甘松-土根茎西南民族大学青藏基地3670 A2-3栽培甘松-净根西南民族大学青藏基地3670 B1-1野生甘松-土根安曲镇下哈拉玛村3561 B1-2野生甘松-净根安曲镇下哈拉玛村3561 B1-3野生甘松-土根茎安曲镇下哈拉玛村3561 B1-4野生甘松-净根茎安曲镇下哈拉玛村3561 B2-1野生甘松-土根阿木乡峨扎村3560 B2-2野生甘松-净根阿木乡峨扎村3560 B2-3野生甘松-土根茎阿木乡峨扎村3560 B2-4野生甘松-净根茎阿木乡峨扎村3560
2.2 DNA提取
2.2.1 根际细菌 于超净台内,将甘松根及根茎附着的根际土壤洗脱到95%乙醇中,于−80 ℃超低温冰箱冷冻保存,按照MIO-BIO PowerSoil DNA Isolation Kit试剂盒的说明书对根际土壤细菌总DNA进行提取。
2.2.2 内生细菌 于超净台内取出样品后,在75%乙醇中浸泡2.5 min,用无菌水清洗3次,切取中间段的植物组织,保证其无菌。再用PBS溶液反复冲洗,将冲洗液离心5 min,转速8000 r/min,合并沉淀置于−80 ℃冻存。临用前放于干冰浴中,于洁净操作台上取出,立即用液氮进行研磨、破壁。按蛋白酶K裂解法和酚氯仿抽提常规方法提取细菌总DNA。
2.3 16 S rDNA V4~V5区的PCR扩增
根据illumina Miseq高通量测序要求,进行双向测序,设计目标区域和带有“5’ Miseq接头- barcode-测序引物-特异引物-3’”的融合引物。并采用2步PCR扩增的方法,确保扩增效率和准确性。
PCR所用的引物已经融合了Miseq测序平台的V4-V5通用引物,外生菌采用引物515F:5’-GTGCCAGCMGCCGCGGTAA-3’和926R:5’-CCGTCAATTCMTTTGAGTTT-3’。内生菌引物为799F:5’-AACMGGATTAGATACCCKG-3’和1193R:5’-ACGTCATCCCCACCTTCC-3’。
采用两步PCR扩增的方法,首先采用特异引物扩增目的片段,将目的片段进行胶回收,而后将回收产物作为模板进行2次PCR扩增,目的是将Illumina平台测序所需的接头测序引物Barcode添加到目的片段的两端。
采用AXYGEN公司的AxyPrepDNA凝胶回收试剂盒回收。回收产物进行qRT-PCR定量。
2.4 RT-PCR定量
全部PCR产物已采用AxyPrepDNA凝胶回收试剂盒进行回收,FTC-3000TM RT-PCR仪对回收的DNA以精确定量,按照等比例进行混合后测序。
2.5 上机测序
样品检测合格后,DNA委托微基生物科技(上海)有限公司完成测序,测序平台为美国Illumina公司Illumina Miseq PE250高通量测序仪。
2.6 数据处理与分析
Miseq测序得到的PEreads,根据barcode对样本进行区分,对序列质量进行质控及过滤;再根据overlap关系进行拼接,拼接后的序列再次进行质控和滤过,最后得到的优化序列。利用软件USEARCH在97%的相似水平上进行操作分类单元(operational taxonomic units,OUT)聚类分析和物种分类学分析,基于OTU聚类分析结果,用于对OTU进行样本内的alpha多样性分析,并对测序深度进行检测。同时,基于分类学信息在各个分类水平上进行群落结构的统计分析,并对样本之间进行beta多样性分析。基于上述分析,再进行群落结构和系统发育等深入的统计学和可视化分析。
3 结果与分析
3.1 甘松根际细菌的分析结果
所有样品扩增区域均为16S rDNA V4~V5,测序条数均超过4.5万条,所有样品的测序深度超过99%,均扩增成功。
3.1.1 序列长度分布 甘松根际土壤样品所测得的8个样本,有效序列数在30 301~39 040,优化序列平均长度为412 bp,见图1。
图1 甘松根际细菌的序列长度分布
3.1.2 各样本OTU分布及物种信息(测序样品的置信分析) 基于OUT-稀释曲线(图2)结果显示,随着测序数量的增加,稀释曲线斜率逐渐降低,但未进入平台期,说明再增加测序量也只会产生少量新的物种(OUTs),说明本次测序数据量合理。
结合Alpna多样性分析结果,Simpson指数呈现出的差异稍明显,表明根茎(B1-3、B2-3、A2-2)根际细菌的种群丰富度和多样性最高,而总体来看仿野生人工栽培品根际细菌丰富度更高;Shannon-Wiener指数、Chao指数、Ace指数结果均表明测序数据量合理,可以反映样品中绝大多数的微生物信息。同时,说明野生甘松与栽培甘松的根际菌群丰富度与均匀度较为一致。
3.1.3 甘松根际细菌群落分布特征 对测得的所有序列进行97%的相似水平下的OUT分类,并进行生物信息统计分析(图3)。
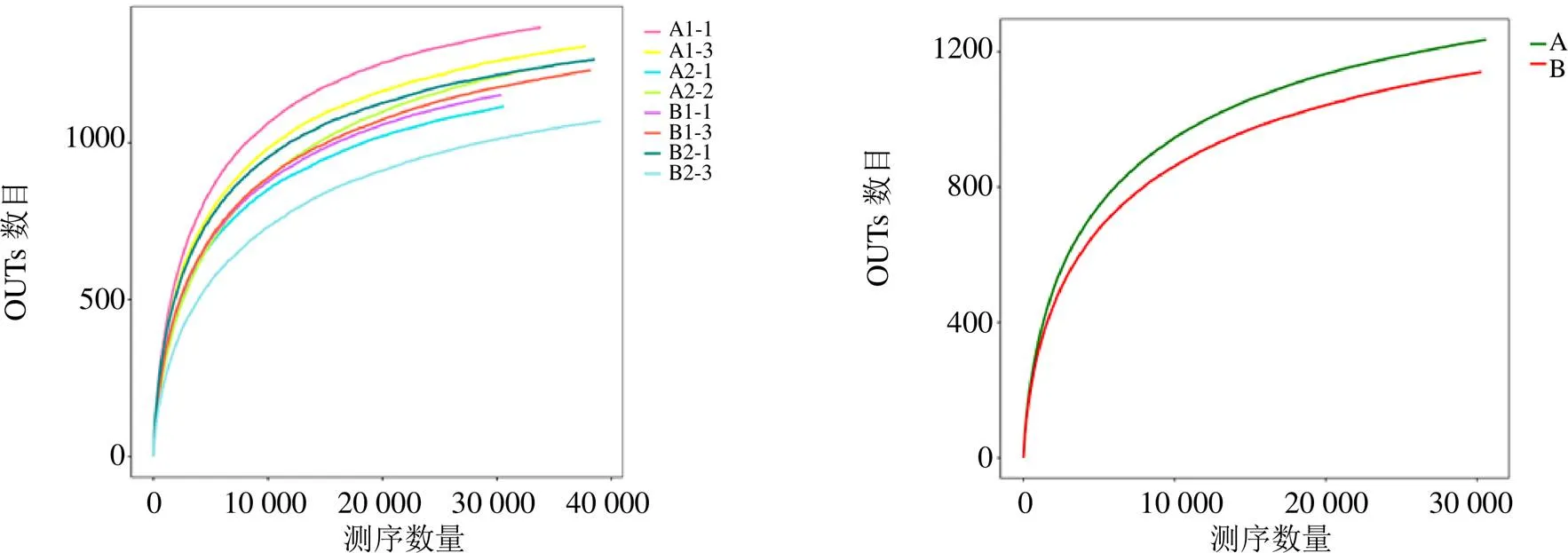
图2 甘松根际细菌稀释性曲线图
在门的分类水平上,野生甘松和仿野生栽培甘松的根际细菌中共检测出22个门,相对丰度较高且共有的8个细菌门类依次为变形菌门(Proteobacteria,46.55%~68.67%)、放线菌门(Actinobacteria,10.57%~27.44%)、酸杆菌门(Acidobacteria,2.62%~16.74%)、拟杆菌门(Bacteroidetes,2.99%~8.07%)、浮霉菌门(Planctomycetes,2.48%~5.08%)、绿弯菌门(Chloroflexi,1.43%~5.41%)、芽单胞菌门(Gemmatimonadetes,0.80%~2.57%)、厚壁菌门(Firmicutes,0.80%~3.28%)等。
在纲的分类水平上,共检测出38个纲,其中相对占优势的有α变形杆菌纲(Alphaproteobacteria,24.14%~44.98%)、-变形菌纲(Gammaproteobacteria,5.32%~21.93%)、放线菌纲(Actinobacteria,5.87%~20.13%)、嗜热油菌纲(Thermoleophilia,3.46%~10.49%)、β-变形菌纲(Betaproteobacteria,2.80%~7.84%)、鞘脂杆菌纲(Sphingobacteriia,2.28%~5.87%)、酸杆菌纲(Acidobacteriia,0.11%~7.65%)、δ-变形菌纲(Deltaproteobacteria,1.29%~6.17%)、浮霉菌纲(Planctomycetacia,1.33%~3.00%)。
在目的分类水平上,共检测出69个目,甘松根际细菌主要分布在根瘤菌目(Rhizobiales,2.38%~25.22%)、鞘脂杆菌目(Sphingobacteriales,2.28%~5.87%)、黄色单胞菌目(Xanthomonadales,2.86%~12.59%)、伯克霍尔德氏菌目(Burkholderiales,1.66%~8.99%)、鞘脂单胞菌目(Sphingomonadales,2.38%~25.22%)、酸杆菌目(Acidobacteriales,2.86%~12.59%)、红螺菌目(Rhodospirillales,2.52%~5.16%)、Gaiellales(1.83%~5.65%)和弗兰克氏菌目(Frankiales,2.42%~4.44%)等。
在科的分类水平上,共检测出119个科,其中在鞘脂单胞菌科(Sphingomonadaceae,2.33%~8.86%)、慢生根瘤菌科(Bradyrhizobiaceae,3.21%~8.24%)、黄色单胞菌科(Xanthomonadaceae,1.33%~11.15%)、酸杆菌科(Acidobacteriaceae,0.11%~7.65%)、丛毛单胞菌科(Comamonadaceae,0.98%~4.34%)、根瘤菌科(Rhizobiaceae,0.97%~5.65%)、肠杆菌科(Enterobacteriacese,0.01%~17.73%)、Chitinophagaceae科(0.97%~3.51%)、黄色杆菌科(Xanthobacteraceae,0.88%~2.51%)等多有分布。
在属的分类水平上,共检测出254个属,其中在慢生根瘤菌属(3.06%~8.06%)、鞘氨醇单胞菌属(0.65%~8.29%)、根瘤菌属(0.85%~5.65%)、单胞菌属(0.08%~6.69%)、鞘脂菌属(0.15%~7.77%)、假黄色单胞菌属(0.003%~1.58%)和属(0.63%~1.71%)等多有分布在种的分类水平上,共检测出268个种,其中有149种细菌尚未被人工条件下获得培养的微生物,有1种未分类的细菌,这2部分细菌占有相对优势。从甘松根际细菌的种水平样品聚类数与柱状图组合分析图(图4)来分析,来自2个产地的野生甘松根的根际细菌聚成一类,根茎的根际细菌也聚成一类,但栽培甘松的根与根茎的根际细菌没有这样的规律。
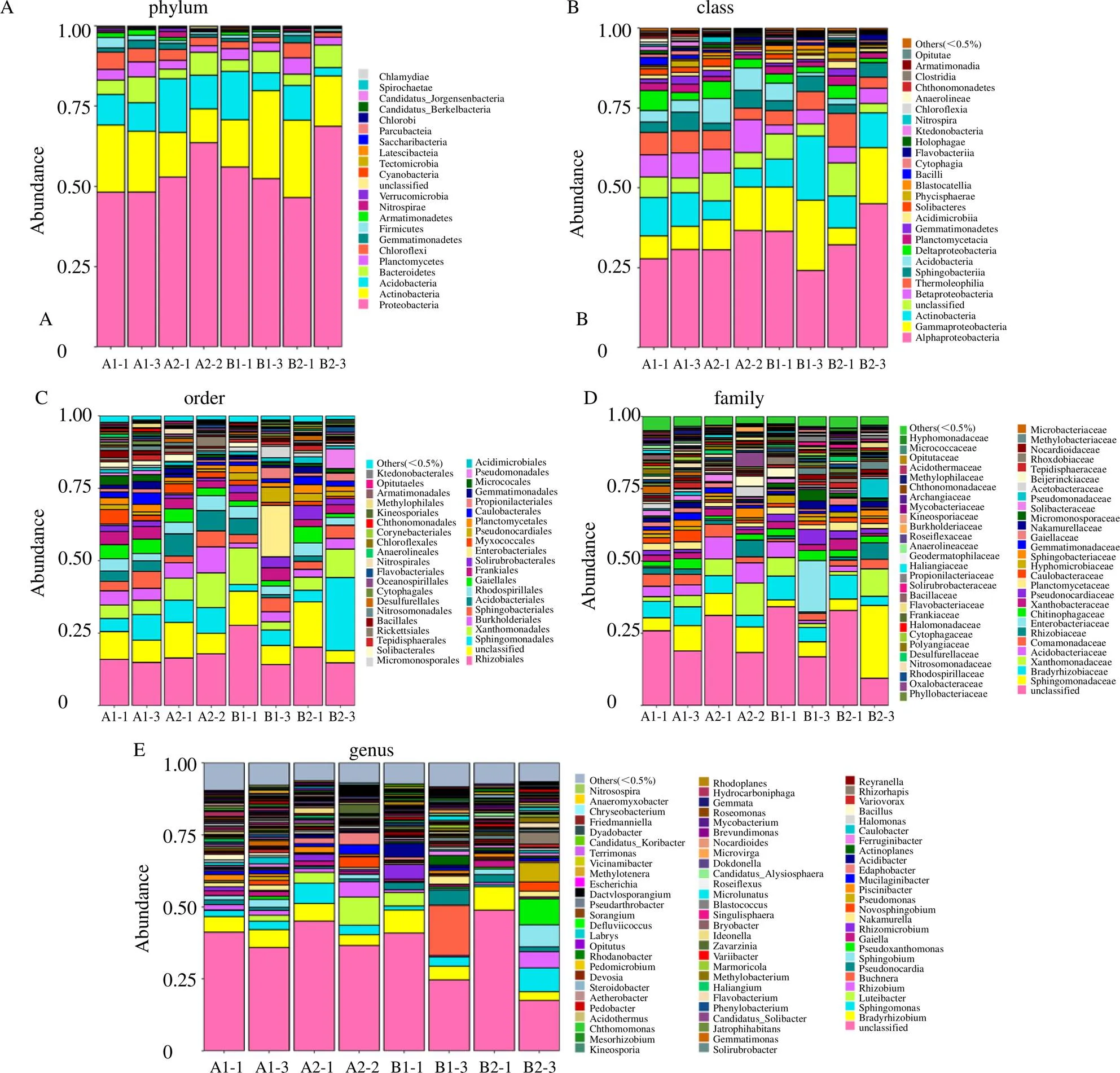
图3 甘松根际细菌的门(A)、纲(B)、目(C)、科(D)、属(E) 水平物种分布柱状图
3.1.4 甘松根际细菌群落主成分分析 基于相似水平为97%的OTU样品表进行分析,得Venn图(图5),可比较直观地观察到野生甘松与仿野生栽培甘松的根际细菌群落均有1448序列被划分入相同的OTU中,各样品中共有的序列有498个。
再根据每个样品OTU的丰度数据计算出每个OTU在每个样品所占的百分比,利用这个百分比信息进行OTU的主成分分析(principal component analysis,PCA)。由图6可知,PC1和PC2的比例综合接近70%,基本可表明各样本整体组成情况。其中,野生甘松根的根际细菌与仿野生栽培甘松根际细菌组成的相似度较高,而野生甘松的根际细菌组成离群较明显。结合门、纲、目、科、属和种水平上的分析结果,仿野生栽培甘松的根际细菌群落与野生甘松根际细菌群落更为相似。

图4 甘松根际细菌的种水平样品聚类数与柱状图组合分析图

图5 甘松根际细菌Venn图-分组(左) 与花瓣图(右)
3.1.5 野生甘松和仿野生栽培甘松根际优势细菌差异分析 以所有野生甘松和仿野生栽培甘松的根际细菌类群为对象,使用LDA Effect Size组间群落差异分析两者的根际细菌群落中主要差异物种(图7)。分析结果表明,仿野生栽培甘松中起到重要作用的根际微生物物种包括假诺卡式菌目(Pseudonocardiales)、Solirubrobacterales目、微单孢菌目(Micromonosporales)等3个目,假诺卡式菌科(Pseudonocardiaceae)、微单孢菌科(Micromonosporaceae)、丙酸杆菌科(Propionibacteriaceae)、土壤红杆菌科(Solirubrobacteraceae)、分支杆菌科(Mycobacteriaceae)和产碱杆菌科(Alcaligenaceae)等6个科,假诺卡式菌属、游动放线菌属、土壤红杆菌属、、小月菌属、微枝形杆菌属红游动菌属、土微菌属、中慢生根瘤菌属、、分枝杆菌属和溶杆菌属等12个属。野生甘松中起到重要作用的根际微生物物种包括β-变形杆菌纲(Betaproteobacteria)、Solibacteres纲、芽孢杆菌纲(Bacilli)等3个纲,伯克霍尔德氏菌目(Burkholderiales)、黏球菌目(Myxococcales)、立克次氏体目(Rickettsiales)、Solibacterales、Nitrosomonadales和Bacillales等6个目,Solibacteraceae、多囊粘菌科(Polyangiaceae)、亚硝化单胞菌科(Nitrosomonadaceae)、伯克氏菌科(Burkholderianceae)等5个科,艾德昂菌属、、未知嗜酸菌属、食烃菌属等5个属。
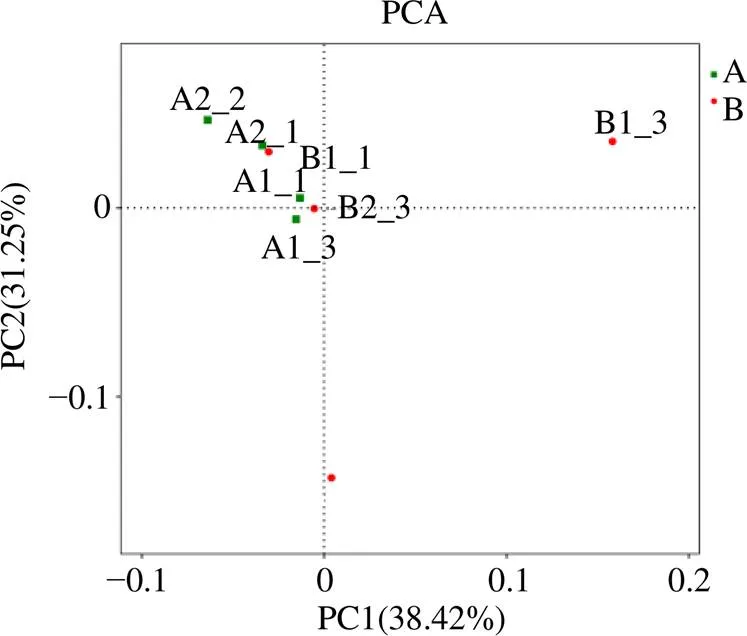
图6 OUT水平上的甘松根际细菌主成分分析

图7 野生甘松和仿野生栽培甘松根际优势细菌LEfSe分析
3.2 甘松根和根茎内生菌的分析结果
所有样品扩增区域均为16S rDNA V4-V5,除A1-2样品的测序条数为逾2.2万条外,测序条数均超过4万条,所有样品的测序深度超过97%,均扩增成功。
3.2.1 序列长度分布 甘松样品所测得的7个样本,有效序列数在30 301~39 040,优化序列平均长度为412 bp,见图8。
3.2.2 各样本OTU分布及物种信息(测序样品的置信分析) 基于OUT-稀释曲线(图9)结果显示,随着测序数量的增加,稀释曲线斜率逐渐降低,趋于进入平台期,说明再增加测序量也只会产生少量新的OUTs。结合Alpna多样性分析指数结果(图10),Simpson指数呈现出的差异稍明显,表明,其中以A2-3和甘松根与根茎的内生细菌的种群丰富度较高,差异也较大,B2-2的丰富度最高、多样性最高;Shannon-Wiener指数、Chao指数、Ace指数野生甘松与仿野生栽培甘松的内生细菌菌群的丰富度与均匀度较为一致。结果均表明测序数据量合理,可以反映样品中绝大多数的微生物信息。
图8 甘松根及根茎的内生细菌的优化序列长度分布
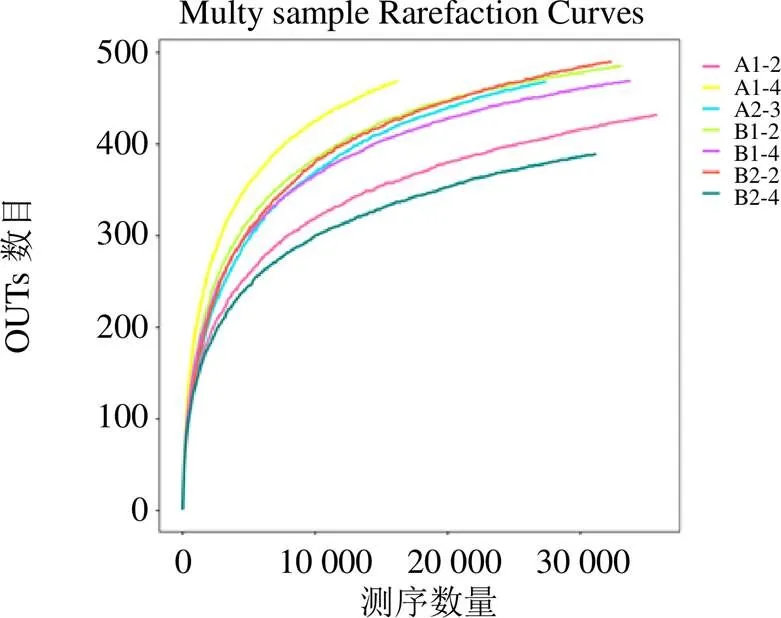
图9 甘松内生细菌稀释性曲线图
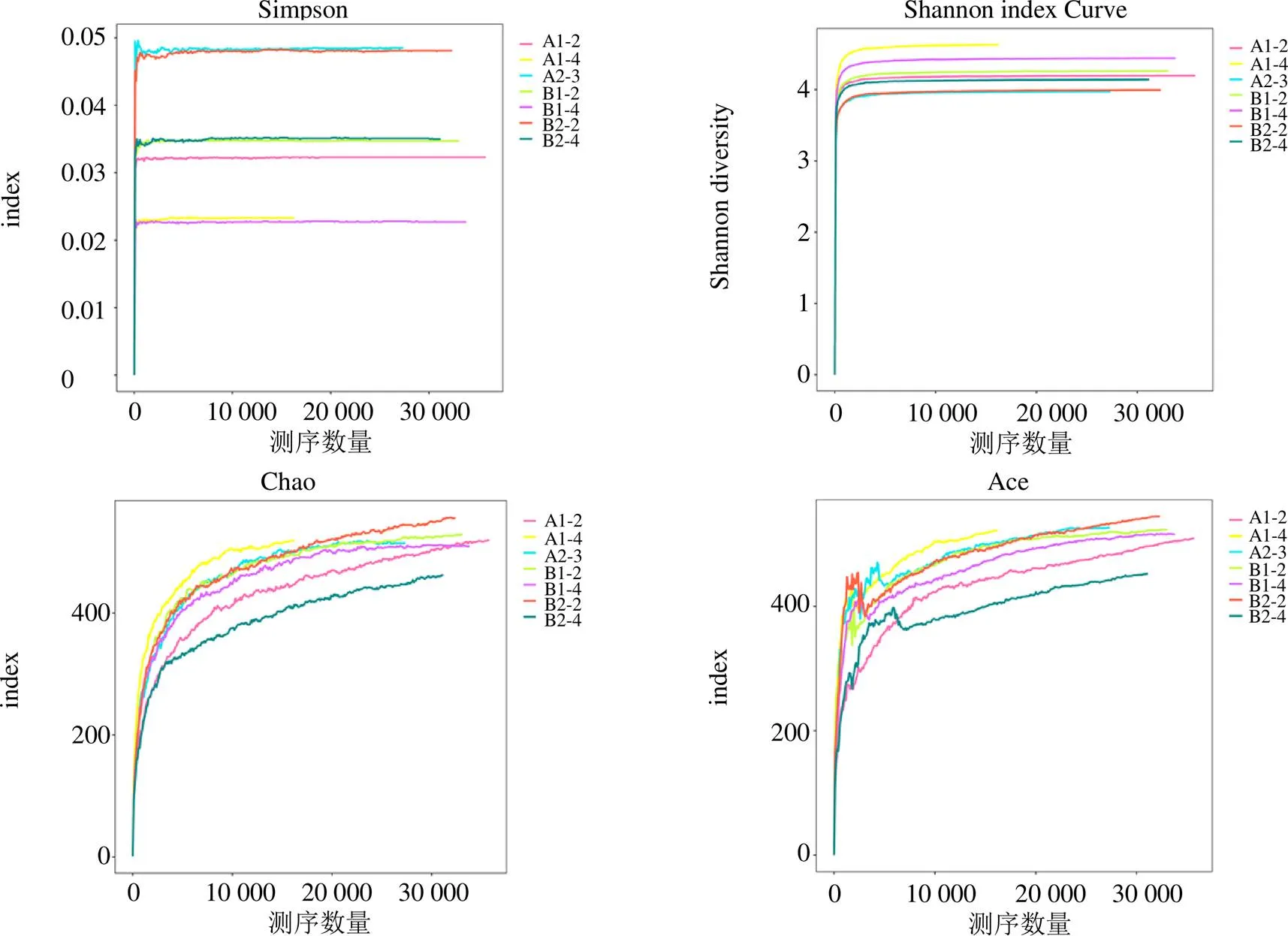
图10 甘松内生细菌Simpson、Shannon、Chao、Ace指数图
3.2.3 甘松根和根茎内生菌群落分布特征 对甘松根及根茎内生细菌测得的所有序列,进行97%的相似水平下的OUT分类,并进行生物信息统计分析(图11)。在门的分类水平上,野生甘松和仿野生栽培甘松的根际内生细菌群落中共检测出16个门,主要分布有变形菌门(Proteobacteria,65.54%~88.09%)、放线菌门(Actinobacteria,5.937%~26.61%)、酸杆菌门(Acidobacteria,0.38%~5.69%)、拟杆菌门(Bacteroidetes,0.22%~3.62%)、厚壁菌门(Firmicutes,0.45%~2.84%)、绿弯菌门(Chloroflexi,0.16%~1.37%)等。
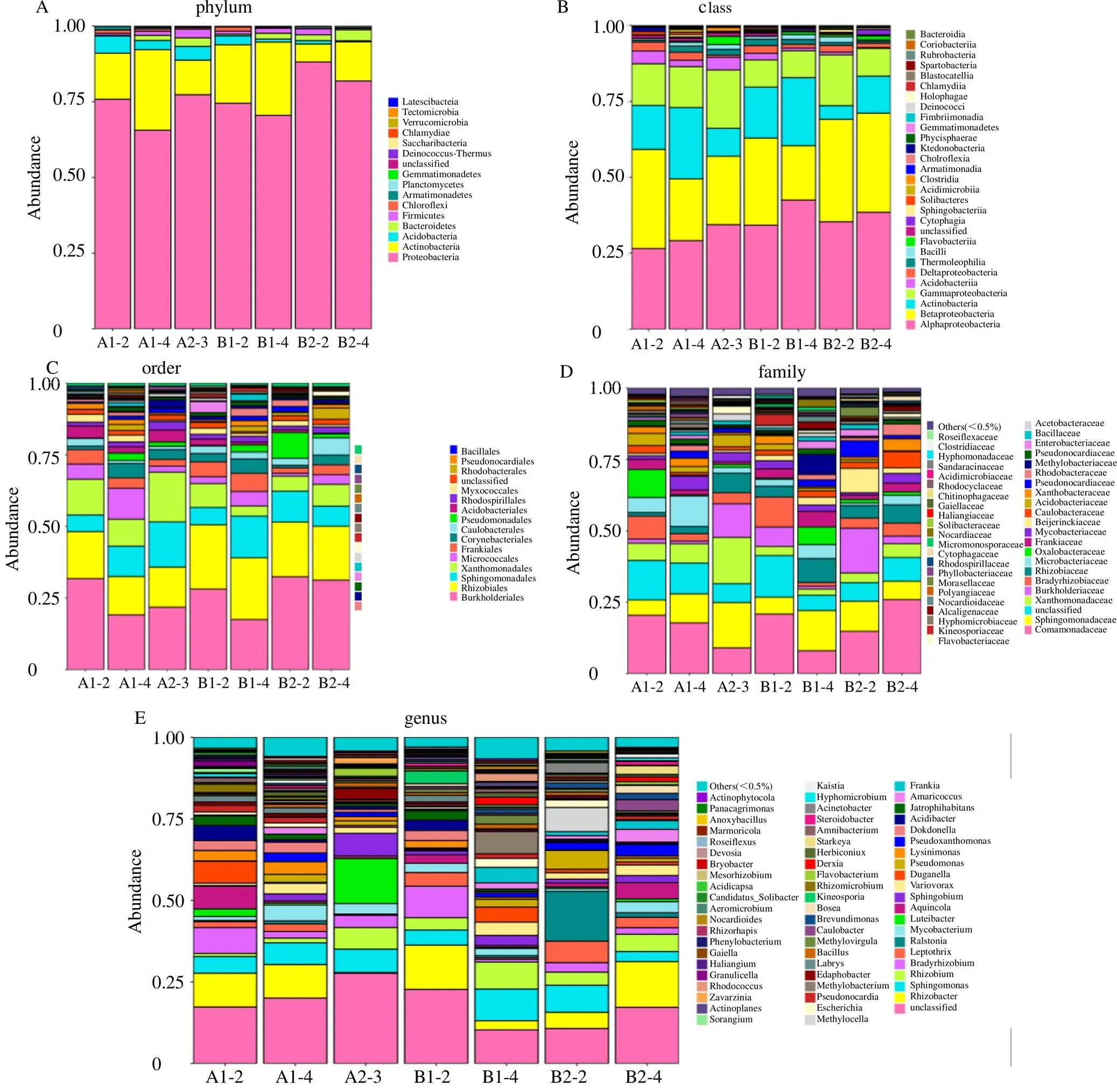
图11 甘松内生细菌的门(A)、纲(B)、目(C)、科(D)、属(E) 水平物种分布柱状图
在纲的分类水平上,共鉴别29个纲,甘松内生细菌在α-变形杆菌纲(Alphaproteobacteria,26.48%~42.47%)、β-变形菌纲(Betaproteobacteria,17.93%~33.78%)、放线菌纲(Actinobacteria,4.49%~23.54%)、γ-变形菌纲(Gammaproteobacteria,8.82%~19.13%)、酸杆菌纲(Acidobacteriia,0.24%~4.22%)、δ-变形菌纲(Deltaproteobacteria,0.70%~2.94%)、嗜热油菌纲(Thermoleophilia,0.62%~2.12%)、芽孢杆菌纲(Bacilli,0.44%~1.91%)、黄杆菌纲(Flavobacteriia,0.06%~2.73%)等中均有分布。
在目的分类水平上,共鉴别60个目,甘松内生细菌在伯克霍尔德氏菌目(Burkholderiales,17.52%~32.36%)、根瘤菌目(Rhizobiales,13.28%~22.45%)、鞘脂单胞菌目(Sphingomonadales,6.07%~15.82%)、黄色单胞菌目(Xanthomonadales,3.51%~17.35%)、微球菌目(Micrococcales,5.83%~15.82%)、弗兰克氏菌目(Frankiales,1.85%~6.34%)、棒状杆菌目(Corynebacteriales,0.89%~5.03%)、柄杆菌目(Caulobacterales,1.02%~5.90%)、单胞菌目(Pseudomonadales,0.12%~8.93%)、酸杆菌目(Acidobacteriales,0.24%~4.22%)等均有分布。
在科的分类水平上,甘松内生细菌鉴别的有107个科,多分布在丛毛单胞菌科(Comamonadaceae,8.05%~25.91%)、鞘脂单胞菌科(Sphingomonadaceae,5.36%~15.80%)、黄色单胞菌科(Xanthomonadaceae,2.14%~6.76%)、伯克氏菌科(Burkholderiaceae,0.97%~15.63%)、根瘤菌科(Rhizobiaceae,1.30%~8.40%)、微杆菌科(Microbacteriaceae,0.91%~10.72%)、弗兰克氏菌科(Frankiaceae,0.94%~5.48%)、分支杆菌科(Mycobacteriaceae,0.84%~4.86%)等科类。
在属的分类水平上,甘松内生细菌共鉴别处出199个属,其中在根瘤杆菌属(0.23%~14.04%)、鞘氨醇单胞菌属(3.13%~9.76%)、根瘤菌属(0.96%~8.27%)、慢生根瘤菌属(0.86%~9.68%)、纤毛菌属(0.21%~6.63%)、分支杆菌属(0.84%~4.86%)、属(0.85%~5.65%)、属(0.59%~7.01%)中多有分布。在种的水平上有145个种,其中68种细菌尚未被人工条件下获得培养的微生物,1种未分类的细菌,这两部分细菌占有相对优势。从甘松内生细菌的种水平差异性矩阵热图(图12)可得知,野生甘松和仿野生栽培甘松的内生细菌最先聚成一类,根际细菌也聚成一类,再与内生细菌聚为一类。
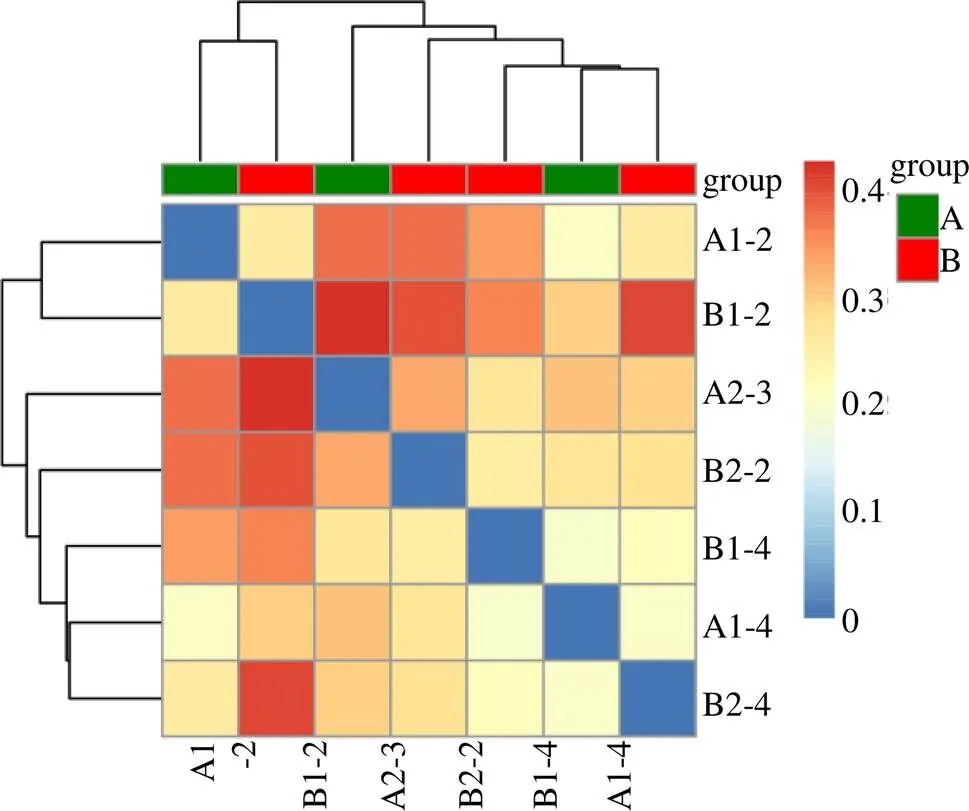
图12 甘松内生细菌的种水平差异性矩阵热图
3.2.4 甘松根和根茎内生菌群落主成分分析 基于相似水平为97%的OTU样品表进行分析,得Venn图(图13),可比较直观地观察到野生甘松与仿野生栽培甘松的内生细菌群落均有562序列被划分入相同的OTU中,各样品中共有的序列有177个。
再根据每个样品OTU的丰度数据计算出每个OTU在每个样品所占的百分比,利用这个百分比信息进行OTU的PCA分析。由图14可知,PC1和PC2的比例综合接近60%,基本可表明各样本整体组成情况。其中,仿野生栽培甘松的样品A1-2、A1-4的内生细菌群落与野生甘松样品B1-2、B1-4和B2-4的内生细菌群落组成的相似度较高,而野生甘松样品B2-2的内生细菌和仿野生栽培甘松样品A2-3的内生细菌组成离群较远。结合门、纲、目、科、属水平和种水平的分析结果,仿野生栽培甘松的内生细菌群落与野生甘松根茎的内生细菌群落更为相似。

图13 甘松内生细菌群落Venn图-分组(左) 与花瓣图(右)

图14 OUT水平上的甘松内生细菌主成分分析
3.2.5 野生甘松和仿野生栽培甘松根及根茎的内生优势细菌差异分析 以所有野生甘松和仿野生栽培甘松的内生细菌类群为对象,使用LDAEffect Size组间群落差异分析野生甘松与仿野生栽培甘松的内生细菌群落中主要差异物种(图15)。分析结果表明,仿野生栽培甘松组别中起到重要作用的内生微生物物种包括酸杆菌门(Acidobacteria)和装甲菌门(Armatimonadetes)2个门,梭状芽胞杆菌纲(Clostridia)和Armatimonadia 2个纲,黄色单胞菌目(Xanthomonadales)、梭状芽胞杆菌目(Clostridiales)、细链孢菌目(Catenulisporales)和Armatimonadales 4个目,黄色单胞菌科(Xanthomonadaceae)、细链孢菌科(Catenulisporaceae)和梭状芽胞杆菌科(Clostridiaceae)等3个科,、细链孢菌属、、罗河杆菌属和5个属。野生甘松组别中起到重要作用的内生微生物物种包括浮霉菌门(Planctomycetes),Phycisphaerae纲,根瘤菌目(Rhizobiales)和Phycisphaerales目,拜叶林克氏菌科(Beijerinckiaceae)、产碱杆菌科(Alcaligenaceae)、Phycisphaeraceae和生丝单胞菌科(Hyphomonadaceae)4个科,弗兰克氏菌属、、r 3个属。
4 讨论
高通量测序技术已被广泛应用于环境[4]、食品[15]、作物培植[9,12,16]以及药用植物[3,5-7,10-11]等微生物群落的多样性研究中。本实验首次运用高通量测序技术对甘松的仿野生栽培品和野生品的根际及内生细菌菌群进行结构分析。
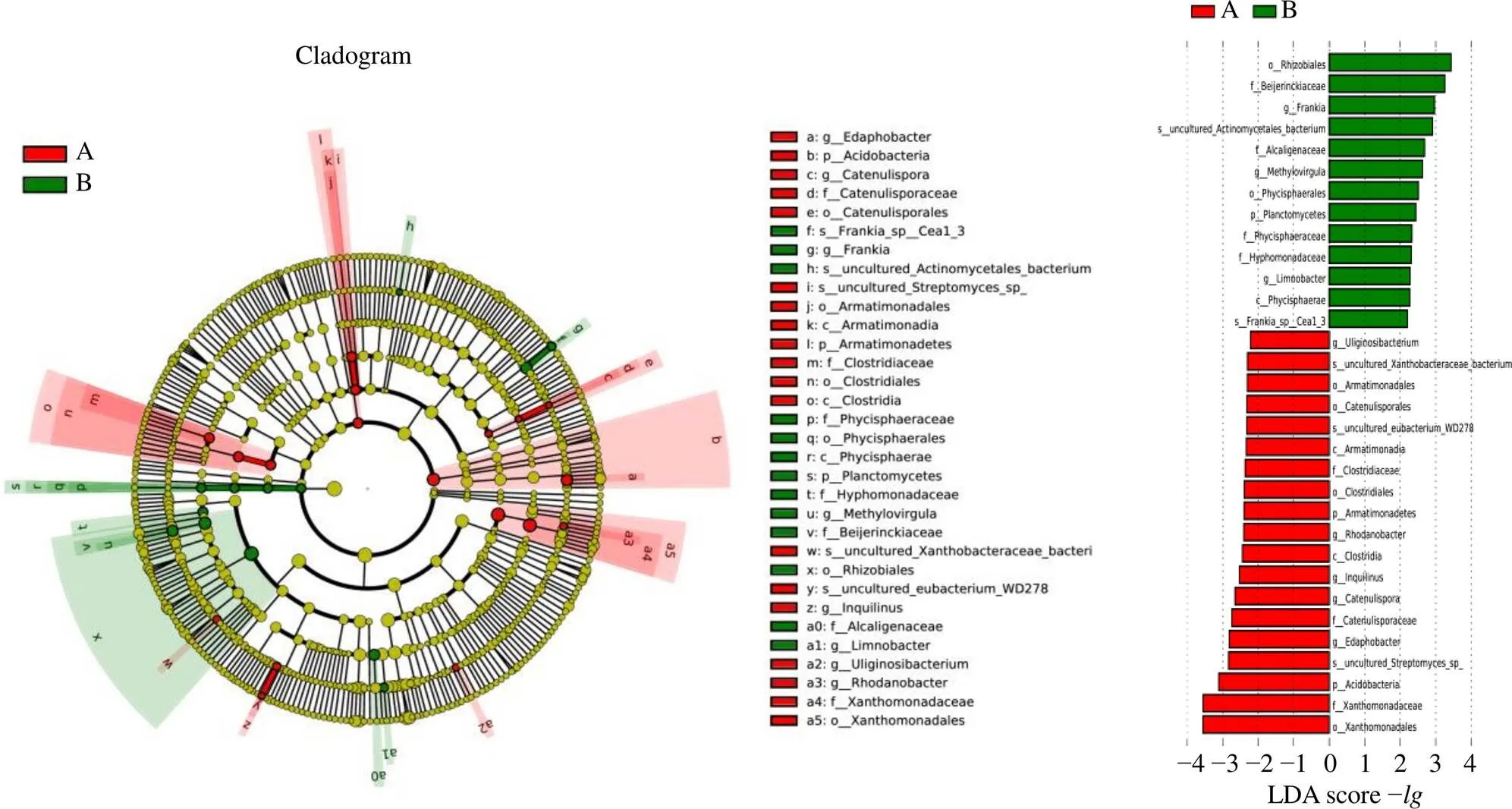
图15 野生甘松和仿野生栽培甘松内生优势细菌LEfSe分析
甘松是青藏高原高寒草甸重要的特有种之一,在保护青藏高原高寒生态系统方面具有重要的作用。在甘松的根际细菌与内生细菌群落中,优势促生菌的功能主要是促进根际土壤养分的转化,增强植物的抗环境胁迫能力和对病原微生物的抵抗力。
仿野生栽培甘松和野生甘松的优势促生菌主要分布在根瘤菌目、鞘脂杆菌目、鞘脂单胞菌目、慢生根瘤菌科、酸杆菌科等。其中,根瘤菌目中的部分细菌具有固氮功能[8],鞘脂杆菌目中的部分细菌可参与铁代谢以及少量的钾和硫的代谢,影响植物的生理代谢,增强植物抗病和抗虫能力[17-22]。鞘脂杆菌目中的部分细菌因能产生热休克蛋白,可提高植物的耐寒性、耐热性和耐旱性[23-25]。酸杆菌科功能的研究比较少,但其在生态系统中具有重要作用,有助于将腐殖质中的有机物转化为土壤中的养分,主动与植物相互作用,起到促进植物生长的细菌作用,以及产生胞外多糖,支持细菌粘附到根表面等[26]。
仿野生栽培甘松根际细菌的优势菌群有假诺卡式菌目、Solirubrobacterales和微单孢菌目等3个目,假诺卡式菌科、微单孢菌科和丙酸杆菌科等6个科;内生细菌的优势菌群有黄色单胞菌目、梭状芽胞杆菌目、细链孢菌目和Armatimonadales等4个目,黄色单胞菌科、细链孢菌科和梭状芽胞杆菌科等3个科,相对丰度显著高于野生甘松。这些差异菌群可能是影响仿野生甘松植物生长的主要细菌群落,例如细链孢菌科菌群是影响重组植物根际微生物共生网络的关键,为根部提供了更多营养物质[27];属的放线菌可抑制植物病原体在根际的生长、分解并利用土壤中的有机质,促进植物生长调节剂的产生[28]。
野生甘松根际细菌的优势菌群有β-变形杆菌纲、Solibacteres纲、芽孢杆菌纲和丰祐菌纲等4个纲,伯克霍尔德氏菌目、黏球菌目、立克次氏体目、Solibacterales目等8个目,Solibacteraceae、多囊粘菌科、亚硝化单胞菌科等8个科;内生细菌的优势菌群有根瘤菌目和Phycisphaerales2个目,拜叶林克氏菌科、产碱杆菌科、Phycisphaeraceae和生丝单胞菌科等4个科,弗兰克氏菌属、、等3个属,相对丰度显著高于仿野生人工栽培甘松。这些差异菌群是甘松植物适应青藏高原高寒的恶劣环境的重要菌群。例如弗兰克氏菌属可显著提高在退化的土壤中移栽后植株的生长、生物量、茎根氮含量和成活率[29];属为很强的甲基营养性菌,可促进植物的增殖、影响种子萌发和根系生长,帮助植物抵抗水分胁迫及帮助保护植物免受干燥和过度辐射等恶劣环境的影响[30]。
这些差异菌群可能是影响仿野生人工栽培甘松与野生甘松药材品质差异的主要细菌群落,而相同的优势促生菌是保持其品质一致的主要细菌群落,后续研究应重点关注。同时,课题组也在对移栽后的仿野生甘松种子与野生甘松种子育苗、移栽、仿野生繁育、药材品质进行系列对比研究。课题后续将围绕药材品质一致性评价,筛选优化出甘松仿野生栽培所需的核心功能微生物混合菌群,并通过分离出的细菌菌群筛选对甘松植物生长的影响,有针对性地改良仿野生培育甘松土壤、调节仿野生繁育品的微生物环境,为开发出提高甘松药材品质的生物菌肥提供重要的研究基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 贾敏如, 张艺. 中国民族药辞典 [M]. 北京: 中国医药科技出版社, 2016: 552.
[2] 中国药典 [S]. 一部. 2020: 87-88.
[3] 刘珍珍, 谷萌萌, 张臣, 等. 基于高通量测序的三七微生物群落结构特征分析 [J]. 中草药, 2020, 51(1): 204-209.
[4] 卢慧, 赵珩, 盛玉钰, 等. 基于高通量测序的两种高寒草甸土壤原核生物群落特征研究 [J]. 生态学报, 2018, 38(22): 8080-8087.
[5] 赵智灵, 刘学周, 魏晓雨, 等. 人参可利用内生菌株的筛选和鉴定 [J]. 中草药, 2015, 46(14): 2143-2148.
[6] 蒋靖怡, 王铁霖, 池秀莲, 等. 基于高通量测序的紫花丹参与白花丹参根际细菌群落结构研究 [J]. 中国中药杂志, 2019, 44(8): 1545-1551.
[7] 姜云, 冉超, 陈长卿, 等. 人参抗病、促生菌的筛选及田间效果评价 [J]. 中国中药杂志, 2018, 43(11): 2230-2235.
[8] 陈文新, 汪恩涛. 中国根瘤菌 [M]. 北京: 科学出版社, 2011: 3-18.
[9] 李聪聪, 朱秉坚, 徐琳, 等. 高寒草甸优势植物叶内、根内与土壤原核微生物群落的分异 [J]. 生态学报, 2020, 40(14): 4942-4953.
[10] 谭勇, 崔尹赡, 季秀玲, 等. 三七连作的根际、根内微生物变化与生态学研究进展 [J]. 中草药, 2017, 48(2): 391-399.
[11] 刘蓬蓬, 陈江宁, 孟莉, 等. 基于Illumina MiSeq高通量测序分析黄芪内生细菌多样性 [J]. 中草药, 2018, 49(11): 2640-2645.
[12] 崔晋龙, 郭顺星, 肖培根. 内生菌与植物的互作关系及对药用植物的影响 [J]. 药学学报, 2017, 52(2): 214-221.
[13] Delseny M, Han B, Hsing Y I. High throughput DNA sequencing: The new sequencing revolution [J]., 2010, 179(5): 407-422.
[14] Luo C W, Tsementzi D, Kyrpides N,. Direct comparisons of Illumina vs.454 sequencing technologies on the same microbial community DNA sample [J]., 2012, 7(2): e30087.
[15] 谭强来, 曾臻, 吴兰兰, 等. 基于高通量测序的江西特色发酵豆豉中微生物群落多样性及其特征分析 [J]. 食品工业科技, 2019, 40(3): 85-89.
[16] 李金花, 高克祥, 万利, 等. 微生物菌剂对楸树幼苗生长及根际土细菌群落结构的影响 [J]. 生态学报, 2020, 40(21): 7588-7601.
[17] 崔曼, 尹彦舒, 张梦琦, 等. 一株大蒜根际细菌特性研究及其对田间大蒜产量和土壤酶活性的影响 [J]. 中国土壤与肥料, 2019(1): 173-179.
[18] Patel M, Kothari I L, Mohan J S S. Plant defense induced inpropagated banana () plantlets byderived elicitors [J]., 2004, 42(7): 728-731.
[19] 周冀衡, 李卫芳, 王丹丹, 等. 钾对病毒侵染后烟草叶片内源保护酶活性的影响 [J]. 中国农业科学, 2000, 33(6): 98-100.
[20] 汪其同, 朱婉芮, 刘梦玲, 等. 基于高通量测序的杨树人工林根际和非根际细菌群落结构比较[J]. 应用与环境生物学报, 2015, 21(5): 967-973.
[21] 程志强. 番茄根际和根内生细菌群落结构组成、多样性、演替及其功能分析 [D]. 福州: 福建师范大学, 2018.
[22] 孙峰, 田伟, 张菲, 等. 丹江口库区库滨带植被土壤细菌群落多样性及PICRUSt功能预测分析 [J]. 环境科学, 2019, 40(1): 421-429.
[23] 汪其同. 杨树人工林根际土壤微生物群落组成及结构研究 [D]. 泰安: 山东农业大学, 2017.
[24] Pegoraro C, Mertz L M, Maia L C,. Importance of heat shock proteins in maize [J]., 2011, 14(2): 85-95.
[25] 曹鹏熙, 刘怡萱, 许国琪, 等. 西藏那曲地区垫状点地梅根际土壤细菌多样性研究 [J]. 环境生态学, 2019, 1(5): 1-9.
[26] Kielak A M, Cipriano M A P, Kuramae E E. Acidobacteria strains from subdivision 1 act as plant growth-promoting bacteria [J]., 2016, 198(10): 987-993.
[27] Chen Y, Bonkowski M, Shen Y,. Root ethylene mediates rhizosphere microbial community reconstruction when chemically detecting cyanide produced by neighbouring plants [J]., 2020, 8(1): 4.
[28] Bhatti A A, Haq S, Bhat R A. Actinomycetes benefaction role in soil and plant health [J]., 2017, 111: 458-467.
[29] Diagne N, Arumugam K, Ngom M,. Use ofand actinorhizal plants for degraded lands reclamation [J]., 2013, 2013: 948258.
[30] Manish Kumar, Divjot Kour, Ajar Nath Yadav,Biodiversity of methylotrophic microbial communities and their potential role in mitigation of abiotic stresses in plants [J]., 2019, 74: 287-308.
Community structure and diversity analysis of rhizosphere bacterial ofand endophytic bacteria in medicinal parts based on high-throughput sequencing technology
LI Ying1, 2, 3, ZHONG Hai-rong2, 4, LI Yi-song1, WEIZE Ri-sha3,5, LI Wen-bing2, 3, 6, LIU Yuan2, 3, 6
1. College of Pharmacy, Southwest Minzu University, Chengdu 610041, China 2. Sichuan Provincial Qiang-Yi Medicinal Resources Protection and Utilization Technology and Engineering Laboratory, Chengdu 610225, China 3. Key Laboratory of Tibetan Plateau Ethnic Medicinal Resources Protection and Utilization, National Ethnic Affairs Commission of China, Chengdu 610225, China 4. Sichuan College of Traditional Chinese Medicine, Mianyang 621000, China 5. The Second People’s Hospital of Liangshan Yi Autonormous Prefecture, Xichang 615000, China 6. Ethnic Medicine Institute, Southwest Minzu University, Chengdu 610225, China
To analyze and compare the population composition, richness, diversity and difference in rhizosphere and endophytic bacteria of the wild and wild imitating cultivated.The 16S rDNA V4-V5 region of rhizosphere bacteria in soil and endophytic bacteria in roots and rhizomes ofthe wild and wild imitating cultivatedwas sequenced by using the Illumina Miseq second-generation high-throughput sequencing technology, and the related biological information was also analyzed.The genome of each sample was sequenced by 16S, and all sequences of bacterial community were OUT classified at 97% similar level, respectively. A total of 22 phyla, 38 classes, 69 orders, 119 families, 254 genera, and 268 species were detected in the rhizosphere bacteria of. And there were 16 phyla, 29 classes, 60 orders, 107 families, 199 genera, and 145 species in rhizosphere bacteria of. The common sequences of rhizosphere and endophytic bacterial communities were 498 and 177, respectively. The comprehensive proportions of PC1 and PC2 groups in principal component analysis were close to 70% and 60%, respectively. Among them, Proteobacteria, Actinobacteria, Acidobacteria and Bacteroidetes ranked the top four in the order of abundance, while there were some differences in the categories and relative abundance of other groups.The main growthpromoting phylums of wild and wild imitating cultivatedmay be mainly concentrated in Proteobacteria, Actinobacteria, Acidobacteria and Bacteroidetes, from which the core functional microorganism mixed flora can be screened out. These results can play a theoretical guiding significance for improving the soil microbial community of wild imitating cultivated
DC.; rhizosphere bacteria; endophytic bacteria; community structure; diversity
R282.2
A
0253 - 2670(2022)03 - 0835 - 13
;10.7501/j.issn.0253-2670.2022.03.024
2021-09-06
国家重点研发计划(2018YFC1706101);四川省科技计划应用基础项目(2020YJ0099);中央高校基本科研业务费专项资金研究类项目(2018NQN13)
李 莹(1982—),女,吉林伊通,汉族,副教授,硕士生导师,研究方向为民族药品种与品质评价研究。E-mail: liying@swun.cn
刘 圆(1968—),女,教授,博士生导师,主要从事民族药品种、品质评价及新药资源保护与利用研究。Tel: (028)85528812 E-mail: 499769896@qq.com
[责任编辑 时圣明]
