宁夏枸杞花药转录组分析及花药发育相关基因的筛选
2022-02-14范文强刘雪霞马小兰王路瑶岳思君唐建宁朱金忠姚新灵
范文强,刘雪霞,马小兰,王路瑶,张 兴,岳思君,唐建宁,朱金忠,姚新灵,郑 蕊*
宁夏枸杞花药转录组分析及花药发育相关基因的筛选
范文强1,刘雪霞1,马小兰1,王路瑶1,张 兴1,岳思君1,唐建宁2,朱金忠3,姚新灵1,郑 蕊1*
1. 宁夏大学生命科学学院,西部特色生物资源保护与利用教育部重点实验室,宁夏优势特色作物现代分子育种重点实验室,宁夏 银川 750021 2. 宁夏枸杞产业发展中心,宁夏 银川 750021 3. 中宁县杞鑫枸杞苗木专业合作社,宁夏 中宁 755100
为了探知宁夏枸杞花药发育过程及挖掘花药发育相关基因。以单双核花粉时期和成熟花粉时期的花药为研究材料,通过高通量Illumina HiSeq2500测序平台进行转录组分析。组装共获得128 151条Unigene,将Unigene与NCBI的非冗余蛋白质数据库(non-redundant protein databasse,NR)、去冗余的蛋白序列数据库(Swiss prot protein database,Swiss-Prot)、基因本体数据库(gene ontology,GO)、直源同源群集数据库(clusters of orthologous groups,COG)、真核同源群数据库(euKaryotic orthologous groups,KOG)、基因功能和代谢途径数据库(Kyoto encyclopedia of genes and genomes,KEGG)数据库比对,共有40 140条得到注释。在错误发现率(false discovery rate,FDR)<0.05且差异倍数(fold change,FC)≥2的条件下,单双核花粉时期与成熟花粉时期的差异表达基因共有46个。KEGG注释发现有4个差异表达基因参与甘油酯代谢、亚油酸代谢、苯丙氨酸代谢和苯丙烷类生物合成4个途径中。富含亮氨酸重复蛋白、细胞周期蛋白、类受体蛋白激酶、E3泛素蛋白连接酶等11个差异表达基因参与了花药发育过程。随机选取其中5个差异表达基因进行qRT-PCR验证,表达结果与转录组数据基本一致,表明其数据真实可靠。为进一步解释宁夏枸杞花药发育的相关分子机制奠定了基础,也为后续研究宁夏枸杞花药发育的生物学特征提供了有益的基因资源。
宁夏枸杞;花药发育;转录组;差异表达基因;生物学特征
宁夏枸杞L.属于茄科(Solanaceae)枸杞属Linn.落叶灌木,是重要的药食兼用植物,具有很高的食用、药用和生态保护价值[1]。枸杞是我国传统的名贵中药材和重要经济作物,具有调节免疫、润肺明目等功效,枸杞叶、果和根中都含有人体所需的蛋白质、氨基酸和微量元素[2]。枸杞子是一味常用的补肝益肾中药,现代医学研究证实其含有胡萝卜素、维生素A、维生素C、维生素B1及钙、磷、铁、锌、锰等营养成分,对造血功能有促进作用,还具有抗衰老、抗肿瘤、抗脂肪肝及降血糖等作用[3]。
花主要由花萼、花瓣、雄蕊和雌蕊4部分组成,其中花药作为雄蕊最重要的组成部分,其发育过程复杂且精细,首先由雄蕊原基经过减数分裂形成小孢子四分体结构,然后花药继续膨大生长,小孢子由四分体结构发育成花粉粒,药室破裂释放花粉,最终花药组织衰老退化[4]。研究植物的花药发育,对于提高植物的抗逆能力、培育新品种以及提高产量具有重要的理论意义与实践价值[5]。花药发育相关基因的研究在许多植物已有报道,在番茄中,通过RNAi,使基因编码的9-顺式-环氧类胡萝卜素双加氧酶(9--epoxycarotenoid dioxygenase,NCED)活性降低,导致番茄花药发育相关基因、、和的转录下调,导致花药发育异常,从而产生了大量异常花粉[6];百合花药发育相关的基因可以在突变体中适当表达,产生正常的花粉粒[7];水稻中基因的严格表达对水稻花药发育至关重要[8]。关于枸杞生长发育[9],生理生态[10]以及基因克隆等方面的研究已有相关报导,其中枸杞基因已经被克隆并进行功能验证,结果表明该基因参与枸杞花药发育过程中淀粉供能的调控[2]。枸杞花药的研究尚处于起步阶段[11]。由于枸杞基因组和转录组相关信息相对缺乏,成为制约研究枸杞花药发育及其调控机制的一个因素。因此,通过转录组学技术挖掘并研究一些与枸杞花药发育相关基因的表达调控,对于解析枸杞花药发育的分子机制具有重要意义。
目前,基于高通量测序技术的转录组分析,已经在植物、动物、微生物转录组研究中广泛应用[12]。因此,本实验利用RNA-Seq技术,选择以体外更加容易培养的单双核花粉时期和减数分裂完成以后的成熟花粉时期枸杞花药进行转录组测序,得到的Unigene进行NCBI的非冗余蛋白质数据库(non-redundant protein databasse,NR)、基因本体数据库(gene ontology,GO)、直源同源群集数据库(clusters of orthologous groups,COG)、真核同源群数据库(euKaryotic orthologous groups,KOG)、基因功能和代谢途径数据库(Kyoto encyclopedia of genes and genomes,KEGG)、去冗余的蛋白序列数据库(Swiss prot protein database,Swiss-Prot)、蛋白质家族数据库(protein family,Pfam)注释,筛选出与花药发育相关的差异表达基因,结果为进一步研究枸杞花药发育提供基因资源和研究基础。
1 材料
“宁杞1号”是宁夏枸杞研究所钟鉎元[13]选育的高产、优质、适应性强的枸杞新品种。于2016年6月取自宁夏育新枸杞种业有限公司(106°6'11.516"E,38°31'1.808"N)标准化管理的枸杞实验田经宁夏大学生命科学学院郑蕊博士鉴定为宁夏枸杞L.。参照徐青等[14]的方法,采集枸杞单双核花粉时期(S1)和成熟花粉时期(S2)的花蕾,设置3个生物学重复,S1时期和S2时期的3个样品分别编号为A1~A3和B1~B3。花蕾的采集结合形态观察、纵横径测量和花药压片法,于干冰上剥离不同时期花蕾中的花药(图1),并立即置于液氮中速冻,长期保存于−80 ℃冰箱备用。
2 方法
2.1 RNA提取及测序文库构建
RNA提取参照TaKaRa公司的RNAisoplus产品说明书进行,提取RNA样品浓度由微量紫外检测仪NanoDrop测定,并使用琼脂糖凝胶电泳检测RNA完整性,以确保枸杞转录组测序文库满足后续分析的需要。
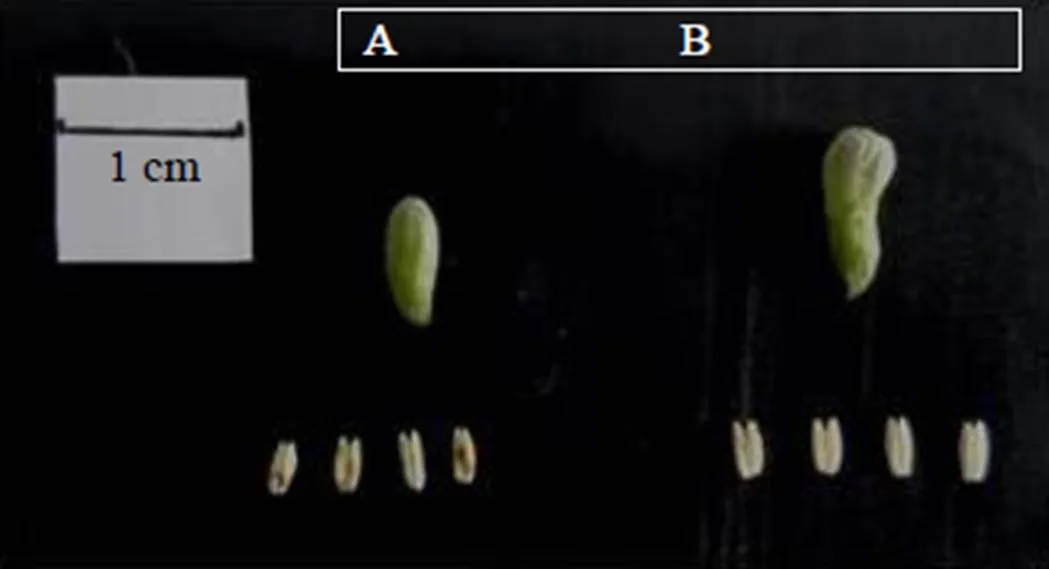
A-S1时期的花蕾和花药 B-S2时期的花蕾和花药
2.2 测序及原始数据的处理
通过高通量illuminaHiSeqTM2500测序平台对已构建好的cDNA文库进行测序,并获得下机数据即原始读段(raw reads)。利用Trinity软件对测序获得的Clean data进行组装,获得枸杞转录组Unigene数据库,通过测序错误率和GC含量对测序数据的质量进行评估,得到Clean data进行分析。
2.3 差异基因的功能注释
使用BLAST软件将Unigene与NR、GO、COG、KOG、KEGG、Swiss-Prot、Pfam等数据库比对(BLAST参数-value≤1.0×10−5和HMMER 参数-value≤1.0×10−10),获得Unigene注释信息。
2.4 花药发育相关差异表达基因的筛选
使用DESeq软件对“宁杞1号”花药S1和S2 2个发育时期的差异表达基因进行分析。在差异表达分析过程中采用公认有效的Benjamini-Hochberg方法对原有假设检验得到的显著性值进行校正,并最终采用校正后的值,即错误发现率(false discovery rate,FDR)<0.05为差异表达基因筛选的关键指标,以降低对大量基因的表达值进行独立的统计假设检验带来的假阳性。在筛选过程中,将FDR<0.05且差异倍数(fold change,FC)≥2作为筛选标准。其中,FC表示2样品(组)间表达量的比值。
2.5 qRT-PCR分析
本研究为了验证转录组数据的可靠性,以枸杞组成型表达基因为内参(GenBank登陆号:HQ415754.1),随机选取5个相对表达量较高的差异表达基因进行qRT-PCR验证,设计qRT-PCR特异引物(表1),利用反转录试剂盒将RNA反转录得到cDNA,采用TB Green Premix Ex Taq II试剂盒,在荧光定量PCR仪上进行定量检测,样品设置3个生物学重复,采用2−ΔΔCt法计算差异基因的相对表达量。
表1 qRT-PCR引物
Table 1 Primers used for real-time quantitative PCR
基因ID基因名称正向引物反向引物 c68267.graph_c0PRX5’-CACCTGTGGATAGGAAGATCA-3’5’-GGAGCACTGTGGATTCATACT-3’ c68844.graph_c0AGPs5’-AGTGAGTGCGAACAATTAAC-3’5’-GTGGTAGTAAGAGATGCGTT-3’ c77007.graph_c0MBR15’-ACGGAAGCTCTGCACATAG-3’5’-GATGACATGGATATTCGTGAT-3’ c75034.graph_c0RPK5’-GAGTATATCTGATGGATATA-3’5’-ACAGGATTAGGTGGCCTA-3’ c72608.graph_c0LRR5’-GATGAACATTGAGTTAACTA-3’5’-CTTCACAACCATTTCAAT-3’ HQ415754.1LbActin5’-GACCTTCAATGTTCCCGCTATG-3’5’-GCCATCACCAGAGTCCAACAC-3’
2.6 统计学方法
本研究使用统计学软件SPSS22和Excel2016对数据进行分析。
3 结果与分析
3.1 枸杞花药转录组测序和clean data组装
样品经过转录组测序以后,共获得44.72 Gb clean data,Q30碱基百分比在92.07%以上(表2),表明转录组数据丰富,质量较高。利用Trinity软件对clean data数据进行组装,共得到128151条Unigene,序列总长度为93 244 314 bp,平均长度为727.61 bp,N50为1170 bp,其中长度区间位于200~300 bp的Unigene数量最多,为42 785条,占33.39%(表3),表明组装完整性较高,可用于后续分析。
3.2 Unigene功能注释
使用BLAST软件将Unigene序列与NR、GO、COG、KOG、KEGG、Swiss-Prot、Pfam等7个数据库比对,最终获得40 140个有注释信息的Unigene,占Unigene总数的31.32%(表4)。
3.3 差异表达基因分析
采用DESeq方法筛选,设置筛选差异条件FDR<0.05,且FC≥2,作为筛选标准,共获得差异表达基因46个,且相对于S1时期,这些基因均在S2时期下调表达(图1)。
表2 转录组测序产量
Table 2 Statistics of transcriptome sequencing output
样品读取数碱基数GC/%Q30/% A129 290 3758 634 418 32643.1792.44 A223 477 5066 921 070 68243.0292.87 A321 597 6166 404 336 10043.5192.14 B122 641 0256 720 401 74042.9992.07 B228 977 3308 608 669 92443.1092.46 B325 044 7647 431 459 82442.8692.36
表3 组装结果
Table 3 Statistics of assembly results
序列长度/nt基因(占比/%) 200~30042 785(33.39) 300~50034 095(26.61) 500~100027 280(21.29) 1000~200014 326(11.18) ≥20009665(7.54) 总数/条128 151 总长度/bp93 244 314 N50长度/bp1170 平均长度/bp727.61
表4 Unigene注释信息
Table 4 Unigene annotation information
数据库Unigene数量百分率/% NR39 35230.71 GO17 50113.66 COG9 184 7.17 KOG19 04014.86 KEGG11 092 8.66 Pfam22 73917.74 Swiss-prot21 53016.80 总计40 14031.32
3.3.1 差异表达基因的GO功能分类 对差异表达基因进行GO分析,结果表明有8个差异表达基因分别被注释到生物学过程(biological process,BP)细胞组分(cellular component,CC)和分子功能(molecular function,MF)中(图2)。
其中,分子功能中催化活性(catalytic activity)和蛋白结合(binding)所占比例最高,分别为7个(87.5%)和6个(75%);细胞组分中最多的是细胞膜部分(membrane),共有1个,占12.5%;生物学过程中则是代谢过程(metabolic process)、细胞过程(cellular process)和单组织过程(single-organism process)比重较大,分别为4个(50%)、3个(37.5%)和2个(25%),如表5所示。
3.3.2 差异表达基因COG/KOG分类 对差异表达基因进行COG分类(图3),结果显示,有17个差异表达基因分布于8类基因家族,注释最多的是仅一般功能预测(general function prediction only,4);其次是翻译(translation,3),复制、重组和修复(reproduction、reorganization and repair,3),信号转导机制(signal transduction mechanisms,3);注释最少的是氨基酸的运输和代谢(transport and metabolism of amino acids,1),脂质的运输和代谢(transport and metabolism of lipids,1),碳水化合物运输与代谢(carbohydrate transport and metabolism,1)以及次生产物合成运输及代谢(secondary metabolites biosynthesis transport and catabolism,1)。

绿色和红色的点代表有显著性表达差异的基因,绿色代表基因表达量下调,红色代表基因表达量上调,黑色的点代表无显著性表达差异的基因
KOG分类发现共有10个基因被注释到5个功能中(图4),其中,含转录本数目最多的是仅一般功能的预测(general function prediction only,5);其次是翻译后修饰(post-translational modifications,3)、蛋白质转换(protein turnover,3)和伴侣蛋白(chaperones,3);最少的是细胞周期调控(cell cycle control,1)、细胞分裂(celldivision,1)、染色体分裂(chromosome partitioning,1)、氨基酸的转运和代谢(amino acid transport and metabolism,1)以及信号转导机制(signal transduction mechanisms,1)。
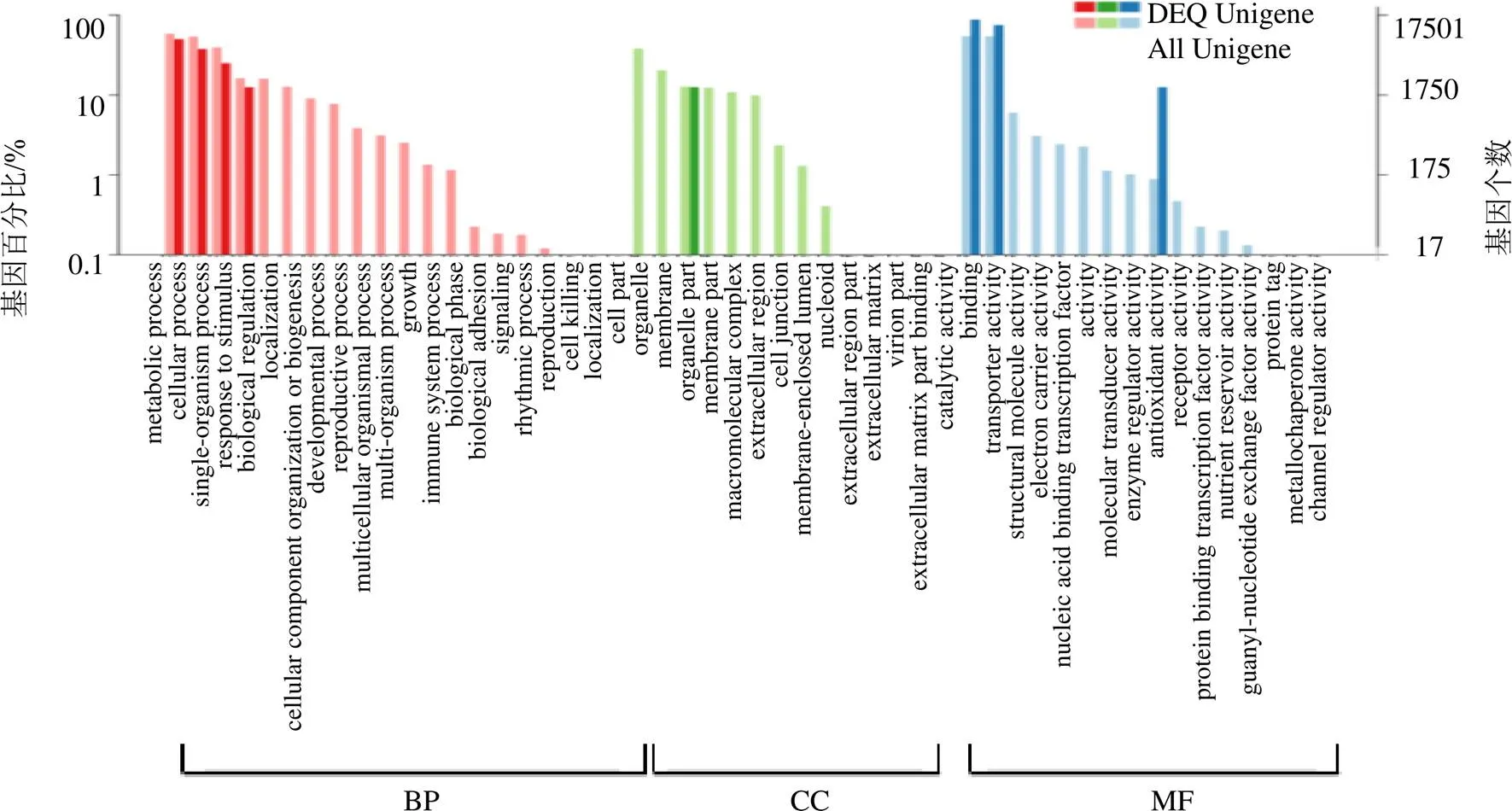
图2 差异表达基因GO二级节点注释
表5 差异表达基因GO功能分类
Table 5 GO functional classification of differentially expressed genes
GO功能分类功能注释DEGs数量百分率/% CC细胞膜112.5 MF催化活性蛋白结合7687.575.0 BP代谢过程细胞过程单组织过程43250.037.525.0
3.3.3 差异表达基因KEGG注释 对差异表达基因进行KEGG注释,发现有3个差异表达基因分别参与甘油酯代谢、亚油酸代谢、苯丙氨酸代谢和苯丙烷类生物合成4条代谢通路(表6)。
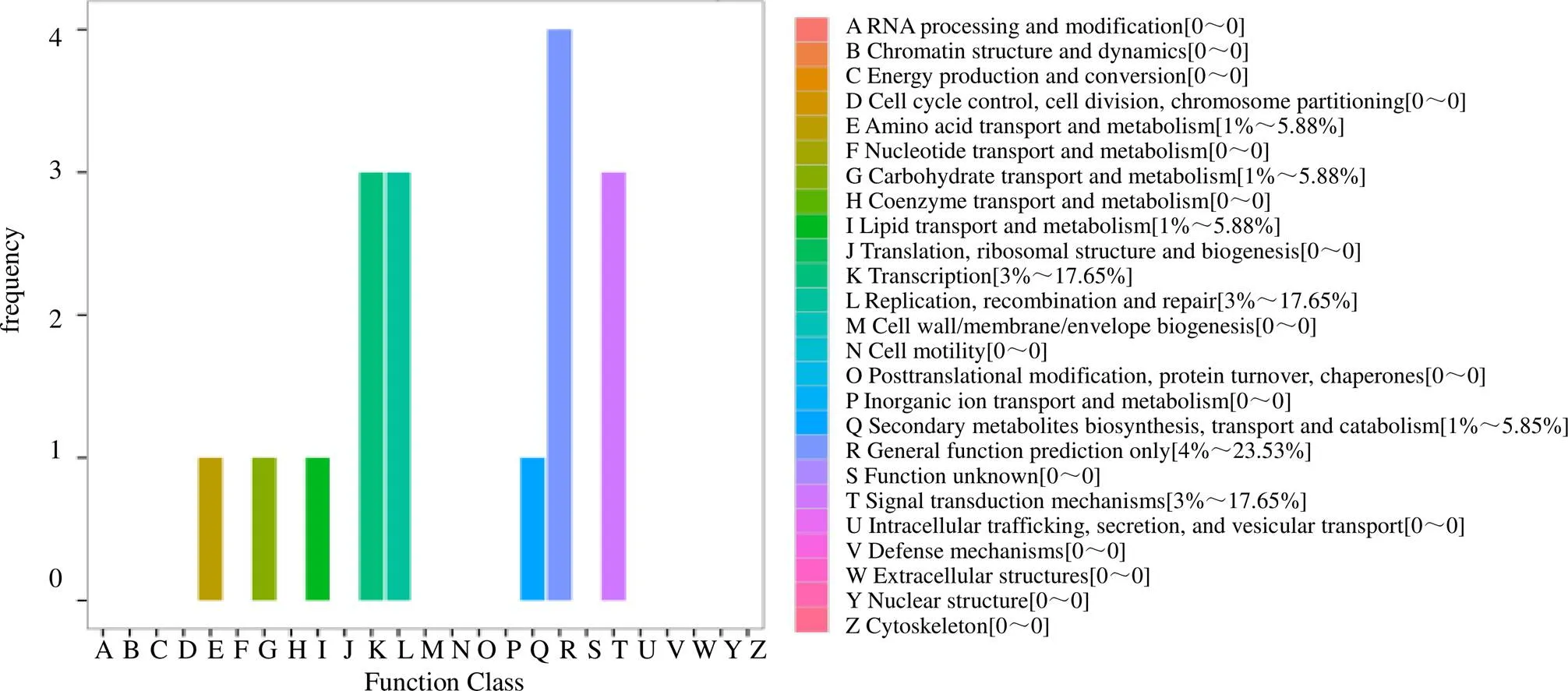
横坐标为COG各分类内容,纵坐标为基因数目

横坐标为KOG各分类内容,纵坐标为基因数目
表6 差异表达基因KEGG功能注释
Table 6 KEGG functional annotation ofdifferentially expressed genes
编号KEGG功能注释基因数量基因ID ko00561甘油酯代谢1c77096.graph_c1 ko00591亚油酸代谢1c31079.graph_c0 ko00940苯丙烷类生物合成1c68267.graph_c0 ko00360苯丙氨酸代谢1c68267.graph_c0
3.4 花药发育相关基因筛选
通过对枸杞转录组测序结果进行功能注释、功能分类及代谢途径分析发现,共筛选到11个与花药发育相关的差异表达基因(表7)。
3.5 差异表达基因的qRT-PCR验证
随机选取5个差异表达基因进行qRT-PCR分析。5个差异表达基因即过氧化物酶(peroxidase,PRX)、阿拉伯半乳糖蛋白(arabinogalactan protein,AGP)、E3泛素蛋白连接酶(E3 ubiquitin-protein ligase MBR1)、类受体蛋白激酶(receptor protein kinase-like,RPK)和富含亮氨酸重复蛋白(leucine-rich repeat protein,LRR),在S2时期的表达量相对于S1时期的表达量均下调,且5个差异表达基因表达水平在S2时期极显著低于S1时期,与转录组测序结果基本一致(图5),表明转录组数据结果可靠。
表7 花药发育相关差异表达基因
Table 7 Differentially expressed genes related to anther development
基因ID基因描述变化倍数基因表达 c68267.graph_c0过氧化物酶−4.590 996 613下调 c77096.graph_c1二酰基甘油酰基转移酶−2.919 934 769下调 c75034.graph_c0过氧化物酶−3.479 978 950下调 c72608.graph_c0富含亮氨酸重复蛋白−3.232 330 297下调 c73778.graph_c0硫氧还蛋白−2.932 284 773下调 c77007.graph_c0E3泛素蛋白连接酶−3.571 161 469下调 c68844.graph_c0阿拉伯半乳糖蛋白−3.730 754 896下调 c77579.graph_c0限制性内切酶−3.097 051 914下调 c77438.graph_c0内切酶−2.956 411 029下调 c69446.graph_c0细胞周期蛋白−3.158 118 976下调 c31079.graph_c0脂氧合酶−3.124 745 110下调

***代表差异极显著,P<0.001
3.6 相关性分析
利用统计学软件对S1和S2 2个时期的转录组数据和qRT-PCR结果进行相关性分析,结果表明S1、S2 2个时期差异表达基因的qRT-PCR结果与转录组数据相关系数分别为0.25、0.41,呈正相关,说明转录组数据可靠。
4 讨论
本研究对“宁杞1号”花药发育过程中S1时期和S2时期的花药进行转录组测序,测序结果与NR、GO、COG、KOG、KEGG、Swiss-Prot、Pfam 7个数据库比对,有注释信息的Unigene占Unigene总数的31.32%,未被注释到的Unigene占68.68%,可能原因是这些Unigene为非编码序列,无法进行同源序列比对;另外,由于枸杞基因组信息缺乏,这些没有被注释到的基因可能是一些未知的基因。对于筛选的差异基因数目较少,推测原因可能是大多数基因在S1时期和S2时期差异表达不明显。
花药发育转录组分析显示,在S1和S2 2个时期,有46个基因差异表达,且在S2时期全部下调表达。46个差异表达基因中,有33个基因在NR数据库中得到注释。将33个基因在PubMud数据库检索发现,PRX、二酰基甘油酰基转移酶、RPK、富含亮氨酸重复基因、硫氧还蛋白、E3泛素蛋白连接酶、AGP、限制性内切酶等11个基因(表7)与拟南芥[15-16]等植物花药发育过程有关。GO和KEGG功能分析表明,有4个差异表达基因被注释到甘油酯代谢、亚油酸代谢、苯丙氨酸代谢和苯丙烷类生物合成4个代谢途径中,其中编码PRX的基因既在苯丙氨酸代谢中表达,也在苯丙烷生物合成中表达,说明该基因的功能与这2个代谢途径比较密切。
PRX是苯丙烷类生物合成中的一类关键酶,苯丙烷类生物合成作为一个重要的代谢通路,是苯丙素代谢网络的核心。苯丙素生物合成会影响植物直立生长,植物体内长途水分运输[16]以及花器官的发育[17-18]。徐青等[14]的研究结果显示,S1时期,绒毡层细胞退化,降解产物流入药室,汇聚形成中央大液泡;S2时期,绒毡层细胞完全消失,表明绒毡层降解产物是花药发育必须的营养物质;Jacobowitz等[15]的研究发现,基因是拟南芥花药发育过程中维持绒毡层和小孢子细胞壁完整性必不可少的,PRX基因突变会导致绒毡层的肥大而导致雄性不育;同时,Hecht等[16]的研究发现,受体样蛋白激酶2基因属于LRR-RLK家族,是花药中层和绒毡层分化所必需的,受体样蛋白激酶2基因突变的花药中不存在中间层,且绒毡层显示肥大,表明受体样蛋白激酶2会影响绒毡层的发育来控制花粉的成熟。本研究结果显示,基因和受体样蛋白激酶2基因在花药发育S2时期的表达量下调,由此推测,在S1时期花药发育需要绒毡层的降解产物提供营养,此时基因和受体样蛋白激酶2基因的表达量较高,而S2时期花粉已完全成熟,不再需要绒毡层的降解来提供营养,所以这2个基因的表达量较S1时期下调。这与前人的研究结果一致,因此推测和受体样蛋白激酶2基因是S1时期降解绒毡层为花药发育提供营养物质必需的基因。此外,甘油酯代谢过程受到二酰基甘油酰基转移酶基因(diacylglycerol acyltransferase,DGAT)的表达调控,Banilas等[19]的研究结果显示,基因在成熟或衰老的橄榄组织中高度表达,同时基因转录物也在花药和子房发育的后期积累,表明基因表达主要影响着花药成熟时期的发育;这与本课题组的研究结果不同,推测可能原因是S2时期花药的发育受到基因和其他基因共同调控。
随机选取5个差异表达基因进行qRT-PCR验证和相关性分析,qRT-PCR结果与转录组数据一致。相关性分析结果表明,S1、S2 2个时期5个差异表达基因的qRT-PCR结果与转录组数据呈正相关,说明转录组数据真实可靠。本研究筛选到的差异表达基因,在花药发育过程中发挥重要的作用,这些差异表达基因的发现为后续研究枸杞花药发育提供基因资源和奠定研究基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhao J H, Li H, Yin Y,. Fruit ripening inandis associated with distinct gene expression patterns [J].2020, 10(8): 1550-1567.
[2] 张兴, 周丽, 乔亚蕊, 等. 枸杞Lb14-3-3c基因克隆及转化马铃薯的研究 [J]. 植物遗传资源学报, 2019, 20(6): 1523-1534.
[3] 陈廷卓. 枸杞子的化学成分与药理作用研究进展 [J]. 中医临床研究, 2010, 2(22): 24.
[4] 胡若琳, 袁超, 牛义, 等. 植物MYB转录因子在花药发育中的调控作用 [J]. 生物工程学报, 2020, 36(11): 2277-2286.
[5] 张在宝, 赵海, 胡梦辉, 等. 组学在花药发育研究中的应用进展I: 转录组学 [J]. 生物技术进展, 2019, 9(5): 433-439.
[6] Wang X H, Xu N, Dong K,. SlNCED1 affects pollen maturation in tomato by regulating the expression of anther-specific genes [J]., 2021, 95(2): 191-205.
[7] Yuan G, Wu Z, Liu X,. Characterization and functional analysis of LoUDT1, a bHLH transcription factor related to anther development in the lily oriental hybrid Siberia (spp.) [J]., 2021, 166: 1087-1095.
[8] Ortolan F, Fonini L S, Pastori T,. Tightly controlled expression of OsbHLH35 is critical for anther development in rice [J]., 2021, 302: 110716.
[9] 郑国琦. 宁夏枸杞果实结构、发育与糖分积累关系研究 [D]. 西安: 西北大学, 2011.
[10] 李捷, 崔永涛, 柏延文, 等. 两种枸杞对干旱胁迫的生理响应及抗旱性评价 [J]. 甘肃农业大学学报, 2019, 54(5): 79-87.
[11] 徐蕊. 枸杞LbMYB103基因在植物花器官发育中的功能初探 [D]. 银川: 宁夏大学, 2018.
[12] Grabherr M G, Haas B J, Yassour M,. Full-length transcriptome assembly from RNA-Seq data without a reference genome [J]., 2011, 29(7): 644-652.
[13] 叶国盛. 枸杞特优品种宁1号 [J]. 农技服务, 1996, (9): 24.
[14] 徐青, 秦垦, 冯爱玲, 等. 枸杞不育系与可育系花药发育的细胞学研究 [J]. 宁夏大学学报: 自然科学版, 2009, 30(3): 263-267.
[15] Jacobowitz J R, Doyle W C, Weng J K. PRX9 and PRX40 are extensin peroxidases essential for maintaining tapetum and microspore cell wall integrity duringanther development [J]., 2019, 31(4): 848-861.
[16] Hecht V, Vielle-Calzada J P, Hartog M V,. TheSOMATIC EMBRYOGENESIS RECEPTOR KINASE 1 gene is expressed in developing ovules and embryos and enhances embryogenic competence in culture [J]., 2001, 127(3): 803-816.
[17] Li Y, Kim J I, Pysh L,. Four isoforms of4-coumarate: CoA ligase have overlapping yet distinct roles in phenylpropanoid metabolism [J]., 2015, 169(4): 2409-2421.
[18] Kumar A, Ellis B E. The phenylalanine ammonia-lyase gene family in raspberry. Structure, expression, and evolution [J]., 2001, 127(1): 230-239.
[19] Banilas G, Karampelias M, Makariti I,. The olive DGAT2 gene is developmentally regulated and shares overlapping but distinct expression patterns with DGAT1 [J]., 2011, 62(2): 521-532.
Anther transcriptome and screening of genes related to anther development in
FAN Wen-qiang1, LIU Xue-xia1, MA Xiao-lan1, WANG Lu-yao1, ZHANG Xing1, YUE Si-jun1, TANG Jian-ning2, ZHU Jin-zhong3, YAO Xin-ling1, ZHENG Rui1
1. Key Laboratory of Protection and Utilization of Special Biological Resources in Western China, Ministry of Education, Key Laboratory of Modern Molecular Breeding for Dominant and Special Crops in Ningxia, College of Life Science, Ningxia University, Yinchuan 750021, China 2.Wolfberry Industry Development Center, Yinchuan 750021, China 3. Qixin Wolfberry Seedling Professional Cooperatives of Zhongning County, Zhongning 755100, China
To investigate the anther development process of, and explore the genes related.The anther transcriptome analysis was performed by the high-throughput Illumina HiSeq2500 sequencing platform using anthers of single microspore and bi-cellular pollen stage and mature pollen stage as research materials.A total of 128,151 unigene were obtained after assembly, and 40,140 unigenes were annotated by searching databases of NR, Swiss-Prot, GO, COG, KOG and KEGG. Under the condition of FDR (false discovery rate) <0.05 and FC (fold change) ≥2, a total of 46 differentially expressed genes were found between single microspore and bi-cellular pollen stage and mature pollen stage. KEGG annotations identified four differentially expressed genes involved in four pathways: glycerol ester metabolism, linoleic acid metabolism, phenylalanine metabolism and phenylpropanoid biosynthesis.There were eleven differentially expressed genes were involved in the anther development process, such as leucine-rich repeat protein (LRR), cyclin (Cyclin), receptor-like protein kinase (RPK), E3 ubiquitin protein ligase (MBR1), and so on. Five of the different expression genes among the eleven genes were randomly selected for qRT-PCR verification, and the expression results were basically consistent with the transcriptome data, indicating that the data were true and reliable.This study lays the foundation for further explaining the molecular mechanisms related to anther development in., and also provides useful genetic resources for subsequent studies on the biological characteristics of anther development in.
L.; anther development; transcriptome; differentially expressed genes; biological characteristics
R282.12
A
0253 - 2670(2022)03 - 0827 - 08
10.7501/j.issn.0253-2670.2022.03.023
2021-10-06
宁夏自然科学基金资助项目(2020AAC03097);宁夏枸杞产业发展中心项目“宁夏枸杞核心种质资源差异性分析及功能基因挖掘”;宁夏回族自治区重点研发计划(重大)重点项目(2019BBF02022)
范文强,男,硕士,研究方向为植物生物学。E-mail: 1534204028@qq.com
郑 蕊,女,博士,研究方向为植物生物技术。E-mail: xlzheng@126.com
[责任编辑 时圣明]
