MALDI-TOF MS鉴定马尔尼菲篮状菌的实验条件优化*
2022-02-11刘俞谷傅俊方江凌晓王艳芳
刘俞谷,贺 莹,傅俊方,龙 军,熊 君,江凌晓,王艳芳△
1.南方医科大学珠江医院检验医学部微生物组医学中心,广东广州 510282;2.南方医科大学珠江医院广东省公共卫生创新平台,广东广州 510282
马尔尼菲篮状菌(TM)是一种双相真菌,流行于东南亚地区及我国南方地区,可致播散性感染,多发于免疫缺陷患者,其病情凶险、预后差,因此早期准确鉴定尤为重要[1-3]。目前,TM的鉴定以其典型菌落特征(温度双相性和红色素)为主,但对于形态不典型菌株,单一温度培养时检验人员易出现判断错误的情况,从而延误患者的诊治。分子生物学方法虽是“金标准”,但目前尚不适用于临床检验科的常规鉴定。近年来,基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF MS)在微生物鉴定领域发展迅速,因其具有快速准确的优点被称为最有前景的鉴定方法[4-5]。目前MALDI-TOF MS应用较广泛的有Bruker Biotyper及VITEK MS系统,但其对于双相真菌的应用研究较为滞后[6]。本研究拟在VITEK MS科研模式(RUO模式)中构建TM的参考数据库,并通过比较不同培养条件及样品前处理方法,探索用于TM质谱鉴定的最佳培养条件和前处理方法。现报道如下。
1 材料与方法
1.1材料来源 南方医科大学珠江医院检验科分离的TM 8株,菌株编号分别为ZJ01、ZJ02、ZJ2360、ZJ399、ZJ18919110、ZJ110307、ZD180201、ZJLin,以上菌株均经形态学及ITS测序鉴定。以大肠埃希菌ATCC8739作为校准和内质控菌株。
1.2仪器与试剂 MALDI-TOF MS仪(法国生物梅里埃股份有限公司,数据库版本V3.0,RUO模式);隔水式电热恒温箱(28、35 ℃),高速冰冻离心机,大型落地摇床(美国Themo Fisher科技有限公司);电子天平;沙保弱葡萄糖琼脂培养基(SDA,广州市迪景微生物科技公司);VITEK MS-CHCA基质液(主要成分为α-氰基-4羟基肉桂酸)、VITEK MS-FA(主要成分为甲酸,酵母菌前处理液)、VITEK MS-DS靶板(法国生物梅里埃股份有限公司);葡萄糖,蛋白胨[生工生物工程(上海)股份有限公司];70%乙醇,甲酸,乙腈(天津市化学试剂供销公司),蒸馏水等。
1.3方法
1.3.1分生孢子悬液制备 于SDA平板接种上述8株TM,28 ℃培养5 d,用含0.05%吐温20的磷酸盐缓冲液收集菌液,并经12层无菌纱布过滤得到孢子悬液,计数并调节孢子浓度为2×107个/毫升。
1.3.2菌株培养 取上述TM菌株约2×106个孢子接种于SDA、沙氏葡萄糖肉汤培养基(SDB)中,于28、35 ℃进行培养,分别在第3、5、7、9天取菌落前处理进行质谱鉴定。以编号ZD180201菌株的质谱数据建立TM质谱参考库。其余7株TM用于验证参考库及构建TM超级谱图库。
1.3.3菌落前处理方法 酵母相菌落(35 ℃)分别采用甲酸乙腈法或者直涂法处理,菌丝相菌落(28 ℃)生长过程的孢子与菌丝不够丰富,且部分生长呈现“咬琼脂”现象,难取样,因此未采用直涂法,按照VITEK MS推荐的丝状真菌前处理方法即甲酸乙腈法处理,具体步骤如下。甲酸乙腈法:按照VITEK MS丝状真菌前处理方法进行处理,即生物安全柜内挑SDA或SDB中菌落分别于900 μL 70%乙醇静置10 min,14 000 r/min离心2 min,弃上清液;沉淀中加入70%甲酸和乙腈各40 μL振荡混匀,14 000 r/min离心2 min。取1 μL上清液及质控菌株加于靶板点位上,干燥后覆盖1 μL CHCA基质液,室温下干燥上机,自动采集质谱谱图。直涂法:生物安全柜内直接取酵母相菌落适量涂靶板,待干后加入0.5 μL VITEK MS-FA,干燥后覆盖1 μL CHCA基质液,同上采集质谱谱图。
1.3.4构建参考库 以其中1株(编号ZD180201)在不同培养基(SDA、SDB),培养温度(28、35 ℃),培养天数(3、5、7、9 d),前处理方法(甲酸乙腈法、直涂法)的高质量谱图,即背景噪音低、基峰分辨率高、主次峰分布错落有致、一致性好、主峰信号强度强、基线稳定及出峰数为80~250个的谱图,构建TM参考库,加入VITEK SARAMI数据库中。
1.3.5结果判读 专用分析软件对鉴定结果进行判读,版本为V3.0。靶板点位通过点位颜色变化来提示结果的可信度,通常有绿、黄、红3种颜色。绿色提示只有一个鉴定结果,概率为60.0%~99.9%,结果可信度水平高。黄色提示仪器对标本分辨率较低,需要进一步采用试验进行区别。红色提示与数据库中任何质谱不匹配。
1.3.6验证并创建超级谱图库 利用其余7株TM验证TM参考库,并汇总高质量质谱谱图,创建超级谱图库,保留39~41个特征性峰,特征性峰权重之和≤1 400。
1.4统计学处理 计数资料以频数或百分率表示,比较不同培养天数、培养温度、前处理方法时的TM质谱鉴定正确率。正确率=正确鉴定菌株数/总数×100%。因样本量小,未进行统计分析。
2 结 果
2.1不同培养天数、培养温度及前处理条件对TM质谱谱图的影响 TM质谱谱图的离子峰以位于质荷比m/z7 848.00、6 113.00、6 668.00、3 335.00附近的特征峰为主,见图1。不同培养温度时,特征峰信号基本相似但略有不同,28 ℃培养特征峰主要以m/z6 113.00附近为主峰,见图1A、B,而35 ℃培养以m/z7 848.00附近为主峰,见图1C、D。
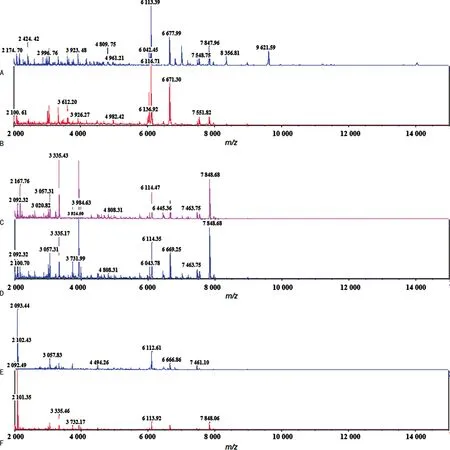
注:A为28 ℃,SDA培养3 d,甲酸乙腈法;B为28 ℃,SDB培养3 d,甲酸乙腈法;C为35 ℃,SDA培养5 d,直涂法;D为35 ℃,SDA培养5 d,甲酸乙腈法;E为28 ℃,SDA培养9 d,甲酸乙腈法;F为35 ℃,SDA培养9 d,直涂法。
相比于SDB,SDA培养的TM更易采集到较多的特征离子峰信号且强度明显的高质量质谱谱图,见图1A、B。TM在SDB 35 ℃培养的菌落采集的高质量谱图数量较少,谱图主要表现为干扰峰多,特征峰信号强度不明显,未纳入参考库。且未使用SDB继续对其他7株临床分离菌株进行培养。
不同培养时长对特征峰的数量与强度影响较为明显,培养3~5 d时采集的质谱谱图质量更佳,可获得较多数量且信号强度明显的特征峰,信噪比较高,见图1A、B、C、D,而培养第9天时特征峰的数量明显减少且信号强度减弱,甚至消失,见图1E、F。
甲酸乙腈法与直涂法前处理方法进行比较后发现,在特征峰最佳的第3天培养时,甲酸乙腈法较直涂法可获得更多数量、信号强度更明显的特征峰,且信噪比更高,质谱谱图与参考库中的特征性质谱谱图匹配效果更好,提示蛋白提取效果更佳,见图1C、D。
2.2MALDI-TOF MS对不同培养温度、培养天数的TM的鉴定正确率比较 不同培养温度下的TM鉴定结果显示,在相同培养天数时,35 ℃培养菌落鉴定正确率均高于28 ℃培养菌落,其中35 ℃培养3~7 d内鉴定正确率均超过70.0%,培养5 d时鉴定正确率可达100.0%。而28 ℃培养菌落则需要在培养3~5 d内行MALDI-TOF MS鉴定,正确率可超过70.0%,见表1。
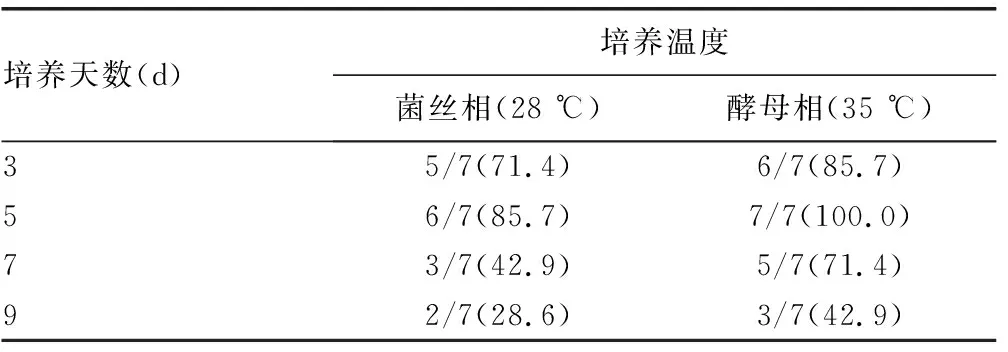
表1 VITEK MS RUO模式对不同培养温度、培养天数的TM鉴定正确率比较[n/n(%)]
不同培养天数下的TM鉴定结果显示,培养第5天鉴定正确率最高(28 ℃培养时鉴定正确率为85.7%,35 ℃培养时鉴定正确率为100.0%),而培养第9天时鉴定正确率最低,均不足50.0%,见表1。
2.3MALDI-TOF MS对不同前处理方法培养的TM的鉴定正确率比较 利用甲酸乙腈法、直涂法对35 ℃,SDA培养的TM进行前处理,结果显示,经甲酸乙腈法提取蛋白进行鉴定的正确率略高于直涂法,见表2。另外,甲酸乙腈法及直涂法对TM的鉴定效果均表现为培养第3~5天鉴定正确率最高,随着培养时间延长,鉴定正确率降低,见表2。

表2 VITEK MS RUO对不同前处理方法的TM的鉴定正确率比较[n/n(%)]
2.4MALDI-TOF MS在不典型TM鉴定中的价值
2.4.1不典型TM的形态学特征 本研究中的不典型TM菌株分离自南方医科大学珠江医院患者肺泡灌洗液和痰液,形态学表现为温度双相型,但是红色素产生极缓慢,28 ℃培养7~9 d局部开始分泌红色素,经ITS测序证实为TM(100%),见图2。
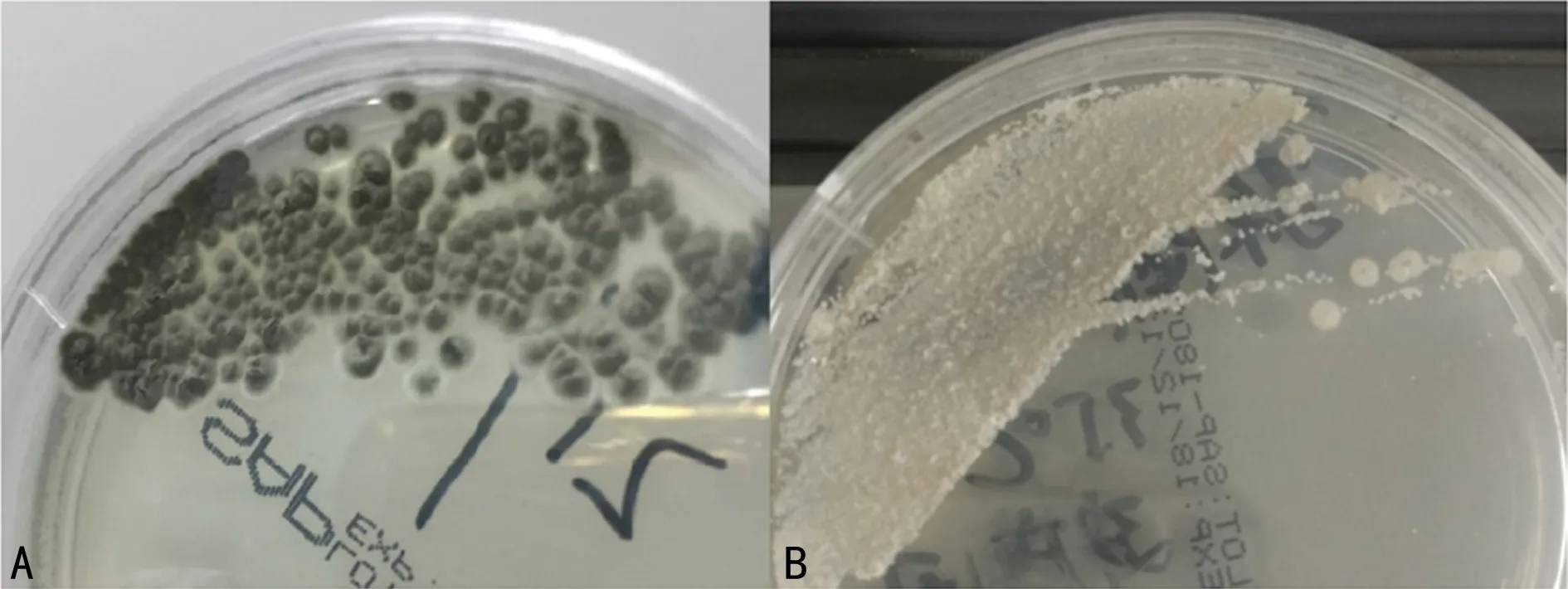
注:A为28 ℃,B为35 ℃。
2.4.2TM自建数据库在不典型菌株鉴定中的应用 对于28 ℃培养7 d未分泌红色素的不典型TM菌株(编号ZJLin),生长速度较典型TM慢,但培养3~5 d时可被TM自建数据库正确鉴定,而培养第7~9天均无法经TM自建数据库正确鉴定。不同温度和前处理方法对鉴定结果均无差异。见表3。

表3 VITEK MS RUO模式TM自建数据库在不典型TM鉴定中的应用
3 讨 论
近年来,随着免疫抑制人群数量的增加,TM感染发病率也随之上升。目前临床微生物实验室对TM的鉴定,主要依赖其温度双相的菌落特征(35 ℃培养为酵母样,28 ℃培养为霉菌样)及典型红色素来判断,但形态学鉴定主要依赖于检验人员的经验。分子生物学鉴定则需要获取足够数量的菌体。对于生长缓慢的菌落,其鉴定耗时长。这限制了TM感染的早期诊断和及时治疗。同时,形态不典型菌株的出现,向微生物实验室对TM的快速准确鉴定提出挑战。
MALDI-TOF MS是微生物鉴定领域的一项极具前景的新技术,有成本低、耗时短、准确、高效等优点,可实现菌株的快速鉴定,目前在国内检验科被广泛推广。但国内外常用的Bruke Biotyper及VITEK MS系统均无TM鉴定参考库,且适合用于TM质谱鉴定的菌落培养条件及前处理方案鲜有报道。
质谱鉴定的准确性受许多因素影响,如培养基种类、培养条件、培养时间、蛋白提取方法等[7]。本研究比较了两种温度(28、35 ℃)、两种培养基(SDA、SDB)培养3~9 d的质谱鉴定正确率。其中从SDB 35 ℃培养菌落采集的质谱谱图数量少,干扰峰较多且特征峰信号强度不明显,考虑为液体培养基摇菌时菌量不足及洗涤不充分所致。因此,操作时应尽可能将菌落沉淀洗涤干净。另外,从28 ℃ SDA及SDB中培养菌落采集到的质谱谱图无明显差异。液体培养基培养操作较复杂,培养液等营养成分会干扰质谱分析,且菌落培养耗时更长,因此固体培养基更适合临床微生物室的快速鉴定。LAU等[8]发现,补充构建数据库后,MALDI-TOF MS能准确鉴定TM,其菌丝相和酵母相质谱谱图类似。本研究发现TM菌丝相及酵母相的特征峰相似,且与文献报道的主峰一致,但在35 ℃培养时鉴定正确率略高。
不同真菌培养时间下质谱谱图的特征峰数量和强度存在明显差异[9-11]。本研究发现,TM培养3~5 d时进行质谱鉴定的正确率高,且第5天最佳,可达100.0%。这主要与此时质谱谱图质量佳、信噪比高及鉴定结果稳定有关。随着培养时间的延长,特征峰信号强度减弱,甚至消失,从而出现错误鉴定或无鉴定结果,这可能与真菌细胞壁较厚且坚韧难破壁、色素产生干扰等有关。
TM于28 ℃时呈菌丝相,35 ℃呈酵母相生长。法国梅里埃公司推荐对丝状真菌采取甲酸乙腈法,对酵母菌采用直涂法进行前处理。直涂法用于酵母菌鉴定效果好,且适用于多种商业化MALDI-TOF MS系统[12-15]。而甲酸乙腈法是利用甲酸及乙腈对菌体进行蛋白提取来获得高质量质谱谱图,不仅适用于酵母菌鉴定[16],也适用于曲霉、皮肤癣菌等丝状真菌鉴定[17-20]。本研究比较两种前处理方法对TM酵母相菌落的鉴定发现,对培养3~5 d的菌落,甲酸乙腈法的鉴定正确率略优于直涂法(100.0%、100.0%vs.71.4%、85.7%)。这与甲酸乙腈法蛋白提取更充分有关。
综上所述,本研究发现经SDA培养3~5 d的酵母相(35 ℃)菌落,经甲酸乙腈法处理后,可获得良好的质谱谱图,鉴定正确率高。此条件也同样适用于形态不典型的TM,为TM的快速、准确鉴定提供了辅助手段。但本研究仅纳入8株TM的质谱谱图,还需要更多菌株进一步完善数据库并验证。MALDI-TOF MS提高了真菌鉴定的准确性,但在鉴定中仍需努力解决如生物安全问题、少见菌株数据库问题及样本处理标准化等问题。
