调衡方对Lewis肺癌荷瘤小鼠瘤组织与肺组织Foxp3、IL-10、TGF-β表达的影响
2022-02-10谭芷芬张宏方于鹏龙王志航徐洋洋王媛媛张怡敏
谭芷芬,张宏方,于鹏龙,王志航,徐洋洋,王媛媛,张怡敏
(陕西中医药大学,陕西 咸阳 712046)
中药方剂多靶点调节免疫抗肿瘤的机制日益成为研究的热点,复方中药(方剂)在恶性肿瘤治疗方面显示出诸多优势并已得到医学界的公认。近年来研究表明肿瘤微环境中CD4+CD25+Treg细胞水平明显升高,该细胞与相关免疫抑制因子共同构建的免疫抑制微环境与肿瘤的进展存在密切关系[1]。CD4+CD25+Treg细胞既可调节抑制周围免疫细胞,又可产生白细胞介素-10(IL-10)、转化生长因子-β(TGF-β)等免疫细胞抑制因子,造成瘤组织中免疫细胞不作为,尤其是TGF-β调节抑制作用最为明显,其可诱导CD4+CD25-T细胞转化为CD4+CD25+Treg细胞,且可降低其周围环境中所有免疫细胞的增殖与分化。而IL-10抑制免疫系统的作用可通过多重机制产生[2]。有研究表明转录因子Foxp3是CD4+CD25+Treg细胞最可靠的特征性标记,它介导了胸腺和外周CD4+CD25+Treg细胞的发育,无论是胸腺还是外周起源的CD4+CD25+Treg细胞都能特异性地表达Foxp3,因此Foxp3可以作为衡量人体中CD4+CD25+Treg细胞数量多少的一个重要指标[3]。经典名方理冲汤源于清代张寿甫《医学衷中参西录》,调衡方为加减取舍了理冲汤的个别药味而化裁出有抑瘤与调节荷瘤体免疫功能的方药[4-10]。该方的粗多糖不仅可提升树突状细胞提呈抗原的能力,还可增强巨噬细胞与红细胞免疫功能[4-6]。但调衡方对荷瘤体免疫抑制性细胞的作用影响仍不清楚,故本实验以小鼠血清、瘤组织与肺组织中Foxp3、IL-10、TGF-β的表达为靶点,从调控荷瘤体免疫抑制性细胞活性等途径切入,探讨调衡方对荷瘤体免疫抑制性细胞调节作用及机制。
1 实验材料与方法
1.1实验动物 雄性C57BL/6小鼠,洁净级二级,体重(20±2)g,鼠龄6~8周,购自西安交通大学医学院实验动物中心,合格证号:SCXK(陕)2018-009,在陕西中医药大学生物技术与免疫实验中心饲养(二级洁净实验室)。所有实验操作均符合动物伦理学要求。
1.2细胞株、试剂和主要仪器 Lewis肺癌细胞株购自南京凯基生物科技发展有限公司。细胞培养液RPMI1640(Gibco),胎牛血清(FBS,购自美国omiga),胰蛋白酶-EDTA消化液(0.25%)含酚红购于武汉普诺赛生命科技有限公司,磷酸盐缓冲液(PBS)干粉购于北京索莱宝科技有限公司,兔抗小鼠Foxp3、兔抗小鼠TGF-β、兔抗小鼠IL-10均购于武汉博士德生物工程有限公司。即用型SABC-POD(兔IgG)试剂盒、DAB显色试剂盒(黄)购于武汉博士德生物工程有限公司,TGF-β、IL-10 ELISA试剂盒购于江苏晶美生物科技有限公司。CCB-150型CO2培养箱(BinDer公司),S200倒置显微镜(重庆奥特光学仪器有限责任公司),酶标仪(美国BioTeK Epoch公司),L530离心机(赛特湘仪公司),赛多利斯电子天平(made by Sartorius),SW-CJ-2FD单人双面超净工作台(苏州净化设备有限公司),HH-S2s数显恒温水浴箱(金坛市大地自动化仪器厂),DHG-9075A型电热恒温鼓风干燥箱(上海-恒科技有限公司),pH值测定仪(上海精宏实验设备有限公司),培养细胞用培养瓶与培养板(Coming公司),细胞计数板(上海市求精生化试剂仪器有限公司),ImagePro plus 6.0型半定量图形分析版软件(MediaCybernetic公司)。
1.3实验用药 经理冲汤加减化裁的调衡方组方:花旗参15 g、生黄芪30 g、莪术10 g、水蛭3 g、白花蛇舌草30 g、生山药30 g、天花粉12 g、川天冬10 g、生鸡内金10 g。各味中药经陕西中医大学附属医院药剂科主任中药师王凡鉴定,均符合2015版《中国药典》质量标准。按中药煎药规定要求,将调衡方组方加工制成流浸膏(3 g生药/mL),分装灭菌置2~10 ℃冰箱备用。贞芪扶正胶囊,甘肃新兰药药业有限公司生产,国药准字J201810501。给药剂量用人与小鼠体表面积折算公式换算。
1.4分组、模型制备及干预方法 采用体重随机分组法将C57BL/6小鼠分为正常组、荷瘤组、贞芪组、调衡方低剂量组、调衡方中剂量组、调衡方高剂量组,每组10只。取生长旺盛的Lewis肺癌细胞,将细胞浓度为6.5×106个/mL的瘤细胞0.2 mL接种于每只小鼠的右侧腋窝皮下。接种24 h后,贞芪组给予贞芪扶正胶囊41.5 g/kg(生药量为0.83 g)灌胃,调衡方低、中、高剂量组分别给予调衡方流浸膏12.5 g/kg、25 g/kg、50 g/kg灌胃,荷瘤组给予等容量生理盐水灌胃,均1次/d,连续8 d。
1.5样本的收集与处理 实验结束后脱颈处死各组小鼠,经心脏取血,随后将血液样本静置2h,3 000 r/min室温离心15 min,取上清液待检;取小鼠瘤组织与肺组织,使用4%多聚甲醛固定24 h,用于后续HE染色与免疫组织化学染色检查。
1.6观察指标及方法
1.6.1瘤组织与肺组织HE染色观察 取制备好的瘤组织与肺组织石蜡切片,置于烘箱中60 ℃烤1~2 h,常规二甲苯、乙醇脱蜡至水,苏木精5 min染色,染色时间依据具体情况而定,流水冲洗并去余色。0.7%盐酸乙醇分化数秒,返蓝,随后伊红染色、脱水:常规二甲苯透明,中性树脂封片,避免气泡。光镜下观察。
1.6.2血清IL-10、TGF-β水平检测 取待检血清,按ELISA试剂盒说明书操作,使用酶标仪(BioTeK Epoch),在450 nm波长依序测量各孔的光密度(OD值)。
1.6.3瘤组织与肺组织中Foxp3、IL-10、TGF-β表达免疫组化检测 将制备好的组织样本置于二甲苯中,脱腊至水,加EDTA 抗原修复缓冲液(pH 9.0),在修复盒中进行抗原修复, 置于3%过氧化氢溶液中避光孵育25 min,PBS缓冲液洗涤。滴加SABC试剂,37 ℃恒温箱中静置20 min,甩去多余的液体。分别加配置好的一抗Foxp3(1∶200稀释)、IL-10(使用浓度为10 μg/mL)、TGF-β(1∶200稀释),37 ℃,1 h;PBS液(pH 7.2~7.6)每次2 min。洗涤 3次,滴加对应的二抗,室温下50 min,PBS液(pH 7.2~7.6)每次2 min。洗涤 3次,滴加DAB显色液,苏木素轻度复染,梯度酒精脱水,二甲苯透明、封片,室温下干燥,显微镜下观察Foxp3、TGF-β、IL-10表达情况并拍照,出现棕褐色颗粒为阳性表达,用半定量图形分析软件ImagePro plus 6.0计算其面积阳性表达率。

2 结 果
2.1各组小鼠瘤组织中瘤细胞形态 HE染色显示:荷瘤组瘤细胞坏死面积很少,有少量的凋亡瘤细胞;调衡方各组多处瘤细胞核固缩、瘤细胞凋亡与坏死,且见瘤细胞膜严重变形,其胞膜皱缩不完整,膜上有许多突起,在瘤组织小血管周围与瘤组织边缘处癌细胞残留坏死物随处可见,尤其是调衡方高、中剂量组明显;贞芪组凋亡瘤细胞与坏死瘤细胞面积较调衡方各组少,但多于荷瘤组。见图1。

图1 荷瘤各组小鼠瘤组织HE染色表现(×400)
2.2各组小鼠肺组织细胞形态 HE染色显示:正常组小鼠肺泡边界轮廓清楚,未见肿瘤灶;荷瘤组小鼠肺组织可见细胞排列混乱的肿瘤转移灶,细胞形状不规则,分布集中,细胞核大、染色深,病理性的核分裂较多,染色较深,肿瘤实、间质间边缘不清;调衡方低剂量组肺组织可见肿瘤细胞,有肿瘤转移灶形成迹象,调衡方中、高剂量组未见明显的肿瘤细胞聚集,且随给药剂量的增大肺泡边界越发清晰,细胞排列与正常肺组织形态越接近;贞芪组肺泡边界轮廓较清楚,偶见肿瘤转移灶,较荷瘤组少,较调衡方中、高剂量组稍多。见图2。
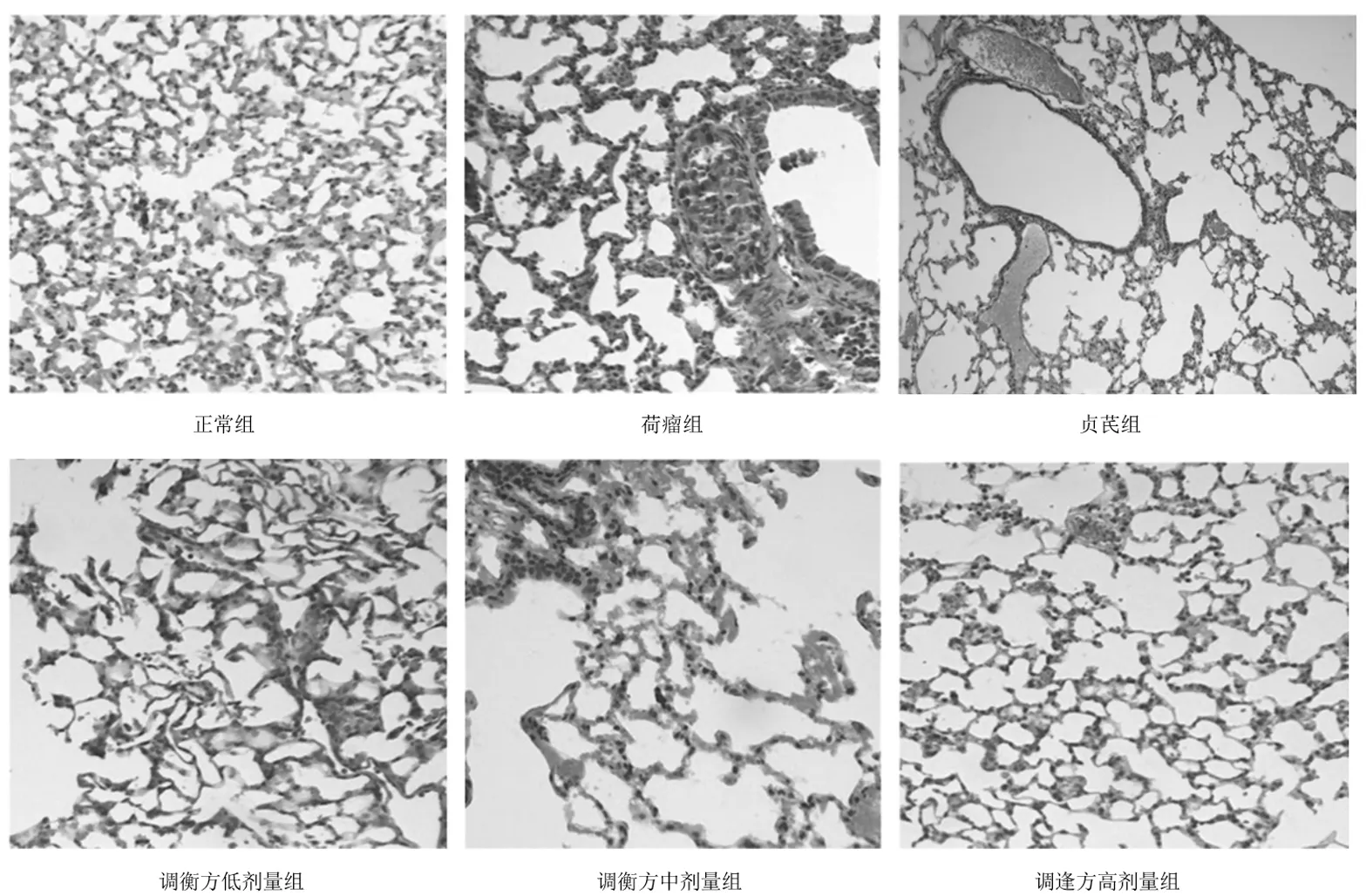
图2 正常组和荷瘤各组小鼠肺组织HE染色表现(×400)
2.3各组小鼠血清IL-10、TGF-β水平比较 荷瘤组血清IL-10、TGF-β水平均明显高于正常组(P均<0.05);贞芪组和调衡方各组血清IL-10、TGF-β水平均明显低于荷瘤组(P均<0.05),调衡方高剂量组均明显低于调衡方低、中剂量组(P均<0.05);调衡方各组血清IL-10水平与贞芪组比较差异均无统计学意义(P均>0.05),调衡方高剂量组血清TGF-β水平明显低于贞芪组(P<0.05)。见表1。

表1 正常组和荷瘤各组小鼠血清IL-10、TGF-β水平比较
2.4各组小鼠瘤组织中Foxp3、IL-10、TGF-β表达情况 免疫组化染色显示,Foxp3蛋白表达多呈弥散性分布,少数局灶性,IL-10和TGF-β蛋白阳性定位于肿瘤细胞的胞浆或胞膜及间质中;贞芪组和调衡方各组Foxp3、IL-10、TGF-β蛋白表达阳性率均明显低于荷瘤组(P均<0.05),调衡方高剂量组均明显低于调衡方低剂量组和贞芪组(P均<0.05)。见图3~6。

图3 荷瘤各组小鼠瘤组织中Foxp3表达情况(免疫组化染色,×400)
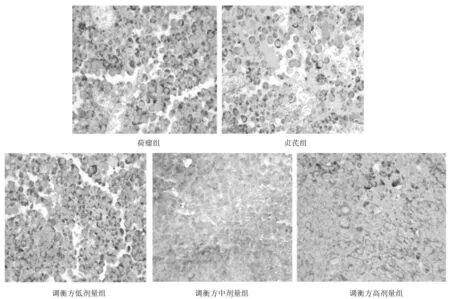
图4 荷瘤各组小鼠瘤组织中IL-10表达情况(免疫组化染色,×400)

图5 荷瘤各组小鼠瘤组织中 TGF-β表达情况(免疫组化染色,×400)

图6 荷瘤各组小鼠瘤组织中Foxp3、IL-10、TGF-β阳性表达率比较
2.5各组小鼠肺组织中Foxp3、IL-10、TGF-β表达情况 正常组显示Foxp3蛋白表达极少,细胞胞浆或胞膜及间质中未见明显IL-10和TGF-β蛋白阳性表达。荷瘤组肺组织中Foxp3、IL-10、TGF-β阳性表达率明显高于正常组(P均<0.05);贞芪组和调衡方各组Foxp3、IL-10、TGF-β阳性表达率均明显低于荷瘤组(P均<0.05),且调衡方高剂量组Foxp3、IL-10、TGF-β均明显低于调衡方低剂量组(P均<0.05)。见图7~10。
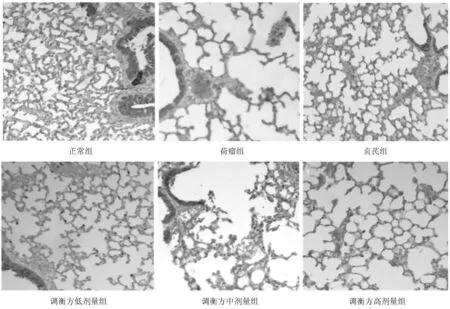
图7 正常组和荷瘤各组小鼠肺组织中Foxp3表达情况(免疫组化染色,×100)
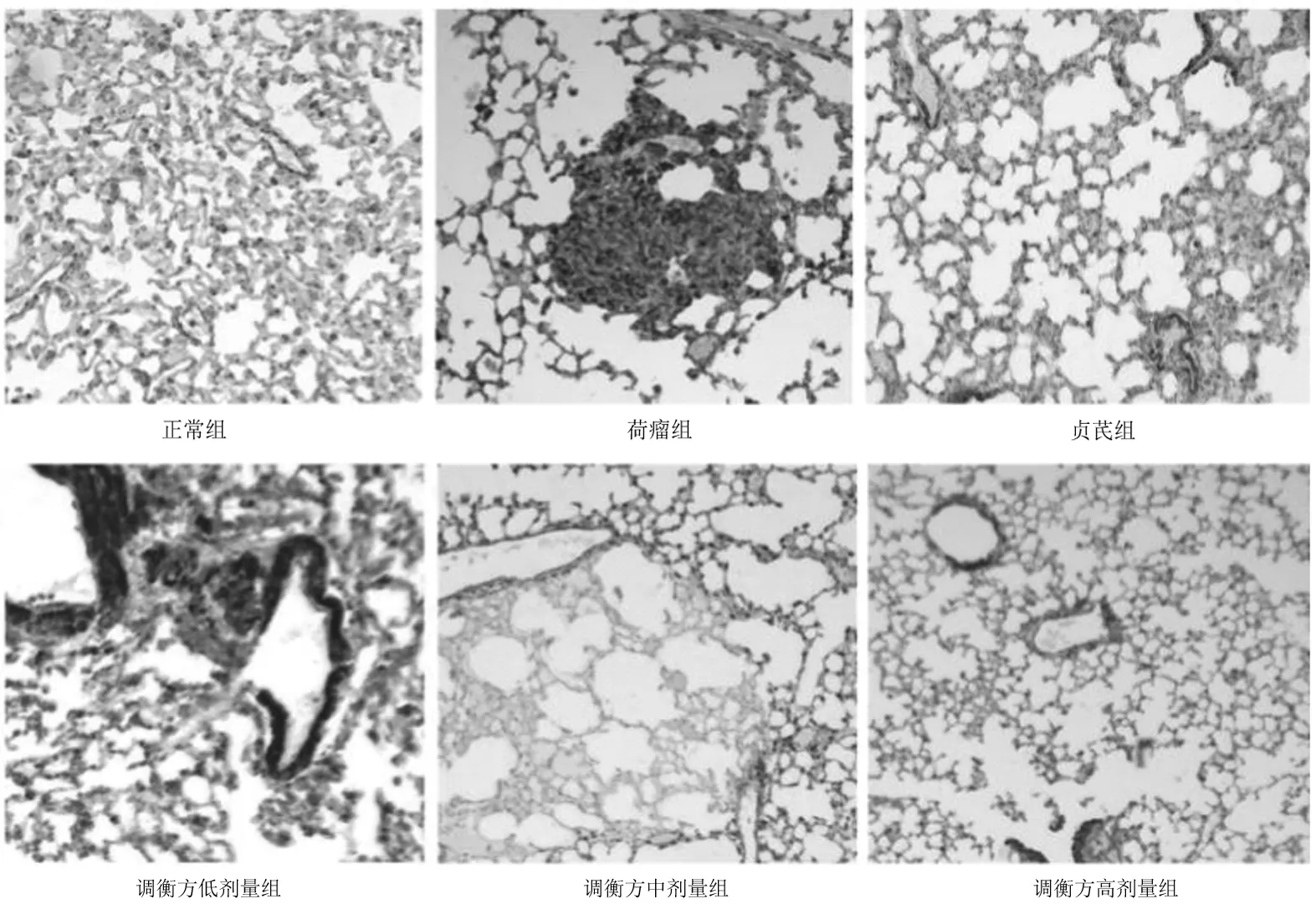
图8 正常组和荷瘤各组小鼠肺组织中IL-10表达情况(免疫组化染色,×100)

图9 正常组和荷瘤各组小鼠肺组织中TGF-β表达情况(免疫组化染色,×100)

图10 正常组和荷瘤各组小鼠肺组织中Foxp3、IL-10、TGF-β阳性表达率比较
3 讨 论
肿瘤归属中医“癥瘕”“积聚”“瘤”“岩”“恶疮”“癌毒”等范畴,正气亏虚为癌毒起病、发展的必要条件,癌毒内结为肿瘤发生的重要病机和物质基础。复方中药调衡方具有益气生血养阴、清热解毒、活血祛瘀之功效,“益气解毒化瘀”能增加机体的“正气”;“益气”可直接扶助正气;“解毒”能减少邪气对正气的耗伤;“化瘀活血”能够祛除局部瘀血阻滞,消除积聚或癥瘕,恢复病灶的血液循环,使瘀血去,新血生,化生正气[11]。本实验以Lewis肺癌细胞建立转移性癌瘤模型,进一步探讨了调衡方对荷瘤体免疫抑制性细胞调节作用及其分泌抑制性细胞因子的影响。
肺癌等恶性肿瘤体周围免疫细胞及肿瘤微环境中各种免疫细胞功能低下,尤其是Treg等抑制性细胞增多与其释放的抑制性细胞因子 IL-10、TGF-β等分泌增加,是导致肿瘤复发与转移的主要原因之一。Treg等抑制性免疫细胞可促进 IL-10、TGF-β等抑制性细胞因子的分泌,进一步抑制CD4+和CD8+T细胞等免疫细胞对肿瘤的免疫应答,从而加速肿瘤的病理进展[12-14];Treg细胞也可通过与肿瘤干细胞(CSCs)相互作用增强肿瘤免疫耐受,促进肿瘤发展[15]。细胞内转录因子Foxp3是CD4+CD25+Treg的自然标志物,并控制其生成与功能的发挥[16],CD4+CD25+Treg可以促进CTLA4和PD-L1、IL-10、TGF-β等抑制性因子高表达而发挥免疫抑制作用。多个研究证实IL-10与肿瘤的转移有关[17-18]。另外从癌变前的肿瘤发展成转移性疾病通常伴随着TGF-β的激活或表达增加[19],发挥全身免疫抑制作用,癌症晚期阶段TGF-β可诱发许多活动促进肿瘤细胞的增长、入侵和转移[20]。随着肿瘤的进展,机体所产生的CD4+CD25+Treg增多,进而释放大量的炎性介质,随之而来的是瘤细胞组织对周围正常细胞器官的挤压及瘤细胞新生血管的大量增生,恶病质增多,肿瘤微环境中的免疫细胞不作为而致的免疫功能低下及紊乱。本实验发现,调衡方能够下调荷瘤小鼠瘤组织与肺组织中Foxp3的表达,从而有效抑制CD4+CD25+Treg对机体的免疫抑制作用,改善肿瘤微环境中免疫抑制情况,从而达到抗肿瘤的目的。调衡方各组血清IL-10、TGF-β水平及瘤组织、肺组织中二者阳性表达率均明显低于荷瘤组,表明调衡方能抑制Lewis肺癌荷瘤小鼠肺脏转移,其抗瘤抑瘤作用与下调抑制性细胞因子IL-10、TGF-β的表达有关。
综上所述,调衡方对Lewis肺癌荷瘤体的作用可能与其下调Foxp3、IL-10、TGF-β表达,改善肿瘤微环境中免疫抑制状况有关,这为肿瘤免疫治疗开辟了新的途径。
利益冲突:所有作者均声明不存在利益冲突。
