几种兰属地生种花瓣花色素组成分析
2022-02-06魏晓羽
刘 红, 魏晓羽, 马 辉, 瞿 辉, 孙 叶
(1.江苏里下河地区农业科学研究所,江苏扬州225007;2.江苏省农业技术推广总站,江苏南京210019)
兰属(CymbidiumSw.)是兰科(Orchidaceae)下的一个属,兰属植物多为附生或地生草本,罕见腐生,多分布于中国、日本、马来西亚、印度北部、菲律宾与婆罗洲,以及澳洲北部等亚热带、热带地区。全属约有48个种,中国分布有29种,其中地生兰种类如春兰(Cymbidiumgeoringii)、蕙兰(Cymbidiumfaberi)、建兰(Cymbidiumensifolium)、墨兰(Cymbidiumsinense)、寒兰(Cymbidiumkanran)、春剑(Cymbidiumlongibracteatum)和莲瓣兰(Cymbidiumlianpan)等被称为中国兰花,简称国兰,在中国有数千年栽培鉴赏的历史。传统国兰优良品种是从野生资源中筛选出的极少数符合中国兰花“瓣型理论”标准的自然变异种[1],是中国特有的珍稀兰花种质资源[2],但是传统国兰优良品种的花色以绿色为主色,色花瓣型品种十分稀有。随着人们兰花鉴赏观的演变,色花类型越来越受到推崇。大花蕙兰(Cymbidiumhybridum)是以兰属中一些大花型附生型品种为亲本,经过多代杂交选择培育出来的花型大、色彩鲜艳、生长强健的优良品种,目前已经发展成为全球五大重要的兰花商品盆花和切花之一,但是大花蕙兰具有无香味、叶型散乱等缺点,并且在中国南方地区不易开花[3]。近年来,通过国兰与大花蕙兰种间杂交,选育兼具二者优点的新品种,已经成为国内兰花人工育种的热点之一。
花色作为观赏植物最重要的性状,主要受到花色素组成及含量的影响[4]。植物花色素主要包括类黄酮、类胡萝卜素、叶绿素和生物碱四大类。其中类胡萝卜素可使花呈现黄色或橙色,叶绿素可使花呈现绿色,甜菜色素可使花呈现红色或黄色。类黄酮是形成花色的重要色素,可分为花青素、花黄素2类。花青素又称花色素,可使花呈现红色或紫红色,主要的花青素包括矢车菊素、天竺葵素、飞燕草素、芍药色素、锦葵色素和矮牵牛素6大类,其中矢车菊素主要呈品红色至红色,芍药色素主要呈紫红色至红色[5]。花青素的甲基化、酰基化及糖基化都能引起花色的变化,花青素的甲基化、糖基化可使红色加深[6]。花黄素主要由黄酮醇、黄酮、黄烷酮、查尔酮等组成,除查尔酮为深黄色外,其他为淡黄色或无色[7],花黄素可能通过与花青素共色素化而参与花的呈色过程[8]。
近年来,国内外对兰科植物花色素的研究逐渐加深,尤其是对类黄酮代谢物组成与结构的鉴定取得了一定进展,在蝴蝶石斛兰、卡特兰、文心兰、大花蕙兰、金钗石斛兰、独蒜兰等兰科植物上已经开展了相关研究[9-14],而关于春兰、墨兰和莲瓣兰等兰属植物花色素组成的研究尚未见报道。本研究拟通过液-质谱联用技术对24种不同色系的中国兰、大花蕙兰及相关杂交种等兰属植物花色素成分进行分析,以期为兰属植物花色形成机理研究奠定基础,为兰花新品种选育提供重要的参考依据。
1 材料与方法
1.1 试验材料及采集
参试的24份材料(表1、图1)取自江苏里下河地区农业科学研究所花卉课题组兰花种质资源圃,包括8份春兰材料(A~H)、4个墨兰品种(I~L)、4个莲瓣兰品种(M~P)、4个大花蕙兰品种(Q~T)及4个春兰与大花蕙兰杂交种(U~X)。

表1 24份兰属参试材料
除春兰大富贵分别选取花蕾期苞片和盛开期舌瓣、外瓣,玉兔选取盛花期捧瓣外,其他材料均选取盛开期花朵外瓣进行色素成分测定,根据《植物新品种特异性、一致性和稳定性测试指南 春兰》(NY/T 2437-2013)描述花朵待测部位颜色。取样时选取生长势一致、花色一致的3个单株为3次生物学重复。将每个单株的花朵全部取下,按照不同部位取样,加液氮研磨成粉末后存于-80 ℃冰箱中备用。
1.2 试剂与仪器设备
色谱级甲酸,购自上海安谱实验科技股份有限公司;色谱级甲醇,购自上海泰坦科技股份有限公司;色谱级乙腈,购自上海沪试实验室器材股份有限公司;叶绿素检测试剂盒(比色法),购自上海禾午生物科技有限公司;矢车菊素-3-O-葡萄糖苷标准品,购自上海西格玛奥德里奇有限公司,纯度达95%以上;芸香苷标准品,购自北京盛世康普化工技术研究院,纯度达96%以上;类胡萝卜素标准品,购自上海西格玛奥德里奇有限公司,纯度达95%以上。
CS-580A分光测色仪,购自杭州彩谱科技有限公司;Sartorius分析天平(型号:BSA124S),购自赛多利斯科学仪器(北京)有限公司;TGL-16M冷冻离心机,购自上海卢湘仪离心机仪器有限公司;UV-6000紫外-可见分光光度计,购自上海元析仪器有限公司;Agilent 1200-6460 QQQ,购自美国安捷伦科技有限公司;LCQ Deca XP MAX液质联用色谱仪,购自美国赛默飞科技有限公司。

材料A~X见表1。图1 24份参试兰属材料Fig.1 24 cultivars of Cymbidium Sw.
1.3 兰花花瓣花色表型的鉴定
对供试材料(除大富贵)盛花期花瓣、大富贵花蕾期苞片的颜色进行描述,以进行花瓣花色表型的鉴定。参照朱佳意等[15]的方法,利用RHCSS(英国皇家园艺学会比色卡)和CIEL*a*b*颜色系统对花色进行定性、数字化描述。L*表示明暗变化程度从0(黑色)到100(白色);a*、b*为正值时,代表红色、黄色,a*、b*为负值时,代表绿色、蓝色;C表示色彩的饱和度,色相角(h)表示色调。
1.4 类黄酮的检测
花瓣中类黄酮的提取参照李崇晖等[16]的方法进行,具体步骤:称取0.1 g冷冻花瓣粉末置于 2 ml 离心管内,加1.5 ml含有0.1%甲酸的甲醇溶液振荡,在4 ℃冰箱内浸提 24 h,每隔6 h振荡1次,提取结束后于1 000 r/min离心10 min,取上清并过0.22 μm 滤膜,得到待测液,每个提取试验进行3次重复。
类黄酮的定性分析利用LCQ Deca XP MAX液质联用色谱仪(HPLC-ESI-MSn)进行,色谱柱为TSK gel ODS-80Ts QA(250.0 mm×4.6 mm,Tosoh,日本)。质谱条件:采用电喷雾离子化(ESI)方法,三重四极杆离子阱分析器,全离子扫描范围为50~2 000m/z;花青素苷、黄酮醇苷分析采用正、负离子(NI)检测模式。毛细管电压为4 000 V,喷雾器压力为 35 Pa,干燥气体(N2)温度为 300 ℃,流速为 10 L/min。
类黄酮的定量分析利用Agilent 1200-6460 QQQ的高效液相色谱-二极管阵列检测法(HPLC-DAD)进行,包括柱温箱(TCC-1260)及光电二极管阵列检测器(DDA-1260)。液相色谱条件:流动相为0.1%甲酸水溶液(A)、乙腈(B)。洗脱程序见表2。色谱柱为Agilent Edipse plus C18(150.0 mm×4.6 mm,5 μm,美国),柱温为35 ℃,进样量为10 μl,流速为0.8 ml/min,检测波长为515 nm(花青素苷)、350 nm(黄酮醇苷),在波长为200~800 nm时对每个吸收峰进行全波长扫描。
花瓣中各类黄酮组分的定量分析采用外标法,将矢车菊素-3-O-葡萄糖苷、芸香苷标准品分别溶于含有0.1%甲酸的甲醇中,最终生成质量浓度0.05~100.00 μg/ml的标准品工作溶液,分别以在515 nm和350 nm处测定的吸光度为横坐标(x)、以质量浓度为纵坐标(Y),得到矢车菊素-3-O-葡萄糖苷相关的标准曲线方程:Y=0.103 3x+3.061 0,R2=0.999 3,芸香苷相关的标准曲线方程:Y=0.402 8x+0.099 4,R2=0.999 5。计算样品中各花青素苷含量(相对于矢车菊素-3-O-葡萄糖苷的含量)、花黄素含量(相对于芸香苷的含量),鲜样的含量单位为μg/g,重复3 次。

表2 流动相的洗脱程序
1.5 类胡萝卜素及叶绿素含量的测定
参照黄昕蕾[17]的方法进行类胡萝卜素的提取,采用紫外-可见分光光度计测定类胡萝卜素含量,测定波长为450 nm,重复3次。参照叶绿素试剂盒方法进行总叶绿素含量的测定,重复3次。
1.6 数据分析
用MassHunter Workstation Software (Version B. 06.00)和Chemdraw Ultra软件对花色成分进行分析,用Excel 2016进行数据整理,用IBM SPSS Statistics 22软件、Duncan’s法进行花色素含量的差异显著性分析,用Origin 2021软件绘制花色的二维、三维散点图,进行主成分分析,用GraphPad Prism 6绘制柱形图。
2 结果与分析
2.1 花色表型分析
兰属植物花色丰富,为了解兰属植物不同色系的着色差异,分别用RHCSS、CIEL*a*b*颜色系统对兰属植物的花色进行定性与数字化描述,详见表3。根据RHCSS评价指标,参试兰花可划分为6种色系,分别为棕色系、紫色系、红紫色系、灰橙色系、黄色系和黄绿色系。
用CIEL*a*b*评价体系量化兰花花色的各项指标,分别以b*、L*为纵坐标,绘制不同色系兰花品种花瓣、花色的二维、三维分布结果,可以看出,灰橙色、黄色和黄绿色主要集中在二维、三维图的上部,棕色、紫色和红紫色主要集中在二维、三维图的下部(图2)。

表3 24份兰属样品的花色表型参数

A:a*、b*的二维分布图;B:a*、b*和L*的三维分布图。图2 24份兰属材料花色指标的二维、三维分布结果(色系由RHSCC值确定)Fig.2 Flower color distribution of 24 Cymbidium Sw. cultivars in coordinate systems of bivariate and trivariate, respectively (The flower colors were identified by the RHSCC value)
如图3所示,黄色系兰属植物的平均L*最高,达59.35,显著高于其他色系兰花(P<0.05);其次为黄绿色系兰花,平均L*为55.30;L*最低的为棕色系兰花,仅为25.60,与其他色系兰花间差异显著(P<0.05);紫色系和红紫色系兰花的L*差别不大,且存在重复区域。红紫色系兰花的平均a*为13.96,显著高于其他色系兰花(P<0.05);其次为紫色系兰花,而黄绿色系、灰橙色系兰花的平均a*分别为-1.87、-2.40,表明它们呈现一定程度的绿色。黄色系兰花的b*最高,达44.62,b*最低的为棕色系兰花,仅为1.26,各色系兰花的b*均为正值,代表不同程度的黄色。C与b*呈现同样的规律,色相角(h)也表现为黄绿色系、黄色系及灰橙色系兰花高于棕色系、紫色系和红紫色系兰花。上述结果表明:紫色、红紫色、棕色和黄色兰花在CIEL*a*b*空间中处于由红色向黄色过渡的区域,而黄绿色系和灰橙色系花处于由绿色向黄色过渡的区域。
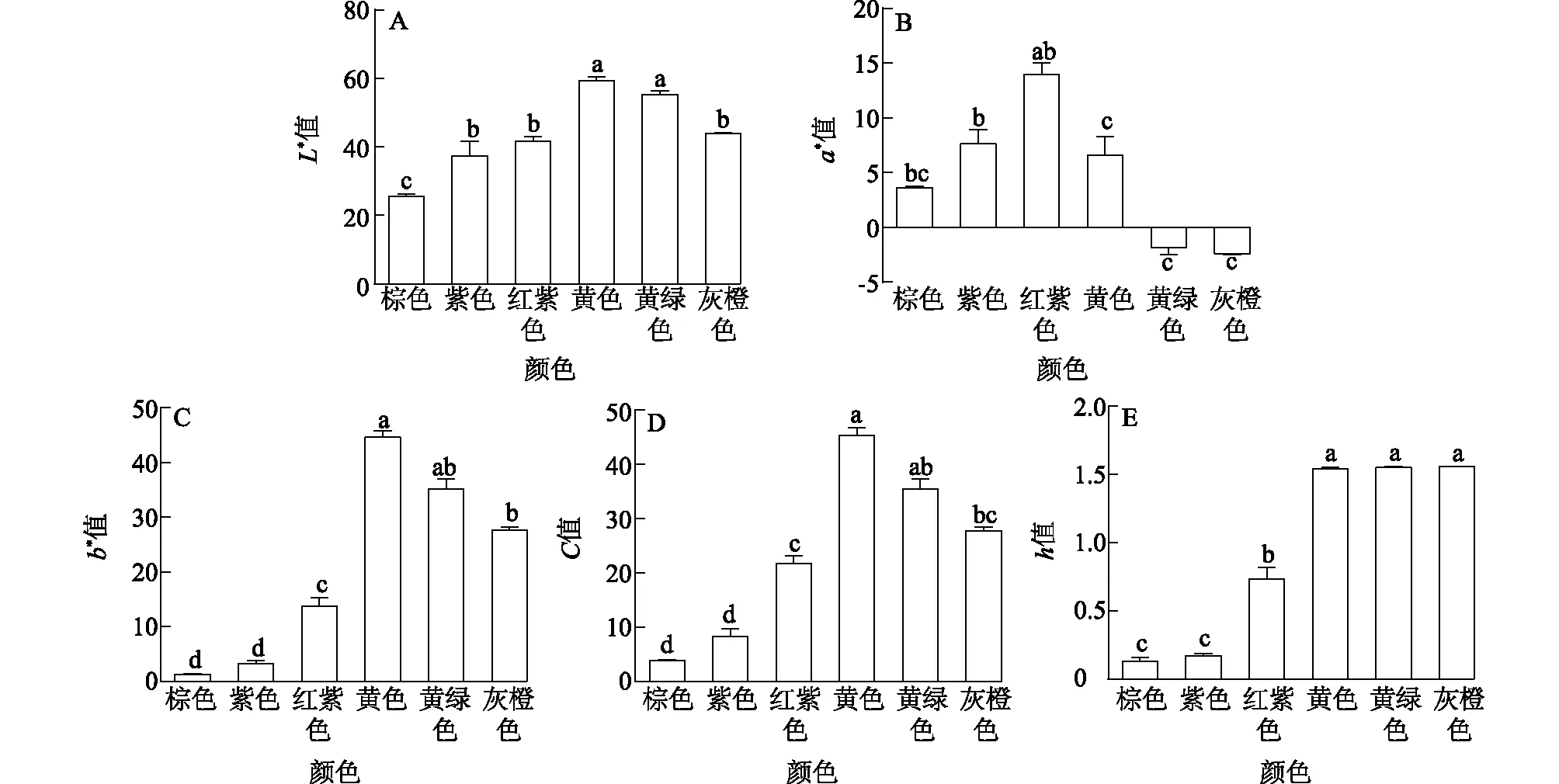
A:L*值;B:a*值;C:b*值;D:C值;E:h值。图3 不同色系兰属植物花色表型的CIE L*a*b*值Fig.3 CIE L*a*b* values in flowers of Cymbidium Sw.
2.2 类黄酮组成成分分析
类黄酮的鉴定基于保留时间、紫外可见吸收光谱(λmax)、特征质荷比、分子离子峰和前人研究中报道的信息,详见表4。在520 nm波长下共检测到6 种花青素苷,图4A为花青素苷种类最丰富的品种大富贵苞片在520 nm下的色谱结果。在350 nm下共检测到47种黄酮醇苷、7种黄酮苷、6种黄烷酮苷及4种未确定的成分,图4B显示了具有代表性的黑墨外瓣的类黄酮色谱结果。
2.2.1 花青素苷 本研究共检测到2种花青素苷元,其中峰a1、a2、a3和a5均产生质荷比(m/z)为287的碎片离子,为矢车菊素苷元(Cyanidin,Cy)的特征碎片离子(表4)。通常情况下,单糖优先连接在花青素苷元的第3位羟基上,2个或2个以上的糖可同时连接在第3位羟基或分别连接在第3位、第5位羟基上[18]。峰a1处分子离子([M+H]+)的m/z为449,由矢车菊素苷元离子结合1 分子葡萄糖基(相对分子质量为162)得到,与矢车菊素3-O-葡萄糖苷标准品一致,因此将峰a1鉴定为矢车菊素3-O-葡萄糖苷(Cyanidin 3-O- glucoside)[8,19]。峰a2 Cy苷元(m/z为287)上连接了2个糖基(相对分子质量分别为162、146),MS2质谱中只能观察到m/z为449的碎片离子([M+H-146]+),而没有观察到m/z为433的碎片离子([M+H-162]+),表明Cy是被1种双糖糖苷化的[20],308为芸香糖苷的特征质荷比,因此将峰a2鉴定为矢车菊素3-O-芸香糖苷(Cyanidin 3-O-rutinoside)[10,12]。峰a3分子离子的m/z约为757,根据文献[13]将峰a3鉴定为矢车菊素-3-O-芸香糖苷-5-O-葡萄糖苷(Cyanidin 3-O-rutinoside-5-O-glucoside)。峰a5[M+H]+对应的m/z为535,较峰a1增加86(为丙二酰基),因而将其鉴定为矢车菊素3-O-丙二酰葡萄糖苷(Cyanidin 3-O-malonylglucoside)[12,15]。峰a4、a6处均产生碎片离子,m/z为301,为芍药花素苷元(Peonidin,Pn)的特征碎片离子,根据前人的报道,分别将峰a4、a6鉴定为芍药花素3-O-芸香糖苷(Peonidin 3-O-rutinoside)、芍药花素3-O-丙二酰葡萄糖苷(Peonidin 3-O- malonylglucoside)[12]。

表4 24份兰属样品花中类黄酮的HPLC-MS分析及结构解析
2.2.2 黄酮醇 质谱分析结果显示,共有 6 种黄酮醇苷元离子,在正离子模式下分别是m/z为287的山柰酚(Kaempferol,Km)、m/z为303的槲皮素(Quercetin,Qu)、m/z为317的异鼠李素(Isorhamnetin,Is)、m/z为319的杨梅黄素(Myricetin,My)、m/z为347的丁香亭(Syringetin,Sy)、m/z为349的二氢丁香亭(Dihydrosyringetin,DHS)。
分子离子峰f1、f8、f9、f46和f58均连续丢失86、162的相对分子质量,产生m/z为347、319、319、303和317的碎片苷元离子。86是丙二酰的特征质荷比,162的相对分子质量大小对应1分子六碳糖,根据Abad-García等[21]的报道,葡萄糖是最常见的单糖,其次为半乳糖、鼠李糖、木糖、阿拉伯糖和葡萄糖醛酸,而甘露糖、果糖和半乳糖醛酸最少见。因此推测峰f1为丁香亭3-O-丙二酰葡萄糖苷(Syringetin 3-O-malonylglucoside);峰f8和f9的质谱信息相同,互为同分异构体,由于当相同苷元连接不同的糖基时,半乳糖苷先于葡萄糖苷洗脱[22-23],因此推测峰f8、f9分别为杨梅素3-O-丙二酰半乳糖苷(Myricetin 3-O-malonylgalactoside)、杨梅素3-O-丙二酰葡萄糖苷(Myricetin 3-O-malonylglucoside)。结合质谱信息及文献报道,推测峰f46、f58分别为槲皮素3-O-丙二酰葡萄糖苷(Quercetin 3-O-malonylglucoside)、异鼠李素3-O-丙二酰葡萄糖苷(Isorhamnetin 3-O-malonylglucoside)[16]。
峰f2 [M+H]+在m/z为579处丢失232的相对分子质量,产生m/z为347的碎片苷元离子,232为琥珀酰阿拉伯糖苷的特征质荷比(琥珀酰的特征质荷比为100,阿拉伯糖苷的特征质荷比为132),因此推测峰f2为丁香亭3-O-琥珀酰阿拉伯糖苷(Syringetin 3-O-succinylarabinoside)。峰f21、f60、f63与f2 的质谱行为相似,且质谱信息相同,峰f21、f60、f63互为同分异构体,皆丢失262的相对分子质量,即丢失1分子琥珀酰(相对分子质量为100)和1分子六糖苷(相对分子质量为162),产生m/z为319的碎片苷元离子。根据上述分析结果,推测峰f21、f60、f63分别为杨梅素3-O-琥珀酰半乳糖苷(Myricetin 3-O-succinylgalactoside)、杨梅素3-O-琥珀酰葡萄糖苷(Myricetin 3-O-succinylglucoside)、杨梅素3-O-琥珀酰己糖苷(Myricetin 3-O-succinylhexose)。
峰f4分子离子([M+H]+)的m/z为511,丢失162 的相对分子质量,产生m/z为349的碎片苷元离子,347为Sy的特征质荷比,根据前人报道,349为二氢丁香亭的m/z[24],因此将峰f4暂定为二氢丁香亭3-O-葡萄糖苷(Dihydrosyringetin 3-O-glucoside)。峰f14、f15互为同分异构体,峰f49、f51和f53互为同分异构体,其质谱行为与峰f4相似,均丢失了1分子六碳糖(相对分子质量为162),结合相关参考文献,推测峰f14、f15分别为山柰酚3-O-半乳糖苷(Kaempferol 3-O-galactoside)[25]、山柰酚3-O-葡萄糖苷(Kaempferol 3-O-glucoside)[10,15-16],峰f49、f51和f53分别为杨梅素3-O-半乳糖苷(Myricetin 3-O-galactoside)[26]、杨梅素3-O-葡萄糖苷(Myricetin 3-O-glucoside)[25]和杨梅素3-O-己糖苷(Myricetin 3-O-hexose)。
峰f5、f13和f61分别是m/z为349、287、319的苷元离子结合相对分子质量为294的双糖(294是桑布双糖特征质荷比[27]),推测峰f5、f13和f61分别为二氢丁香亭3-O-桑布双糖(Dihydrosyringetin 3-O-sambubioside)、山柰酚3-O-桑布双糖(Kaempferol 3-O-sambubioside)和杨梅素3-O-桑布双糖(Myricetin 3-O-sambubioside)。峰f11、f12中只检测到质荷比为349的碎片苷元离子,因此推测其为二氢丁香亭衍生物(Dihydrosyringetin derivative)。
峰f41的液相色谱保留时间及质谱特征与标准品芸香苷相同, 则推测峰f41为芸香苷(Rutin)[10,12,19]。由峰f37、f40的质谱信息看出,它们与已知组分峰f41为同分异构体。峰f40苷元的Qu上连接了2个糖基,分别为1分子鼠李糖(相对分子质量为146)和1分子己糖(相对分子质量为162),在MS2质谱信息中,只能观察到m/z为465的碎片离子([M+H-146]+),而没有观察到m/z为449的碎片离子([M+H-162]+),表明Qu被1种双糖糖苷化。由于m/z为465的碎片([M+H-146]+)的丰度小于m/z为303的碎片([Y0+,M + H - (146+162)]),因此判断该双糖是通过1→2糖苷键连接的[20],进而推测其为槲皮素-3-鼠李糖-(1→2)-葡萄糖[Quercetin 3-O-rhamnopyranosyl-(1→2)-glucopyranoside],即槲皮素3-O-新橙皮糖苷(Quercetin 3-O-neohesperidoside)]。刺槐双糖(Robinoside)[Rhamnopyranosyl-(1→6)-galactopyranoside]与芸香糖苷[Rhamnopyranosyl-(1→6)-glucopyranoside]亦为同分异构体,且当它们连接相同苷元时,刺槐双糖的出峰时间较芸香糖早,根据已知组分峰f43与峰f45[12,25]、f50与f52[10,12,16],可以推测峰f37为槲皮素3-O-刺槐双糖(Quercetin 3-O-robinoside)。峰f16的质谱信息与上述成分相似,但无同分异构体,推测其为杨梅素3-O-芸香糖苷(Myricetin 3-O-rutinoside)。
峰f17分子离子([M+H]+)的m/z约为595,丢失了1分子葡萄糖醛酸(相对分子质量为176)和1分子琥珀酰(相对分子质量为100),产生m/z为319的碎片苷元离子,推测其为杨梅素3-O-琥珀酰葡萄糖醛酸苷(Myricetin 3-O-succinylglucuronide)。
峰f18、f30、f31、f32、f34和f39的质谱行为相似,均为分子离子连续丢失2分子糖苷后产生苷元离子。不同化合物中的糖苷化位置不同,如花青素通常发生在3碳位、5碳位,黄酮醇、黄烷-3-醇通常发生在3碳位、7碳位,黄酮、黄烷酮通常发生在7碳位[28]。峰f18连续丢失2分子鼠李糖苷(相对分子质量为146)后产生m/z为319的碎片苷元离子,推测其为杨梅素3-O-鼠李糖-7-O-鼠李糖苷(Myricetin 3-O-rhamnoside-7-O-rhamnoside)。根据已有研究结果,推测峰f31、f32与峰f34分别为山柰酚3-O-葡萄糖-7-O-葡萄糖苷(Kaempferol 3-O-glucoside-7-O-glucoside)、槲皮素3-O-半乳糖-7-O-葡萄糖苷(Quercetin 3-O- galactoside-7-O-glucoside)和槲皮素3-O-葡萄糖-7-O-葡萄糖苷(Quercetin 3-O-glucoside-7-O-glucoside)[9,29]。峰f30与峰f39的质谱行为一致,互为同分异构体,且与峰f32、f34相似,推测峰f30与峰f39分别为杨梅素3-O-半乳糖-7-O-葡萄糖苷(Myricetin 3-O-galactoside-7-O-glucoside)和杨梅素3-O-葡萄糖-7-O-葡萄糖苷(Myricetin 3-O-glucoside-7-O-glucoside)。
峰f19和峰f22的质谱行为类似,都为分子离子连续丢失糖苷或酰基化糖苷后产生的苷元离子。峰f22与山柰酚3-O-芸香糖-7-O-葡萄糖苷(Kaempferol 3-O-rutinoside-7-O-glucoside)的质谱信息一致[9]。同理,推测峰f19为槲皮素3-O-葡萄糖-7-O-丙二酰葡萄糖苷(Quercetin 3-O-glucoside-7-O- malonyl-glucoside)。
峰f26与峰f27的质谱信息相同,根据已有研究结果,峰f26与杨梅素3-O-没食子酰半乳糖苷(Myricetin 3-O-galloylgalactoside)的结构一致[18],因此推测峰f27为杨梅素3-O-没食子酰葡萄糖苷(Myricetin 3-O-galloylglucoside)。同理,f35与已报道的槲皮素3-O-没食子酰葡萄糖苷(Quercetin 3-O-galloylglucoside)结构一致[27]。
从峰f20、f25、f29、f44、f55、f56、f57中均检测到质荷比为319的碎片苷元离子,但是根据分子离子信息,无法推测具体化合物,均暂认为它们是杨梅素衍生物(Myricetin derivative)。
2.2.3 黄酮 根据质谱数据,在波长为350 nm的条件下共检测到7种黄酮苷,包括2种黄酮苷元离子,在正离子模式下分别为m/z为271的芹菜素(Apigenin,Ap)[30]、m/z约为301的金圣草黄素(Chrysoeriol,Ch)[31]。峰f3分子离子[M+H]+的m/z为609,丢失1分子芸香糖苷(相对分子质量为308)后,产生m/z为301的碎片苷元离子。通常情况下,黄酮、黄烷酮类糖元优先连接在苷元的7位羟基上,因此推测峰f3为金圣草黄素7-O-芸香糖苷(Chrysoeriol 7-O-rutinoside)[32]。峰f10分子离子丢失1分子阿魏酰葡萄糖苷(相对分子质量为338),推定为金圣草黄素7-O-阿魏酰葡萄糖苷(Chrysoeriol 7-O-feruloylglucoside)。峰f38中检测到Ch苷元,但根据分子离子的m/z无法推测其结构组成,因而暂将其推测为金圣草黄素衍生物(Chrysoeriol derivative)。峰f47分子离子丢失1分子葡萄糖苷(相对分子质量为162)和1分子木糖苷(相对分子质量为132),推测其为金圣草黄素7-O-桑布双糖(Chrysoeriol 7-O-sambubioside)。峰f48分子离子丢失了2分子葡萄糖苷,经MassBank查询,与金圣草黄素7-O-槐糖苷(Chrysoeriol 7-O-sophoroside)一致(登记号:PN000073)。峰f24、f42均为芹菜素类衍生物,峰f24的质谱信息与MassBank中芹菜素7-O-丙二酰葡萄糖苷(Apigenin 7-O-malonylglucoside)相符(登记号:PN000048)。峰f42的质谱行为与峰f48相似,均为分子离子丢失2分子葡萄糖苷,因此推测峰f42为芹菜素7-O-槐糖苷(Apigenin 7-O-sophoroside)。
2.2.4 黄烷酮 从峰f6、f7、f23、f28、f36、f59中均检测到m/z为273的碎片柚皮素(Na)苷元[30],经MassBank查询,峰f6为柚皮素7-O-葡萄糖苷(Naringenin 7-O-glucoside)(登记号:PR306370),峰f7为柚皮素7-O-芸香糖苷(Naringenin 7-O-rutinoside)(登记号: PR302552)。峰f23分子离子丢失了1分子阿魏酰(相对分子质量为176)和1分子鼠李糖苷(相对分子质量为146),推定其为柚皮素7-O-阿魏酰鼠李糖苷(Naringenin 7-O-ferulylrhamnoside)。峰f28分子离子丢失了1分子鼠李糖苷(相对分子质量为146),推测其为柚皮素7-O-鼠李糖苷(Naringenin 7-O-rhamnoside)。峰f36分子离子丢失了1分子阿魏酰(相对分子质量为176)、1分子葡萄糖苷(相对分子质量为162),推测其为柚皮素7-O-阿魏酰葡萄糖苷(Naringenin 7-O-feruloylglucoside)。峰f59的质谱行为与峰f48相似,因而推测其为柚皮素7-O-槐糖苷(Naringenin 7-O-sophoroside)。
2.3 花色素组成与定量分析
由于兰花外瓣、捧瓣和舌瓣有不同的着色模式,通常外瓣、捧瓣以同样的方式着色,但是对于蝶花,其花瓣着色模式发生了变化,与舌瓣类似,是经过修饰的,在颜色、形状上都不同。本研究选取不同色系兰花的不同组织部位进行类黄酮、类胡萝卜素和叶绿素含量的测定,可以较全面地分析兰花色素分布特点。研究发现,24份兰属植物花组织中均含有类黄酮、类胡萝卜素和叶绿素(表5)。
2.3.1 类黄酮代谢物成分及含量 在24个样品中共检测到70种类黄酮代谢物,包括6种花青素苷类物质、47种黄酮醇苷类物质、7种黄酮苷类物质、6种黄烷酮苷类物质和4种未确定的代谢物。棕色系花瓣中共包含42种类黄酮代谢物,紫色系花瓣中共包含31种类黄酮代谢物,红紫色系花瓣中共包含61种类黄酮代谢物,黄色系花瓣中共包含34种类黄酮代谢物,黄绿色系花瓣中共包含56种类黄酮代谢物,灰橙色系花瓣中共包含23种类黄酮代谢物。对每种类黄酮代谢物的相对含量进行横向归一化处理,由图5可以看出,棕色系、紫色系、红紫色系和灰橙色系花的类黄酮代谢物与黄色系、黄绿色系花的类黄酮代谢物具有明显差异。
2.3.1.1 花青素苷 在参试的兰属植物花朵中,有16份中检测出花青素苷,包含4种矢车菊素、2种芍药色素(图6),其中只有大富贵苞片中检出6种花青素苷,其余材料中检测出1~5种花青素苷。兰属植物不同色系花朵所含花青素类别与含量差异较大, 总花青素苷(TAC)含量整体表现为棕色系>紫色系>红紫色系>灰橙色系>黄绿色系>黄色系,分别为1 656.92 μg/g、430.62 μg/g、277.61 μg/g、142.88 μg/g、85.20 μg/g和0 μg/g(图7)。从棕色系花中检出4种花青素苷,包括矢车菊素 3-O-葡萄糖苷、矢车菊素 3-O-芸香糖苷、矢车菊素 3-O-芸香糖苷-5-O-葡萄糖苷和芍药花素3-O-芸香糖苷,其中矢车菊素 3-O-葡萄糖苷、芍药花素3-O-芸香糖苷的相对含量明显高于其他色系;紫色系花中均含有花青素苷,共检出6.0种花青素苷,平均每个材料检出5.5种花青素苷,且均含有矢车菊素、芍药花素;红紫色系花中均含有花青素苷,共检出6.0种花青素苷,每个材料中的花青素苷数量平均为3.4种,其中有7份样品中只含有矢车菊素,3 份样品中同时检出矢车菊素、芍药花素;灰橙色系花中有3种花青素苷,均为矢车菊素;在黄绿色系花中,只有2个材料中检出花青素苷,其中从大富贵外瓣中检出1种花青素,从瑞梅外瓣中检出2种花青素苷,均为矢车菊素,在检出花青素苷的样品中,TAC含量处于最低水平;黄色系花的外瓣不含有花青素。此外,春兰大富贵花朵不同部位含有的花青素苷种类和TAC含量不同,其苞片含有4种Cy、2种Pn,舌瓣含有3种Cy,外瓣只含有1种Cy;不同部位的TAC含量表现为苞片>舌瓣>外瓣,分别为520.74 μg/g、275.52 μg/g和52.87μg/g,差异显著(P<0.05)。
在所有检出花青素苷的样品中,矢车菊素含量均高于芍药花素含量,为主要的花青素类型,并且除F-19中的花青素苷含量以矢车菊素 3-O-葡萄糖苷为主外,有8个材料中的花青素苷含量以矢车菊素 3-O-芸香糖苷为主,10个材料中的花青素苷含量以矢车菊素 3-O-丙二酰葡萄糖苷为主。
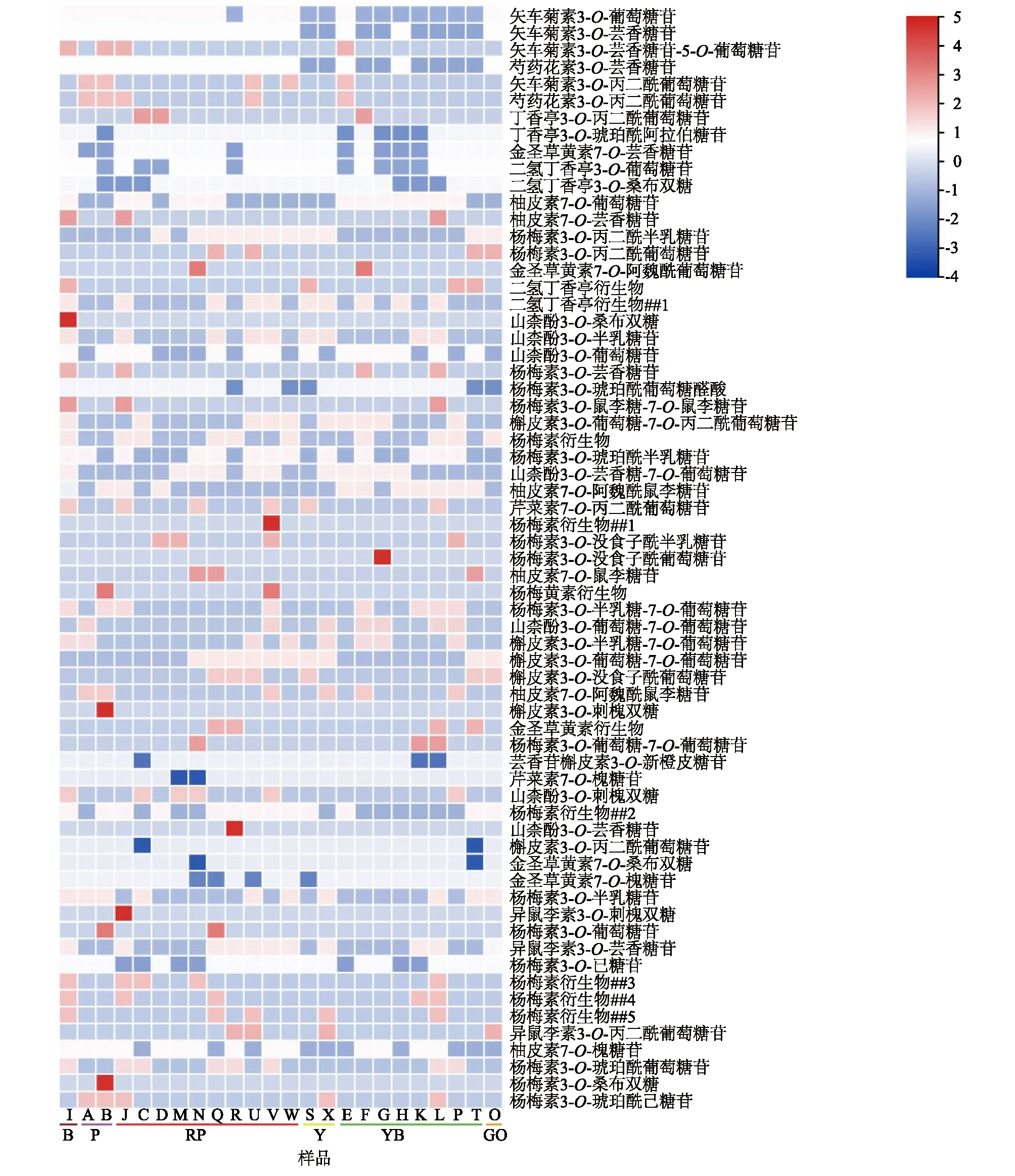
样品A~X见表1。B:棕色系;P:紫色系;RP:红紫色系;Y:黄色系;YB:黄绿色系;GO:灰橙色系。代谢物相对含量采用归一化处理,图中的颜色取决于兰属花朵的浓度,蓝色代表浓度较低,红色代表浓度较高;##1、##2、##3、##4、##5表示未命名。图5 24份兰属样品花中类黄酮物质相对含量热图Fig.5 A heat map of relative content of flavonoids in the flowers of 24 Cymbidium Sw. samples

样品A~X见表1。图6 24份兰属样品花中的花青素苷组成及含量Fig.6 The composition and content of anthocyanin in flowers of 24 Cymbidium Sw. samples
2.3.1.2 花黄素 除花青素苷外,在参试材料中共检出64种花黄素,包括黄酮醇、黄酮和黄烷酮等。黄酮醇苷元有6种,分别为Km、Qu、Is、My、Sy和DHS,其中Km、Qu和My型苷元存在于所有样品中,而少数样品中未检出Is、Sy或DHS苷元;黄酮苷元有2种,分别为Ap和Ch,其中Ch在所有样品中都存在,而Ap仅存在于9个样品中;黄烷酮苷元为Na,在4份样品(O、S、U和W)中未检出(表6)。由图5可以看出,从不同色系的材料中检出11~36个组分,峰f40、f41、f45、f46、f47为普遍存在的花黄素,其中峰f40仅C、K和L中未检出,峰f41仅M、N中未检出,峰f45仅C、T中未检出,峰f46仅N、T中未检出,而峰f47仅N、Q、S和U中未检出;峰f13、f25、f27、f44、f49、f62、f63、f64分别为样品N、V、G、R、J、I、T和Q所特有的,峰f37、f60为样品B所特有的; 峰f7、f18仅存在于墨兰(I、J和L)中,具有一定的种属特异性。
由表4可以看出,在所有检出的64种花黄素成分中,只有峰f15、f22、f31、f32、f34、f41、f43、f45、f46、f50、f52等11种曾在兰科植物中报道过,峰f3、f6、f7、f13、f14、f24、f26、f35、f48、f51等10种在其他物种研究或数据库中报道过,其余除峰f11、f12、f20、f25、f29、f33、f38、f44、f54、f55、f56、f57、f62、f64等14种没有得到准确鉴定外,有28种黄花素为首次报道,分别为丁香亭3-O-丙二酰葡萄糖苷(峰f1)、丁香亭3-O-琥珀酰阿拉伯糖苷(峰f2)、二氢丁香亭3-O-葡萄糖苷(峰f4)、二氢丁香亭3-O-桑布双糖(峰f5)、杨梅素3-O-丙二酰半乳糖苷(峰f8)、杨梅素3-O-丙二酰葡萄糖苷(峰f9)、金圣草黄素7-O-阿魏酰葡萄糖苷(峰f10)、杨梅素3-O-芸香糖苷(峰f16)、杨梅素3-O-琥珀酰葡萄糖醛酸苷(峰f17)、杨梅素3-O-鼠李糖-7-O-鼠李糖苷(峰f18)、槲皮素3-O-葡萄糖-7-O-丙二酰葡萄糖苷(峰f19)、杨梅素3-O-琥珀酰半乳糖苷(峰f21)、柚皮素7-O-阿魏酰鼠李糖苷(峰f23)、杨梅素3-O-没食子酰葡萄糖苷(峰f27)、柚皮素7-O-鼠李糖苷(峰f28)、杨梅素3-O-半乳糖-7-O-葡萄糖苷(峰f30)、柚皮素7-O-阿魏酰葡萄糖苷(峰f36)、槲皮素3-O-刺槐双糖(峰f37)、杨梅素3-O-葡萄糖-7-O-葡萄糖苷(峰f39)、槲皮素3-O-新橙皮糖苷(峰f40)、芹菜素7-O-槐糖苷(峰f42)、金圣草黄素7-O-桑布双糖(峰f47)、杨梅素3-O-半乳糖苷(峰f49)、杨梅素3-O-己糖苷(峰f53)、柚皮素7-O-槐糖苷(峰f59)、杨梅素3-O-琥珀酰葡萄糖苷(峰f60)、杨梅素3-O-桑布双糖(峰f61)和杨梅素3-O-琥珀酰己糖苷(峰f63)。同时,本研究检出的杨梅素、丁香亭和柚皮素类衍生物为首次在兰科植物中发现。
由图7可以看出,不同色系兰属植物花中的类黄酮含量存在一定差异,总类黄酮(TFC)、总黄酮醇、总黄酮和总黄烷酮含量最高的均为棕色系,分别为12 817.74 μg/g、10 504.35 μg/g、1 296.60 μg/g和1 016.80 μg/g,远高于其他色系,且差异显著(P<0.05),而其他色系之间的总类黄酮含量无显著差异;紫色系的TFC、总黄酮醇和总黄酮含量均最低,灰橙色系的总黄烷酮含量最低。棕色系花瓣中的黄酮醇类物质主要以山柰酚、槲皮素、丁香亭和二氢丁香亭为苷元,黄酮类物质以芹菜素、金圣草黄素为苷元,其中金圣草黄素7-O-桑布双糖含量显著高于其他色系;黄烷酮以柚皮素为苷元,其中柚皮素7-O-葡萄糖苷、柚皮素7-O-芸香糖苷含量明显高于其他色系。黑墨、樱姬爪和白墨为墨兰,其TFC、总黄酮醇、总黄烷酮含量在所有样品中分别位列第1、2、4位,可见墨兰的TFC、总黄酮醇和总黄烷酮含量相对较高,具有一定的种属特异性,详见图5、表5和表6。
除大富贵舌瓣、玉兔捧瓣外,所有样品中的黄酮醇在总类黄酮中均占最高比例,为53.01%~97.93%,其中占比最高的为韩国小姐;大富贵舌瓣中的黄酮醇、黄酮占比接近;玉兔捧瓣中的黄酮醇占比仅为32.02%,而黄酮占比为67.02%;各样品中的黄烷酮占比较低,为0~14.01%。由此可见,黄酮醇为兰属植物花的主要花黄素类型(表5)。由表6可以看出,有18个样品中Qu含量在总黄酮醇含量中的占比达33.92%~75.81%,为主要的黄酮醇类型;而滇梅中的Km占比达55.44%,为主要的黄酮醇类型;金公主外瓣中以My为主要的黄酮醇类型,占比为30.87%;玉兔、FH-16、FH-19和大富贵舌瓣中以Ch为主要的黄酮醇类型,占比分别为39.12%、43.91%、46.99%和29.95%。除玉兔、白墨、金公主、FH-16、FH-19、大富贵舌瓣和瑞梅外,有21份样品中的槲皮素3-O-芸香糖苷(芸香苷)含量最高,为主要的黄酮醇类物质。
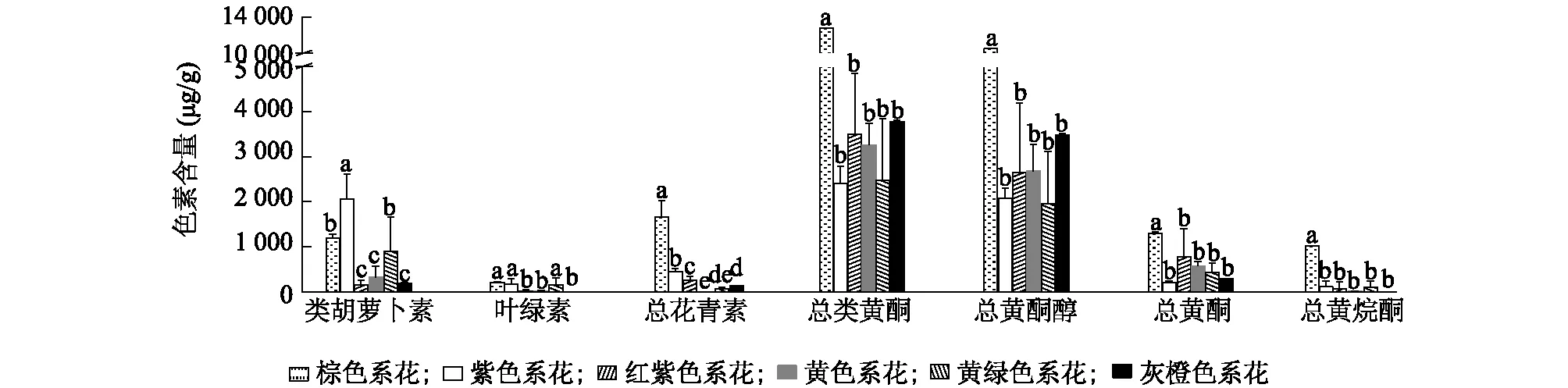
同一类色素对应的不同色系花柱上标有不同小写字母表示差异显著(P<0.05)。图7 不同色系兰属植物花中花色素含量Fig.7 Anthocyanin content in flowers of Cymbidium Sw. samples with different colors
2.3.2 类黄酮的主成分分析 以不同色系的24种兰花为样本,以类黄酮组成及含量作为变量,用Origin 2021进行主成分分析。如图8所示,共提取出特征值大于1的2个主成分,不同材料分布在不同象限中,其中第1主成分的特征值为7.339,贡献率为66.716%,第2主成分的特征值为2.012,贡献率为18.290%,2个主成分的累计贡献率达到85.006%,表明前2个主成分基本可以代表24种兰花含有的85%的类黄酮信息。变量山柰酚3-O-半乳糖苷、山柰酚3-O-刺槐双糖、槲皮素3-O-新橙皮糖苷、槲皮素3-O-芸香糖苷、槲皮素3-O-丙二酰葡萄糖苷、柚皮素7-O-葡萄糖苷、矢车菊素 3-O-葡萄糖苷、矢车菊素 3-O-芸香糖苷-5-O-葡萄糖苷、矢车菊素 3-O-丙二酰葡萄糖苷含量在第1主成分的正方向有较高的载荷系数,即与第1主成分表现为正相关,主要为槲皮素、山柰酚和矢车菊素类物质,表明槲皮素、山柰酚为兰花植物花中的主要黄酮醇,矢车菊素为主要的花青素;变量芍药花素3-O-芸香糖苷、芍药花素3-O-丙二酰葡萄糖苷含量在第2主成分的正方向有较高的载荷系数,表明与第2主成分呈正相关,为芍药花素类花青素苷。
从得分结果可以看出,黑墨(I)、樱姬爪(J)、大富贵苞片(B)、白墨(L)、韩国小姐(Q)沿第1主成分正向分布,并且黑墨与峰f14、f43、f40、f41、f46、f6、a1、a3、a6靠近,表明这些成分在黑墨花瓣中的含量占有较高比例;凝香紫(A)、大富贵苞片(B)、樱姬爪(J)、FH-19W、FH-16U沿第2主成分正向分布,表明这几个材料都含有芍药花素,其中大富贵苞片向峰a4、a6靠近,表明其中芍药花素占有较高比例。其余材料包括红紫色、黄色、黄绿色和灰橙色系,均分布于第1主成分、第2主成分的负方向,且具有较低的载荷系数,表明它们与第1、第2主成分呈弱负相关。上述结果表明,主成分分析能够反映不同兰花材料的类黄酮组成及含量差异。
2.3.3 类胡萝卜素定量分析 由图7可知,不同色系兰属植物花中类胡萝卜素含量为158.75~2 067.56 μg/g,其中紫色系含量最高,红紫色系含量最低。所有样品中都含有类胡萝卜素,含量为50.92~2 532.13 μg/g,含量最高的为大富贵苞片,其次是苍岩素(2 173.34 μg/g),红霞中的含量最低(表5)。黄色系黄金小神童、FH-10中的类胡萝卜素含量分别为551.53 μg/g、105.66 μg/g。大富贵不同部位的类胡萝卜素含量表现为苞片(2 532.13 μg/g)>外瓣(1 576.77 μg/g)>舌瓣(145.64 μg/g),差异显著(P<0.05)。
从不同种群花中的类胡萝卜素含量来看,春兰类的类胡萝卜素含量较高,除大富贵舌瓣、扬红荷外瓣外,其他部分的类胡萝卜素含量均达到1 000.00 μg/g以上,而其他兰属植物除黑墨以外,类胡萝卜素含量均在1 000.00 μg/g以下,尤其是莲瓣兰品种、春兰与大花蕙兰杂交种的整体类胡萝卜素含量水平较低,平均含量分别为137.28μg/g、123.35μg/g。
2.3.4 总叶绿素含量的定量分析 由图7可以看出,不同色系兰属植物花中叶绿素含量排序为棕色系>紫色系>黄绿色系>红紫色系>黄色系>灰橙色系,含量分别为214.94 μg/g、180.01 μg/g、159.76 μg/g、22.39 μg/g、19.74 μg/g和1.97 μg/g,前3名与后3名间存在显著差异(P<0.05)。由表5可以看出,所有样品中都含有叶绿素,含量为1.97~419.92 μg/g,总叶绿素含量最高的为苍岩素外瓣,其次是大富贵外瓣,为316.23 μg/g,瑞梅外瓣的叶绿素含量也较高,达179.70 μg/g,在所有样品中位列第5位,这些均为春兰绿花品种,且与其他品种间差异明显;大富贵花中不同部位的叶绿素含量排序为外瓣(316.23 μg/g)>苞片(73.73 μg/g)>舌瓣(8.71 μg/g),差异显著(P<0.05)。

PC1:主成分1;PC2:主成分2;a1~a6:分别为矢车菊素3-O-葡萄糖苷、矢车菊素3-O-芸香糖苷、矢车菊素3-O-芸香糖苷-5-O-葡萄糖苷、芍药花素3-O-芸香糖苷、矢车菊素3-O-丙二酰葡萄糖苷、芍药花素3-O-丙二酰葡萄糖苷;f1~f64:检出的花黄素,详见表4。图8 24份兰属样品花中类黄酮含量的主成分分析Fig.8 Principal component analysis of the contents of flavonoids in flowers of 24 Cymbidium Sw. samples
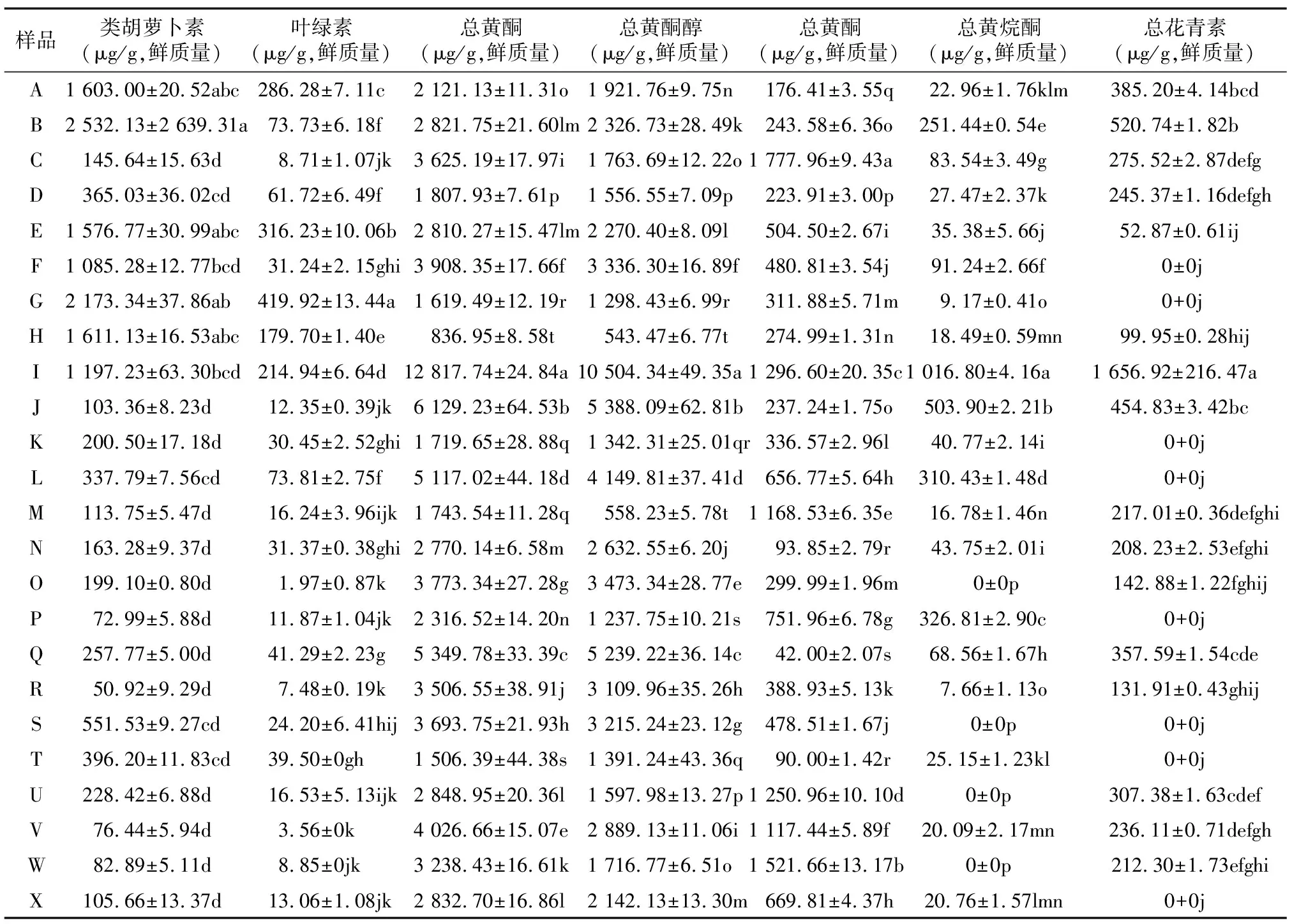
表5 24份兰属样品花中花色素组成及含量

表6 24份兰属样品花中花黄素组成及含量
2.4 花色表型与花色素含量的相关性分析
为了分析参试兰属植物花瓣的颜色与花色素含量的关系,对花色CIEL*a*b*参数与胡萝卜素、叶绿素、类黄酮、花青素苷物质及类黄酮主成分含量进行相关性分析。如表7、表8所示,明度(L*)与TAC、Cy含量呈极显著负相关(P<0.01),相关系数分别为-0.557、-0.533,与a1、a5含量呈显著负相关(P<0.05),相关系数分别为-0.460、-0.472;红绿程度(a*)与叶绿素含量呈显著负相关,相关系数为-0.463(P<0.05);黄蓝程度(b*)与TAC含量呈极显著负相关(P<0.01),相关系数为-0.528,与Cy、a1、a3、a5和a6含量呈显著负相关,相关系数分别为-0.496、-0.455、-0.405、-0.448和-0.411(P<0.05);饱和度(C)与TAC、Cy含量呈极显著负相关,相关系数分别为-0.558和-0.532(P<0.01),与a1、a3和a5含量呈显著负相关,相关系数分别为-0.497、-0.448和-0.494(P<0.05),且与Sy含量呈显著负相关,相关系数为-0.405(P<0.05)。
3 讨论
3.1 24份兰属样品花中类黄酮组成概况
本研究利用HPLC-MS方法分析了24个兰属样品花中的类黄酮成分,共检测出6种花青素,包括4种矢车菊素、2种芍药花素;另外检测到64种黄酮醇、黄酮、黄烷酮类物质,包括山柰酚、槲皮素、异鼠李素、杨梅黄素、丁香亭、芹菜素、金圣草黄素和柚皮素类物质,其中山柰酚、槲皮素、杨梅黄素和金圣草黄素为所有样品共有的。对现有兰科植物花中黄酮组成进行研究,发现其中都检测出了矢车菊素、槲皮素、山柰酚和异鼠李素,但是不同研究中检测出的花青素、花黄色素种类和数量差别较大,本研究检出的花黄色素种类、数量高于以往的研究。张艺祎[14]在四川独蒜兰花瓣中检测到4种矢车菊素、飞燕草素;宋小蒙[13]在金钗石斛兰花中鉴定出 13 种矢车菊素、飞燕草素衍生物;Wang 等[12]在不同色系大花蕙兰中检测出6种矢车菊素、芍药色素糖苷,6种槲皮素、山柰酚和异鼠李素糖苷;李文建等[29]在建兰花瓣中检测到8种矢车菊素、飞燕草素、天竺葵素、芍药花素,12种槲皮素、山柰酚和异鼠李素;王紫珊[10]在卡特兰Pink Lady花瓣中共发现9种矢车菊素、芍药花素和矮牵牛素衍生物,18种槲皮素、山柰酚和异鼠李素糖苷;李崇晖等[9]从不同颜色蝴蝶石斛兰品种花中共检测出28种矢车菊素糖苷与19 种槲皮素、山柰酚和异鼠李素糖苷;李崇辉等[16]在文心兰唇瓣中检测到5 种矢车菊素、芍药花素糖苷和23种黄酮、黄酮醇苷(苷元有木樨草素、金圣草黄素、槲皮素、山柰酚和异鼠李素);Griesbach[33]在大花蕙兰中检测到黄酮芹菜素糖苷。本研究检出的杨梅素、丁香亭和柚皮素类衍生物均为首次在兰科植物中发现,类黄酮种类多样性的增加丰富了对兰科植物花中类黄酮生物合成途径的认识。
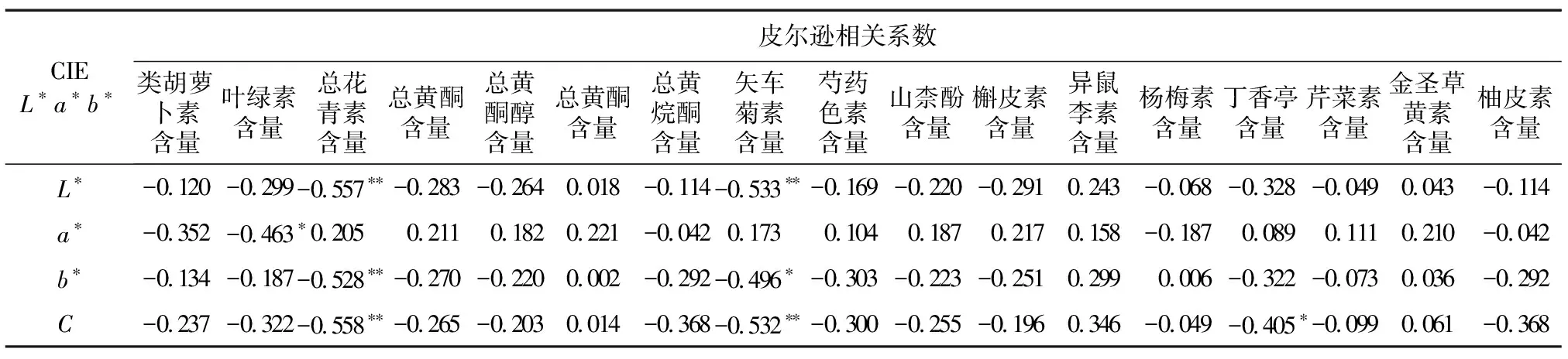
表7 24份兰属样品花色表型参数与花色素含量的相关性
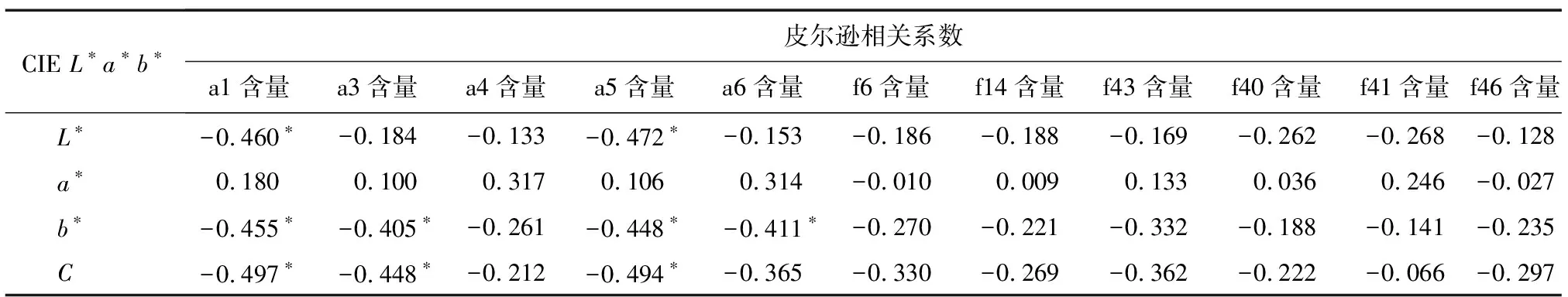
表8 24份兰属样品花色表型参数与类黄酮类物质主要成分含量的相关性
通过主成分分析发现,参试兰花花中主要的类黄酮成分为黄酮醇、黄烷酮、花青素,其中主要黄酮醇为槲皮素、山柰酚,主要黄烷酮为柚皮素,主要花青素为矢车菊素,与本研究中类黄酮定量分析结果相互印证。从类黄酮定量分析结果看出,共有16份材料含有花青素,不同色系兰花材料的TAC含量表现为棕色系>紫色系>红紫色系>灰橙色系>黄绿色系>黄色系,在红紫色、紫色和棕色系花瓣中含有大量花青素,而灰橙色系花瓣中TAC含量较低,黄绿色系外瓣不含TAC或含量极低,黄色系外瓣中无花青素。在检出花青素的16份样品中,花青素类型均以矢车菊素为主,其中有8个样品以矢车菊素 3-O-芸香糖苷为主,7个样品以矢车菊素3-O-丙二酰葡萄糖苷为主。所有样品中均检出花黄素,其中黄酮醇占比最大,且以槲皮素为主,槲皮素3-O-芸香糖苷含量最高,这与前人的研究结果相似。Wang等[12]研究发现,矢车菊素3-O-芸香糖苷、芍药花素3-O-芸香糖苷为大花蕙兰的主要花青素苷,在黄色、绿色和白色系大花蕙兰外瓣中没有花青素。庄于彦[11]在研究有红色斑点的文心兰花色素成分时检出矢车菊素、芍药花素2种苷元,并认为紫花品种具有较高的花青素含量,且以矢车菊素为主,绿色系、白色系蝴蝶石斛兰花中不含花青素[9]。以上研究结果表明,矢车菊素是兰属植物花中主要的花青素,其次为芍药花素,以矢车菊素 3-O-芸香糖苷为主要成分;槲皮素、山柰酚和异鼠李素为普遍存在的黄酮醇类物质,并且以槲皮素为主,槲皮素-3-O-芸香糖苷为主要成分。
3.2 24份兰属样品花色素对花色的影响
为了探究花色素对花色表型的影响,本研究统计了花青素、花黄素、类胡萝卜素、叶绿素及类黄酮主成分与花色的相关性。前人研究发现,文心兰、蝴蝶兰的总花青素苷含量与花色的明度(L*)、色相(b*)呈显著负相关[9,16]。本研究结果与之相似,由不同色系的花色表型与花色素含量之间的相关性分析结果可知,L*与TAC、Cy含量呈极显著负相关,说明总花青素及矢车菊素含量是影响L*的重要因素,随着TAC或Cy含量的增加,可使花色变暗,反之可使明度提高;L*与a1和a5含量呈显著负相关,说明矢车菊素 3-O-葡萄糖苷、矢车菊素 3-O-丙二酰葡萄糖苷是影响L*的主要花色素。红绿程度(a*)与叶绿素含量呈显著负相关,表明当a*>0时,随着叶绿素的积累,花瓣的红色程度会减弱;当a*<0时,花瓣的绿色程度会加深,说明叶绿素是影响花色红绿程度的重要因素。b*与TAC含量呈极显著负相关,与Cy、a1、a3、a5和a6含量呈显著负相关,说明总花青素、矢车菊素及矢车菊素 3-O-葡萄糖苷、矢车菊素 3-O-芸香糖苷-5-O-葡萄糖苷、矢车菊素 3-O-丙二酰葡萄糖苷、芍药花素3-O-丙二酰葡萄糖苷含量是影响b*的重要花色素,并且随着TAC、Cy、a1、a3、a5和a6含量的增加,当b*>0时,花瓣的黄色程度会随之下降;当b*<0时,花瓣的蓝色程度会随之增加,花色向红紫色和紫色方向变化;随着TAC、Cy、a1、a3、a5和a6含量的降低,b*发生相反变化。饱和度(C)与TAC、Cy含量呈极显著负相关,与a1、a3和a5含量呈显著负相关,说明总花青素、矢车菊素以及矢车菊素 3-O-葡萄糖苷、矢车菊素 3-O-芸香糖苷-5-O-葡萄糖苷、矢车菊素 3-O-丙二酰葡萄糖苷为影响花色饱和度的主要色素,并且随着TAC、Cy、a1、a3、a5的积累,花瓣的色彩饱和度会随之下降。而除Sy含量与C呈显著负相关外,花黄素含量与花色表型没有显著的相关性,说明花黄素不是颜色参数的主要影响因素,与Li等[34]的研究结果一致,但可作为辅助色素,影响花青素色素的颜色,有研究结果表明,花黄素与糖苷发生的共色作用可以使花青素更加稳定[35]。
有研究者认为,兰花红色部分(暗红色和暗紫红色)的花色主要取决于花青素苷元比例,芍药花素含量越高,花色越偏向红色;矢车菊素含量越高,花色越偏向紫色;类胡萝卜素可以使花呈现黄色、橙色[11]。本研究中所有检出花青素的样品均以矢车菊素为主,并且花色呈现红紫色至紫色。
本研究对春兰大富贵花朵不同部位花色素进行了检测,结果表明,TAC含量表现为苞片>舌瓣>外瓣,类胡萝卜素含量表现为苞片>外瓣>舌瓣,叶绿素含量表现为外瓣>苞片>舌瓣,均存在显著差异。大富贵苞片呈现紫色,其花青素、类胡萝卜素和叶绿素含量均具有较高水平,由于具有较高含量的花青素,使花色向红紫色、紫色方向变化,明度降低,而较高含量的叶绿素使花色绿色程度加深,同时由于类胡萝卜素与花青素协同作用,可使花色呈现出单一类花色素无法呈现的橘红色至红色、青铜色至棕色的变化[36],在上述3种花色素的综合作用下,大富贵苞片颜色向紫色方向变化。同理,黑墨花中含有极高含量的花青素(为大富贵苞片的3.14倍),使其花色较暗,在与较高含量的类胡萝卜素、叶绿素协同作用下呈现出棕色。大富贵舌瓣呈白底红斑,其类胡萝卜素、叶绿素含量较低,而花青素含量较高,前人研究发现,大花蕙兰绿色、白色花的舌瓣红斑明显则表明花青素含量较高,红斑浅淡则表明只含有微量花青素[12]。此外,在文心兰舌瓣为黄色、绿色的材料中也未检出花青素[16]。以上研究结果表明,参试兰属植物花舌瓣红斑部分主要由花青素决定,舌瓣底色主要受类胡萝卜素、叶绿素影响;大富贵外瓣为绿色并有1条红筋,其叶绿素、类胡萝卜素含量较高,TAC含量较低,推测其瓣绿色主要受叶绿素影响,而瓣红筋部分由花青素产生。
在所有参试材料中都检测到了类胡萝卜素、叶绿素,黄色系和黄绿色系花瓣中类胡萝卜素水平与红紫色系没有明显差异,但黄色系不含有花青素,黄绿色系含有低含量或不含有花青素,表明使参试兰属植物花色呈黄色的主要花色素是类胡萝卜素。与本研究结果相似的是,Hieber等[37]发现切花文心兰Onc. Gower Ramsey系列的黄色唇瓣中的主要黄色色素是几种类胡萝卜素。与粉红色、红色系月季相比,黄色月季花瓣中的花青素苷含量很低,总黄酮醇含量适中,类胡萝卜素含量最高[8]。
根据RHCSS评价指标,本研究有8份材料被判断为黄绿色系,但目测又可将其分为绿色、黄绿色,绿色包括大富贵外瓣以及苍岩素、瑞梅、白墨、莲瓣素、翠玉外瓣,其中白墨、莲瓣素和翠玉外瓣叶绿素含量较低,为11.87~110.64 μg/g,类胡萝卜素含量也较低,为72.99~513.38 μg/g,且不含花青素,叶绿素为这3个材料的主要花色素;苍岩素、大富贵和瑞梅外瓣叶绿素含量水平较高,为154.6~316.23 μg/g,虽然类胡萝卜素含量均为黄色系材料的2~5倍,达799.60~1 611.13 μg/g,且大富贵、瑞梅外瓣含有少量的花青素,含量为52.87~99.95 μg/g,但可能由于叶绿素水平较高因而呈现绿色,表明叶绿素对兰属植物花色呈现绿色有重要影响。此外,凝香紫、黑墨与韩国小姐外瓣的叶绿素含量在种群内也处于较高水平,但其外瓣分别呈现紫色、棕色及红紫色,可能与其同时含有高含量的花青素有关。
综上,推测花青素、叶绿素是本研究中参试兰属植物花呈色的关键色素,类胡萝卜素是黄色花的主要色素。
3.3 24份兰属材料花中类黄酮代谢途径推测
根据花中代谢物的相对含量,结合前人的研究结果[12,29],推测兰属植物花瓣中类黄酮代谢途径如下:香豆酰-COA和丙二酰-COA依次在查耳酮合成酶(CHS)、查耳酮异构酶(CHI)的催化下生成柚皮素(是合成所有类黄酮所必需的)。柚皮素在黄酮合酶(FNS)催化下生成芹菜素,进而在F3′H催化下生成木樨草素,在甲基转移酶(MT)催化下生成金圣草黄素[38-39],这是黄酮合成的关键分支步骤。柚皮素受黄烷酮-3-羟化酶(F3H)的催化,生成二氢山柰酚(DHK),DHK分别受类黄酮-3′-羟化酶(F3′H)、类黄酮-3′-5′-羟化酶(F3′5′H)的作用,合成二氢槲皮素(DHQ)和二氢杨梅素(DHM)。DHK、DHQ和DHM在黄酮醇合成酶(FLS)作用下分别生成山柰酚、槲皮素和杨梅素,这是黄酮醇合成的关键分步骤[40]。槲皮素、杨梅素进而在甲基转移酶MT作用下分别生成异鼠李素、丁香亭。另外,DHK、DHQ和DHM 在二氢黄酮醇还原酶(DFR)和花青素苷元合成酶(ANS)的催化下分别产生着色的花青素如天竺葵素、矢车菊素和飞燕草素[36],其中矢车菊素受到MT的催化而合成芍药花素,飞燕草素接连受到MT的催化,分别合成矮牵牛素和锦葵素(图9)。综合分析可知,本研究参试兰属花组织中检测到矢车菊素和芍药色素的衍生物,表明花青素的形成涉及ABP通路中的矢车菊素合成分支。

虚线框表示本研究未涉及的代谢途径;CHS:查尔酮合成酶;CHI:查尔酮异构酶;FNS:黄酮合成酶;F3H:黄烷酮-3-羟化酶;F3′H:类黄酮-3-羟化酶; F3′5′H:类黄酮 3′5′-羟化酶;FLS:黄酮醇合成酶;DFR:二氢黄酮醇还原酶;ANS:花青素合成酶; 3GT:类黄酮 3-O-葡萄糖基转移酶;MT:转甲基酶。图9 24份兰属材料花中类黄酮代谢途径Fig.9 Metabolic pathways of flavonoids in flowers of 24 Cymbidium Sw. samples
