热应激对猪颗粒细胞蛋白质表达谱的影响
2022-02-05王泽平赵为民付言峰李碧侠任守文程金花
王泽平, 沈 婕, 赵为民, 付言峰, 李碧侠, 任守文, 程金花, 李 辉
(1.江苏省农业科学院宿迁市农业科学研究所,江苏宿迁223800;2.江苏省农业科学院畜牧研究所,江苏南京210014;3.广西大学动物科学技术学院,广西南宁530005)
猪的皮肤较厚,皮下脂肪含量高且汗腺不发达,故调节体温能力相对较差。研究结果表明,猪最适温度为12~21 ℃[1],当环境温度由18 ℃升至29 ℃时,猪体温将从34.6 ℃升至37.4 ℃[2],而直肠温度将从39.2 ℃升高至40.0 ℃[3]。因此当外界气温超过27 ℃时,母猪体温也将被动升高而产生热应激[4],并对猪机体造成不良影响。以母猪为例,当受到热应激时可表现出发情不明显、乏情或短促发情等症状,经产母猪断奶7 d内发情率显著降低,而后备母猪则表现出初情期推迟等现象[5-6]。夏秋时节,中国大部分地区的气温超过30 ℃,因此母猪受到热应激是夏秋季节造成中国养猪业受损的重要因素,随着全球变暖,热应激的影响将更加严重。然而,目前人们对热应激影响母猪繁殖性能的机制并不清楚。
颗粒细胞介于膜细胞和卵母细胞之间,是体内唯一与卵母细胞直接接触的体细胞。它们可以通过分泌类固醇类激素、供给卵母细胞营养物质、接收并传递信号等方式参与维持卵泡发育、促进卵母细胞成熟和诱导排卵等过程。颗粒细胞功能受损将影响动物卵泡发育和繁殖活动[7]。养殖过程中,动物常常受到一些因素的影响,导致颗粒细胞功能紊乱,主要表现在类固醇激素分泌能力下降、细胞增殖抑制/凋亡、黄体化受阻等[8-10],其直接后果是抑制动物的繁殖性能,最终影响畜牧业的健康发展。遗憾的是,目前关于热应激直接影响颗粒细胞的研究相对较少且大多从单一角度或者在某一点上展开研究,例如,前人研究发现热应激可抑制颗粒细胞中促卵泡素受体(FSHR)表达,并促进细胞凋亡[11]。我们前期研究也发现热应激处理猪颗粒细胞可显著抑制雌激素的分泌,造成热休克蛋白HSP70表达量上调[9, 12]。总体而言,目前在热应激影响卵泡颗粒细胞功能方面缺乏系统性、整体性的认识。为解决该问题,本研究拟先解析热应激对猪颗粒细胞蛋白质表达谱的影响。
1 材料与方法
1.1 试验材料
将在屠宰场取的猪卵巢,放置于装有37 ℃生理盐水(预先加入1%青霉素/链霉素)的保温瓶中尽快拿回实验室处理。在实验室超净台中清洗消毒卵巢,擦净残留液体后,选取直径大于5 mm卵泡,用一次性注射器抽取其卵泡液,并利用Ficoll-Paque梯度离心法分离出颗粒细胞[13]。分离出的细胞经多次清洗后用DMEM/F12培养液(含10%胎牛血清、1%青霉素/链霉素)稀释后接种于6孔板中,并置于37 ℃,含有5% CO2、95%空气的培养箱中持续静止培养24 h后,用温热的无Ca2+、Mg2+的磷酸盐缓冲溶液(PBS)清洗2~3次,洗掉未贴壁细胞,更换新的DMEM/F12培养液(含10%胎牛血清、1%青霉素/链霉素)后进行后续处理。
1.2 热应激处理
将获得的细胞随机分为2组。一组为对照组,将细胞放入37 ℃的细胞培养箱中培养3 h;另一组作为热应激组,将细胞放入41 ℃的细胞培养箱中培养3 h。处理结束后,用温热的无Ca2+、Mg2+的PBS彻底清洗细胞,确保无培养基残留,然后将细胞刮下备用。所有试验重复3次。
1.3 蛋白质的提取及定量
收集的细胞按照蛋白质组学的标准流程进行处理。处理过程简述如下:细胞沉淀先用四乙基溴化铵缓冲溶液(TEAB)溶解;裂解后的初始蛋白质溶液经超声破碎后离心并收集上清液,弃掉细胞碎片。在收集的上清液中加入4倍体积的预冷丙酮[含有10 mmol/L的二硫苏糖醇(DTT)],充分混匀后放置在4 ℃冰箱中静置2 h,蛋白质沉淀逐渐析出后通过离心将蛋白质沉淀收集至管底,再用预冷丙酮(含10 mmol/L的DTT)清洗蛋白质沉淀后进行干燥。最终用四乙基溴化铵(TEAB)溶解蛋白质沉淀,并对蛋白质进行定量。
1.4 蛋白质样品酶解、脱盐及标记
选取一定质量的蛋白质溶液,调整体积后用NH4HCO3(50 mmol/L)进行稀释,加入胰蛋白酶溶液,置于37 ℃培养箱中酶解过夜。酶解结束后将酶解液进行脱盐处理;脱盐后的蛋白质按照试剂盒说明书进行标记。标记结束后在所有标记样本中取相同体积进行混合,准备上机分离。
1.5 蛋白质样品组分分离及液相色谱-质谱/质谱(LC-MS/MS)检测
将上述混合后的样本用Thermo DINOEX Ultimate 3000 BioRS分成12个组分,并利用AB SCIEX nano LC-MS/MS(Triple TOF 5600 plus)对每个组分依次进行质谱检测。
1.6 蛋白质的鉴定、差异表达蛋白质的功能注释和通路分析
以可信度95%为标准对所得的肽段进行筛选,可信度大于95%的肽段用搜索引擎ProteinpilotTMV4.5进行搜索。当差异表达倍数≥1.5倍(即上调≥1.5倍或下调≤0.67倍)且P值≤0.05时,视为显著差异表达蛋白质,并利用在线分析系统BLAST2GO (http://www.Blast2GO.com/)对所有差异表达蛋白质进行GO功能注释,随后利用通路数据库KEGG进行通路分析。
2 结果与分析
2.1 热应激后猪颗粒细胞的蛋白质总体鉴定情况
利用同位素标记相对和绝对定量(iTRAQ)技术对受热应激处理的猪颗粒细胞的蛋白质进行定量分析,共鉴定到5 451个蛋白质。鉴定肽段数为35 936个,其中至少包含2个Unique肽段的蛋白质数为4 448个。本研究鉴定到的肽段的长度主要分布在7.00~20.00 aa,其中大多数肽段的长度为11.00 aa,平均长度为14.57 aa,处于肽段长度合理范围(图1A)。对可信度≥95%的肽段覆盖度分布的分析结果显示,覆盖度介于0~10.0%的蛋白质数量占总鉴定蛋白质数量的38.49%(图1B)。
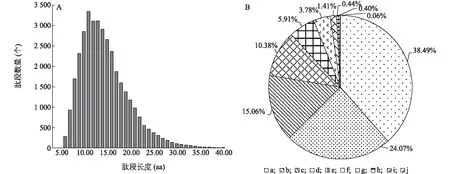
A:肽段长度分布;B:蛋白质鉴定覆盖度分布。a:0~10.0%; b:10.1%~20.0%; c:20.1%~30.0%; d:30.1%~40.0%; e:40.1%~50.0%; f:50.1%~60.0%; g:60.1%~70.0%; h:70.1%~80.0%; i:80.1%~90.0%; j:90.0%~100.0%。图1 肽段长度分布和蛋白质覆盖度Fig.1 Distribution of peptides length and protein sequence coverage
2.2 差异表达蛋白质分析
通过对热应激处理的猪颗粒细胞中蛋白质表达的分析,共鉴定到289个差异表达蛋白质,其中上调表达蛋白质162个,下调表达蛋白质127个(部分差异表达蛋白质见表1和表2)。从表1中可以看出,热休克蛋白HSP70、HSP90等与热应激相关的标志性蛋白质上调表达。这些蛋白质的上调表达也可被视为热应激处理成功的标志。同时,肽基脯氨酸顺反异构酶、钙网蛋白、钙调理蛋白等蛋白质上调表达(表1)。而组蛋白H4、载脂蛋白E、芳香化酶3、雌二醇17β-脱氢酶、三磷酸腺苷合成酶α亚基等蛋白质表达显著下调(表2)。
我们进一步对对照组和热应激组样品的分析结果进行聚类分析,从图2可以看出,3个生物学重复之间重复性良好,且差异表达蛋白质的聚类清晰。
2.3 差异表达蛋白质的直系同源簇(COG)注释
为预测和系统了解所鉴定到的蛋白质的潜在生物学功能,我们对所有鉴定到的蛋白质与COG数据库进行了比对分析和分类统计。图3是本次鉴定结果比对到COG数据库的统计结果。
2.4 差异表达蛋白质的GO分类和KEGG分析
为解析差异表达蛋白质的生物学功能,本研究对所有的差异表达蛋白质进行了注释。如图4所示,本研究所鉴定到的差异表达蛋白质参与了细胞过程、代谢过程、生物调控、应激反应等相关功能的调控。

表1 部分上调表达的差异蛋白质
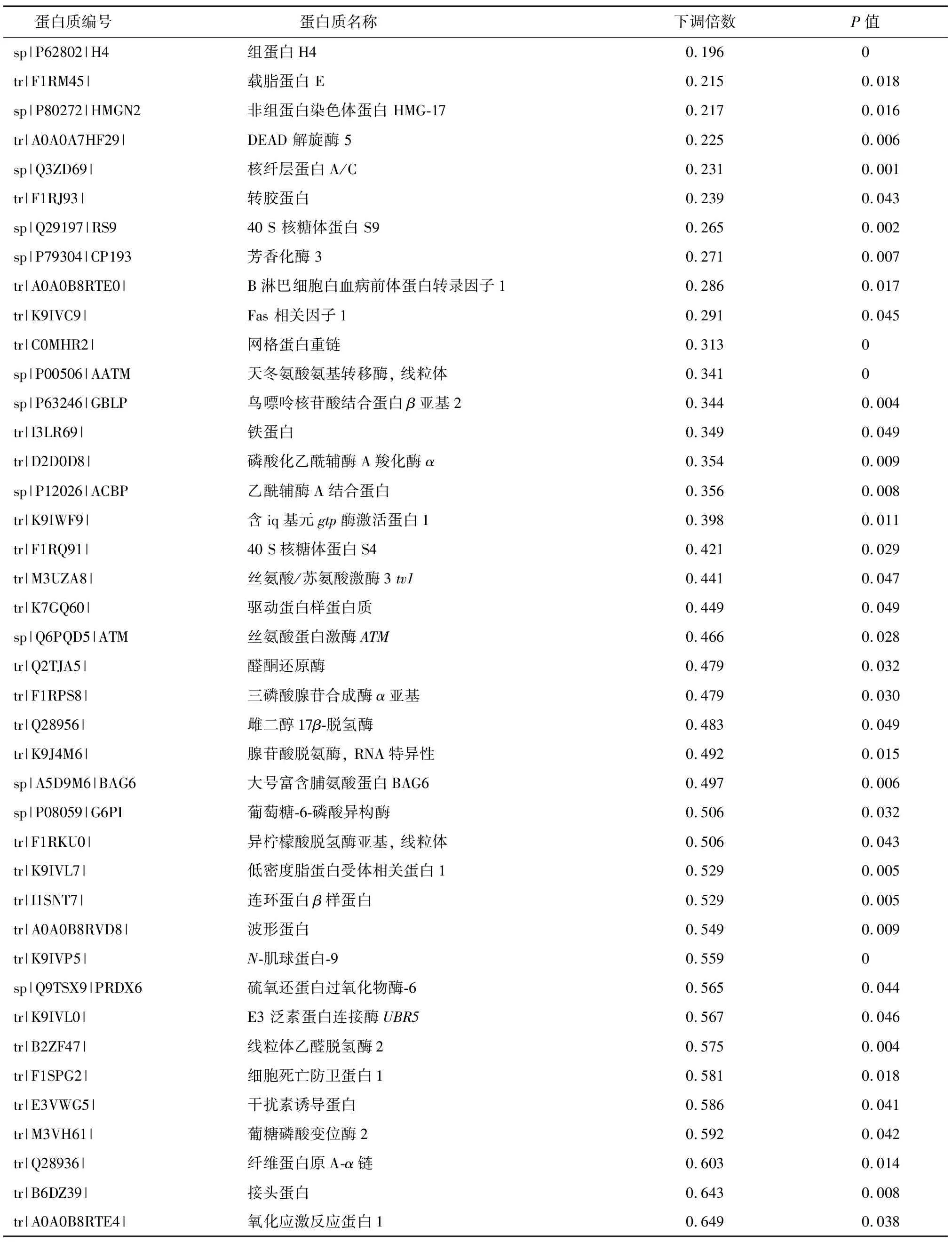
表2 部分下调表达的差异蛋白质
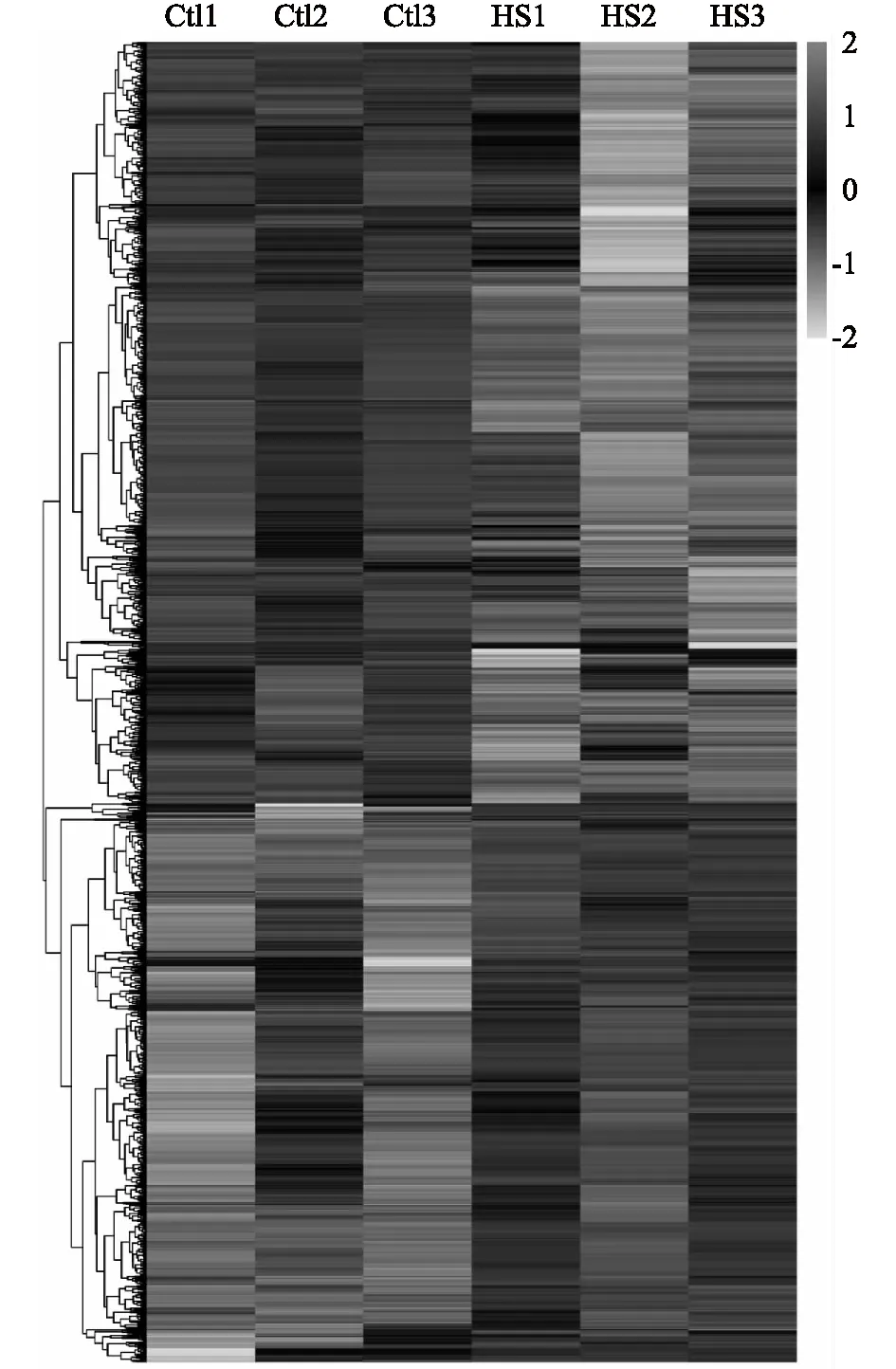
Ctl:对照;HS: 热应激。图2 猪颗粒细胞受热应激过程中差异表达蛋白质的聚类分析Fig.2 Clustering results of differentially expressed proteins in porcine granulosa cells during heat stress
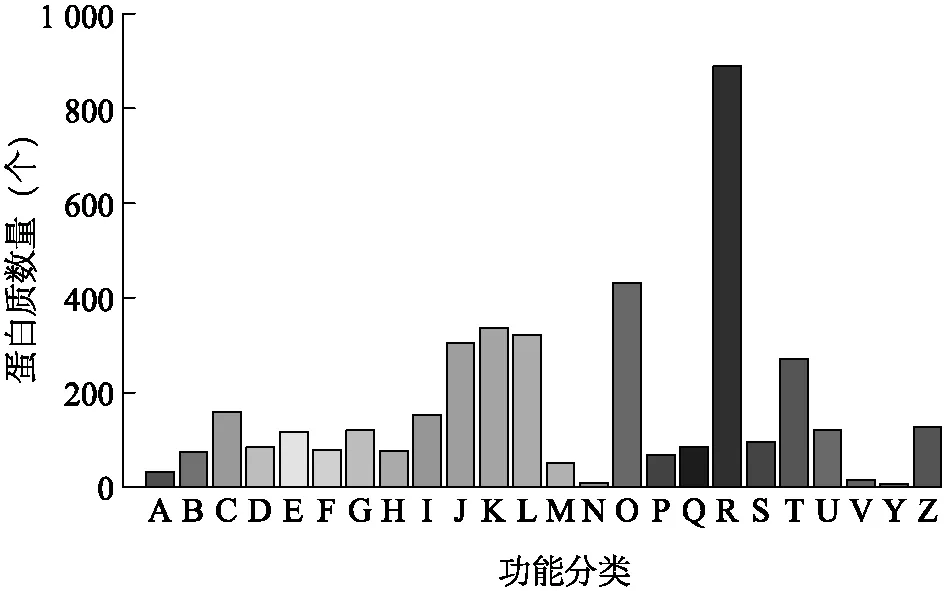
A:RNA加工和修饰; B:染色质结构和动态变化; C:能量产生和变化; D:细胞周期控制,细胞分裂,染色体分割; E:氨基酸运输和代谢; F:核苷酸转移和代谢; G:碳水化合物转移和代谢; H:辅酶转移和代谢; I:脂类转移和代谢; J:翻译,核糖体结构和生物发生; K:转录; L:复制,重组和修复; M:细胞壁/膜/壳生成; N:细胞运动; O:转录后修饰,蛋白质折叠,分子伴侣; P:无机盐离子转运和代谢; Q:次级代谢产物生成,转运和代谢; R:功能预测; S:未知功能; T:信号转导机制; U:胞内交通,分泌和微囊转运; V:防御机制; Y:核结构; Z:细胞骨架。图3 蛋白质的直系同源簇注释分析Fig.3 COG annotation analysis of proteins

1:细胞过程; 2:代谢过程; 3:生物调控; 4:应激反应; 5:生物过程调控; 6:细胞组分配置或生物发生; 7:发育过程; 8:多细胞生物过程; 9:定位; 10:定位建立; 11:信号; 12:死亡; 13:免疫系统过程; 14:正调控生物过程; 15:负调控生物过程; 16:细胞增殖; 17:运动; 18:繁殖; 19:繁殖过程; 20:多物种过程; 21:生长; 22:病毒繁殖; 23:生物黏附; 24:细胞; 25:细胞组分; 26:细胞器; 27:细胞器组分; 28:大分子复合物; 29:膜封闭腔; 30:胞外域; 31:部分胞外域; 32:结合; 33:催化活性; 34:结构分子活动; 35:转运活性; 36:能量调控活性; 37:蛋白质结合转录因子活性; 38:抗氧化活性; 39:受体调控活性。图4 差异表达蛋白质的GO功能注释结果Fig.4 GO function annotation results of differentially expressed proteins
为进一步了解差异表达蛋白质所富集的通路,进行了KEGG通路分析。如图5所示,表达量上调的蛋白质主要富集在剪接体以及内质网的蛋白质加工、代谢通路、胞吞、RNA降解和氧化磷酸化等信号通路中。而下调表达蛋白质则显著富集在代谢通路、次级代谢产物的生物合成、嘌呤代谢、泛素化蛋白质降解、糖酵解/糖异生以及胞间紧密连接等信号通路中。

A:上调表达蛋白质富集的通路及数量占比;B:下调表达蛋白质富集的通路及数量占比。a1:剪接体; b1:内质网蛋白质加工; c1:代谢通路; d1:胞吞; e1:帕金森病; f1:亨廷顿症; g1:抗原加工和递呈; h1:RNA降解; i1:氧化磷酸化; j1:阿尔茨海默病。a:代谢通路; b:次级代谢产物的生物合成; c:不同环境下微生物的代谢; d:嘌呤代谢; e:泛素化蛋白质降解; f:糖酵解/糖异生; g:胞间紧密连接; h:磷酸戊糖途径; i:淀粉和糖代谢; j:氨糖和核糖代谢。图5 差异表达蛋白质的KEGG通路分析结果Fig.5 KEGG pathway analysis results of differentially expressed proteins
3 讨论
热应激可导致雌性动物短促发情或乏情、降低受胎率、早期胚胎死亡和流产等问题[12]。前人研究发现,热应激可经下丘脑-垂体-性腺轴对动物的内分泌产生不良影响进而造成上述问题[14]。热应激导致动物内分泌紊乱主要表现在性激素[促性腺激素释放激素(GnRH)、促卵泡激素(FSH)和促黄体激素(LH)等]分泌量下降、抑制促性腺激素受体基因的表达[15-17]等。此外,通过下丘脑-垂体-性腺轴,热应激还可调控其他激素的分泌,例如抑制促甲状腺激素[18]、甲状腺激素[19]以及促肾上腺皮质激素释放激素[20]等激素的合成和分泌,从而增加肾上腺皮质激素分泌量,造成黄体提早溶解,引起早期胚胎死亡或流产[21]。
热应激通过下丘脑-垂体-性腺轴对颗粒细胞功能产生影响,是其重要的内分泌调控路径。然而,就颗粒细胞所处的位置来讲,其位于动物腹腔最深处,受热应激时,猪机体深处的体温,即核心体温显著升高[22],升高的核心温度必然直接作用于颗粒细胞而影响其功能。遗憾的是,当前对于热应激直接影响颗粒细胞的研究较少。因此本研究通过体外培养的方式,将颗粒细胞所处的卵泡微环境、下丘脑-垂体-性腺轴以及内分泌环境的影响剥离,纯粹在细胞水平上对热应激调控颗粒细胞功能的分子机理开展研究。我们前期在体外模拟了颗粒细胞受到热应激的状态:将颗粒细胞分别在37 ℃(对照组)和41 ℃(热应激组)培养箱中培养,结果发现,颗粒细胞合成雌激素和孕酮的能力随着温度的升高显著下降,且与之相关的CYP11A1、CYP19A1和FSHR基因表达量显著下调,但HSP70的表达量显著上调[9]。上述结果说明热应激可直接对颗粒细胞的功能产生影响。
为深入了解热应激对猪卵泡颗粒细胞功能的影响,并最终为解决受热应激的母猪繁殖性能降低的问题提供理论依据,本研究利用iTRAQ技术对受热应激处理的猪颗粒细胞的蛋白质表达差异进行了系统研究,共鉴定到5 451个蛋白质。这是目前已知鉴定到的相对较多的猪卵泡颗粒细胞蛋白质组表达谱,并筛选出了289个差异表达蛋白质,其中上调表达蛋白质162个,下调表达蛋白质127个。通过对这些差异表达蛋白质的GO分类和KEGG通路分析,初步阐明其分类属性和富集的功能通路。我们推测这些差异表达蛋白质在细胞抵抗热应激和减轻热应激对细胞造成损伤方面起到重要作用。例如,热休克蛋白HSP70和HSP90是细胞受热应激的标志性蛋白质,作为分子伴侣,它们参与蛋白质折叠,在抵御不利因素造成的应激或凋亡过程中发挥了重要作用[23],其表达量的升高也标志着细胞正在抵御热应激带来的损害[24]。
在对差异表达蛋白质富集的KEGG通路分析中我们发现了参与内质网蛋白质加工、RNA降解以及氧化磷酸化等过程的重要通路,说明这些通路的激活参与颗粒细胞抵抗热应激的过程。以氧化磷酸化为例,该过程是还原型烟酰胺腺嘌呤二核苷酸(NADH)通过氧化制造细胞代谢的重要能量载体——三磷酸腺苷(ATP)的过程[25],其详细过程为:电子经电子传递链从供体转移至载体上,最后传递到受体,同时释放能量以便ATP的合成[26]。Yin等[27]也发现热应激处理可促进卵丘颗粒细胞中ATP的合成,在我们前期研究中发现脂多糖(LPS)处理亦可上调猪颗粒细胞中ATP的合成[28]。这些结果充分说明,细胞提高胞内ATP的合成可能是为了抵御受到的不良刺激。然而合成的ATP如何参与抵御不良刺激,目前尚不清晰,这需要我们通过进一步的研究加以阐明。
4 结论
本研究利用iTRAQ技术对受热应激处理的猪颗粒细胞的蛋白质表达谱进行了研究,初步筛选出289个差异表达蛋白质,并分别富集到蛋白质的泛素化降解、蛋白质加工、胞吞、RNA降解、氧化磷酸化、嘌呤代谢、次生代谢产物的生物合成、糖酵解以及胞间紧密连接等信号通路中,也预示这些差异表达蛋白质和信号通路参与了热应激对猪颗粒细胞功能影响的过程。
