马钱苷在脑缺血再灌注损伤中的作用及机制
2022-02-04徐小雯李哲明应夏丽
徐小雯 李哲明 应夏丽
缺血性脑卒中为血栓或栓子阻塞脑内动脉引起的常见脑血管疾病,具有较高的疾病致残率和病死率,溶栓及介入治疗恢复阻塞脑血管血流是目前治疗该病的有效手段[1-2]。脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)发生于阻塞脑血管血流恢复再通过程中,可加重脑缺血损伤和神经系统障碍,对患者脑部造成二次伤害[1,3-4]。中药山茱萸为山茱萸科植物山茱萸的干燥成熟果肉[3],马钱苷是山茱萸中含量最高的环烯醚萜苷类物质,是山茱萸的主要活性成分之一,具有神经保护作用[5]。研究发现马钱苷能通过减少CIRI小鼠神经细胞凋亡而发挥神经保护作用[6],但具体作用机制还需实验完善。因此,本研究拟通过体内外实验,探索马钱苷治疗CIRI的作用机制,为开发抗脑缺血损伤药物提供基础。
1 材料和方法
1.1 材料及实验试剂 成年雄性SD大鼠(250~300 g)30只购自上海西普尔-必凯实验动物有限公司[动物生产许可证:SCXK(沪)2018-0006],饲养于杭州鹰旸生物科技有限公司动物中心[动物使用SYXK许可证:(浙)2020-0024],实验批准号:EYOUNG-20210205-02。小鼠来源神经瘤母细胞(N2a)购自赛百慷(上海)生物技术股份有限公司。TNF-α、IL-6、IL-1β的ELISA检测试剂盒(批号分别为MM-0180R2、MM-0190R2、MM-0047R2)购自江苏酶免实业有限公司。逆转录试剂盒(批号:CW2569)购自北京康为世纪生物科技有限公司。乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒(批号:C0016)购自上海碧云天生物技术有限公司。2,3,5-氯化三苯基四氮唑(TTC)染液(批号:F603BA0025)购自上海生工生物工程股份有限公司。TUNEL检测试剂盒(批号:G1501)购自武汉赛维尔生物科技有限公司。Triton X-100(批号:HFH10)购自美国Thermo公司。二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(批号:pc0020)购自北京索莱宝科技有限公司。细胞凋亡检测试剂盒(批号:556547)购自美国BD公司。NF-κB、p38丝裂原活化蛋白激酶(p38 MAPK,p38)、磷酸化-p38(pospho-p38,p-p38)、半胱氨酸蛋白酶-3(Caspase-3)、活化Caspase-3(cleaved-Caspase-3)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号分别为AF5006、BF8015、AF4001、AF6311、AF7022、AF7021)购自美国Affinity公司。马钱苷结晶(20 mg,纯度≥98%)购自上海源叶生物科技有限公司(批号:B20822),根据需要溶于纯净水备用。
1.2 实验动物分组及模型建立 大鼠适应性喂养1周,随机分为假手术组、CIRI组及CIRI+马钱苷低、中、高剂量组,每组6只。参照Dai等[7]方法制备大鼠CIRI模型,大鼠麻醉、固定后,于颈部中线切开。分离右侧的颈总动脉、颈外动脉、颈内动脉。将颈外动脉结扎,夹闭其余2根动脉,从颈外动脉引入栓线缓缓推入颅内,1 h后取出栓线,恢复灌注24 h。以出现前爪不能完全伸展,身体出现旋转、倾倒,无法行走等表现为CIRI模型制备成功[8]。假手术组仅分离颈总动脉、颈外动脉、颈内动脉,不进行栓塞处理。CIRI+马钱苷低、中、高剂量组按体质量分别给予5、10、15 mg/kg马钱苷,腹腔注射,连续给药7 d,假手术组与CIRI组给予等体积0.9%氯化钠溶液。
1.3 细胞分组及模型制备 N2a置于10%FBS、2 mmol/L谷氨酰胺、100 mg/L链霉素的改良培养基中,37℃、5%CO2正常培养。随机分为正常对照组、氧糖剥夺/复氧(oxygen and glucose deprivation reaeration,OGD/R)组及OGD/R+马钱苷低、中、高剂量组。参照Lu等[9]方法建立OGD/R模型,取对数生长期细胞,使用脱氧无糖汉克斯平衡盐溶液,在37℃、体积分数分别为95%氮气和5%CO2低氧室孵育2 h进行氧剥夺。正常对照组在人工脑脊液中用10 mmol/L葡萄糖洗涤2次,继续培养24 h;OGD/R组和OGD/R+马钱苷低、中、高剂量组正常氧气条件下继续培养24 h,OGD/R+马钱苷低、中、高剂量组的马钱苷摩尔浓度分别为10、20、30 μmol/L。
1.4 大鼠观测指标
1.4.1 大鼠脑组织梗死率测量 采用TTC染色法。腹腔注射1.5%戊巴比妥钠(30 mg/kg)对大鼠进行深度麻醉,取出大脑称质量,切成1~2 mm薄片,多聚甲醛固定30 min,TTC染液孵育15 min。测量梗死区域(白色)与非梗死区(红色)面积,计算脑梗死率(%)=脑梗死区面积/脑总面积×100%。
1.4.2 大鼠血清中IL-1β、IL-6和TNF-α水平的检测 采用ELISA法。大鼠颈动脉取血后,3 500 r/min离心15 min,取上清液备用。取酶标板加入各组待测样本10 μl和40 μl稀释液,另设置标准品孔加入50 μl标准品,每孔加入辣根过氧化物酶标记的检测抗体100 μl,温育1 h后洗板。加入显色剂后避光反应,测定各孔吸光度,以空白孔作对照,计算血清样本中IL-1β、IL-6和TNF-α水平。
1.4.3 大鼠脑组织凋亡细胞检测 采用TUNEL染色法。取大鼠脑组织制备石蜡切片。常规脱蜡后,修复切片,洗涤。TUNEL染液孵育标本2 h,清洗。加DAPI染液,避光孵育10 min。荧光显微镜下观察绿色的TUNEL阳性的凋亡细胞,计算神经细胞凋亡率(%)=(TUNEL阳性细胞数/视野内细胞数)×100%。
1.4.4 大鼠脑组织Caspase-3、B淋巴细胞瘤-2(Bcl-2)、Bcl-2关联X基因(Bax)mRNA表达的检测 采用qRT-PCR法。参照试剂盒方法,每200 mg脑组织加入1 000 μl的 Trizol进行mRNA的提取,置于-80℃冰箱保存备用。配制反应体系逆转录合成cDNA,反应条件:42℃,15 min;85℃,5 min。逆转录结束后进行实时荧光定量PCR,之后进行PCR反应优化,PCR反应条件为95℃变性10 min;95 ℃,15 s;60 ℃,60 s;40次循环。采用2-ΔΔCt方法计算脑组织内Caspase-3、Bcl-2、Bax mRNA相对表达量。各引物序列见表1。

表1 引物序列
1.4.5 大鼠脑组织 NF-κB、p38、p-p38、Caspase-3、cleaved-Caspase-3蛋白表达的检测 采用Western blot法。取100 mg脑组织尽量剪碎,加入1 ml冷裂解缓冲液,制备匀浆,充分破碎后静置于冰上裂解15~30 min。取匀浆液放入离心管中,12 000 r/min,4℃离心5 min,取上清液转移至新的预冷的离心管中,根据BCA试剂盒方法测定组织中总蛋白浓度。使用聚丙烯酰胺凝胶电泳,切下条带后转聚偏二氟乙烯膜,5%脱脂奶粉孵育,清洗。加入需检测的蛋白一抗抗体,4℃过夜孵育。室温下振荡,吸弃上清液,清洗3遍。5%脱脂奶粉孵育,加入二抗抗体孵育1.5 h。化学发光仪显影,以GADPH为内参,计算大鼠脑组织内各蛋白表达水平。
1.5 细胞观测指标
1.5.1 N2a中LDH释放率的测定 采用LDH法。吸取5组细胞孵育缓冲液,12 000 r/min离心15 min,取上清液转移到新的96孔板上;用适量Tritonx-100裂解细胞。参照LDH细胞毒性检测试剂盒方法分别检测上清液和细胞中LDH含量,计算LDH释放率=上清液的LDH/(上清液的LDH+细胞内的LDH)×100%。
1.5.2 N2a凋亡的检测 采用流式细胞术。分别取5组对数生长期细胞接种于6孔板,预冷PBS缓冲液清洗,调整细胞密度为1×106/ml。加入500 μl结合缓冲液混匀细胞,离心弃上清液,加入100 μl结合缓冲液。加入 5 μl Annexin V-FITC 和 10 μl PI的凋亡试剂,室温避光环境下反应15 min,后加入400 μl结合缓冲液重悬细胞。流式细胞仪检测细胞凋亡率。
1.5.3 N2a中Caspase-3、Bcl-2、Bax mRNA表达的检测 采用qRT-PCR法。取每组1×107细胞,Trizol裂解提取总RNA。参照1.4.4操作处理样本。采用2-ΔΔCt方法计算5组细胞中Caspase-3、Bcl-2、Bax基因相对表达量。各引物序列见表2。
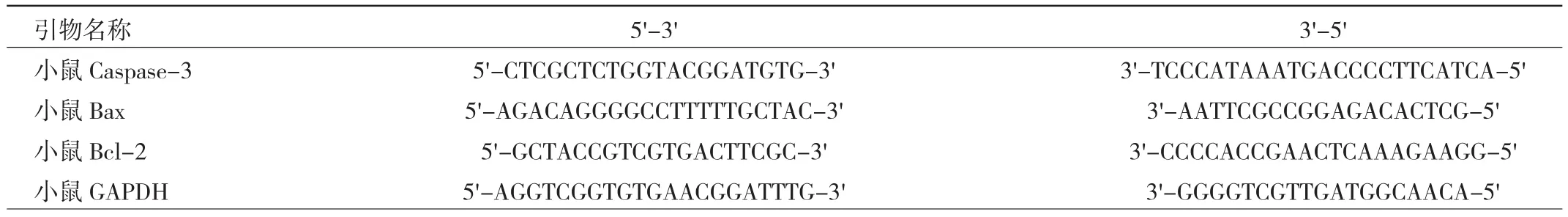
表2 引物序列
1.5.4 N2a中NF-κB、p38、p-p38、Caspase-3、cleaved-Caspase-3蛋白表达的检测 采用Western blot法。取各组细胞进行裂解,离心取上清液。参照方法1.4.5操作处理样本。化学发光仪显影,GADPH为内参,计算5组细胞中各蛋白表达水平。
1.6 统计学处理 采用SPSS 16.0统计软件。计量资料以±s表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠指标观测结果
2.1.1 5组大鼠脑组织梗死面积和梗死率的比较 与假手术组相比,CIRI组大鼠脑组织梗死面积增加,梗死率显著升高,差异有统计学意义(P<0.01),见图1a(插页)。相比CIRI组,CIRI+马钱苷低、中、高剂量组大鼠脑梗死面积和梗死率均下降,其中CIRI+马钱苷中、高剂量组大鼠脑梗死面积和梗死率显著下降(P<0.01),见图1b(插页)。
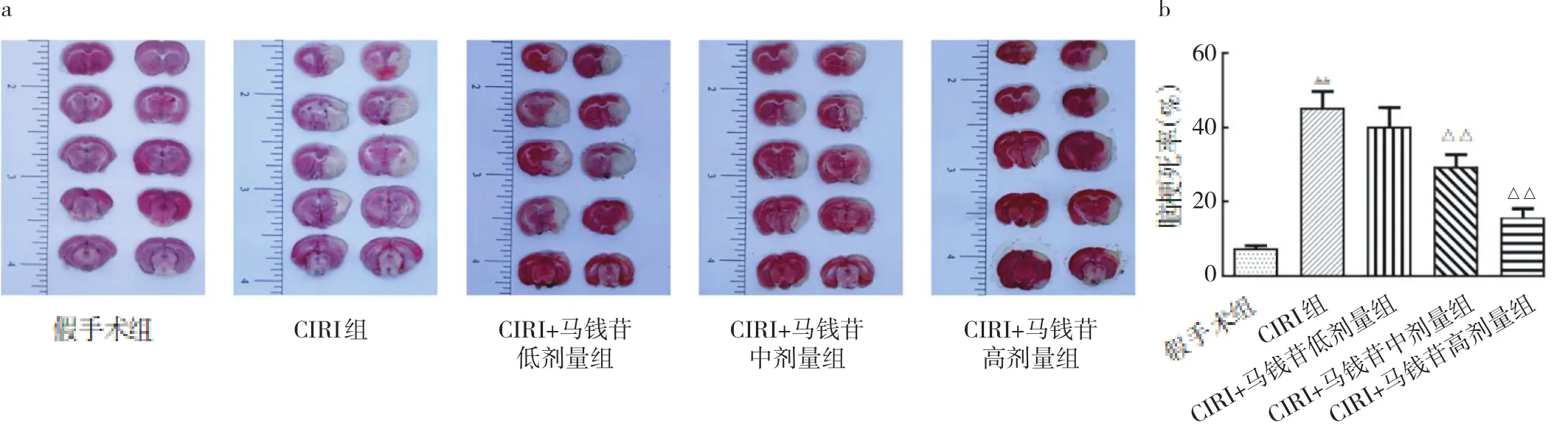
图1 5组大鼠脑组织梗死面积和梗死率比较(a:脑组织梗死面积;b:脑梗死率)
2.1.2 5组大鼠血清中IL-1β、IL-6和TNF-α表达水平的比较 相比假手术组,CIRI组大鼠血清IL-1β、IL-6和TNF-α水平均显著升高,差异均有统计学意义(均P<0.01)。相比CIRI组,CIRI+马钱苷低、中、高剂量组大鼠血清IL-1β、IL-6和TNF-α水平均下降,其中CIRI+马钱苷中、高剂量组大鼠IL-1β、IL-6和TNF-α水平均显著降低,差异均有统计学意义(均P<0.01),见表3。

表3 5组大鼠血清中IL-1β、TNF-α和IL-6表达的比较(ng/L)
2.1.3 5组大鼠脑组织凋亡细胞数量和凋亡率的比较 与其他4组相比,假手术组凋亡细胞数量较少,TUNEL染色仅可见极少数凋亡细胞,见图2a(插页);相比其他4组,CIRI组出现大量凋亡细胞,细胞凋亡率显著升高(P<0.01);相比CIRI组,CIRI+马钱苷中、高剂量组细胞凋亡率均显著下降(均P<0.01),见图2b(插页)。

图2 5组大鼠脑组织神经细胞凋亡及凋亡率比较(a:TUNEL染色,400×;b:细胞凋亡率)
2.1.4 5组大鼠脑组织中Bcl-2、Bax、Caspase-3 mRNA表达的比较 相比假手术组,CIRI组Bax、Caspase-3的mRNA相对表达量显著升高,Bcl-2的mRNA相对表达量显著降低,差异均有统计学意义(均P<0.01)。与CIRI组相比,CIRI+马钱苷低、中、高剂量组Bcl-2的mRNA相对表达量显著升高,Bax、Caspase-3的mRNA相对表达量显著降低,差异均有统计学意义(均P<0.05),见图3。
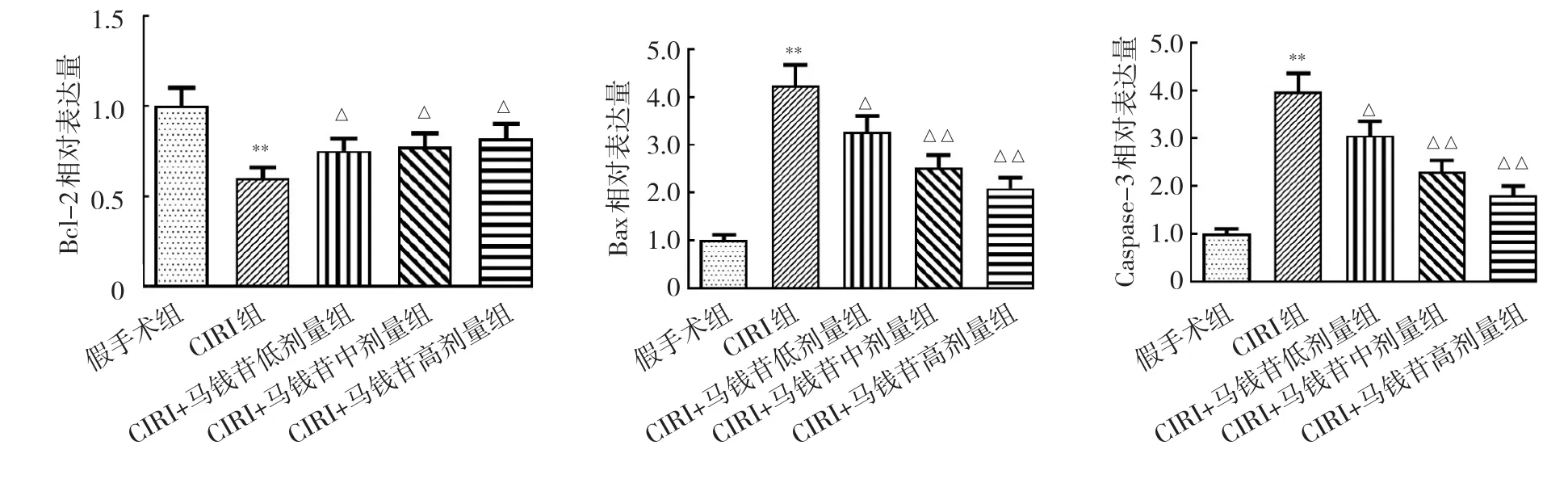
图3 大鼠脑组织中Caspase-3、Bax、Bcl-2 mRNA表达的比较
2.1.5 5组大鼠脑组织中NF-κB、p38、p-p38、Caspase-3、cleaved-Caspase-3蛋白表达的比较 相比假手术组,CIRI组 NF-κB、p-p38/p38和 cleaved-Caspase-3/Caspase-3蛋白相对表达量均显著升高,差异均有统计学意义(均P<0.01);相比CIRI组,CIRI+马钱苷低、中、高剂量组NF-κB、p-38/p38和cleaved-Caspase-3/Caspase-3蛋白相对表达量均降低,其中CIRI+马钱苷中、高剂量组NF-κB、p-p38/p38和cleaved-Caspase-3/Caspase-3蛋白相对表达量均显著降低,差异均有统计学意义(均P<0.05),见图4。
图4 大鼠脑组织中NF-κB、p38、p-p38、Caspase-3、cleaved-Caspase-3蛋白表达的比较(a:NF-κB、p-p38/p38、cleaved-Caspase-3/Caspase-3蛋白表达水平;b:蛋白电泳图)
2.2 细胞指标观测结果
2.2.1 5组N2a LDH释放率的比较 相比正常对照组,OGD/R组LDH释放率显著升高,差异有统计学意义(P<0.01);相比OGD/R组,OGD/R+马钱苷低、中、高剂量组LDH释放率均降低,其中OGD/R+马钱苷中、高剂量组LDH释放率均显著降低,差异均有统计学意义(均P<0.01),见图5。

图5 5组N2a LDH释放率的比较
2.2.2 5组N2a细胞凋亡率的比较 相比于正常对照组,OGD/R组细胞凋亡率显著升高,差异有统计学意义(P<0.01);相比于OGD/R组,OGD/R+马钱苷中、高剂量组细胞凋亡率均显著降低,差异均有统计学意义(均P<0.01),见图6。
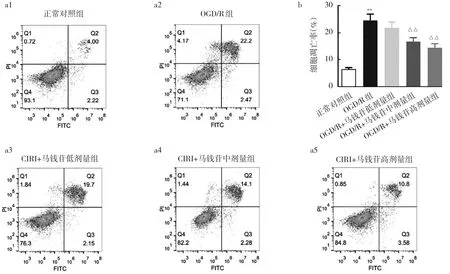
图6 5组N2a细胞凋亡和凋亡率比较(a1~a5:流式细胞术检测凋亡细胞;b:5组细胞凋亡率)
2.2.3 5组N2a中Bcl-2、Bax、Caspase-3 mRNA表达的比较 与正常对照组相比,OGD/R组Bax、Caspase-3的mRNA相对表达量均显著升高,Bcl-2的mRNA相对表达量显著降低,差异均有统计学意义(均P<0.05)。相比OGD/R组,OGD/R+马钱苷低、中、高剂量组Bcl-2表达均显著升高,Bax、Caspase-3相对表达量均显著降低,差异均有统计学意义(均P<0.05),见图7。
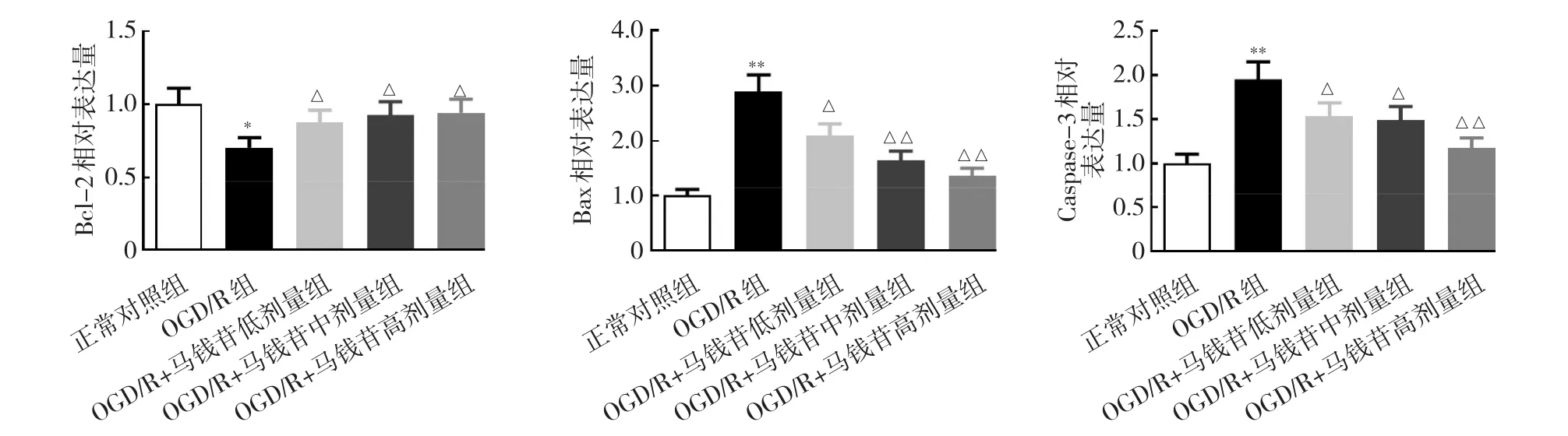
图7 5组N2a Caspase-3、Bax、Bcl-2 mRNA表达的比较
2.2.4 5组 N2a中 NF-κB、p38、p-p38、Caspase-3、cleaved-Caspase-3蛋白表达的比较 相比正常对照组,OGD/R组细胞中NF-κB、p-p38/p38和cleaved-Caspase-3/Caspase-3蛋白相对表达量均显著升高,差异均有统计学意义(均P<0.01)。相比OGD/R组,OGD/R+马钱苷中、高剂量组NF-κB、p-p38/p38和cleaved-Caspase-3/Caspase-3蛋白相对表达量均显著降低(均P<0.05),见图8。
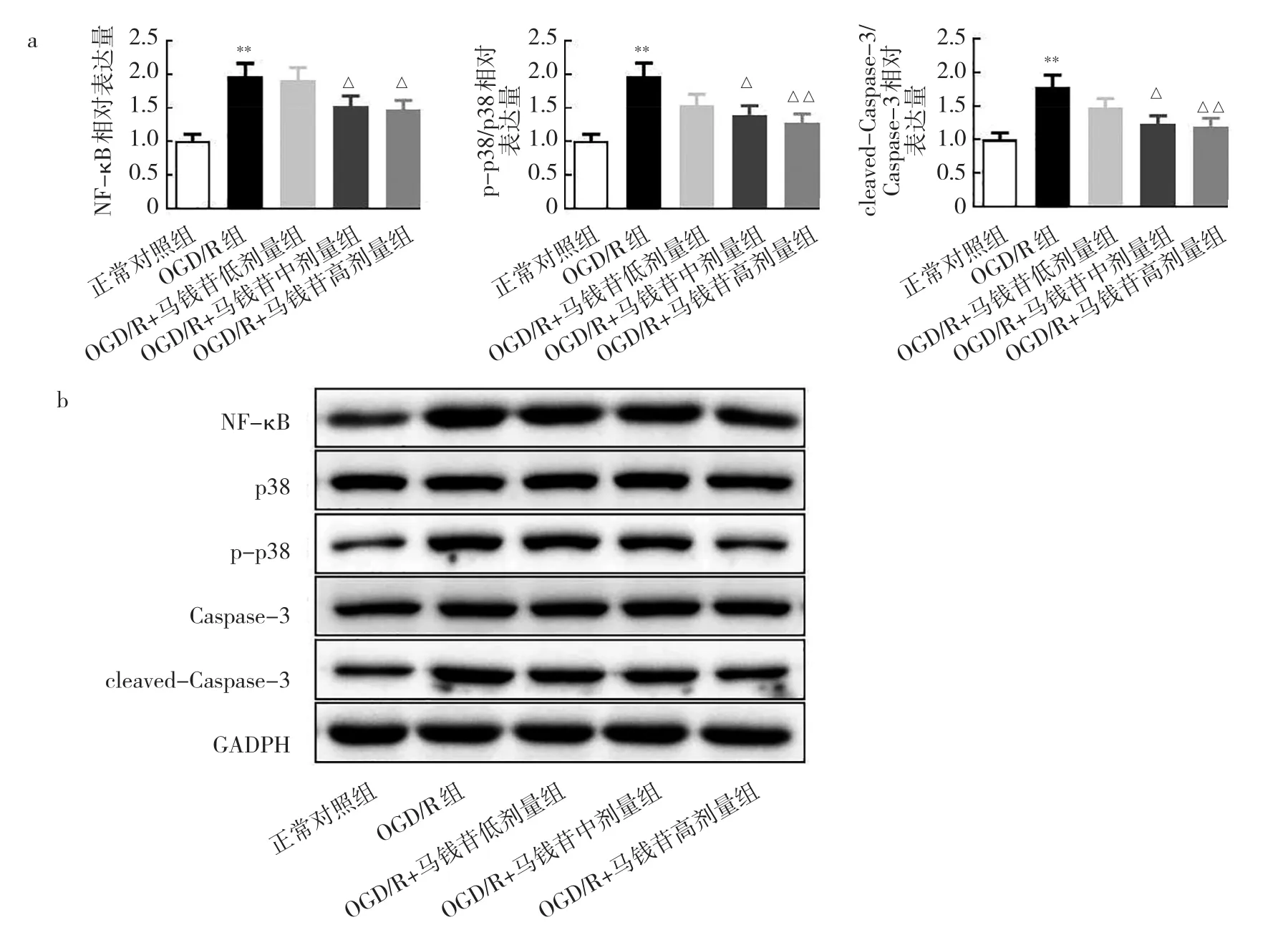
图8 5组N2a NF-κB、p38、p-p38、Caspase-3、cleaved-Caspase-3蛋白表达的比较(a:NF-κB、p-p38/p38、cleaved-Caspase-3/Caspase-3蛋白表达水平;b:蛋白电泳图)
3 讨论
缺血性脑卒中治疗过程中出现的再灌注损伤(reperfusion injury,R/I)对脑组织及脑神经元的恢复影响极大,是目前治疗缺血性脑疾病过程中的主要障碍,有效减轻R/I对于CIRI治疗具有重要临床意义。许多中药被报道能够改善CIRI[8,10-11]。而马钱苷在阿尔兹海默病、帕金森病等神经系统疾病治疗和神经系统调节中的作用提示其对CIRI可能存在保护作用[1]。
线栓法是制备CIRI大鼠模型的常用方法之一,实验效果较好[12]。本研究采用线栓法令大鼠右侧脑部缺血1 h后再进行血流灌注24 h,灌注后大鼠出现身体倾向对侧一边,对侧前肢不能伸展等典型症状,表明CIRI大鼠模型制备成功[13]。R/I的炎症反应可加重脑组织损伤,研究表明促炎性细胞因子如TNF-α、IL-6等水平升高加重脑血管收缩,加剧血脑屏障破坏,不利于脑组织损伤的恢复[14-15]。本研究发现,与假手术组大鼠相比,CIRI大鼠的脑梗死面积和血清中IL-1β、IL-6、TNF-α等促炎性细胞因子水平显著升高,而不同剂量马钱苷干预后大鼠脑梗死情况和炎症反应均得到改善,其中以CIRI+马钱苷中、高剂量组的改善效果最为显著。OGD/R是体外模拟缺血再灌注损伤模型的方法之一,其模拟效果接近人体的病理生理状态,细胞外LDH释放量可用于反映细胞损伤程度[16-17]。本研究发现,N2a经OGD/R造模后细胞LDH释放率显著增加,表明细胞损伤程度严重;而OGD/R+马钱苷中、高剂量组细胞LDH释放率显著减少,表明马钱苷能够减轻R/I引起的神经细胞损伤。
细胞凋亡是基因控制的存在于生物体内的细胞程序性死亡过程,是 CIRI的发病机制之一[6,10,18]。Bcl-2和Bax同属Bcl-2蛋白家族成员,两者在细胞凋亡中分别扮演抑制和促进凋亡的角色,cleaved-Caspases-3是Caspases-3的活化形式,是细胞凋亡程序的主要执行者[16]。研究表明马钱苷可通过下调脑组织缺血区域Caspase-3蛋白表达,减少脑组织R/I的神经细胞凋亡[6]。本研究使用Tunel染色和流式细胞术检测发现,CIRI大鼠神经细胞和OGD/R诱导后的N2a凋亡数量增加,不同剂量马钱苷干预后细胞凋亡数量显著减少,提示马钱苷可抑制R/I引起的神经细胞凋亡。CIRI大鼠脑组织和OGD/R诱导后的N2a中Bcl-2 mRNA表达均显著降低,Bax、Caspase-3 mRNA表达均显著增加,与王玉等[19]研究结果一致;在不同剂量马钱苷干预后,CIRI大鼠脑组织和OGD/R诱导后的N2a中 Bcl-2 mRNA表达均增加,Bax、Caspase-3 mRNA表达均降低,推测马钱苷通过促进Bcl-2表达、抑制Bax和Caspase-3表达从而抑制体内外R/I的神经细胞凋亡。
NF-κB是调控细胞炎症反应、增殖以及凋亡的重要因子之一[20],脑组织缺血损伤可引起NF-κB信号转导通路的激活[21-22]。p38可在脑缺血组织中被激活,引起NF-κB转录诱导神经细胞发生炎症反应和凋亡,因此阻断p-p38/NF-κB通路可减轻脑梗死的炎症损伤[21]。研究表明,NF-κB/p38通路在肺缺血R/I中介导炎症介质释放,引起器官功能障碍[23]。库亚萍等[24]研究发现,NF-κB/p38 MAPK通路在CIRI大鼠脑组织中表达上调,而下调该通路表达能够减轻大鼠脑组织炎症反应。既往研究表明,马钱苷可抑制NF-κB和p-38蛋白表达,促进神经细胞活力,发挥神经保护作用[25-26]。本研究发现,p-p38/p38和NF-κB在CIRI大鼠脑组织和CIRI细胞中的相对表达量均显著升高,而不同剂量马钱苷处理后,p-p38/p38和NF-κB表达均降低,提示马钱苷在体内外可通过抑制p38/NF-κB信号通路改善I/R后的炎症损伤作用。
综上所述,马钱苷在体内外对R/I的神经细胞具有改善作用,其作用是通过调控NF-κB/p38信号通路减少炎性介质释放、抑制神经细胞凋亡来实现的。
